Способы и устройства для доставки лекарственного средства к глазной ткани с помощью микроиглы
Иллюстрации
Показать всеГруппа изобретений относится к офтальмологии и может использоваться для введения лекарственного средства в глаз пациента. Устройство для введения лекарственного средства в глаз пациента содержит полую микроиглу, имеющую острый конец и канал, через который жидкость может передаваться через микроиглу; тело устройства для удержания микроиглы, имеющее конец, служащий как основание, из которого простирается микроигла; и привод для контролируемой инфузии жидкой лекарственной композиции через микроиглу, при этом устройство сконфигурировано для введения кончика микроиглы в место введения в белочную оболочку глаза и выполнено с возможностью введения жидкой лекарственной композиции с помощью инфузии в супрахориоидальное пространство и в стороне от места введения. Способ введения лекарственного средства в глаз пациента включает введение полой микроиглы в белочную оболочку глаза в место введения и введение при помощи инфузии в течение определенного периода времени через вставленную микроиглу в супрахориоидальное пространство глаза жидкой лекарственной композиции, содержащей лекарственное средство в количестве, эффективном для доставки этого лекарственного средства в супрахориоидальное пространство, причем введенная при помощи инфузии лекарственная композиция циркулирует в пределах супрахориоидального пространства в стороне от места введения. Группа изобретений обеспечивает высокоточную доставку лекарственного препарата, уменьшает инвазивность. 3 н. и 27 з.п. ф-лы, 32 ил., 1 табл.
Реферат
ЗАЯВЛЕНИЕ О СПОНСИРУЕМОМ ГОСУДАРСТВОМ ИССЛЕДОВАНИИ ИЛИ РАЗРАБОТКЕ
Это изобретение было сделано при поддержке правительства США в рамках договора №8 ROI EB00260-03 и договора № R24EY017045-01, которые были компенсированы Национальным институтом здравоохранения. Правительство США имеет определенные права на изобретение.
УРОВЕНЬ ТЕХНИКИ
Это изобретение полностью относится к области офтальмологических видов лечения. А более конкретно к использованию микроиглы для инфузии жидкой лекарственной композиции в глазные ткани для целевой локальной доставки лекарственного средства.
Доставка лекарственного средства в глаз является чрезвычайно трудной, особенно доставка макромолекул и доставка в заднюю часть глаза. Многие воспалительные и пролиферативные заболевания в задней области глаза требуют долгосрочного фармакологического лечения. Примеры таких заболеваний включают дегенерацию желтого пятна, диабетическую ретинопатию и увеит. Трудно доставлять эффективные дозы лекарственного средства в заднюю часть глаза, используя обычные способы доставки, такие как местное нанесение, обладающее плохой эффективностью, и системное введение, которое часто вызывает серьезные побочные эффекты (Geroski & Edelhauser, Invest. Ophthalmol. Vis. Sci. 41: 961-64 (2000)). Например, в то время как глазные капли являются удобными в лечении состояний, влияющих на внешнюю поверхность глаза или ткани в передней части глаза, глазные капли не могут значительной мерой проникать в заднюю часть глаза, как это может быть необходимо для лечения различных заболеваний сетчатки.
Инъекция непосредственно в глаз с использованием обычных игл и шприцев часто эффективна, но требует профессиональной подготовки и вызывает озабоченность по поводу безопасности (Maurice, J. Ocul. Pharmacol. Ther. 17: 393-401 (2001)). Кроме того, хотелось бы иметь возможность свести к минимуму количество и/или частоту глазных инъекций, необходимых для доставки терапевтически эффективных количеств лекарственного средства к участкам глазной ткани, которые в них нуждаются.
Было изучено супрахориоидальное пространство глаза, и описана его катетеризация как возможный путь доставки лекарственных средств. См., например, работу Olsen, et al. American J. Oprhamology 142 (5): 777-87 (Nov. 2006); PCT публикацию заявки на патент № WO 2007/100745 для Iscience Interventional Corporation.
Поэтому было бы желательно предоставить лучшие, более безопасные, более эффективные способы непосредственной доставки терапевтических веществ в ткани глаза. Также было бы желательно предоставить устройства, пригодные для таких способов, которые могут быть относительно недорогими в производстве и в использовании. Кроме того, было бы желательно предоставить способы для высокоточной доставки лекарственного средства к склере, хориоидальной, увеальной, макулярной, цилиарной, относящейся к стекловидному телу и ретинальной тканям.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предоставлены способы и устройства для введения лекарственного средства в глаз пациента. Эти способы могут быть использованы, например, при лечении увеитов, глаукомы, диабетического макулярного отека, возрастной макулярной дегенерации или цитомегаловирусного ретинита. В одном аспекте способ включает в себя введение полой микроиглы в склеру глаза в месте введения, микроиглы, имеющей острый конец с отверстием, и введение с помощью инфузии в течение определенного периода времени жидкой лекарственной композиции, которая содержит лекарственное средство, через введенную микроиглу и в супрахориоидальное пространство глаза, где в течение определенного периода времени введенная лекарственная композиция циркулирует в пределах супрахориоидального пространства в стороне от места введения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
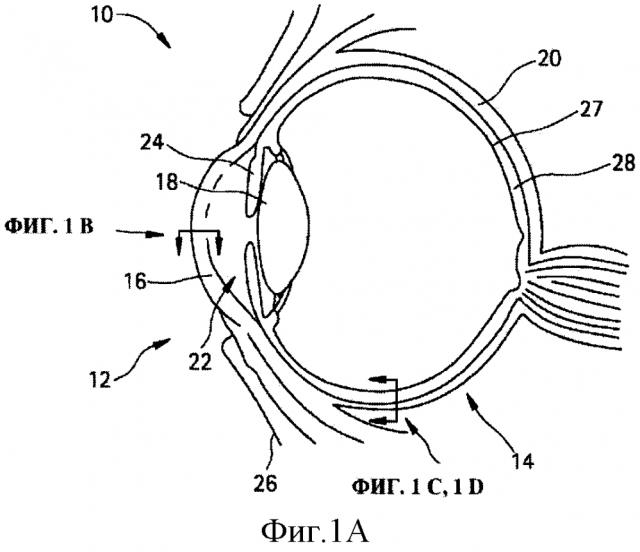
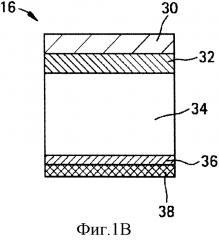
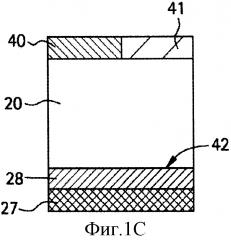
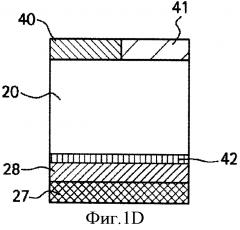
ФИГ. 1А,1В,1С и 1D являются иллюстрацией поперечного сечения тканевых структур человеческого глаза. Глаз в целом (1А), крупный план роговицы (1В) и крупный план склеры и связанных с ними тканей глаза без жидкости в супрахориоидальном пространстве (1C) или с жидкостью в супрахориоидальном пространстве (1D).
ФИГ.2 представляет собой вид поперечного сечения микроигольчатого устройства, включающего полую микроиглу, расположенную в продолговатом теле, согласно одному варианту воплощения.
ФИГ.3 представляет собой вид поперечного сечения продолговатого тела микроигольчатого устройства, показанного на ФИГ. 2.
ФИГ.4 является иллюстрацией микроигольчатого устройства в соответствии с одним вариантом воплощения.
ФИГ.5 является иллюстрацией микроигольчатого устройства в соответствии с одним вариантом воплощения.
ФИГ. 6А и 6В иллюстрируют вариант воплощения процесса использования полой микроиглы для доставки лекарственного средства в супрахориоидальное пространство глаза, где процесс включает в себя введение полой микроиглы в склеру и инфузию жидкой лекарственной композиции в супрахориоидальное пространство.
ФИГ. 7А демонстрирует сравнение полой микроиглы в соответствии с одним вариантом воплощения по сравнению с кончиком обычной подкожной иглы 30 калибра.
ФИГ.7В показывает схематическое изображение пользовательской акриловой модели, изготовленной в такой форме, которая соответствует целостному глазу.
ФИГ. 8А и 8В представляют собой полученные при помощи светлопольной микроскопии изображения сагиттального сечения глаза свиньи до и после инфузии сульфородамина соответственно.
ФИГ. 9А, 9В, 9С и 9D являются рентгеноскопическими изображениями срезов из замороженных тканей глаза свиньи, без инфузии в супрахориоидальное пространство (9А), срезов из замороженных тканей глаза кролика, после вливания 500 нм флуоресцентных частиц в плоскости осевого сечения и в виде коллажа, чтобы сформировать панорамный вид (9В), срезов из замороженных тканей глаза свиньи после вливания 500 нм флуоресцентных частиц в сагиттальном направлении и в виде коллажа, чтобы показать пространства, как переднее, так и заднее по отношению к месту введения микроиглы (9С), и срезов из замороженных тканей глаза человека после инфузии 500 нм флуоресцентных частиц в сагиттальном направлении и в виде коллажа, чтобы показать пространства, как переднее, так и заднее по отношению к месту введения микроиглы (9D). Вставки ФИГ.9В, 9С и 9D показывают увеличенные виды места введения микроиглы.
ФИГ. 10А и 10В являются изображениями микрокомпьютерной томографии, показывающие периферическое распространение 1 мкм контрастных частиц, введенных при помощи инфузии в супрахориоидальное пространство глаза свиньи, изображенными в поперечном сечении (10А) и трехмерной реконструкцией изображений поперечного сечения (10В).
ФИГ. 11А, 11В, 11С и 11D являются графиками, показывающими влияние инфузионного давления и длины микроиглы на долю успешных попыток супрахориоидальной доставки частиц размером 20 нм (11А), частиц размером 100 нм (11В), частиц размером 500 нм (11С) и частиц размером 1000 нм (11D) в глаза свиньи.
ФИГ. 12А и 12В представляют собой рентгеноскопические изображения срезов из замороженных тканей глаза свиньи после инфузии частиц размером 20 нм (12А) и частиц 1000 нм (12В) в сагиттальном направлении и в виде коллажа, чтобы показать пространства, как переднее, так и заднее по отношению к месту введения микроиглы. Вставки ФИГ. 12А и 12В показывают увеличенные виды места введения микроиглы.
ФИГ. 13А и 13В являются графиками, показывающими влияние инфузионного давления и длины микроиглы на долю успешных попыток супрахориоидальной доставки частиц размером 1000 нм для имитации внутриглазного давления 18 мм рт.ст.(13А) и 36 мм рт.ст.(13В).
ФИГ.14 является одномерной сканограммой глаз кролика через линию прямой видимости, полученной после введения флуоресцеина натрия в супрахориоидальное пространство, с осью x, представляющей позицию глаз от задней части (0) к передней (160), и осью y, представляющей интенсивность флуоресценции в этой позиции.
ФИГ.15 представляет собой график, демонстрирующий скорость клиренса флуоресцеина натрия из супрахориоидального пространства с течением времени.
ФИГ.16 представляет собой график, демонстрирующий скорость клиренса частиц размером 20 нм из супрахориоидального пространства с течением времени.
ФИГ.17 представляет собой график, демонстрирующий скорость клиренса частиц размером 500 нм из супрахориоидального пространства с течением времени.
ФИГ.18 является блок-схемой способа введения лекарственного средства в глаз, согласно одному варианту воплощения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ВОПЛОЩЕНИЯ
Эффективная система доставки лекарственного средства для доставки лекарственного средства в глаз оптимально должна включать четыре общие характеристики: во-первых, она должна быть минимально инвазивной и безопасной, во-вторых, лекарственное средство должно быть введено таким образом, чтобы оно было хорошо нацелено на заданные ткани и ограничивало воздействие на другие области глаза, в-третьих, она должна быть способна доставлять лекарственные средства контролируемым и стабильным образом, и, в-четвертых, она должна быть максимально простой в использовании, насколько это возможно. Варианты осуществления настоящего описания удовлетворяют этим потребностям путем предоставления микроигольчатых устройств и способов их использования для улучшения доставки лекарственного средства в глаз.
В одном преимущественном и типичном варианте воплощения способов, описанных здесь, доставка лекарственного средства достигается за счет инъекции (введения) микроиглы в склеру, и инъекции (инфузии) лекарственной композиции через вставленную микроиглу в супрахориоидальное пространство глаза. Микроигла способна точно доставить лекарственное средство в супрахориоидальное пространство для последующей локальной доставки в близлежащие ткани, нуждающиеся в лечении. Лекарственное средство может высвобождаться в глазные ткани из введенного при помощи инфузии объема (или, например, из микрочастиц в нем) в течение длительного периода, например нескольких часов, или дней, или недель, или месяцев после того, как микроигла была вставлена и вынута. Это может выгодно обеспечить повышенную биодоступность лекарственного средства по сравнению, например, с доставкой при помощи местного нанесения лекарственной композиции на поверхности глазной ткани. С данными микроиглами способ преимущественно включает точный контроль глубины введения в глазную ткань, так что кончик микроиглы может быть помещен в супрахориоидальное пространство или в склеру, но достаточно близко к супрахориоидальному пространству для циркулирования введенной при помощи инфузии лекарственной композиции в супрахориоидальное пространство. Преимущественно это может быть достигнуто без контакта с подлежащими тканями, такими как ткани сосудистой оболочки и сетчатки.
Микроиглы дают возможность сделать эту доставку минимально инвазивным образом, превосходящим традиционные способы с использованием игл. Например, микроиглы по настоящему изобретению преимущественно могут быть введены перпендикулярно в склеру, достигая супрахориоидального пространства короткой дистанцией проникновения. Это отличается от обычных длинных игл или канюли, которые должны подходить к супрахориоидальному пространству под крутым углом, проходя больший путь проникновения через склеру и другие ткани глаза, увеличивая размер траектории иглы и, следовательно, увеличивая риск инфекции и/или сосудистого разрыва. С такими длинными иглами возможность точно контролировать глубину введения снижается по сравнению со способом применения микроиглы, описанным в настоящем документе.
Преимущественно, по сравнению с ранее известными устройствами игл, доставка лекарственного средства в супрахориоидальное пространство предоставляет возможность доставки жидкой лекарственной композиции за одно введение к большей площади ткани и в ткани, являющиеся более трудной мишенью. Не желая быть связанными какой-либо теорией, считается, что после поступления в супрахориоидальное пространство жидкая лекарственная композиция циркулирует к периферии от места введения, по направлению к ретинохориоидальной ткани, желтому пятну и зрительному нерву в задней части глаза, а также вперед в сторону сосудистой оболочки глазного яблока и цилиарного тела. Кроме того, часть введенной с помощью инфузии жидкой лекарственной композиции может оставаться в склере вблизи места введения микроиглы, выступая в качестве дополнительного депо лекарственной композиции, которая впоследствии может диффундировать в супрахориоидальное пространство, а затем в другие соседние ткани.
Как используется здесь, термин "супрахориоидальное пространство", который является синонимом термина "супрахориоидальный" или "супрахориоид", описывает потенциальное пространство в области глаза, расположенное между склерой и сосудистой оболочкой глаза. Эта область в основном состоит из плотно упакованных слоев длинных пигментированных отростков, полученных от каждой из двух соседних тканей, однако в этой области может развиваться пространство в результате накопления жидкости или другого материала в супрахориоидальном пространстве и прилегающих тканях. Специалистам в данной области техники будет понятно, что супрахориоидальное пространство часто расширяется в результате накопление жидкости из-за некоторых болезненных состояний глаз или в результате некоторых травм, или в результате хирургического вмешательства. В данном описании, однако, накопление жидкости создается преднамеренно при помощи инфузии лекарственной композиции в область над сосудистой оболочкой глаза для создания супрахориоидального пространства (которое заполнено лекарственной композицией). Не желая быть связанными какой-либо теорией, считается, что эта область служит в качестве пути для увеосклерального оттока (т.е. естественного процесса перемещения глазной жидкости из одной области глаза к другой насквозь) и превращается в реальное пространство в случаях отделения сосудистой оболочки глаза от склеры.
Способы применения микроиглы
Микроигольчатые устройства, описанные здесь, могут быть использованы для доставки лекарственных композиций в глаз пациента, в частности для лечения, диагностики или профилактики глазных заболеваний. В предпочтительном варианте воплощения пациент является пациентом-человеком, нуждающимся в лечении. Пациент может быть взрослым или ребенком. В других вариантах воплощения пациент может быть млекопитающим, не являющимся человеком.
Широкий спектр глазных болезней и расстройств может быть пролечен с помощью способов и устройств, описанных здесь. Не ограничивающие примеры глазных болезней включают увеит, глаукому, диабетический макулярный отек или ретинопатию, макулярную дегенерацию и генетические заболевания. Описанные здесь способы являются особенно полезными для местной доставки лекарственных средств, которые должны быть введены в заднюю область глаза, например к ретинохориоидальной ткани, желтому пятну, и зрительному нерву в задней части глаза. В одном варианте воплощения способы и устройства для доставки, описанные здесь, могут быть использованы в видах применения на основе генной терапии. Например, способы могут вводить жидкую лекарственную композицию в супрахориоидальное пространство для доставки выбранных ДНК, РНК или олигонуклеотидов к целевым глазным тканям.
Микроиглы могут быть использованы для целевой доставки к определенным тканям или областям внутри глаза или в соседние ткани. В различных вариантах воплощения способы могут быть предназначены для доставки лекарственного средства конкретно к белочной оболочке глаза, к сосудистой оболочке глаза, мембране Бруха, пигментному эпителию сетчатки, субретинальному пространству, сетчатке, желтому пятну, диску зрительного нерва, зрительному нерву, цилиарному телу, трабекулярной сети, водянистой влаге, стекловидному телу и другим глазным тканям или соседним тканям, нуждающимся в лечении.
Как используется здесь, термины "глазная ткань" и "глаз" 10 включают в себя как передний сегмент 12 глаза (т.е. часть глаза, находящуюся перед хрусталиком), так и задний сегмент 14 глаза (т.е. часть глаза, находящуюся позади хрусталика), как продемонстрировано на ФИГ.1А. Передний сегмент 12 ограничен роговицей 16 и хрусталиком 18, в то время как задний сегмент 14 ограничен склерой 20 и хрусталиком 18. Передний сегмент 12 далее подразделяется на переднюю камеру 22, между радужной оболочкой 24 и роговицей 16, и заднюю камеру 26, между хрусталиком 18 и радужной оболочкой 24. Открытая часть склеры 20 на переднем сегменте 12 глаза защищена прозрачной мембраной, которая называется конъюнктива (не показано). Расположенными под склерой 20 являются сосудистая оболочка глаза 28 и сетчатка 27, совместно именуемые ретинахориоидальной тканью. Рыхлая соединительная ткань или потенциальное пространство между сосудистой оболочкой глаза 28 и склерой 20 называется супрахориоидальным пространством (не показано). ФИГ.1В демонстрирует роговицу 16, которая состоит из эпителия 30, слоя Боумена 32, стромы 34, мембраны Десцемета 36 и эндотелия 38. ФИГ.1С и ФИГ.1D демонстрируют склеру 20 с прилегающими теноновой капсулой 40 или конъюнктивой 41, супрахориоидальное пространство 42, сосудистую оболочку глаза 28 и сетчатку 27 как без жидкости в супрахориоидальном пространстве, так и с жидкостью соответственно.
Способ введения лекарственного средства в глаз обычно включает этапы введения полой микроиглы в склеру, а затем введения при помощи инфузии жидкой лекарственной композиции через полую микроиглу в супрахориоидальное пространство глаза.
Введение
В одном варианте воплощения место введения находится между экватором и лимбом глаза. В другом варианте место введения находится между приблизительно 2 мм и приблизительно 10 мм сзади от лимба глаза. В вариантах воплощения место введения микроиглы расположено примерно около экватора глаза. В другом варианте воплощения место введения находится между экватором и лимбом глаза. В другом варианте место введения находится от 2 до 10 мм сзади от лимба глаза. В другом варианте воплощения лекарственная композиция вводится в супрахориоидальное пространство в месте инъекции (т.е. на кончике микроиглы), а затем циркулирует через супрахориоидальное пространство в сторону от места инъекции, в то время как происходит инъекция. В другом варианте воплощения место инъекции (т.е. на кончике микроиглы) находится перед экватором глаза и, по меньшей мере, часть лекарственной композиции циркулирует сзади от экватора глаза, в то время как происходит инъекция (т.е., в то время, когда лекарственная композиция продолжает вытекать из микроиглы). В другом варианте воплощения место инъекции (т.е. на кончике микроиглы) находится перед экватором глаза и, по меньшей мере, часть лекарственной композиции циркулирует около макулы, в то время как происходит инъекция (т.е., в то время, когда лекарственная композиция продолжает вытекать из микроиглы).
Важно отметить, что глубина введения микроиглы в глазную ткань точно контролируется. Для контроля глубины введения микроигл, описанных здесь, могут быть использованы различные способы. В конкретном варианте воплощения глубина введения ограничена выбранной длиной или эффективной длиной микроиглы. "Эффективная длина" представляет собой ту часть, которая доступна для тканевого введения, т.е. длина, которая простирается от основы и была бы введена, если бы была нулевая деформация ткани; она не принимает во внимание любую проксимальную часть микроиглы, которая простирается в или через основу и, следовательно, не может быть введена в ткань. То есть, микроигла может иметь длину, примерно равную желаемой глубине проникновения. В одном варианте воплощения микроигла является достаточно короткой, так что кончик микроиглы может быть вставлен по существу к основанию склеры (т.е. вблизи границы склеры и сосудистой оболочки глаза), без полного проникновения через склеру. В другом варианте воплощения кончик микроиглы вставляется через склеру в супрахориоидальное пространство без проникновения через сосудистую оболочку глаза.
В другом варианте воплощения разработаны микроиглы, имеющие длину больше, чем желаемая глубина проникновения, но микроиглы вводятся контролируемым образом в ткани только на часть пути. Частичное введение можно контролировать с помощью механических свойств ткани, которая изгибается и углубляется во время процесса введения микроиглы. Таким образом, по мере того как микроиглу вводят в ткани, ее движение частично упруго деформирует ткани и частично проникает в ткани. Контролируя степень деформации ткани, можно управлять глубиной введения микроиглы.
Дополнительные свойства контроля введения описаны дальше в разделе "Свойства контроля для направления движения микроиглы в способах использования" ниже.
В другом варианте воплощения микроиглу вводят в ткани с помощью вращательного/сверлящего способа и/или вибрирующих действий. Таким образом, микроигла может быть введена на заданную глубину, например, сверление микроиглами на желаемое число оборотов, которое соответствует требуемой глубине в ткани. См., например, публикацию патентной заявки США №20050137525 AI, работу Wang et al., которая включена в настоящий документ в качестве ссылки для описания сверлящих микроигл. Вращательные/сверлящие техники и/или вибрирующие действия могут быть применены во время этапа введения, этапа выведения, или во время обоих этапов.
Инфузия
В предпочтительном варианте воплощения жидкую лекарственную композицию вводят при помощи инфузии в супрахориоидальное пространство через полую микроиглу при помощи вытеснения лекарственной композиция из резервуарного источника в глазные ткани с использованием градиента давления (например, накачивание насосом, шприцем). В других вариантах воплощения лекарственная композиция может быть вытеснена из резервуарного источника в глазную ткань с помощью электрического поля (например, лекарственный электрофорез) или другой приложенной снаружи энергии (например, ультразвуковая/акустическая энергия).
В одном варианте воплощения количество жидкой лекарственной композиции введенной при помощи инфузии в супрахориоидальное пространство из введенной микроиглы составляет от 10 микролитров до 200 микролитров, например, от 50 мкл до 150 мкл. В другом варианте воплощения приблизительно от 10 микролитров приблизительно до 500 микролитров, например, от 50 мкл до 250 мкл, вводят при помощи инфузии через микроиглу в супрахориоидальное пространство.
В одном варианте воплощения движущая сила или давление вливания жидкой лекарственной композиции через микроиглу заставляет введенную при помощи инфузии лекарственную композицию циркулировать в супрахориоидальном пространстве и достигать задней части глаза во время процесса введения (т.е. во время инфузии). Это может произойти менее чем за одну или две минуты, например, от 1 сек до 100 сек, например, от 10 до 30 секунд. В одном аспекте желательно, чтобы жидкая лекарственная композиция циркулировала к периферии в супрахориоидальном пространстве во время процесса инфузии к участку, который находится, по меньшей мере, на расстоянии 2,5 мм в стороне от места введения, к участку, который находится, по меньшей мере, на расстоянии 5 мм в стороне от места введения, или к участку, который находится, по меньшей мере, на расстоянии 10 мм в стороне от места введения. Желательно, чтобы жидкая лекарственная композиция циркулировала к периферии в супрахориоидальном пространстве от места введения по направлению к задней части глаза (т.е., к ретинохориоидальной ткани, желтому пятну и зрительному нерву в заднем сегменте глаза).
Количество лекарственного средства, доставляемого в глазную ткань, также можно регулировать, в частности, при помощи типа микроиглы, которая используется, и того, как она используется. В одном типичном варианте воплощения полая микроигла вводится в глазную ткань и постепенно выводится из глазной ткани после введения для доставки жидкого лекарственного средства, где после достижения определенной дозы доставка может быть остановлена путем отключения движущей силы жидкости, такой как давление (например, от механического устройства, такого как шприц) или электрическое поле, чтобы избежать утечки/неконтролируемой доставки лекарственного средства. Желательно, чтобы количество лекарственного средства, которое доставляется, контролировалось вытеснением жидкой лекарственной композиции при соответствующем инфузионном давлении. В некоторых вариантах воплощения инфузионное давление может составлять, по меньшей мере, 150 кПа, по меньшей мере, 250 кПа, или, по меньшей мере, 300 кПа. Подходящее инфузионное давление может варьироваться в зависимости от конкретного пациента или вида.
Специалистам в данной области техники будет понятно, однако, что желаемое инфузионное давление для доставки соответствующего количества жидкой лекарственной композиции может зависеть от глубины введения микроиглы и состава жидкой лекарственной композиции. Например, большее инфузионное давление может потребоваться в вариантах воплощения, в которых лекарственная композиция для доставки в глаз находится в виде наночастиц или микрочастиц или включает наночастицы или микрочастицы, заключающие в себе активное вещество или микропузырьки. Воплощения методики инкапсуляции наночастиц или микрочастиц хорошо известны в данной области техники.
Дополнительные свойства для контроля инфузии описаны ниже в разделе "Контроль транспорта через микроиглу".
В одном варианте воплощения способ введения лекарственного средства в глаз может дополнительно включать частичное выведение полой микроиглы назад после этапа введения и до и/или во время инфузии лекарственной композиции. В конкретном варианте воплощения частичное выведение назад микроиглы происходит до этапа инфузии жидкой лекарственной композиции в глазную ткань. Этот этап введения/выведения назад может образовывать карман, и благоприятно позволяет жидкой лекарственной композиции вытекать из микроиглы беспрепятственно или с меньшими препятствиями на отверстие на кончике микроиглы со стороны глазной ткани. Этот карман может быть наполнен лекарственной композицией, но также может служить и в качестве канала, через который жидкая лекарственная композиция может циркулировать из микроиглы, через карман и в супрахориоидальное пространство. ФИГ.6А демонстрирует полую микроиглу 130, введенную в склеру 20, с лекарственной композицией 131, временно расположенной в полом канале микроиглы. (Сообщение жидкости с резервуаром жидкой лекарственной композиции не показано.) ФИГ.6В демонстрирует микроиглу 130 после частичного выведения назад и инфузии жидкой лекарственной композиции 131 в супрахориоидальное пространство. Стрелки показывают периферическую циркуляцию лекарственной композиции через супрахориоидальное пространство.
В конкретном варианте воплощения микроигла вводит с помощью инфузии лекарственную композицию через склеру в супрахориоидальное пространство для контролируемого (т.е., замедленного, отсроченного или модулированного с течением времени) высвобождения лекарственного средства в одну или несколько глазных или соседних тканей. Такое "замедленное высвобождение" или "отсроченное высвобождение" или "модулированное высвобождение", как правило, является более продолжительным, чем получаемое при помощи местного нанесения лекарственной композиции на глазную ткань. В конкретном варианте воплощения существует отсроченное, замедленное или модулированное высвобождение лекарственной композиции, после того как, по меньшей мере, одну микроиглу выводят из глазной ткани. Этот способ доставки может быть особенно благоприятным с глазными тканями, где желательно, чтобы процесс введения и выведения происходил в течение более короткого периода времени, чтобы свести к минимуму дискомфорт пациента - в отличие от трансдермального нанесения микроигольчатых патчей, где патчи можно с большей вероятностью носить (с установленными микроиглами) в течение продолжительного периода без дискомфорта пациента.
Другие этапы, варианты и способы применения
В другом аспекте способ введения лекарственного средства в глаз пациента может включать в себя мониторинг введения микроиглы и/или инфузии жидкой лекарственной композиции для обеспечения точной доставки жидкой лекарственной композиции в супрахориоидальное пространство (ФИГ.18). Такой мониторинг может быть достигнут при использовании направляемых изображением способов обратной связи во время одного или более из этих этапов, не ограничивающие примеры которых включают традиционную микроскопию, МРТ, рентген, конфокальную микроскопию, окулярную когерентную томографию (например, переднюю сегментооптическую когерентную томографию, ретинальную томографию Гейдельберга, спектральную оптическую когерентную томографию), флюоресцентную ангиографию, ангиографию с индоцианином зеленым, стереоскопические фотографии глазного дна высокого разрешения, изображения аутофлуоресценции, изображения ультраширокого поля, а также различные методики ультразвукового исследования. Таким образом, способ может дополнительно включать определение того, циркулирует ли начальная инфузия жидкой лекарственной композиции в супрахориоидальное пространство глаза и в стороне от места введения. Если будет установлено, что начальное вливание было успешным, желаемый объем жидкой лекарственной композиции может быть введен путем инфузии и инфузию прекращают путем удаления движущей силы жидкости, такой как давление и выведения микроиглы назад из глаза. Однако если будет установлено, что начальное вливание жидкой лекарственной композиции было неудачным (т.е., по существу, лекарственная композиция не циркулирует в супрахориоидальном пространстве глаза и в стороне от места введения), то микроигла может быть переустановлена, и процесс повторяется до тех пор, пока не достигается успешная доставка.
Микроигла необязательно может быть частью группы из двух или более микроигл, так что способ дополнительно включает введение, по меньшей мере, второй микроиглы в склеру, без проникновения через склеру. В одном варианте воплощения, в котором группу из двух или более микроигл вводят в глазную ткань, лекарственные композиции каждой из двух или более микроигл могут быть одинаковыми или отличаться друг от друга лекарственным средством, композицией, объемом/количеством лекарственной композиции, или комбинацией этих параметров. В одном случае различные типы лекарственных композиций могут быть введены через одну или несколько микроигл. Например, введение второй полой микроиглы, содержащей вторую лекарственную композицию, в глазную ткань приведет к доставке второй лекарственной композиции в глазную ткань.
Микроигольчатые устройства, описанные здесь, могут быть адаптированы для удаления из глаза веществ, таких как образцы жидкости, ткани или молекулы.
Специалистам в данной области техники будет понятно, однако, что другие виды микроигл (например, твердые микроиглы) и другие способы доставки лекарственной композиции в глазную ткань могут быть использованы вместо инфузионных способов, описанных здесь или в сочетании с ними. Не ограничивающие примеры включают растворение, по меньшей мере, частично, покрытие лекарственной композицией свободной части микроиглы; отсоединение, по меньшей мере, частично, покрытой лекарственной композицией (например, в основном как нетронутый рукав или внутренний фрагмент) свободной части микроиглы, разрушение или растворение свободной части микроиглы от основания, с которым микроигла является одним целым или к которому она присоединена; или любую их комбинацию.
Микроигольчатые устройства, описанные здесь, также могут быть адаптированы для использования одной или нескольких микроигл в качестве сенсорного устройства для обнаружения аналитов, электрической активности, и оптических или других сигналов. Сенсорное устройство может включать в себя сенсоры давления, температуры, химических веществ и/или электромагнитных полей (например, света). Биосенсоры могут быть расположены на поверхности или внутри микроиглы, или внутри устройства, со связью с тканями тела через микроиглу. Микроигольчатый биосенсор может быть любым из четырех классов основных датчиков: потенциометрический, амперометрический, оптический и физико-химический. В одном варианте воплощения полая микроигла наполнена веществом, таким как гель, который имеет считывающие функциональные возможности, связанные с ним. В применении для считывания, основанного на связывании с субстратом или на реакции, опосредованной ферментами, субстрат или фермент может быть зафиксирован во внутренней части иглы. В другом варианте воплощения в микроигольчатое устройство может быть включен волновод, чтобы направлять свет в определенное место, или для обнаружения, например, с помощью таких средств, как pH краситель для оценки цвета. Кроме того, тепло, электричество, свет, ультразвук или другие формы энергии могут быть точно переданы для того, чтобы непосредственно стимулировать, повреждать или лечить конкретную ткань, или для диагностических целей.
Микроигольчатое устройство
Микроигольчатое устройство включает полую микроиглу. Устройство может включать в себя удлиненный корпус для удержания проксимального конца микроиглы. Устройство может дополнительно включать в себя средства для проведения жидкой лекарственной композиции через микроиглу. Например, средства могут представлять собой гибкий или жесткий канал в жидкостной связи с основанием или проксимальным концом микроиглы. Средства могут также включать насос или другие устройства для создания градиента давления для индуцирования потока жидкости через устройство. Канал может быть функционально связан с источником жидкой лекарственной композиции. Источником может быть любой подходящий контейнер. В одном варианте воплощения источник может быть в виде обычного шприца. Источником может быть одноразовый контейнер со стандартной дозой.
Микроигла
Как используется здесь, термин "полый" включает в себя один прямой канал через центр микроиглы, а также несколько каналов; каналы, которые следуют сложными путями через микроиглы, множественные точки входа и выхода из канала(ов), и перекрещивание или сети из каналов. То есть, полая микроигла имеет структуру, которая включает в себя один или несколько непрерывных путей от основания микроиглы к точке выхода в стержне и/или кончик части микроиглы, дистальной к основанию.
Как используется здесь, термин "микроигла" относится к трубчатому телу, имеющему основание, стержень и острый конец, подходящий для введения в склеру и другую глазную ткань, и имеет размеры, подходящие для минимально инвазивного введения и инфузии жидкой лекарственной композиции, как описано здесь. То есть, микроигла имеет длину или эффективную длину, которая не превышает 2000 микрон, и ширину (или диаметр), которая не превышает 500 микрон.
В различных вариантах воплощения микроигла может иметь длину приблизительно от 50 мкм до 2000 мкм. В другом конкретном варианте воплощения микроигла может иметь длину приблизительно от 150 мкм приблизительно до 1500 мкм, приблизительно от 300 мкм приблизительно до 1250 мкм, приблизительно от 500 мкм приблизительно до 1250 мкм, приблизительно от 700 мкм приблизительно до 1000 мкм, или приблизительно от 800 приблизительно до 1000 мкм. В предпочтительном варианте воплощения длина микроиглы составляет приблизительно 1000 мкм. В различных вариантах воплощения проксимальная часть микроиглы имеет максимальную ширину или размер поперечного сечения приблизительно от 50 мкм до 500 мкм, приблизительно от 50 мкм приблизительно до 400 мкм, приблизительно от 100 мкм приблизительно до 400 мкм, приблизительно от 200 мкм приблизительно до 400 мкм, или приблизительно от 100 мкм приблизительно до 250 мкм, с диаметром отверстия приблизительно от 5 мкм приблизительно до 400 мкм. В конкретном варианте проксимальная часть микроиглы имеет максимальную ширину или размер поперечного сечения приблизительно 400 мкм. Специалистам в данной области техники будет понятно, однако, что в вариантах воплощения, в которых кончик микр