Удаление и восстановление содержания клеток в органах и тканях
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к тканевой инженерии. Предложена лишенная клеток путем перфузии сосудистая ткань свиньи, коровы, овцы, собаки или человека, содержащая лишенный клеток внеклеточный матрикс указанной ткани. При этом указанный внеклеточный матрикс включает сосудистое дерево. Указанный лишенный клеток внеклеточный матрикс указанной ткани сохраняет большую часть жидкости, введенной в указанное сосудистое дерево лишенного клеток внеклеточного матрикса. Предложен способ лишения ткани клеток методом перфузии, а также часть органа, лишенного клеток методом перфузии. Группа изобретений позволяет обеспечить возможность эффективной реконструкции органа или ткани. 4 н. и 12 з.п. ф-лы, 2 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к органам и тканям, а конкретнее, к способам и материалам для удаления и восстановления содержания клеток в органах и тканях.
Предпосылки изобретения
Матрицы биологического происхождения были разработаны для тканевой инженерии и регенерации. Однако матрицы, разработанные до настоящего времени, в целом имеют нарушенную матричную структуру и не имеют сосудистого ложа, которое обеспечивает возможность эффективной реконструкции органа или ткани. В настоящем описании описаны способы удаления и восстановления содержания клеток в органах и тканях.
Краткое описание сущности изобретения
Изобретение относится к способам и материалам для удаления клеток из органа и ткани, а также к способам и материалам для восстановления содержания клеток в бесклеточном органе или ткани.
В одном из аспектов, изобретение относится к бесклеточному сердцу млекопитающего. Бесклеточное сердце млекопитающего включает бесклеточную внеклеточную матрицу сердца, которая имеет наружную поверхность. Внеклеточная матрица бесклеточного сердца по существу сохраняет морфологию внеклеточной матрицы перед удалением клеток, и наружная поверхность внеклеточной матрицы является по существу интактной.
Характерные примеры сердца включают без ограничения сердца грызунов, сердца свиней, сердца кроликов, сердца коров, сердца овец или сердца собак. Другой пример сердца представляет собой сердце человека. Бесклеточное сердце может быть трупным. В некоторых вариантах осуществления, бесклеточное сердце представляет собой часть всего сердца. Например, часть всего сердца может включать без ограничения участок сердца, аортальный клапан, митральный клапан, клапан легочной артерии, трехстворчатый клапан, правое предсердие, левое предсердие, правый желудочек, левый желудочек, перегородку, коронарную сосудистую сеть, легочную артерию или легочную вену.
В другом аспекте, изобретение относится к солидному органу. Солидный орган, как указано в описании, включает описанное выше бесклеточное сердце и популяцию регенеративных клеток, прикрепленных к нему. В некоторых вариантах осуществления. регенеративные клетки представляют собой плюрипотентные клетки. В некоторых вариантах осуществления, регенеративные клетки представляют собой эмбриональные стволовые клетки, клетки пупочного канатика, стволовые клетки или клетки-предшественники, полученные у взрослых, клетки, полученные из костного мозга, клетки, полученные из крови, мезенхимальные стволовые клетки (MSC), клетки, полученные из скелетных мышц, мультипотентные взрослые клетки-предшественники (МАРС), стволовые клетки сердца (CSC) или стволовые клетки, происходящие из мультипотентных взрослых сердечных клеток. В некоторых вариантах осуществления, регенеративные клетки представляют собой сердечные фибробласты, клетки микрососудистой системы сердца или аортальные эндотелиальные клетки.
В целом, количество регенеративных клеток, присоединенных к бесклеточному сердцу, составляет по меньшей мере примерно 1000. В некоторых вариантах осуществления, количество регенеративных клеток, присоединенных к бесклеточному сердцу, составляет от примерно 1000 клеток/мг ткани (влажной массы; т.е., массы до удаления клеток) до примерно 10000000 клеток/мг ткани (влажной массы). В некоторых вариантах осуществления регенеративные клетки гетерогенны для бесклеточного сердца. Также, в некоторых вариантах осуществления, солидный орган предназначен для трансплантации пациенту, и регенеративные клетки аутологичны для пациента.
В еще одном аспекте, изобретение относится к способу получения солидного органа. Такой способ в целом включает получение бесклеточного сердца, как описано в описании, и приведение в контакт бесклеточного сердца с популяцией регенеративных клеток в условиях, в которых регенеративные клетки прививаются, размножаются и/или дифференцируются внутри и на бесклеточном сердце. В одном из вариантов осуществления, регенеративные клетки инъецируют или перфузируют в бесклеточное сердце.
В еще одном аспекте, изобретение относится к способу удаления клеток из сердца. Такой способ включает получение сердца, введение канюли в одну или несколько полостей сердца, сосуда и/или протока для получения канюлированного сердца и перфузию канюлированного сердца первой средой, разрушающей клетки, через одну или несколько канюль. Например, перфузия можно осуществлять во многих направлениях из каждой канюлированной полости, сосуда и/или протока. Обычно среда, разрушающая клетки, включает по меньшей мере один детергент, такой как SDS (додецилсульфат натрия), PEG (полиэтиленгликоль) или Triton X.
Такой способ также может включать перфузию канюлированного сердца второй средой, разрушающей клетки, через несколько канюль. Как правило, первая среда, разрушающая клетки, может представлять собой анионный детергент, такой как SDS, а вторая среда, разрушающая клетки, может представлять собой ионный детергент, такой как Triton X. В таких способах, перфузия может продолжаться в течение примерно от 2 до 12 ч/г (влажной массы) сердечной ткани.
Если нет других определений, то все технически и научные термины, используемые в настоящем описании, имеют значение, понятное среднему специалисту в данной области, к которой относится настоящее изобретение. Хотя способы и материалы, аналогичные или эквивалентные описаны в настоящем документе, можно использовать в практике или при тестировании настоящего изобретения, ниже описаны подходящие способы и материалы. Кроме того, материалы, способы и примеры являются только иллюстративными, а не ограничивающими. Все публикации, патентные заявки, патенты и другие ссылки, указанные в настоящем описании, полностью включены в него в качестве ссылки в полном объеме. В случае противоречий в настоящем описании, включая раздел «определения», будут сделаны соответствующие указания.
Подробное описание одного или нескольких вариантов осуществления изобретения изложены в сопроводительных чертежах в описании, ниже. Другие признаки, объекты и преимущества изобретения будут очевидны из чертежей и подробного описания, а также из формулы изобретения.
Описание чертежей
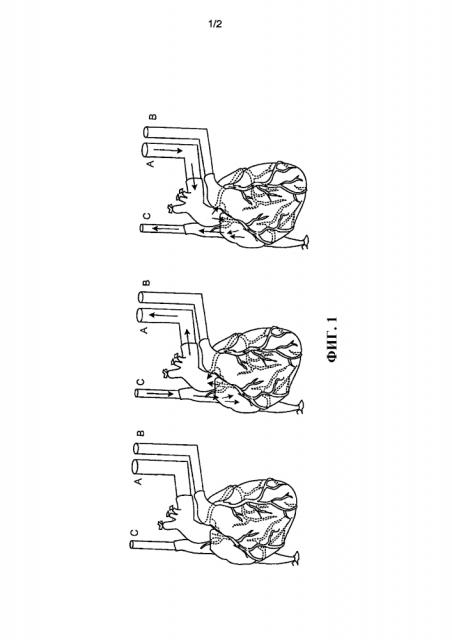
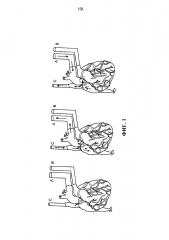
На фиг.1 представлен схематический чертеж, показывающий исходную подготовку для удаления клеток сердца. Аорта, легочная артерия и верхняя полая вена канюлированы (соответственно А, В, С), нижняя полая вена, плечеголовная артерия, левая общая сонная артерия и левая подключичная артерия перевязаны. Стрелки показывают направление перфузии в антеградном и ретроградном режиме.
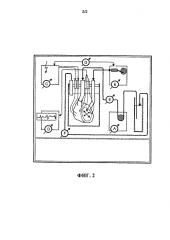
На фиг.2 представлено схематическое изображение одного из вариантов осуществления устройства для удаления/восстановления содержания клеток.
Одинаковые обозначающие символы на различных чертежах указывают на одинаковые элементы.
Подробное описание
Солидные органы, как правило, имеют три основных компонента, внеклеточную матрицу (ЕСМ), располагающиеся в ней клетки и сосудистое ложе. Удаление клеток из солидного органа, как описано в описании, приводит к удалению большинства или всех клеточных компонентов, в то же время по существу сохраняя внеклеточную матрицу (ЕСМ) и сосудистое ложе. Затем бесклеточный солидный орган можно использовать в качестве каркаса для восстановления содержания клеток.
Млекопитающие, у которых можно получить солидные органы, включают без ограничения грызунов, свиней, кроликов, крупный рогатый скот, овец, собак и людей. Органы и ткани, используемые в описанных в описании способах, могут быть трупными.
Указанные в настоящем описании солидные органы включают без ограничения сердце, печень, легкие, скелетные мышцы, мозг, поджелудочную железу, селезенку, почки, матку и мочевой пузырь. Используемый здесь термин «солидный орган» относится к органу, который имеет «по существу закрытую» сосудистую систему. «По существу закрытая» сосудистая система в отношении органа означает, что при перфузии жидкостью большая часть жидкости содержится внутри солидного органа и не вытекает из солидного органа, при условии, что основные сосуды канюлированы, перевязаны или отграничены другим образом. Несмотря на наличие «по существу закрытой» сосудистой системы, многие из перечисленных выше солидных органов имеют определенные сосуды «входа» и «выхода», которые используются для введения и передвижения жидкости по всему органу во время перфузии.
В дополнение к описанным выше солидным органам, другие типы васкуляризированных органов или тканей, такие как, например, все или части суставов (например, коленных, плечевых или тазобедренных), трахея или спинной мозг, можно лишить клеток, используя описанные здесь способы. Кроме того, раскрытые здесь способы можно также использовать для удаления клеток бессосудистых тканей, таких как, например, хрящ или роговица.
Бесклеточный орган или ткань, как описано в описании (например, сердце или печень) или любая их часть (например, аортальный клапан, митральный клапан, клапан легочной артерии, трехстворчатый клапан, легочная вена, легочная артерия, коронарные сосуды, перегородка, правое предсердие, левое предсердие, правый желудочек или левый желудочек) с восстановленным содержанием клеток или без него, можно использовать для трансплантации пациенту. Альтернативно, описанный в настоящем описании орган или ткань с восстановленным содержанием клеток можно использовать для исследования, например, клеток, подвергающихся дифференциации, и/или клеточной организации органа или ткани.
Удаление клеток из органов или тканей
Изобретение относится к способам и материалам для удаления клеток из органа или ткани млекопитающего. Первоначальная стадия удаления клеток из органа или ткани представляет собой, если возможно, канюлирование органа или ткани. Сосуды, протоки и/или полости органа или ткани можно канюлировать, используя способы и материалы, известные в данной области. Следующая стадия удаления клеток из органа или ткани представляет собой перфузию канюлированного органа или ткани средой для разрушения клеток. Перфузия через орган может осуществляться во многих направлениях (например, антеградное или ретроградное).
Перфузия сердца по Лангендорфу широко применяется в данной области, поскольку представляет собой физиологическую перфузию (также известную как четырехкамерная перфузия в рабочем режиме). См., например, Dehnert, The Isolated Perfused Warm-Blooded Heart According to Langendorff, In Methods in Experimental Physiology и Pharmacology: Biological Measurement Techniques V.Biomesstechnik-Verlag March GmbH, West Germany, 1988. Коротко, для перфузии по Лангендорфу аорта канюлируется и присоединяется к резервуару, содержащему среду, разрушающую клетки. Среду, разрушающую клетки, можно подавать в ретроградном направлении вниз по аорте или при постоянной скорости потока, поступающем, например, путем вливания или с помощью роликового насоса, или под постоянным гидростатическим давлением. В обоих случаях, аортальные клапаны принуждаются к закрытию, и перфузионная жидкость направляется в устья коронарных артерий (посредством этого перфузируя всю желудочковую массу сердца), которая затем дренируется в правое предсердие через коронарный синус. Для перфузии в рабочем режиме, вторая канюля соединяется с левым предсердием. И перфузию можно сменить с ретроградной на антеградную.
В данной области известны способы перфузии других органов и тканей. В качестве примера, в следующих ссылках описана перфузия легких, печени, почек, мозга и конечностей. Van Putte et al., 2002, Ann. Thorac. Surg., 74(3):893-8; den Butter et al., 1995, Transpl. Int., 8:466-71; Firth et ak., 1989, Clin. Sci. (Lond.) 77(6):657-61; Mazzetti et al., 2004, Brain Res., 999(1):81-90; Wagner et al., 2003, J. Artif. Organs, 6(3):183-91.
Для удаления клеток из органа или ткани можно использовать одну или несколько сред для разрушения клеток. Среды для разрушения клеток в целом включают по меньшей мере один детергент, такой как SDS, PEG или Triton X. Среды для разрушения клеток могут включать воду, если среда осмотически несовместима с клетками. Альтернативно, среды для разрушения клеток могут включать буфер (например, PBS (солевой раствор с фосфатным буфером)) для осмотической совместимости с клетками. Среды для разрушения клеток могут также включать ферменты, такие как без ограничения одна или несколько коллагеназ, одна или несколько диспаз, одна или несколько ДНаз, или протеаза, такая как трипсин. В некоторых случаях, среды для разрушения клеток могут также или альтернативно включать ингибиторы одного или нескольких ферментов (например, ингибиторов протеазы, ингибиторов нуклеазы и/или ингибиторов коллагеназы).
В определенных вариантах осуществления, канюлированный орган или ткань можно перфузировать последовательно двумя различными средами для разрушения клеток. Например, первая среда для разрушения клеток может включать анионный детергент, такой как SDS, а вторая среда для разрушения клеток может включать ионный детергент, такой как Triton X. После перфузии по меньшей мере одной средой для разрушения клеток, например, промывочными растворами и/или растворами, содержащими один или несколько ферментов, таких как ферменты, раскрытые в настоящем описании.
Чередование направления перфузии (например, антеградного и ретроградного) может помочь эффективно удалить клетки из всего органа или ткани. Описанное в настоящем описании удаление клеток по существу удаляет клетки органа наружу, приводя к очень небольшому повреждению ЕСМ. Клетки из органа или ткани можно удалять при подходящей температуре от 4 до 40°С. В зависимости от размера и массы органа или ткани, и конкретного детергента (детергентов) и концентрации детергента (детергентов) в разрушающей клетки среде, орган или ткань в целом перфузируется разрушающей клетки средой примерно от 2 до 12 ч/г солидного органа или ткани. Включая промывания, орган можно перфузировать в течение периода до примерно от 12 до примерно 72 ч/г ткани. Перфузия в целом приближается к физиологическим условиям, включая пульсирующий поток, скорость и давление.
Как указано в настоящем описании, бесклеточный орган или ткань состоит по существу из компонента внеклеточной матрицы (ЕСМ) всех или большинства областей органа или ткани, включая компонент ЕСМ сосудистого дерева. Компоненты ЕСМ могут включать любой или все из следующих компонентов: фибронектин, ламинин, эластин, членов семейства коллагена (например, коллаген I, III и IV), гликозоаминогликаны, молотое вещество, ретикулярные волокна и тромбоспондин, которые могут оставаться организованными в виде определенных структур, таких как базальная пластинка. Успешное удаление клеток определяется как отсутствие выявляемых мышечных нитей, эндотелиальных клеток, гладкомышечных клеток и ядер в гистологических срезах с использованием стандартных процедур гистологического окрашивания. Предпочтительно, но необязательно, остаточные клеточные осколки также удалялись из бесклеточного органа или ткани.
Для эффективного восстановления содержания клеток и создания органа или ткани, важно, чтобы сохранялась морфология и архитектура ЕСМ (т.е., оставалась по существу интактной) во время и после процесса удаления клеток. Используемый здесь термин «морфология» относится к общей форме органа или ткани ЕСМ, тогда как используемый здесь термин «архитектура» относится к наружной поверхности, внутренней поверхности и ЕСМ между ними.
Морфологию и архитектуру ЕСМ можно исследовать визуально и/или гистологически. Например, базальную пластинку наружной поверхности солидного органа или внутри сосудистой сети органа или ткани не следует удалять или значительно повреждать во время удаления клеток. Кроме того, фибриллы ЕСМ должны быть такими же, как в органе или ткани, которые не были лишены клеток, или значимо не измененными.
Одно или несколько соединений можно вносить в бесклеточный орган или ткань или наносить на них, например, для сохранения бесклеточного органа, или для подготовки бесклеточного органа или ткани к удалению клеток и/или для содействия клеткам или стимуляции их во время процесса восстановления содержания клеток. Такие соединения включают без ограничения один или несколько факторов роста (например, VEGF (сосудистый эндотелиальный фактор роста), DKK-1 (ген, ингибирующий активность остеобластов), FGF (фактор роста фибробластов), BMP-1, BMP-4 (белки, участвующие в остеогенезе), SDF-1 (фактор-1, полученный из стромальных клеток), IGF (инсулиноподобный фактор роста) и HGF (фактор роста гепатоцитов)), иммуномодулирующих агентов (например, цитокинов, глюкокортикоидов, антагонистов IL2R, антагонистов лейкотриена) и/или факторов, которые модифицируют каскад свертывания (например, аспирина, белков, связывающих гепарин, и гепарина). Кроме того, бесклеточный орган или ткань можно, кроме того, обработать, например, облучением (например, УФ, гамма) для уменьшения или устранения присутствия любого типа микроорганизма, остающегося на бесклеточном органе или ткани или в них.
Восстановление содержания клеток в органах или тканях
Изобретение относится к материалам и способам создания органа или ткани. Орган или ткань можно создавать путем приведения в контакт описанных в описании бесклеточного органа или ткани с популяцией регенеративных клеток. Используемый в настоящем описании термин «регенеративные клетки» обозначает любые клетки, используемые для восстановления содержания клеток в бесклеточном органе или ткани. Регенеративные клетки могут представлять собой тотипотентные клетки, плюрипотентные клетки или мультипотентные клетки, и могут быть некоммитированными или коммитированными. Регенеративные клетки могут также представлять собой клетки одной линии дифференцировки. Кроме того, регенеративные клетки могут представлять собой недифференцированные клетки, частично дифференцированные клетки или полностью дифференцированные клетки. Указанные в настоящем описании регенеративные клетки включают эмбриональные стволовые клетки (по данным определения Национального Института Здоровья (NIH), см., например, глоссарий на сайте Интернета www.stemcells.nih.gov). Регенеративные клетки также включают недифференцированные клетки, клетки-предшественники и полученные «взрослые» стволовые клетки, включая клетки пупочного канатика и фетальные стволовые клетки.
Примеры регенеративных клеток, которые можно использовать для восстановления содержания клеток в органе или ткани, включают без ограничения эмбриональные стволовые клетки, клетки крови пупочного канатика, полученные из ткани стволовые клетки или клетки-предшественники, полученные из костного мозга стволовые клетки или клетки-предшественники, мезенхимальные стволовые клетки (MSC), клетки, полученные из скелетных мышц, или мультипотентные взрослые недифференцированные клетки-предшественники (МАРС). Дополнительные регенеративные клетки, которые можно использовать, включают сердечные стволовые клетки (CSC), мультипотентные взрослые, полученные из сердца стволовые клетки, сердечные фибробласты, эндотелиальные клетки сердечной микрососудистой системы, или эндотелиальные клетки аорты. В качестве регенеративных клеток можно также использовать полученные из костного мозга стволовые клетки, такие как мононуклеарные клетки костного мозга (BM-MNC), эндотелиальные или сосудистые стволовые клетки или недифференцированные клетки-предшественники (ЕРС).
Количество регенеративных клеток, которые вводятся в бесклеточный орган или на него для генерирования органа или ткани, зависит и от органа (например, какой орган, размер и масса органа) или ткани, и от типа и стадии развития регенеративных клеток. Различные типы клеток могут иметь различные тенденции в отношении плотности популяции, которую достигнут те клетки. Аналогичным образом, различные органы или ткани могут быть заполнены клетками с различной плотностью. В качестве примера, бесклеточный орган или ткань может «засеваться» по меньшей мере примерно 1000 (например, по меньшей мере 10000, 100000, 1000000, 10000000 или 100000000) регенеративных клеток; или иметь примерно от 1000 клеток/мг ткани (влажной массы, т.е., перед удалением клеток) до примерно 10000000 клеток/мг ткани (влажной массы), прикрепленных к ней.
Регенеративные клетки можно ввести («засеять») в бесклеточный орган или ткань инъекцией в один или несколько участков. Кроме того, в бесклеточный орган или ткань можно ввести более одного типа клеток (т.е., смесь клеток). Например, смесь клеток можно инъецировать в множественные положения в бесклеточный орган или ткань, или различные типы клеток можно инъецировать в различные части бесклеточного органа или ткани. Альтернативно, или в дополнение к инъекции, регенеративные клетки или смесь клеток можно ввести перфузией в канюлированный орган или ткань. Например, регенеративные клетки можно перфузировать в бесклеточный орган, используя перфузионную среду, которую можно затем заменить средой экспансии и/или дифференциации для индукции роста и/или дифференциации регенеративных клеток.
Во время восстановления содержания клеток, орган или ткань поддерживаются в условиях, при которых по меньшей мере некоторые из регенеративных клеток могут размножаться и/или дифференцироваться внутри и на бесклеточном органе или ткани. Эти условия включают без ограничения соответствующую температуру и/или давление, электрическую и/или механическую активность, силу, соответствующие количества О2 и/или СО2, соответствующее количество влажности и стерильные или почти стерильные условия. Во время восстановления содержания клеток, бесклеточный орган или ткань и регенеративные клетки, прикрепленные к ним, поддерживаются в подходящей среде. Например, для регенеративных клеток могут потребоваться питательные добавки (например, питательные вещества и/или источник углерода, например, глюкоза), экзогенных гормонов или факторов роста, и/или определенного рН.
Регенеративные клетки могут быть аллогенными для бесклеточного органа или ткани (например, бесклеточного человеческого органа или ткани человека, засеянных человеческими регенеративными клетками), или регенеративные клетки могут быть ксеногенными для бесклеточного органа или ткани (например, бесклеточного органа или ткани свиньи, засеянных регенеративными клетками человека). Используемый в настоящем описании термин «аллогенные» относится к клеткам, полученным у того же вида, как вид, от которого происходит орган или ткань (например, родственных или не родственных индивидуумов), тогда как используемый в настоящем описании термин «ксеногенные» относится к клеткам, полученным от вида, отличного от вида, от которого происходит орган или ткань.
В некоторых случаях, орган или ткань, генерированные способами, описанными в настоящем описании, трансплантируется пациенту. В этих случаях, регенеративные клетки, используемые для восстановления содержания клеток в бесклеточном органе или ткани, можно получить у пациента, так что регенеративные клетки являются «аутологичными» для пациента. Регенеративные клетки пациента можно получить, например, из крови, костного мозга, тканей или органов на различных стадиях жизни (например, пренатально, неонатально или перинатально, во время подросткового периода или в качестве взрослого), используя способы, известные в данной области. Альтернативно, регенеративные клетки, используемые для восстановления содержания клеток в бесклеточном органе или ткани, могут быть сингенными (т.е., от идентичных близнецов) для пациента; регенеративные клетки могут представлять собой клетки, подобранные по лимфоцитарному антигену человека (HLA), например, от родственника пациента или от подобранного по HLA индивидуума, не являющегося родственником пациента; или аллогенные клетки могут быть аллогенными для пациента, например, от донора, не подобранного по HLA.
Независимо от источника регенеративных клеток (например, аутологичные или нет), бесклеточный солидный орган может быть аутологичным, аллогенным или ксеногенным для пациента.
В определенных случаях, в бесклеточном органе содержание клеток можно восстановить клетками in vivo (например, после трансплантации органа или ткани индивидууму). Восстановление содержания клеток in vivo можно осуществить, как описано выше (например, инъекцией или перфузией), например, любыми из описанных в настоящем описании регенеративных клеток. Альтернативно или дополнительно, засевание in vivo бесклеточного органа или ткани эндогенными клетками может происходить естественно или может быть опосредовано факторами, доставляемыми в ткань с восстановленным содержанием клеток.
Развитие регенеративных клеток можно контролировать во время восстановления содержания клеток. Например, количество клеток на органе или ткани или в них можно оценить взятием биопсии в одну или несколько точек времени во время восстановления содержания клеток. Кроме того, количество дифференциации, которой подверглись клетки, можно контролировать определением того, присутствуют или нет различные маркеры в клетке или популяции клеток. Маркеры, связанные с различными типами клеток и различными стадиями дифференциации для этих типов клеток, известны в данной области, и их можно легко выявить, используя антитела и стандартные иммуноанализы. См., например, Current Protocols in Immunology, 2005, Coligan et al., Eds., John Wiley & Sons, Chapter 3 and 11. Анализы нуклеиновых кислот, а также морфологическую и/или гистологическую оценку можно использовать для мониторинга восстановления содержания клеток.
Система регуляции для удаления и восстановления содержания клеток в органе или ткани
Изобретение также относится к системе (например, биореактору) для удаления и восстановления содержания клеток в органе или ткани. Такая система в целом включает по меньшей мере одно устройство для канюлирования органа или ткани, перфузионный аппарат для перфузии органа или ткани через канюлю (канюли), и средство (например, устройство для помещения содержимого) для поддержания стерильной среды для органа или ткани. Канюлирование и перфузия представляют собой хорошо известные методики в данной области. Устройство для канюлирования в целом включает полую трубку соответствующего размера для введения в сосуд, проток, и/или полость органа или ткани. Обычно, в органе канюлируются один или несколько сосудов, протоков и/или полостей. Аппарат для перфузии может включать удерживающий контейнер для жидкости (например, среды для разрушения клеток) и механизм для продвижения жидкости через орган (например, насос, воздушное давление, сила тяжести) через одну или несколько канюль. Стерильность органа или ткани во время удаления и/или восстановления содержания клеток можно поддерживать с использованием разнообразных методик, известных в данной области, таких как регулирование и фильтрация воздушного потока и/или перфузия, например, антибиотиками, противогрибковыми препаратами или другими противомикробными средствами для предотвращения роста нежелательных микроорганизмов.
С помощью описанной в настоящем описании системы для удаления и восстановления содержания клеток в органах или тканях можно контролировать определенные перфузионные характеристики (например, давления, объема, типа потока, температуры, газов, рН), механические силы (например, движения и напряжения стенок желудочков) и электрическую стимуляцию (например, навязывания ритма). Поскольку коронарное сосудистое ложе изменяется в ходе удаления и/или восстановления содержания клеток (например, сосудистое сопротивление, объем), аппарат для перфузии, контролируемый давлением, имеет преимущества во избежание больших колебаний. Эффективность перфузии можно оценить в вытекающей жидкости и в срезах ткани. Объем перфузии, типа потока, температуру, парциальное давление О2 и СО2 и рН можно контролировать, используя стандартные способы.
Для мониторинга устройства (например, биореактора) и/или органа или ткани можно использовать датчики. Сономикрометрию, микроманометрию и/или измерения проводимости можно использовать для получения информации о зависимости объема от давления или задействованной ударной работе при преднагрузке в отношении движения и функции стенки миокарда. Например, датчики можно использовать для мониторинга давления жидкости, протекающей через канюлированный орган или ткань; окружающей температуры в устройстве и/или температуры органа или ткани; рН и/или скорости потока жидкости, протекающей через канюлированный орган или ткань; и/или биологической активности восстановления содержания клеток в органе или ткани. В дополнение к наличию датчиков для мониторинга таких признаков, устройство для удаления и восстановления содержания клеток в органе или ткани может также включать средство для поддержания или регулирования таких признаков. Средство для поддержания или регулирования таких признаков может включать такие компоненты как термометр, термостат, электроды, датчики давления, клапаны перелива, клапаны для изменения скорости потока жидкости, клапаны для открытия и закрытия жидкостных соединений для растворов, используемых для изменения рН раствора, баллончик, внешний электростимулятор и/или камера растяжимости. Для содействия обеспечению стабильных условий (например, температуры), камеры, резервуары и трубки могут быть заключены в водяные кожухи.
Во время восстановления содержания клеток может иметь преимущество - воздействие механической нагрузки на орган и прикрепленные к нему клетки. В качестве примера, для воздействия механического напряжения на сердце, в левый желудочек через левое предсердие можно ввести баллончик. Поршневой насос, который обеспечивает возможность регулировки объема и скорости, можно соединить с баллоном для имитации движения и напряжения стенки левого желудочка. Для мониторинга движения и напряжения стенки, движение и давление стенки левого желудочка можно измерить, используя микроманометрию, и/или сономикрометрию. В некоторых вариантах осуществления, внешний электростимулятор может быть соединен с поршневым насосом для обеспечения синхронизированной стимуляции при каждом опорожнении желудочкового баллона (которое эквивалентно систоле). Периферическую ЭКГ можно регистрировать с поверхности сердца для обеспечения возможности регулировки напряжения электростимуляции, мониторинга де- и реполяризации, и для предоставления упрощенной поверхностной карты в процессе или после восстановления содержания клеток в сердце.
Механическое растяжение желудочка можно также достичь присоединением перистальтического насоса к канюле, введенной в левый желудочек, через левое предсердие. Аналогично описанной выше процедуре с использованием баллона, растяжение желудочка, достигаемое периодическим движением жидкости (например, пульсирующим потоком) через канюлю, можно синхронизировать электрической стимуляцией.
Используя описанные в настоящем описании способы и материалы, можно удалить и восстановить содержание клеток в сердце млекопитающего при поддержании его в соответствующих условиях, можно создать функционально полноценное сердце, которое выполняет сократительную функцию и реагирует на стимулы электростимуляции, и/или фармакологические средства. Это функционирующее сердце с восстановленным содержанием клеток можно трансплантировать млекопитающему, и оно может функционировать в течение некоторого периода времени.
На фиг.2 показан один из вариантов осуществления устройства для удаления и/или восстановления содержания клеток в органе или ткани (например, биореактора). Показанный вариант осуществления представляет собой биореактор для удаления и/или восстановления содержания клеток в сердце. Этот вариант осуществления имеет перистальтический насос (А) с регулируемой скоростью и объемом; поршневой насос с регулируемой скоростью и объемом, соединенный со внутрижелудочковым баллоном (В); внешний электростимулятор с регулируемым напряжением, частотой и амплитудой (С); регистратор ЭКГ (D); датчик давления в «артериальной магистрали» (которое равно давлению в коронарных артериях) (Е); датчик давления в «венозной» магистрали (которое равно давлению в коронарном синусе) (F); и синхронизацию между электростимулятором и поршневым насосом (G).
Система создания органа или ткани можно регулировать считываемой компьютером средой хранения в сочетании с программируемым процессором (например, используемая в настоящем описании считываемая компьютером среда хранения имеет хранящиеся на ней инструкции для вызова выполнения программируемым процессором определенных стадий). Например, такая среда хранения, в комбинации с программируемым процессором, может получать и обрабатывать информацию одного или нескольких из датчиков. Такая среда хранения, в комбинации с программируемым процессором, может также передавать информацию и инструкции назад в биореактор и/или орган или ткань.
Орган или ткань, подвергающиеся восстановлению содержания клеток, можно контролировать на наличие биологической активности. Биологическая активность может представлять собой биологическую активность самого органа или ткани, такую как электрическая активность, механическая активность, механическое давление, сократимость и/или напряжение стенки органа или ткани. Кроме того, биологическую активность клеток, прикрепленных к органу или ткани, можно контролировать, например, на активность транспорта/обмена железа, клеточное деление и/или жизнеспособность клеток. См., например, Laboratory Textbook of Anatomy и Physiology (2001, Wood, Prentice Hall) и Current Protocols in Cell Biology (2001, Bonifacino et al., Eds, John Wiley & Sons). Как обсуждалось выше, может быть полезно имитировать активную нагрузку на орган во время восстановления содержания клеток. Считываемую компьютером среду хранения по изобретению в комбинации с программируемым процессором можно использовать для координации компонентов, необходимых для контроля и поддержания активной нагрузки на орган или ткань.
В одном варианте осуществления, массу органа можно ввести в описанную здесь считываемую компьютером среду хранения, которая, в комбинации с программируемым процессором, может рассчитывать интервалы времени воздействия и величины давления перфузии для данного конкретного органа или ткани. Такая среда хранения может регистрировать преднагрузку и постнагрузку (соответственно давление до и после перфузии) и скорость потока. В настоящем варианте осуществления, считываемая компьютером среда хранения в комбинации с программируемым процессором может регулировать перфузионное давление, направление перфузии и/или тип перфузионного раствора через один или несколько насосов и/или клапанные регуляторы.
В соответствии с настоящим изобретением, можно использовать обычные методики молекулярной биологии, микробиологии, биохимии и клеточной биологии, известные в данной области. Такие методики подробно описаны в литературе. Далее изобретение будет описано в следующих примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
ПРИМЕРЫ
Раздел А. Удаление клеток (Часть I)
Пример 1 – Получение солидного органа для удаления клеток
Во избежание образования посмертных тромбов, крысам-донорам системно вводили гепарин в дозе 400 ЕД гепарина/кг массы донора. После введения гепарина сердце и примыкающие крупные сосуды осторожно удаляли.
Сердце помещали в физиологический солевой раствор (0,9%), содержащий гепарин (2000 ЕД/мл) и держали при 5°С до дальнейшей обработки. В стерильных условиях, соединительную ткань отделяли от сердца и крупных сосудов. Нижние полые вены и левые и правые легочные вены перевязывали дистальнее правого и левого предсердия, используя одноволоконные, нерассасываемые лигатуры.
Пример 2 – Канюлирование и перфузия солидного органа
Сердце для перфузии устанавливали на аппарат для удаления клеток (фиг.1). Нисходящую грудную аорту канюлировали для обеспечения возможности ретроградной коронарной перфузии (фиг.1, канюля А). Ветви грудной аорты (например, плечеголовной ствол, общую сонную артерию, левую подключичную артерию) перевязы