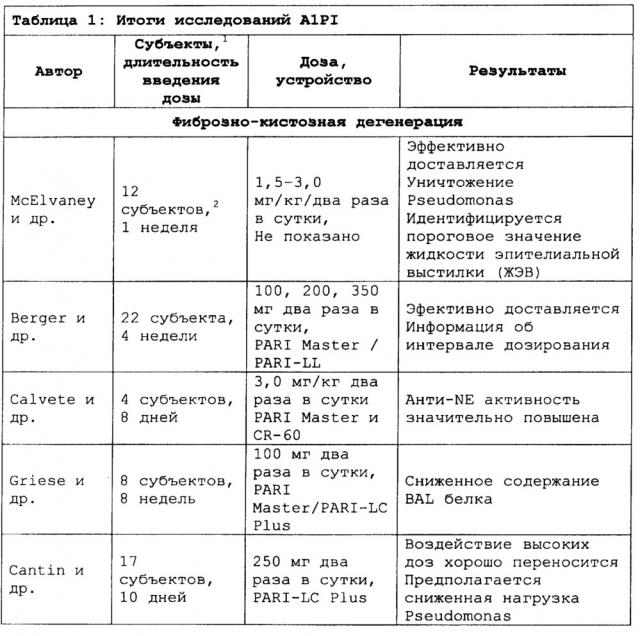
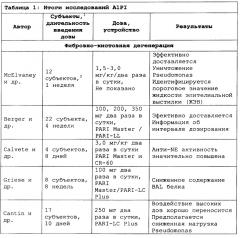
Ингибитор альфа1-протеиназы для задержки начала или прогрессирования легочных обострений
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к пульмонологии, и может быть использована для задержки начала или снижения прогрессирования одного или более симптомов, ассоциированных с лёгочными обострениями. Предложены способы, включающие введение субъекту эффективного количества ингибитора альфа1-протеиназы, очищенного при использовании хроматографии (A1PI-HC) путём ежедневной ингаляции в течение долгосрочного периода времени от 21 дня до 10 лет. При этом в одном варианте способа A1PI-HC является аэрозолированным и его вводят при использовании ингалятора в эффективном количество A1PI-HC от приблизительно 25 до приблизительно 750 мг в сутки или от приблизительно 0,5 до приблизительно 15 мг/кг/сутки. Возраст пациента должен составлять по крайней мере 12 лет. Лёгочное расстройство или заболевание представляет собой фиброзно-кистозную дегенерацию, хроническую обструктивную болезнь лёгких (ХОБЛ), дефицит альфа1-протеиназы (дефицит A1PI), эмфизему, астму, микобактерильную инфекцию, пневмонию, бронхоэктазию или хронический бронхит. Предложен также вариант способа, включающий предварительную идентификацию субъектов с повышенным риском обострений легочных заболеваний, приемлемых для A1PI поддерживающей терапии. При этом способ включает оценку одного или более критериев субъекта, таких как (a) возраст; (b) история обострений; (c) функция лёгких (FEV1); (d) хронический продуктивный кашель (с мокротой); (e) инфекционная нагрузка патогеном верхних и нижних дыхательных путей; (f) маркеры воспаления респираторного тракта выдыхаемого газа; (g) ответ на экзогенную провокацию для исследования на гиперреактивность дыхательных путей; (h) количество и классы сопутствующих средств лечения; (i) профиль генетического риска для респираторного заболевания; (j) факторы риска окружающей среды, такие как история курения, аллергии, факторы профессионального риска и/или воздействие загрязнения воздуха. После этого определяют, является ли или нет субъект кандидатом для A1PI поддерживающей терапии на основе указанных выше критериев, и вводят субъекту эффективное количество A1PI-НС путём ежедневной ингаляции в течение долгосрочного периода времени от 21 дня до 10 лет. В другом варианте способа указанное выше ингаляционное введение A1PI-HC проводят с помощью аэрозоля, генерируемого ингалятором один или более раз в сутки. Кумулятивная эффективная доза A1PI-НС составляет от приблизительно 25 до приблизительно 750 мг один раз в сутки. Группа изобретений обеспечивает эффективную профилактику и лечение лёгочных заболеваний и их обострений, ассоциированных с дефицитом альфа1-протеиназы за счёт введения препарата непосредственно в нижние отделы респираторного тракта при его низких терапевтических дозах. 5 н. и 7 з.п. ф-лы, 3 табл., 3 ил., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
В данной заявке описываются способы задержки начала легочных обострений или снижения их прогрессирования путем введения ингаляционного ингибитора альфа1-протеиназы.
УРОВЕНЬ ТЕХНИКИ
Ингибитор альфа1-протеиназы (в данной заявке употребляется сокращение A1PI; который также является известным как ингибитор альфа-1 протеиназы, альфа-1 PI, A1PI, α-1 PI, α1PI, ингибитор трипсина альфа-1, альфа-1 антитрипсин, альфа1АТ, А1А, и А1АТ, ААТ, среди прочих), представляет собой основной ингибитор сыворотки крови (серпин) у людей. A1PI экспрессируется в виде белка из 418 аминокислот с остатками 1-24, которые представляют собой сигнальный пептид. Зрелый белок, который состоит из остатков 25-418, представляет собой одноцепочечный гликопротеин, который имеет молекулярный вес приблизительно 51 кДа. Смотри Фигуру 1. В то время как A1PI не содержит каких-либо дисульфидных связей, этот белок является высокоструктурированным, с 80% аминокислот, которые размещаются в восьми хорошо определенных α-спиралях или трех больших β-складках. Были обнаружены три аспарагина, связанные с углеводом, в положениях остатков Asn 70, Asn 107 и Asn 271 (нумерация такая, как в белке полной длины). Это приводит к возникновению множества изоформ A1PI, которые имеют изоэлектрические точки в интервале от 4,0 до 5,0. Моносахариды гликана включают N-ацетилглюкозамин, маннозу, галактозу, фукозу и сиаловую кислоту.
Нормальные концентрации A1PI в плазме крови колеблются от 1,3 до 3,5 мг/мл. A1PI функционирует путем защиты клеток от протеаз, вовлеченных в свертывание крови и воспаление. A1PI ингбирует трипсин, химотрипсин и различные формы эластаз, кожную коллагеназу, ренин, урокиназу и протеазы полиморфонуклеарных лимфоцитов, среди прочих. A1PI служит в качестве псевдосубстрата для этих протеаз, которые атакуют петлю реактивного центра молекулы A1PI (остатки Gly 368 - Lys 392) путем расщепления связи между остатками Met 358 - Ser 359, образуя комплекс A1PI-протеаза. Этот комплекс быстро выводится из кровеносной системы.
Одна из эндогенных ролей A1PI заключается в регуляции активности эластазы нейтрофилов, которая разрушает чужеродные белки и повреждает нативную ткань, присутствующую в легких. При отсутствии достаточных количеств A1PI эластаза разрушает ткань легких, что с течением времени приводит к хроническому повреждению ткани легких и эмфиземе.
Белок A1PI представляет собой белок острой фазы воспаления, и его синтез как такового повышается во время эпизодов воспаления или стресса, что, в частности, имеет место во время периодов обострения. Пациенты с дефицитом A1PI испытывают риск тяжелого повреждения легких во время периодов обострения по причине неспособности установления эффективного повышения A1PI в острой фазе. Относительный дефицит A1PI может также возникать у нормальных индивидуумов во время периодов острого обострения, что приводит к избытку эластазы нейтрофилов, приводящей к разрушению ткани легких.
Внутривенные A1PI использовались в качестве средства лечения недостаточности альфа1-анти-трипсина (AATD; то есть, дефицита A1PI), врожденного заболевания. Последствия низких уровней A1PI в жидкости эпителиальной выстилки нижней части респираторного тракта индивидуумов с дефицитом A1PI представляют собой недостаточный защитный экран анти-эластазы нейтрофилов легких, так, что эластаза нейтрофилов является способной действовать беспрепятственно для атаки и разрушения альвеолярных структур. Обусловленное этим повреждение легких значительным образом усиливается курением сигарет и является необратимым.
Кроме того, ингаляционные A1PI были предложены в качестве острой терапии для снижения тяжести и длительности подтвержденных острых обострений легочных заболеваний. Смотри патенты США №7,879,800 и 7,973,005. Однако подтвержденные обострения легочных заболеваний могут быть сложными для устранения при использовании A1PI. Кроме того, повторяемые обострения повреждают ткань легких и могут прогрессивно снижать FEV1 субъекта. Введение A1PI в начале воспаления предполагается как такое, которое является более эффективным, чем ожидание развития дополнительных симптомов обострения, которые могут отставать от начала воспаления на часы - дни. Усовершенствованная терапия, которая задерживает начало легочных обострений или снижает их прогрессирование, заведомо является желательной.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ
В данной заявке описываются способы для задержки начала легочных обострений или снижения их прогрессирования у субъекта, который в этом нуждается, включающие введение субъекту эффективного количества A1PI путем ингаляции.
В одном аспекте способа, описанного в данной заявке, A1PI является аэрозолированным.
В другом аспекте способа, описанного в данной заявке, A1PI вводится при использовании ингалятора.
В другом аспекте способа, описанного в данной заявке, A1PI вводится, по крайней мере, один раз в день.
В другом аспекте способа, описанного в данной заявке, эффективное количество A1PI составляет от приблизительно 25 мг до приблизительно 750 мг A1PI в сутки.
В другом аспекте способа, описанного в данной заявке, эффективное количество A1PI составляет от приблизительно 0,5 мг/кг/сутки до приблизительно 15 мг/кг/сутки.
В другом аспекте способа, описанного в данной заявке, субъект, который нуждается в этом, представляет собой такого в возрасте, по крайней мере, 12 лет.
В частном воплощении способа, описанного в данной заявке, обострения легочных заболеваний ассоциируются с фиброзно-кистозной дегенерацией, ХОБЛ (хронической обструктивной болезнью легких), AATD (дефицитом альфа анти-трипсина), эмфиземой, астмой, микобактериальной инфекцией, пневмонией, бронхоэктазией или хроническим бронхитом.
В частном воплощении способа, описанного в данной заявке, обострения легочных заболеваний ассоциируются с повышенной тяжестью обострений; повышенной частотой обострений; сниженной функцией легких; сниженным уровнем FEV1 повышенной потерей ткани легких; сниженными уровнями ингибитора альфа1-протеиназы; повышенными уровнями легочной эластазы; повышенным уровнем легочных инфекций; повышенной бактериальной нагрузкой легких или повышенной сердечной аритмией.
В другом аспекте способа, описанного в данной заявке, A1PI очищают с помощью способа, описанного в публикации патентной заявки США US 2011/0237781 А1.
В другом аспекте способа, описанного в данной заявке, A1PI представляет собой рекомбинаный A1PI.
В другом аспекте способа, описанного в данной заявке, A1PI очищают с помощью способа для очистки A1PI из водного раствора, содержащего A1PI, при этом способ включает: (а) удаление части контаминирующих белков из водного раствора путем осаждения для получения очищенного раствора, содержащего A1PI; (b) пропускание очищенного раствора через анионообменную смолу так, что A1PI связывается с анионообменной смолой; (с) элюирование A1PI из анионообменной смолы для получение элюированного раствора, содержащего A1PI; (d) пропускание элюированного раствора через катионообменную смолу; (е) сбор элюата, прошедшего через катионообменную смолу, который содержит A1PI; и (f) приведение в контакт элюированного раствора этапа (с) или элюата этапа (е) с гидрофобным адсорбентом, по крайней мере, одной HIC среды.
Кроме того, в данной заявке описывается способ задержки начала или прогрессирования одного или более симптомов, которые ассоциируются с легочным расстройством или заболеванием у субъекта, который в этом нуждается, включающий ежедневное введение эффективного количества A1PI путем ингаляции; где A1PI является аэрозолированным; при этом A1PI вводится при использовании ингалятора; где эффективное количество A1PI составляет от приблизительно 25 мг до приблизительно 750 мг A1PI в сутки; а также где эффективное количество A1PI составляет от приблизительно 0,5 мг/кг/сутки до приблизительно 15 мг/кг/сутки; где субъект является таким в возрасте, по крайней мере, 12 лет; при этом легочное расстройство или заболевание представляет собой фиброзно-кистозную дегенерацию, ХОБЛ, дефицит A1PI, эмфизему, астму, микобактериальную инфекцию, пневмонию, бронхоэктазию или хронический бронхит; и где легочное расстройство или заболевание ассоциируются с одним или более обострением легочных заболеваний; повышенной тяжестью обострений; повышенной частотой обострений; сниженной функцией легких; сниженным уровнем FEV1; повышенной потерей ткани легких; сниженными уровнями ингибитора альфа1-протеиназы; повышенными уровнями легочной эластазы; повышенным уровнем легочных инфекций; повышенной бактериальной нагрузкой легких или повышенной сердечной аритмией.
Кроме того, в данной заявке описывается способ для идентификации субъекта, который нуждается в A1PI поддерживающей терапии для задержки начала или снижения прогрессирования обострений легочных заболеваний, включающий оценку одного или более из критериев, относящихся к субъекту: (а) возраст; (b) история обострений; (с) функция легких (FEV1); (d) хронический продуктивный кашель (с мокротой); (е) инфекционная нагрузка патогеном верхних и нижних дыхательных путей; (f) маркеры воспаления респираторного тракта выдыхаемого газа; (g) ответ на экзогенную провокацию для исследования на гиперреактивность дыхательных путей; (h) количество и классы сопутствующих средств лечения; (i) профиль генетического риска для респираторного заболевания; и (j) переменные окружающей среды, такие, как история курения, аллергии, факторы профессионального риска и/или воздействие загрязнения воздуха; и где определение осуществляют для того, чтобы установить, является ли субъект (или не является ли) кандидатом для A1PI поддерживающей терапии на основе указанных выше критериев.
Кроме того, в данной заявке описываются способы для идентификации субъектов с повышенным риском обострений легочных заболеваний, приемлемых для A1PI поддерживающей терапии, при этом способ включает оценку одного или более критериев, относящихся к субъекту (а) возраст; (b) история обострений; (с) функция легких (FEV1); (d) хронический продуктивный кашель (с мокротой); (е) инфекционная нагрузка патогеном верхних и нижних дыхательных путей; (f) маркеры воспаления респираторного тракта выдыхаемого газа; (g) ответ на экзогенную провокацию для исследования на гиперреактивность дыхательных путей; (h) количество и классы сопутствующих средств лечения; (i) профиль генетического риска для респираторного заболевания; и (j) переменные окружающей среды, такие, как история курения, аллергии, факторы профессионального риска и/или воздействие загрязнения воздуха; и где определение осуществляют для того, чтобы установить, является ли субъект (или не является ли) кандидатом для A1PI поддерживающей терапии на основе указанных выше критериев.
Кроме того, в данной заявке описывается применение A1PI для задержки начала или прогрессирования легочных обострений у субъекта, который в этом нуждается, которое включает ежедневное введение эффективного количества ингаляционного A1PI.
Кроме того, в данной заявке описывается применение A1PI для задержки начала или прогрессирования легочного заболевания у субъекта, который в этом нуждается, включающее ежедневное введение эффективного количества ингаляционного A1PI.
Кроме того, в данной заявке описывается применение A1PI для поддержания свободного от легочного заболевания состояния, которое включает ежедневное введение эффективного количества ингаляционного A1PI.
Кроме того, в данной заявке описывается устройство для введения аэрозолированного A1PI для ингаляции, включающее распылитель.
В одном аспекте устройство для введения аэрозолированного A1PI, которое включает распылитель, где распылитель содержит (а) аэрозольный генератор, включающий: контейнер для хранения жидкости, который включает жидкую фармацевтическую композицию; диафрагму, имеющую одну сторону и противоположную вторую сторону, при этом диафрагма содержит множество отверстий, простирающихся через нее от первой стороны до второй стороны, где первая сторона является соединенной с контейнером для хранения жидкости, так, что жидкость, заполняющая контейнер для хранения, входит в контакт с первой стороной диафрагмы; и генератор колебаний, способный к вызывать колебания диафрагмы так, что жидкость, содержащаяся в контейнере для хранения жидкости, распыляется на вторую сторону диафрагмы через отверстия на диафрагме; (b) камеру для смешивания, в которую аэрозольный генератор выталкивает указанный аэрозоль, при этом камера для смешивания находится в контакте со второй стороной диафрагмы; и (с) ингаляционный клапан, который является открытым для того, чтобы позволить осуществлять поступление атмосферного воздуха в камеру для смешивания во время фазы ингаляции, и является закрытым для того, чтобы предотвратить выход указанного аэрозоля из камеры для смешивания в фазу выделения; где фармацевтическая композиция A1PI распыляется с помощью ингаляционного распылителя с образованием аэрозольной композиции.
В другом аспекте устройства для введения аэрозолированного A1PI для ингаляции, описанного в данной заявке, указанное устройство может включать клапан выхода.
Кроме того, в данной заявке описываются средства для введения аэрозолированного A1PI для ингаляции, включающие распылитель.
Кроме того, в данной заявке описывается способ задержки начала или снижения прогрессирования одного или более симптомов, асоциированных с обострениями легочных заболеваний у субъекта, который включает способ для идентификации субъектов с повышенным риском обострений легочных заболеваний, приемлемых для A1PI поддерживающей терапии, где способ включает оценку одного или более критериев, относящихся к субъекту (а) возраст; (b) история обострений; (с) функция легких (FEV1); (d) хронический продуктивный кашель (с мокротой); (е) инфекционная нагрузка патогеном верхних и нижних дыхательных путей; (f) маркеры воспаления респираторного тракта выдыхаемого газа; (g) ответ на экзогенную провокацию для исследования на гиперреактивность дыхательных путей; (h) количество и классы сопутствующих средств лечения; (i) профиль генетического риска для респираторного заболевания; и (j) переменные окружающей среды, такие, как история курения, аллергии, факторы профессионального риска и/или воздействие загрязнения воздуха; и где определение осуществляют для того, чтобы установить, является ли субъект (или не является ли) кандидатом для A1PI поддерживающей терапии на основе указанных выше критериев, и введение этому субъекту эффективного количества A1PI путем ингаляции.
Кроме того, в данной заявке описывается способ для задержки начала или снижения прогрессирования одного или более симптомов, ассоциированных с легочным обострением у субъекта, при этом способ включает ежедневное введение эффективного количества A1PI путем ингаляции, где субъект имеет одно или более из следующих (а) повышенный риск острого обострения легочного заболевания; (b) значительное снижение респираторной функции; или (с) история обострений легочных заболеваний, ассоциированных с фиброзно-кистозной дегенерацией, ХОБЛ, дефицитом A1PI, эмфиземой, астмой, микобактериальной инфекцией, пневмонией, бронхоэктазией или хроническим бронхитом; где субъект получает ингаляционный A1PI, который вводится с помощью аэрозоля и обеспечивается с помощью ингалятора один или более раз в сутки; и где куммулятивно эффективная доза A1PI составляет от приблизительно 25 мг до приблизительно 750 мг в сутки.
Другой аспект, описанный в данной заявке, представляет собой способ для задержки начала или снижения прогрессирования одного или более симптомов, ассоциированных с легочным обострением у субъекта, при этом способ включает ежедневное введение эффективного количества A1PI путем ингаляции, где способ может приводить к сниженной госпитализации; сниженной интенсивности ухода или необходимости механической вентиляции; сниженному потреблению ресурсов или нагрузки системы здравоохранения; сниженному пропуску занятий или работы; сниженной потребности в антибиотиках; сниженной потребности в стероидах; сниженной частоте рецидивов; сниженной смертности; и улучшенному качеству жизни для субъектов.
Другие воплощения, описанные в данной заявке, представляют собой наборы для задержки начала или снижения прогрессирования одного или более симптомов, ассоциированных с легочным обострением у субъекта.
Один аспект, описанный в данной заявке, представляет собой набор для задержки начала или прогрессирования обострений легочных заболеваний, который включает A1PI в готовом к использованию контейнере.
Другой аспект, описанный в данной заявке, представляет собой набор, который также включает, по крайней мере, одну дозу, по крайней мере, одной композиции для применения в способах, описанных в данной заявке. В некоторых аспектах, например, набор включает, по крайней мере, одну дневную дозу или одну эффективную дозу A1PI.
Другой аспект, описанный в данной заявке, представляет собой набор, который также включает, по крайней мере, одну дозу, по крайней мере, одной композиции для задержки начала легочных обострений или их прогрессирования, как описано в данной заявке, и устройство для доставки этой композиции.
Другой аспект, описанный в данной заявке, представляет собой набор, который дополнительно включает один или более дополнительных агентов, как описано в данной заявке, для задержки начала или прогрессирования легочных обострений, включая один или более бронходилататоров, один или более кортикостероидов и/или одно или более муколитических средств, одно или более отхаркивающих средств, один или более антибиотиков или один или более антиоксидантов.
Другой аспект, описанный в данной заявке, представляет собой набор для задержки начала или прогрессирования легочных обострений у субъекта, который в этом нуждается, как описано в данной заявке, который включает: по крайней мере, одну дозу A1PI, или, по крайней мере, эффективную дозу A1PI, каждая из которых содержится в индивидуальном контейнере; инструкции для применения набора и оценки субъекта, который в этом нуждается; необязательно, устройство для введения A1PI путем ингаляции; необязательно, один или более дополнительных агентов, как описано в данной заявке, для задержки начала или прогрессирования легочных обострений, включая один или более бронходилататоров, один или более кортикостероидов и/или одно или более муколитических средств, одно или более отхаркивающих средств, один или более антибиотиков или один или более антиоксидантов.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
ФИГУРА 1 Первичная последовательность полноразмерного человеческого ингибитора альфа1-протеиназы, A1PI. Зрелый белок состоит из аминокислот 25-419.
ФИГУРА 2: Функциональная диаграмма схемы очистки для человеческого A1PI-HC из второй фракции Коэна IV-1 массы. Смотри в публикации патентной заявки США № US 2011/0237781 А1.
ФИГУРА 3: Количество острых легочных обострений у пациентов с фиброзно-кистозной дегенерацией в 2005 году по возрастным группам. Ось X показывает интервалы возраста, с каждым столбцом возрастного интервала, подразделенным в соответствии с процентным соотношением пациентов, которые имеют определенное количество обострений, как обозначается цветом на надписях к фигуре. Данные ежегодного отчета за 2005 год реестра пациентов Фонда муковисцидоза.
ПОДРОБНОЕ ОПИСАНИЕ
A1PI до настоящего момента не использовался для хронической (долгосрочной) поддерживающей терапии при введении респираторным путем для задержки начала или снижения прогрессирования легочных обострений.
Как используется в данной заявке, термины и фразы "обострение" "обострение легочного заболевания" "период обострения" и "эпизод обострения" используются попеременно для описания повышения тяжести легочного заболевания или расстройства и каких-либо его симптомов, которые ассоциируются с ухудшением качества жизни пациентов. В общем случае, обострения являются частыми у пациентов с хроническими легочными заболеваниями. "Обострения легочных заболеваний" относится к ухудшению и/или повышению тяжести, и/или величины симптома легочного заболевания по причине воспаления или инфекции. Обострение легочного заболевания в общем случае характеризуется: (а) затрудненным дыханием; (b) слабостью; (с) усиленным кашлем; (d) хроническим, более продуктивным кашлем (то есть, повышенным выделением мокроты); (е) сокращением функции легких (FEV1); (f) маркерами воспаления респираторного тракта выдыхаемого газа; и (g) профилем генетического риска для респираторного заболевания, или другими маркерами легочной функции. Обострения легочных заболеваний выявляют высокую степень корреляции с длительным повреждением ткани легких и функции.
"Острый", как используется в данной заявке, означает внезапное возникновение и проявление выраженной тяжести. В отношении доставки или воздействия "острый" относится к относительно короткой длительности.
"Хронический", как используется в данной заявке, означает тот, который существует в течение длительного периода времени, иногда также означает наличие низкой интенсивности. В отношении доставки или выведения "хронический" означает удлиненный или длительный период.
Как используется в данной заявке, фраза "фиброзно-кистозная дегенерация" (муковисцидоз) или "CF" относится к наследственному аутосомальному рецессивному расстройству, которое вызывается мутациями в гене, который кодирует муковисцидозный трансмембранный регулятор проводимости (CFTR) хлоридного канала.
"Недостаток альфа1-антитрипсина" или "дефицит A1PI," как используется в данной заявке, относится к аутосмомальному рецессивному генетическому расстройству, которое вызывает как легочные, так и печеночные заболевания. Дефицит A1PI поражает 1 из 1800 живых новорожденных в популяции Северной Европы и Северной Америки. Фундаментальный патологический процесс дефицита A1PI представляет собой аккумуляцию молекул мутантного ингибитора альфа1-протеазы в виде полимеров в гепатоцитах. Полученные низкие уровни A1PI в крови приводят к повреждению легких протеиназами и, в конечном счете, к эмфиземе. Заболевание легких у пациентов с дефицитом A1PI обычно имеет более раннее начало, чем у пациентов с хронической обструктивной болезнью легких (COPD) и часто оказывается непропорциональным их истории курения. Типичная модель демонстрирует преобладание эмфиземы нижней доли легкого или панаценозной эмфиземы. Патогенез эмфиземы, ассоциированной с дефицитом A1PI, является тесно связанным с эластазой нейтрофилов. Лейкоцитарная эластаза, фермент нейтрофилов, связывается с активным сайтом A1PI и необратимо инактивирует его стохастическим образом. Высокие уровни эластазы вызывают деградацию эластина, что приводит к значительному повреждению ткани легких. Курение представляет собой четко выраженный составляющий фактор для развития заболевания легких.
Генетические факторы и факторы риска, связанные с окружающей средой, такие, как история курения, аллергии, профессиональное воздействие отравляющих веществ, и/или воздействие загрязнения воздуха, также являются вовлеченными в патогенез ассоциированных с A1PI заболеваний легких.
Термин "эмфизема", как используется в данной заявке, относится к патологическому состоянию легких, при котором существует снижение респираторной функции и частая одышка по причине патологического повышения размера воздушных полостей, что вызывается необратимым обширным разрывом альвеол и/или разрушением альвеолярных стенок с помощью эластазы нейтрофилов. Эмфизема представляет собой патологическое состояние легких, которое характеризуется патологическим увеличением размера воздушных полостей, что приводит к натужному дыханию и повышенной чувствительности к инфекции. Это может быть вызвано необратимым обширным разрывом альвеол или разрушением альвеолярных стенок. По причине повреждения, которому подвергаются ткани легких, теряется эластичность ткани, что приводит к воздушной ловушке в воздушных капсулах и к нарушению обмена кислорода и диоксида углерода. В связи с повреждениями стенок поддержка респираторных путей утрачивается, что приводит к обструкции потока воздуха. Эмфизема и хронический бронхит часто существуют одновременно и включаются в понятие хроническая обструктивная болезнь легких.
Как используется в данной заявке, фраза "хроническая обструктивная болезнь легких" или "ХОБЛ," относится к болезненному состоянию, которое характеризуется ограничением потока воздуха, что не является полностью обратимым. Ограничение потока воздуха обычно является как прогрессирующим, так и ассоциированным с патологическим воспалительным ответом легких на вредоносные частицы или газы. Симптомы, функциональные патологии и осложнения ХОБЛ могут приписываться этому явлению, которое лежит в основе патологического воспалительного ответа, и процессам, которые являются с ним связанными.
Хроническое ограничение потока воздуха, характерное для ХОБЛ, вызывается комбинацией заболевания мелких респираторных путей (обструктивный бронхиолит) и паренхиматозной деструкции (эмфизема), относительный вклад каждого из них варьирует в зависимости от субъекта. Хроническое воспаление вызывает реконструкцию и сужение малых дыхательных путей. Деструкция легочной паренхимы, как и воспалительные процессы, приводит к потере альвеолярного прикрепления к малым дыхательным путям и снижают эластическую тягу легких; эти изменения уменьшают способность дыхательных путей оставаться открытыми в процессе дыхания.
Дополнительно к воспалению, два других процесса подразумеваются как важные в патогенезе ХОБЛ: дисбаланс протеиназ и антипротеиназ в легких и оксидативный стресс. Эти процессы могут сами по себе быть последствиями воспаления или они могут возникать в результате воздействия факторов окружающей среды (например, окислительные соединения в сигаретном дыме), генетических факторов (например, дефицит альфа1-антитрипсина).
Прогрессивное течение ХОБЛ осложняется эпизодами обострения, которые имеют множество причин и возникают с повышающейся частотой как прогрессирование заболевания. Наиболее общие причины для обострения представляют собой инфекцию трахеобронхиального дерева и загрязнение воздуха, но причина приблизительно трети из подвергающихся мониторингу серьезных обострений не может быть идентифицирована. Этот эффект обострений может быть более очевидным у пациентов, которые имеют от легкой до умеренной формы заболевания, и повышенное число обострений было продемонстрировано как такое, которое коррелирует со снижением переноса газа в процессе выдоха. Обострения могут подвергаться лечению в домашних условиях, но очень часто является необходимым медицинское вмешательство и госпитализация. Больничная смертность пациентов, госпитализированных по причине ХОБЛ, составляет приблизительно 10%, и долгосрочное выживание является слабым.
Трехгодичное исследование по данным наблюдения за 2138 пациентами с ХОБЛ Hurst и др. показало, что существует очевидный фенотип подверженности обострению. Hurst и др., N. Engl. J. Med. 363: 1128-1138. Эта группа пациентов имела два или более обострений в год. Наилучший показатель фенотипа подверженности обострению представляет собой историю частых обострений. Hurst и др., N. Engl. J. Med. 363: 1128-1138.
"Астма", как используется в данной заявке, относится к хроническому респираторному заболеванию, часто возникающему в результате аллергии, которое характеризуется внезапным рецидивирующим приступом утрудненного дыхания, сдавливания грудной клетки и кашлем. При типичной астматической реакциии IgE антитела главным образом присоединяются к тучным клеткам, которые находятся в выстилке легких в тесной связи с бронхиолами и малыми бронхами. Антиген, который поступает в воздушные пути, будет, таким образом, реагировать с комплексом тучная клетка-антитело, вызывая высвобождение нескольких веществ, включая, но без ограничения таковыми, интерлейкиновые цитокины, хемокины и медиаторы, имеющие происхождение от арахидоновой кислоты, что приводит к сужению бронхов, гиперреактивности воздушных путей, избыточной секреции слизи и воспалению воздушных путей.
"Пневмония", как используется в данной заявке, относится к острой инфекции одного или более функциональных элементов легких, включая альвеолярные пространства и интерстициальную ткань. В общем случае, пневмония может возникать в результате острого заболевания легких, воспалительного заболевания легких или любых изменений функция легких благодаря таким факторам, как воспаление или коагуляция.
"Тяжелый хронический бронхит" или "бронхоэктазия", как используется в данной заявке, относится к патологической и необратимой дилатации проксимальных бронхов среднего размера (>2 мм в диаметре), вызванной деструкцией мышечных и эластических компонентов стенок бронхов. Это заболевание может быть врожденным или приобретенным. Бронхоэктазия может быть вызвана бактериями Streptococcus pneumoniae, Haemophilus influenzae, Staphylococus aureus и Moraxella catarrhalis, a атипические пневмонии вызываются Legionella pneumoniae, Chlamydia pneumoniae и Mycoplasma pneumoniae, включая Pseudomonas aeruginosa.
"Микобактерильная инфекция", как используется в данной заявке, относится к легочной инфекции, вызванной различными видами Mycobacterium. "Туберкулез" или "ТВ" представляет собой один пример переносимой воздухом хронической инфекции Mycobacterium tuberculosis.
Термин "субъект", как используется в данной заявке, относится к любому животному, индивидууму или пациенту, в отношении которого применяются способы, описанные в данной заявке. В общем случае, субъект представляет собой человека, хотя, как может быть оценено специалистом в данной области техники, субъект может представлять собой животное. Таким образом, другие животные, включая млекопитающих, таких, как грызуны (включая мышей, крыс, хомяков и морских свинок), коты, собаки, кролики, сельскохозяйственные животные, включая коров, лошадей, коз, овец, свиней и т.д., и приматы, отличные от человека (включая обезьян, шимпанзе, орангутангов и горилл), являются включенными в определение субъекта.
"Субъект, который нуждается (в лечении)", как используется в данной заявке, относится к субъекту, который имеет обострение заболевания легких или имеет риск развития такового. Субъект, который нуждается (в лечении), может иметь респираторное заболевание или расстройство, которое ассоциируется с обострением заболевания легких, или иметь риск развития такового.
Термины "лечить", "подвергается лечению" и "лечение", как используется в данной заявке, относится к задержке начала легочных обострений или снижению их прогрессирования, как описано в данной заявке.
"Ингаляция" относится к способу введения соединения, который доставляет эффективное количество соединения, которое таким образом вводится или доставляется к тканям легких или нижних дыхательных путей субъекта при использовании ингаляции соединения, с помощью чего соединение вводится в легкие. Как используется в данной заявке, "введение" представляет собой синоним "доставки".
Фразы "легочное введение", "респираторное введение", "пульмональная доставка" и "респираторная доставка" являются синонимами, как используется в данной заявке, и относятся к введению или доставке A1PI субъекту путем ингаляции через рот и/или нос в легкие и нижние дыхательные пути.
Как используется в данной заявке, фразы "терапевтически эффективное количество", "эффективное количество" или "эффективная доза" являются синонимами и относятся к количеству A1PI, которое является эффективным для задержки начала легочных обострений или снижения прогрессирования таковых в течение периода времени у субъекта, которому оно вводится, как описано в данной заявке. Как используется в данной заявке, "терапевтический эффект" относится к выходу или последствиям, которые получают в результате введения терапевтически эффективного количества A1PI субъекту, который может включать задержку начала легочных обострений или снижение их прогрессирования, как описано в данной заявке, среди прочих эффектов.
"Терапия" или "терапевтический", как используется в данной заявке, относится к введению эффективного количества A1PI для задержки начала легочных обострений или снижения прогрессирования таковых.
"Поддерживающая терапия", как используется в данной заявке, относится к регулярному, периодическому введению A1PI для поддержания достаточного уровня A1PI в легких у субъекта или системе кровообращения для наличия терапевтического эффекта у субъекта.
"Дополнительная терапия", как используется в данной заявке, относится к дополнению, замещению или повышению in vivo недостаточных количеств или концентраций биомолекулы, такой как A1PI для того, чтобы получить терапевтический эффект у субъекта.
Один аспект способа, описанного в данной заявке, представляет собой A1PI поддерживающую терапию для респираторных заболеваний или расстройств, которые ассоциируются с обострением легочных заболеваний. В некоторых аспектах способов, описанных в данной заявке, A1PI поддерживающая терапия включает дополнительную терапию.
Неограничивающие примеры симптомов, ассоциированных с обострениями легочных заболеваний у субъекта, охватывают такие, которые включают критерии Фукса, такие, как изменения мокроты; появившийся или повышенный гемоптизиз; усиленный кашель; повышенную одышку; чувство тревоги, усталости или сонливости; лихорадка с температурой тела выше 38°С; анорексия или потеря веса; боль или болезненность в придаточных пазухах носа; изменение синусоидального секрета; изменения физического исследования грудной клетки; снижение легочной функции (FEV1) на 10 процентов или более по сравнению с ранее зарегистрированным значением; или любые радиографические изменения, показательные для инфекции легких. Для того чтобы соответствовать критериям Фукса, должны присутствовать любые четыре из перечисленных выше. Смотри Fuchs и др., N. Engl. J. Med. 331: 637-642 (1994).
"Ингибитор альфа1-протеазы" или "A1PI," как используется в данной заявке, относится ко всем существующим в природе полиморфным формам A1PI. A1PI также относится к A1PI, полученному из плазмы крови, и A1PI, который может быть получен коммерческим путем. A1PI также относится к человеческому или не-человеческому A1PI. В некоторых аспектах A1PI представляет собой полученный из плазмы крови A1PI. В некоторых аспектах A1PI получают массы фракции Коэна IV-1. В других аспектах A1PI получают из истощенной по альбумину фракции плазмы крови, преципитата V Коэна, или из предварительно очищенной фракции препарата A1PI. Патенты США №4,697,003; 5,610,285; 6,093,804; 6,462,180; 6,525,176; 6,974,792 и 7,879,800 является введенным в данную заявку в качестве ссылки для описания способов очистки A1PI.
"Рекомбинантный A1PI", как используется в данной заявке, относится к A1PI, который представляет собой продукт методики рекомбинантной ДНК или трансгенной технологии. Фраза "рекомбинантный A1PI" также включает функциональные фрагменты A1PI, химерные белки, которые включают A1PI или их функциональные фрагменты, слитые белки или фрагменты A1PI, гомологи, полученные путем аналогичного замещения одной или более аминокислот A1PI, и различные виды гомологов. Например, ген, кодирующий A1PI, может быть встроен в ген млекопитающих, который кодирует белок молочной сыворотки таким образом, что последовательность ДНК экспрессируется в молочной железе, например, как описывается патенте США №5,322,775, который является введенным в данную заявку в качестве ссылки для описания способа получения подобного белку соединения. "Рекомбинантный A1PI" также относится к A1PI белкам, которые синтезируются химически с помощью способов, известных в данной области техники, таких, как, например, твердофазный пептидный синтез. Аминокислотная и нуклеотидная последовательности для A1PI и/или продукции рекомбинантного A1PI описываются, например, в патентах США №4,711,848; 4,732,973; 4,931,373; 5,079,336; 5,134,119; 5,218,091; 6,072,029; и Wright и др., Biotechnology 9: 830 (1991); и Archibald и др., Proc. Natl. Acad. Sci. (USA), 87: 5178 (1990), каждый из которых является введенным в данную заявку в качестве ссылки для описания последовательности A1PI, рекомбинантного A1PI и/или рекомбинантной экспрессии A1PI.
Фраза "фармацевтическая композиция", как используется в данной заявке, включает препараты, содержащие A1PI, как описано в данной за