Схемы лечения и способы улучшения зрительной функции при расстройствах зрения, связанных с дефицитом эндогенного ретиноида
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к офтальмологии, и предназначена для улучшения зрительной функции у субъекта. Для улучшения зрительной функции у субъекта, имеющего дефицит эндогенно продуцированного 11-цис-ретиналя, вводят первую терапевтическую дозу синтетического производного ретиналя субъекту в форме разделенной дневной дозы в течение периода времени приблизительно от 2 до приблизительно 7 дней. Затем предоставляют период отдыха приблизительно от 7 до приблизительно 28 дней. Далее вводят вторую терапевтическую дозу синтетического производного ретиналя указанному субъекту по окончании периода отдыха. Синтетическое производное ретиналя выбирают из 9-цис-ретинилового сложного эфира или 11-цис-ретинилового сложного эфира. Указанный субъект имеет снижение зрительной функции до введения второй терапевтической дозы. В других воплощениях обеспечиваются способы и набор для улучшения зрительной функции у субъекта, имеющего мутацию гена RPE65 или LRAT или имеющего дефицит эндогенного ретиноида, а также у субъекта с пигментным ретинитом. Использование группы изобретений обеспечивает эффективное улучшение зрительной функции у субъекта без возникновения побочных эффектов. 6 н. и 176 з.п. ф-лы, 14 ил., 7 табл., 6 пр.
Реферат
Родственные заявки
Данная заявка заявляет преимущество приоритета по отношению к предварительной патентной заявке США № 61/605 729, поданной 1 марта 2012 г., предварительной патентной заявке США № 61/642 212, поданной 3 мая 2012 г., и предварительной патентной заявке США № 61/644 360, поданной 8 мая 2012 г., описание которых целиком включено в настоящий документ в качестве ссылки.
Область изобретения
Данное описание относится к схемам лечения и способам улучшения зрительной функции у субъекта, имеющего расстройство зрения, связанное с дефицитом эндогенного ретиноида, включающим введение субъекту синтетического производного ретиналя.
Предпосылки
Наследственные заболевания сетчатки (IRD), вызываемые генными мутациями, которые нарушают или препятствуют продукции, конверсии и/или регенерации 11-цис-ретиналя, приводят к тяжелому ухудшению зрения и детской слепоте. 11-цис-ретиналь представляет собой эндогенный ретиноид, вырабатываемый пигментным эпителием сетчатки (RPE) путем изомеризации и окисления полностью-транс-ретинола (витамина А, полученного из пищи). 11-цис-ретиналь функционирует в качестве хромофора и ковалентно связывается с белком опсином с образованием изородопсина. Зрение начинается, когда фотон света захватывается 11-цис-ретиналем, что приводит к изомеризации в полностью-транс-ретиналь и диссоциации от опсина. Зрение поддерживается циклизацией полностью-транс-ретиналя обратно в 11-цис-ретиналь, что происходит благодаря сложной серии биохимических реакций, в которой участвует множество ферментов и белков в ретиноидном цикле или в зрительном цикле.
Дефициты эндогенного ретиноида, такие как те, которые вызваны мутациями генов, кодирующих ферменты и белки, участвующие в зрительном цикле, нарушают синтез 11-цис-ретиналя, что приводит к расстройствам зрения из-за недостатка или истощения 11-цис-ретиналя.
Например, пигментный ретинит (RP) представляет собой наследственное заболевание сетчатки, характерной чертой которого является дегенерация фоторецепторных клеток палочек и колбочек (Hartong, D.T. et al., Lancet, 368, 1795-1809 (2006)). Существует ряд форм RP, которые все со временем демонстрируют различные ограничения зрительной функции, а течение и прогрессирование заболевания демонстрируют значительное разнообразие у разных индивидуумов. RP обычно характеризуется первоначальными симптомами ночной слепоты, которые возникают в подростковом или молодом возрасте, утратой центрального зрения, которая может приводить к слепоте или тяжелому нарушению зрения. Возраст возникновения заболевания является весьма вариабельным и находится в пределах от детства до середины зрелого возраста. Классификацию заболевания RP можно осуществлять по возрасту возникновения, например, врожденный RP (иногда называемый LCA), возникновение RP в юношеском возрасте, возникновение RP в подростковом возрасте, возникновение RP у взрослых и позднее возникновение RP. Реакции ERG являются ранним индикатором утраты функции палочек и колбочек при RP, и снижение реакций ERG может быть очевидным в первые несколько лет жизни, даже если симптомы появляются значительно позднее.
Типичный RP проявляется как первичная дегенерация палочек, с вторичной дегенерацией колбочек, и впоследствии описывается как дистрофия палочек-колбочек; при этом палочки поражаются больше, чем колбочки. Указанная последовательность вовлечения фоторецепторов объясняет, почему у некоторых субъектов с RP первоначально возникает ночная слепота, и только позднее - нарушение зрения при наличии освещения. Альтернативно, приблизительно 10-20% субъектов с RP имеют дистрофию палочек-колбочек.
RP может вызываться дефектами в многих различных генах и в связанных с ними путями заболевания. В настоящее время обнаружено более 200 причинных RP мутаций в более чем 100 различных генах.
Генотипы RP являются гетерогенными, а субъекты, имеющие RP, с одной и той же мутацией могут демонстрировать различные фенотипы. RP можно классифицировать по типу наследования, например, аутосомный доминантный (ad) RP, аутосомный рецессивный (ar) RP, Х-связанный (XL) или связанный с полом RP, спорадический RP (симплекс RP; большинство рецессивные) или дигенный RP. По современным оценкам, RP страдает по меньшей мере 300000 человек во всем мире, из которых приблизительно 20-30% имеют аутосомный рецессивный RP (arRP).
За последние годы были открыты мутации в генах LRAT и RPE65 у субъектов с arRP или adRP. Указанные специфические мутации, а также мутации в АВСА4 и RDH12, связаны с дефектами ретиноидного метаболизма зрительного цикла и могут приводить к дегенерации фоторецепторов. Дефициты эндогенного ретиноида, такие как те, которые вызываются мутациями в генах, кодирующих ферменты и белки, участвующие в зрительном цикле, нарушают синтез 11-цис-ретиналя, что приводит к расстройствам зрения из-за недостатка или истощения 11-цис-ретиналя.
Белок, кодируемый геном RPE65, имеет биохимическую связь с ретинол-связывающим белком и 11-цис-ретинол-дегидрогеназой и является необходимым для продукции 11-цис-ретиналя (Gollapalli, D.R. et al., Biochemistry, 42(19): 5809-5818 (2003) и Redmond, T.M. et al., Nat. Genet., 20(4): 344-351 (1998)). 11-цис-ретиналь представляет собой эндогенный ретиноид, вырабатываемый пигментным эпителием сетчатки (RPE) путем изомеризации и окисления полностью-транс-ретинола (витамина А, полученного из пищи). 11-цис-ретиналь функционирует в качестве хромофора и ковалентно связывается с белком опсином с образованием родопсина. Зрение начинается, когда фотон света захватывается 11-цис-ретиналем, что приводит к изомеризации в полностью-транс-ретиналь и диссоциации от опсина. Зрение поддерживается циклизацией полностью-транс-ретиналя обратно в 11-цис-ретиналь, что происходит благодаря сложной серии биохимических реакций, в которой участвует множество ферментов и белков в ретиноидном цикле или в зрительном цикле. Доклиническая и клиническая информация показывает, что утрата функции белка RPE65 блокирует процессинг ретиноидов после эстерификации витамина А с мембранными липидами и приводит к потере зрения.
Мутации RPE65 преимущественно связаны с ранним возникновением тяжелой дистрофии сетчатки, с дегенерацией палочек-колбочек, нистагмом и тяжелой потерей зрения в течение первых нескольких лет жизни. Тяжесть заболевания, возникающего из-за мутаций RPE65, как представляется, почти совершенно не зависит от типов мутаций, присутствующих у субъектов с RP. Многие субъекты RPE65 обладают общим фенотипом, характеризующимся плохой, но еще пригодной зрительной функцией в первые годы жизни (измеримые ERG колбочек), которая резко снижается в течение школьного возраста. Помимо этого, у ряда указанных субъектов с RP сохраняются остаточные островки периферического зрения, хотя и значительно скомпрометированные, до третьего десятилетия жизни.
Прогрессирующая утрата поля зрения (VF) является одним из признаков RP и обычно используется как средство мониторинга прогрессирования заболевания (Grover et al., Ophthalmology, 105: 1069-1075 (1998)). Имеется наблюдение, что большинство субъектов с RP официально являются слепыми к 40-летнему возрасту, из-за сокращенных в тяжелой степени полей зрения в силу утраты функции палочек, преобладающей над уменьшением чувствительности колбочек.
Нарушение остроты зрения (VA) также можно отметить для лечения RP, хотя субъекты с ранним началом RP, как сообщается, имеют более стабильную VA по сравнению с другими типами RP, а уровень нарушения VA может широко варьироваться между субъектами с RP. Например, сообщалось, что у многих пациентов с RP на поздних стадиях с малым островком оставшегося центрального поля зрения VA может оставаться нормальной. У других пациентов с RP снижение VA может быть более выраженным.
Для примера, врожденный амавроз Лебера (LCA), причина наследственной детской слепоты, который поражает детей от самого рождения или вскоре после него, связан с наследственной генной мутацией, например, в гене RPE65, который кодирует белок пигментного эпителия сетчатки 65 (RPE65), и/или с наследственной генной мутацией в гене LRAT, который кодирует фермент лецитин:ретинол-ацетилтрансферазу (LRAT). Пациенты с LCA утрачивают способность генерировать 11-цис-ретиналь в адекватных количествах и, следовательно, имеют тяжелую потерю зрения при рождении, нистагм, плохую реакцию зрачков и резко уменьшенные электроретинограммы. Существует значительная клиническая вариабельность тяжести LCA, включая внутрисемейную вариабельность тяжести. LCA демонстрирует клиническую и генетическую гетерогенность с точки зрения естественной истории потери зрения, поведения в условиях плохой освещенности и генетических дефектов, ответственных за фенотип.
Белоточечный пигментный ретинит (RPA) представляет собой другую форму RP, которая демонстрирует недостаток 11-цис-ретиналя в палочках. Недавно были идентифицированы гомозиготные мутации со сдвигом рамки считывания в LRAT как причина RPA у некоторых субъектов, и сообщалось о том, что LRAT является четвертым геном, участвующем в зрительном цикле, который может вызывать белоточечную ретинопатию (Littink et al., Ophthalmology, 119: 1899-906 (2012)).
Врожденная стационарная ночная слепота (CSNB) и белоточечное глазное дно представляют собой группу заболеваний, которые манифестируют ночной слепотой, но прогрессирующей потери зрения не происходит, как при RP. Некоторые формы CSNB возникают из-за замедления метаболического цикла 11-цис-ретиналя. До недавних пор полагали, что белоточечное глазное дно является особым случаем CSNB, при котором на сетчатке появляются сотни маленьких белых точек. Недавно было показано, что это также прогрессирующее заболевание, хотя и более медленно текущее, чем RP. Оно вызывается генными дефектами, которые приводят к замедлению метаболического цикла 11-цис-ретиналя, включая гетерозиготные мутации в RPE65 (Schatz et al., Ophthalmology, 118:888-94 (2011)).
Использование синтетических производных ретиналя и их композиций в способах восстановления или стабилизации функции фоторецепторов в системе зрения позвоночных описано в международных опубликованных патентных заявках №№ WO 2004/082622, WO 2006/002097, WO 2009/102418, WO 2011/034551 и WO 2011/132084 и в опубликованных патентных заявках США №№ 2004/0242704, 2008/0221208 (выдан патент США № 7951841) и 2010/0035986 (выдан патент США № 8324270). Исследование по оценке эффектов ежедневного и прерывистого дозирования 9-цис-ретинилацетата, синтетического производного ретиналя, у стареющих мышей описано в Maeda, T. еt al., Investigative Ophthalmology & Visual Science (2009), Vol. 50, № 9, pp. 4368-4378).
Эксперименты на животных показали, что синтетические ретиноиды, которые являются высокочувствительными к свету соединениями, фотоизомеризуются или «обесцвечиваются» светом из сетчатки всего за несколько часов, если глаза не закрыты. Указанные исследования проводились на животных, которых держали в темноте в течение определенных периодов времени во время лечения синтетическими ретиноидами вплоть до периода оценки, с целью минимизировать фотоизомеризацию/обесцвечивание синтетического ретиноида, приводящие к неудаче самой цели лечения. Batten M.L. et al. “Pharmacological and rAAV Gene Therapy Rescue of Visual Functions in a Blind Mouse Model of Leber Congenital Amaurosis” PLoS Medicine vol. 2, p. 333 (2005); Margaron, P., Castaner, L., and Narfstrom, K. “Evaluation of Intravitreal cis-Retinoid Replacement Therapy in a Canine of Leber’s Congenital Amaurosis” Invest. Ophthalmol. Vis. Sci. 2009; 50:E-Abstract 6280; Gearhart P.M., Gearhart C., Thompson D.A., Petersen-Jones S.M. “Improvement of visual performance with intravitreal administration of 9-cis-retinal in Rpe65-mutant dogs” Arch. Ophthalmol. 2010; 128(11): 1442-8.
Частое введение любого ретиноида для компенсации эффекта обесцвечивания влечет за собой хорошо известную токсичность ретиноидного класса соединений. См. Teelmann, K. “Retinoids: Toxicity and Taretogenicity to Date”, Pharmac. Ther., Vol. 40, pp. 29-43 (1989); Gerber, L.E. et al. “Changes in Lipid Metabolism During Retinoid Administration” J. Amer. Acad. Derm., Vol. 6, pp. 664-74 (1982); Allen L.H. “Estimating the Potential for Vit A Toxicity in Women and Young Children” J. Nutr., Vol. 132, pp 2907-19 (2002); Silverman, A.K. “Hypervitaminosis A Syndrome: A Paradigm of Retinoid Side Effects” J. Amer. Acad. Derm., Vol. 16, pp. 1027-39 (1987); Zech L.A. et al. “Changes in Plasma Cholesterol and Triglyceride Levels After Treatment with Oral Isotretinoin” Arch. Dermatol., Vol. 119, pp. 987-93 (1983). Токсичность, вызванная хроническим введением ретиноидов, может вызывать изменения жирового обмена, повреждение печени, тошноту, рвоту, затуманенное зрение, повреждение костей, помехи в развитии костей и несколько других серьезных нежелательных эффектов.
В контексте улучшения зрительной функции у субъекта с дефицитом эндогенного ретиноида, таким как RP или LCA, который представляет собой хроническое состояние, требующее пожизненного лечения, указанные токсические эффекты могут быть очень важными. Указанные побочные эффекты внушают особую озабоченность у молодых субъектов, чувствительность которых к побочным эффектам, связанная с их физическим развитием, хорошо известна.
Данная комбинация необходимости повторного введения в ответ на обесцвечивание и нежелательных серьезных побочных эффектов повторного введения представляет собой проблему для использования синтетических ретиноидов для улучшения зрительной функции у субъекта с дефицитом эндогенного ретиноида, таким как RP или LCA. Недавние исследования оценивали пригодность ретиноидов для лечения указанных расстройств и были сделаны выводы, что ретиноиды и сходные соединения не являются хорошими терапевтическими кандидатами. См. Fan J. et al. “Light Prevents Exogenous 11-cis Retinal from Maintaining Cone Photoreceptors in Chromofore-deficient Mice”, Invest. Ophthalmol. Vis. Sci January 12, 2011, 10-6437.
Сущность изобретения
Настоящее изобретение относится к определенным схемам дозирования синтетических производных ретиналя, которые могут замещать эндогенно продуцируемый 11-цис-ретиналь, вызывая, таким образом, значительное улучшение зрения у субъекта, имеющего дефицит эндогенного ретиноида, в течение интервала отдыха менее одного месяца, такой как от 7 до 28 дней; в то же время имеющим приемлемый профиль безопасности в течение повторных циклов дозирования и отдыха. В определенных вариантах осуществления настоящего изобретения приемлемый профиль безопасности может достигаться минимизацией и/или уменьшением тяжести токсических побочных эффектов, связанных с частым и последующим введением синтетических производных ретиналя в течение последующих циклов дозирования. В определенных вариантах осуществления настоящего изобретения дефицит эндогенного ретиноида вызывается мутациями в генах, кодирующих ферменты и белки, участвующие в зрительном цикле, как у субъектов с пигментным ретинитом (RP) или с врожденным амаврозом Лебера (LCA). Соответственно, представлены терапевтические схемы и способы улучшения зрительной функции у субъекта с RP, LCA или другим расстройством зрения, связанным с дефицитом эндогенного 11-цис-ретиналя, включающие в себя введение синтетического производного ретиналя субъекту.
В определенных вариантах осуществления настоящее изобретение относится к способу улучшения зрительной функции у субъекта, имеющего дефицит эндогенного 11-цис-ретиналя, включающему в себя а) введение первой терапевтической дозы синтетического производного ретиналя субъекту, который в этом нуждается; b) предоставление периода отдыха менее одного месяца, такого как период приблизительно от 7 до 28 дней; и с) введение второй терапевтической дозы 9- или 11-цис-ретинилового сложного эфира указанному субъекту по окончании периода отдыха.
В определенных вариантах осуществления настоящее изобретение относится к способу улучшения зрительной функции у субъекта, включающему в себя а) введение первой терапевтической дозы 9- или 11-цис-ретинилового сложного эфира субъекту, который в этом нуждается; b) предоставление периода отдыха менее одного месяца, такого как период приблизительно от 7 до 28 дней; и с) введение второй терапевтической дозы 9- или 11-цис-ретинилового сложного эфира указанному субъекту по окончании периода отдыха.
В определенных вариантах осуществления настоящего изобретения субъект имеет дефицит эндогенно продуцируемого 11-цис-ретиналя. В некоторых вариантах осуществления настоящего изобретения 9- или 11-цис-ретиниловый сложный эфир обеспечивает замещение эндогенно продуцируемого 11-цис-ретиналя.
В некоторых вариантах осуществления настоящего изобретения субъект имеет мутацию гена LRAT. В других вариантах осуществления настоящего изобретения субъект имеет мутацию гена RPE65.
В определенных вариантах осуществления настоящего изобретения субъект имеет RP от умеренного до тяжелого. В других вариантах осуществления настоящего изобретения субъект имеет легкий RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет RP с ранним началом или ювенильный RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет наследственный RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет начало RP в юношеском возрасте. В других вариантах осуществления настоящего изобретения субъект имеет начало RP в подростковом возрасте. В других вариантах осуществления настоящего изобретения субъект имеет начало RP во взрослом возрасте или позднее начало RP. В определенных вариантах осуществления настоящего изобретения субъект имеет аутосомный рецессивный RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет аутосомный доминантный RP.
В определенных вариантах осуществления настоящего изобретения субъект имеет LCA.
В некоторых вариантах осуществления настоящего изобретения способ улучшения зрительной функции у субъекта, включая субъекта с RP, дополнительно включает в себя повторение этапов b) и с) один или более раз.
В определенных вариантах осуществления настоящего изобретения первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени от 2 до 7 дней. В некоторых вариантах осуществления настоящего изобретения первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени 7 дней. В других вариантах осуществления настоящего изобретения первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени 5 дней.
В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно от 7 дней до приблизительно 21 дня. В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 21 день. В других вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 14 дней. В других вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 7 дней.
В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно от 280 мг/м2 до приблизительно 420 мг/м2. В некоторых вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 280 мг/м2. В некоторых вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 420 мг/м2.
В определенных вариантах осуществления настоящего изобретения терапевтические дозы вводят перорально.
В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 5 мг/м2 в день, или приблизительно 10 мг/м2 в день, или приблизительно 20 мг/м2 в день, или приблизительно 40 мг/м2 в день. В других вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 60 мг/м2 в день.
В определенных вариантах осуществления настоящего изобретения вторую терапевтическую дозу вводят, в основном, в течение такого же периода времени и, в основном, в таком же количестве, что и первую терапевтическую дозу.
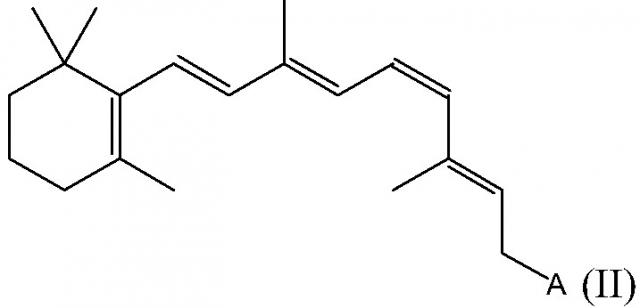
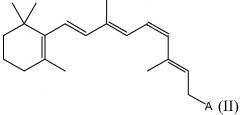
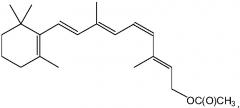
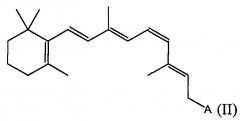
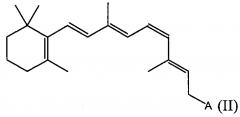
В определенных вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 9-цис-ретиниловый сложный эфир. В некоторых вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 9-цис-ретинилацетат. В некоторых вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 11-цис-ретинилацетат.
В определенных вариантах осуществления настоящего изобретения улучшение зрительной функции включает в себя увеличение поля зрения в глазу по меньшей мере на 20% от исходной величины, по результатам измерения с использованием анализа поля зрения Голдмана (GVF). В других вариантах осуществления настоящего изобретения улучшение зрительной функции включает в себя улучшение остроты зрения в глазу, большее или равное 5 буквам, по сравнению с исходной величиной, по результатам измерения с использованием таблицы исследования по раннему лечению диабетической ретинопатии (ETDRS). В других вариантах осуществления настоящего изобретения улучшение зрительной функции включает в себя клинически значимое увеличение чувствительности сетчатки по сравнению с исходной величиной.
Настоящее изобретение относится также к способу улучшения зрительной функции у субъекта с дефицитом эндогенного ретиноида, таким как RP, включающему в себя: а) введение первой терапевтической дозы 9-цис-ретинилацетата, в котором первую терапевтическую дозу вводят в количестве приблизительно от 40 мг/м2 до 60 мг/м2 в день в течение периода времени 7 дней, субъекту, который в этом нуждается; b) предоставление периода отдыха приблизительно от 7 дней до 21 дня; и с) введение второй терапевтической дозы 9-цис-ретинилацетата по окончании периода отдыха субъекту, который в этом нуждается.
В определенных вариантах осуществления настоящего изобретения субъект имеет дефицит эндогенно продуцируемого 11-цис-ретиналя. В определенных вариантах осуществления настоящего изобретения 9-цис-ретинилацетат обеспечивает замещение эндогенно продуцируемого 11-цис-ретиналя.
В определенных вариантах осуществления настоящего изобретения субъект имеет мутацию гена LRAT. В некоторых вариантах осуществления настоящего изобретения субъект имеет мутацию гена RPE65.
В определенных вариантах осуществления настоящего изобретения субъект имеет RP от умеренного до тяжелого. В некоторых вариантах осуществления настоящего изобретения субъект имеет легкий RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет раннее начало RP или ювенильный RP.
В некоторых вариантах осуществления настоящего изобретения способ улучшения зрительной функции у субъекта с RP дополнительно включает в себя повторение этапов b) и с) один или более раз.
В некоторых вариантах осуществления настоящего изобретения улучшение зрительной функции включает в себя увеличение поля зрения в глазу по меньшей мере на 20% от исходной величины, по результатам измерения с использованием анализа поля зрения Голдмана (GVF) или улучшение остроты зрения в глазу, большее или равное 5 буквам, по сравнению с исходной величиной, по результатам измерения с использованием таблицы исследования по раннему лечению диабетической ретинопатии (ETDRS), или и то, и другое.
В некоторых вариантах осуществления настоящего изобретения вторую терапевтическую дозу вводят, в основном, в течение такого же периода времени и, в основном, в таком же количестве, что и первую терапевтическую дозу.
В некоторых вариантах осуществления настоящего изобретения терапевтические дозы вводят перорально.
В определенных вариантах осуществления настоящего изобретения субъектом является человек.
Настоящее изобретение относится также к способу улучшения зрительной функции у субъекта с дефицитом эндогенного ретиноида, таким как RP, включающему в себя введение по меньшей мере первой и второй терапевтической дозы 9- или 11-цис-ретинилового сложного эфира субъекту, который в этом нуждается; в котором период отдыха между первой дозой и второй дозой составляет менее одного месяца, такой как приблизительно от 7 до приблизительно 28 дней, и в котором улучшение зрительной функции включает в себя увеличение поля зрения в глазу по меньшей мере на 20% от исходной величины, по результатам измерения с использованием анализа поля зрения Голдмана (GVF), улучшение остроты зрения в глазу, большее или равное 5 буквам, по сравнению с исходной величиной, по результатам измерения с использованием таблицы исследования по раннему лечению диабетической ретинопатии (ETDRS), или и то, и другое.
В определенных вариантах осуществления настоящего изобретения 9- или 11-цис-ретиниловый сложный эфир обеспечивает замещение эндогенно продуцируемого 11-цис-ретиналя.
В некоторых вариантах осуществления настоящего изобретения субъект имеет дефицит эндогенно продуцируемого 11-цис-ретиналя. В определенных вариантах осуществления настоящего изобретения субъект имеет мутацию гена LRAT. В других вариантах осуществления настоящего изобретения субъект имеет мутацию гена RPE65.
В некоторых вариантах осуществления настоящего изобретения субъект имеет RP от умеренного до тяжелого. В некоторых вариантах осуществления настоящего изобретения субъект имеет легкий RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет раннее начало RP или ювенильный RP.
В определенных вариантах осуществления настоящего изобретения субъект имеет LCA.
В определенных вариантах осуществления настоящего изобретения первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени от 2 до 7 дней. В некоторых вариантах осуществления настоящего изобретения первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени 7 дней. В некоторых вариантах осуществления настоящего изобретения первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени 5 дней. В некоторых вариантах осуществления настоящего изобретения первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени 6 дней или 4 дней, или 3 дней, или двух дней.
В определенных вариантах осуществления настоящего изобретения период отдыха, в течение которого терапевтическую дозу не вводят, составляет приблизительно от 2 дней до приблизительно 21 дня, приблизительно от 2 дней до приблизительно 25 дней или приблизительно от 2 дней до приблизительно 28 дней. В определенных вариантах осуществления настоящего изобретения период отдыха, в течение которого терапевтическую дозу не вводят, составляет приблизительно от 7 дней до приблизительно 21 дня, приблизительно от 7 дней до приблизительно 25 дней или приблизительно от 7 дней до приблизительно 28 дней. В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно от 7 дней до приблизительно 21 дня. В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 21 день. В других вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 14 дней. В других вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 7 дней.
В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно от 280 мг/м2 до приблизительно 420 мг/м2 объединенной суммарной дозы. В некоторых вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 280 мг/м2 объединенной суммарной дозы. В некоторых вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 420 мг/м2 объединенной суммарной дозы.
В некоторых вариантах осуществления настоящего изобретения терапевтические дозы вводят перорально.
В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 10 мг/м2 в день. В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 20 мг/м2 в день. В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 40 мг/м2 в день. В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 60 мг/м2 в день.
В определенных вариантах осуществления настоящего изобретения вторую терапевтическую дозу вводят, в основном, в течение такого же периода времени и, в основном, в таком же количестве, что и первую терапевтическую дозу.
В определенных вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 9-цис-ретиниловый сложный эфир. В некоторых вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 9-цис-ретинилацетат. В некоторых вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 11-цис-ретинилацетат.
Настоящее изобретение относится также к набору для улучшения зрительной функции у субъекта с дефицитом эндогенного ретиноида, таким как RP, включающему в себя: а) по меньшей мере первую терапевтическую дозу 9- или 11-цис-ретинилового сложного эфира; и b) инструкции по применению, которые предусматривают период отдыха между первой терапевтической дозой и второй дозой, в которых период отдыха составляет менее месяца, такой как приблизительно от 7 до приблизительно 28 дней.
В некоторых вариантах осуществления настоящего изобретения 9- или 11-цис-ретиниловый сложный эфир обеспечивает замещение эндогенно продуцируемого 11-цис-ретиналя.
В определенных вариантах осуществления настоящего изобретения субъект имеет дефицит эндогенно продуцируемого 11-цис-ретиналя. В некоторых вариантах осуществления настоящего изобретения субъект имеет мутацию гена LRAT. В других вариантах осуществления настоящего изобретения субъект имеет мутацию гена RPE65.
В некоторых вариантах осуществления настоящего изобретения субъект имеет RP от умеренного до тяжелого. В других вариантах осуществления настоящего изобретения субъект имеет легкий RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет раннее начало RP или ювенильный RP.
В определенных вариантах осуществления настоящего изобретения инструкции указывают, что первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени от 2 до 7 дней или в течение периода времени от 2 до 5 дней. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что первую терапевтическую дозу вводят в виде разделенной дозы в течение периода времени 7 дней. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что период отдыха составляет приблизительно от 2 дней до приблизительно 21 дня. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что период отдыха составляет приблизительно от 7 дней до приблизительно 21 дня. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что период отдыха составляет приблизительно 21 день. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что период отдыха составляет приблизительно 14 дней. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что период отдыха составляет приблизительно 7 дней. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что период отдыха составляет приблизительно 23 дня, 25 дней или 28 дней. В некоторых вариантах осуществления настоящего изобретения инструкции указывают, что общий период отдыха плюс период дозирования объединяются, что соответствует 28 дням или 30 дням, для каждого периода лечения по схеме дозирования.
В определенных вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно от 280 мг/м2 до приблизительно 420 мг/м2. В некоторых вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 280 мг/м2. В некоторых вариантах осуществления настоящего изобретения первая терапевтическая доза составляет приблизительно 420 мг/м2.
В определенных вариантах осуществления настоящего изобретения терапевтическую дозу вводят перорально.
В определенных вариантах осуществления настоящего изобретения инструкции указывают, что первая терапевтическая доза составляет приблизительно 10 мг/м2 в день. В определенных вариантах осуществления настоящего изобретения инструкции указывают, что первая терапевтическая доза составляет приблизительно 20 мг/м2 в день. В определенных вариантах осуществления настоящего изобретения инструкции указывают, что первая терапевтическая доза составляет приблизительно 40 мг/м2 в день. В определенных вариантах осуществления настоящего изобретения инструкции указывают, что первая терапевтическая доза составляет приблизительно 60 мг/м2 в день.
В определенных вариантах осуществления настоящего изобретения вторую терапевтическую дозу вводят, в основном, в течение такого же периода времени и, в основном, в таком же количестве, что и первую терапевтическую дозу.
В определенных вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 9-цис-ретинилацетат. В других вариантах осуществления настоящего изобретения ретиниловый сложный эфир представляет собой 11-цис-ретинилацетат.
В определенных вариантах осуществления настоящего изобретения улучшение зрительной функции включает в себя увеличение поля зрения в глазу по меньшей мере на 20% от исходной величины, по результатам измерения с использованием анализа поля зрения Голдмана (GVF). В некоторых вариантах осуществления настоящего изобретения улучшение зрительной функции включает в себя улучшение остроты зрения в глазу, большее или равное 5 буквам, по сравнению с исходной величиной, по результатам измерения с использованием таблицы исследования по раннему лечению диабетической ретинопатии (ETDRS). В некоторых вариантах осуществления настоящего изобретения улучшение зрительной функции включает в себя клинически значимое увеличение чувствительности сетчатки по сравнению с исходной величиной.
Настоящее изобретение относится также к схеме дозирования для улучшения зрительной функции у субъекта с RP, в которой схема дозирования включает в себя по меньшей мере первую терапевтическую дозу, вторую терапевтическую дозу и период отдыха между первой терапевтической дозой и второй терапевтической дозой; указанная схема включает в себя: а) введение первой дозы 9- или 11-цис-ретинилового сложного эфира в течение периода времени приблизительно от 2 до приблизительно 7 дней, субъекту, который в этом нуждается; b) предоставление периода отдыха менее одного месяца, такого как приблизительно от 7 до 28 дней, между первой терапевтической дозой и второй терапевтической дозой; и с) введение второй терапевтической дозы 9- или 11-цис-ретинилового сложного эфира по окончании периода отдыха субъекту, который в этом нуждается.
В определенных вариантах осуществления настоящего изобретения 9- или 11-цис-ретиниловый сложный эфир обеспечивает замещение эндогенно продуцируемого 11-цис-ретиналя.
В определенных вариантах осуществления настоящего изобретения субъект имеет дефицит эндогенно продуцируемого 11-цис-ретиналя. В некоторых вариантах осуществления настоящего изобретения субъект имеет мутацию гена LRAT. В других вариантах осуществления настоящего изобретения субъект имеет мутацию гена RPE65.
В определенных вариантах осуществления настоящего изобретения субъект имеет RP от умеренного до тяжелого. В некоторых вариантах осуществления настоящего изобретения субъект имеет легкий RP. В некоторых вариантах осуществления настоящего изобретения субъект имеет раннее начало RP или ювенильный RP.
В определенных вариантах осуществления настоящего изобретения схема дозирования дополнительно включает в себя повторение этапов b) и с) один или более раз.
В некоторых вариантах осуществления настоящего изобретения первую дозу вводят в виде разделенной дозы в течение периода времени 7 дней.
В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно от 2 дней до приблизительно 28 дней, такой как приблизительно от 7 дней до приблизительно 28 дней. В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно от 7 дней до приблизительно 21 дня. В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 21 день. В некоторых вариантах осуществления настоящего изобретения период отдыха составляет приблизительно 14 дней. В некоторых вариантах о