Способы и средства для мониторинга нарушения тканевого гомеостаза в организме
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для ранней диагностики и мониторинга заболевания у субъекта с использованием циркулирующих тканевых макрофагов. Способ включает этапы: a) обеспечения биологического образца для тестирования от указанного субъекта, причем указанный образец содержит циркулирующие тканевые макрофаги (СТМ); b) окрашивания указанных СТМ с использованием панели дифференциально меченых различных антител против опорных маркеров CD14, CD16, CD300e, CD36 и HLADR с целью идентификации и подсчета различных субпопуляций СТМ; c) фиксации, пермеабилизации и окрашивания СТМ с использованием одного или нескольких антител для обнаружения против одного или более эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, полученного в результате внутриклеточной деградации не принадлежащего СТМ белка, отдельными СТМ в тканях, из которых они происходят, тем самым идентифицируя по меньшей мере одну субпопуляцию циркулирующих тканеспецифических макрофагов (CTSM). Далее проводят анализ с применением многопараметрической проточной цитометрии указанных окрашенных СТМ и CTSM путем селективного пропускания по опорным маркерам CD14, CD16, CD300e, CD36 и HLADR с целью определения количества сигналов каждого определенного меченого антитела, связанного с отдельными клетками. Определяют относительное и абсолютное количество отдельных клеток в каждой субпопуляции СТМ и каждой специфической субпопуляции CTSM, экспрессирующих каждый из измеренных внутриклеточных эпитопов. Расчет относительного и абсолютного количества клеток проводят в каждой субпопуляции СТМ и каждой специфической субпопуляции CTSM, каждое из которых происходит из различных нормальных и измененных тканей, что определяют с помощью оцениваемого набора отдельных протеазо-индуцированных фрагментов белка. Проводят определение количества связанного с антителами сигнала, ассоциированного с каждым отдельным оцениваемым внутриклеточным пептидом, с целью получения профиля окрашивания CTSM. А также сравнивают тестируемый профиль окрашивания CTSM с нормальным профилем окрашивания CTSM для каждой оцениваемой ткани, причем повышенное количество CTSM свидетельствует о наличии заболевания. Группа изобретений относится также к набору для ранней диагностики и мониторинга заболевания у субъекта с использованием циркулирующих тканевых макрофагов. Использование данной группы изобретений позволяет проводить раннюю диагностику и мониторинг заболевания у субъекта с использованием циркулирующих тканевых макрофагов по опорным маркерам CD14, CD16, CD300e, CD36 и HLADR. 2 н. и 21 з.п. ф-лы, 2 табл., 2 пр., 7 ил.
Реферат
Настоящее изобретение относится к области медицинской диагностики. Оно обеспечивает новые средства, включая диагностические наборы и способы сканирования всего организма, направленные, в числе прочего, на оценку физиологических процессов, воздействий, связанных с образом жизни и окружающей средой, раннюю диагностику и мониторинг заболеваний и их лечение.
Полное сканирование организма представляет собой сканирование всего тела субъекта для поддержки диагностики и лечения здорового состояния и болезней. Оно также может быть известно как КТ всего организма, если используют технологию компьютерной томографии (КТ), хотя существует много технологий медицинской визуализации, которые могут выполнять полное сканирование организма. Полное сканирование организма теоретически может обнаружить смертельные заболевания (например, рак) на ранних стадиях, что может спасти жизнь. В то же время на практике преимущества известных в настоящее время способов полного сканирования организма могут не перевешивать риски и затраты. Таким образом, возникают разногласия по поводу использования способов полного сканирования организма при скрининге пациентов, у которых еще не диагностировано заболевание, или у которых отсутствуют симптомы, указывающие на заболевание. Как и при любом тесте, используемом для скрининга заболевания, необходимо взвесить риски КТ-сканирования всего организма по сравнению с пользой от выявления излечимого заболевания на ранней стадии. По сравнению с большинством других рентгенодиагностических процедур, КТ приводит к относительно высоким дозам облучения, что может быть связано с очень небольшим, но значительным увеличением возможности развития рака у человека в будущем. Важно отметить, что современные методики визуализации требуют дорогостоящего оборудования, с помощью которого можно анализировать только одного субъекта одновременно. В отличие от этого, анализ крови можно выполнять параллельно для многих людей, а необходимое для него оборудование широко доступно во многих диагностических лабораториях. Кроме того, для анализа крови пациенту не нужно ехать в центр скрининга, а достаточно отбора образца крови на месте с его последующей транспортировкой.
Авторы настоящего изобретения признают необходимость альтернативных средств и способов сканирования всего организма субъекта, при которых польза от выявления излечиваемого заболевания на ранней стадии намного перевешивает риск. Они разработали концептуально новую систему сканирования всего организма, предназначенную для оценки физиологических процессов, скрининга состояния здоровья в целом и ранней диагностики и мониторинга заболеваний и их терапии (например, лечения). Она включает проточно-цитометрическое сканирование организма (FlowBoScan) или сканирование тканевых макрофагов (TiMaScan) с использованием тканевых макрофагов в крови в качестве показателя нарушенного гомеостаза тканей и заболевания. Указанный новый инструмент не предполагает какого-либо воздействия вредных излучений на организм. В противоположность этому, TiMaScan можно выполнить с использованием легкодоступных образцов, полученных из организма, например, периферической крови.
Во всех тканях в организме человека и животных поддерживается тонкое гомеостатическое равновесие между пролиферацией и гибелью клеток, главным образом запрограммированной гибелью клеток путем апоптоза (тип I) и аутофагии (тип II). В зависимости от типа ткани уровень гомеостатической активности является более высоким или низким. Например, эпителиальные клетки в кишечнике, гемопоэтические клетки в костном мозге и эпителий кожи характеризуются высокой интенсивностью обновления, в то время как эта интенсивность обновления снижена в других тканях, например, нервной системе, печени, почках и мышцах. Тем не менее клеточный гомеостаз поддерживается во всех тканях или на высоком, или на более низком уровне. В дополнение к базовому уровню гомеостаза процессы активации, регенерации и старения влияют на гомеостаз пролиферации и гибели клеток, приводя к росту или инволюции. Например, активация за счет частого использования приводит к повышению базового уровня гомеостаза до более высокого уровня гомеостаза, например, увеличению объема и состава мышц за счет специфических физических упражнений при занятиях спортом и инволюции таких мышц при прекращении тренировок. Кроме того, износ кожи при тяжелом труде или воздействии химических веществ утолщает кожу ладоней и подошв; такие мозоли исчезают при прекращении износа.
Определенные состояния могут менять или даже нарушать уровень клеточного гомеостаза, например:
- повреждение тканей (травмы или хирургическое вмешательство) и последующее восстановление;
- функциональное стрессовое воздействие на системы органов, например, злоупотребление алкоголем и нарушение функции печени, или участие в марафоне и триатлоне и истощение мышц; (преждевременная) возрастная инволюция (старение);
- подавление и последующая регенерация, например, с помощью таких лекарств, как кортикостероиды;
- воспаление и последующее восстановление за счет регенерации и/или фиброза, например, при аутоиммунных заболеваниях;
- инфекционные длительные вялотекущие и постепенно развивающиеся заболевания, например, туберкулез, болезнь Лайма, Ку-лихорадка и др.;
- нарушение регуляции пролиферации с последующей гиперплазией и, возможно, также последующей дисплазией и злокачественной трансформацией.
Несмотря на высокие уровни гомеостатической пролиферации и апоптоза, мертвые клетки или погибающие клетки редко наблюдают в срезах тканей. По-видимому, мертвые клетки и апоптозные клетки быстро и эффективно удаляются тканевыми макрофагами. Справедливо предположить, что каждый отдельный тканевый макрофаг обслуживает определенную (ограниченную) область вовлеченной ткани и может эффективно удалять апоптозные клетки и другие повреждения тканей. Поскольку каждый тканевый макрофаг, скорее всего, обрабатывает ограниченное количество апоптозных клеток (например, от 20 до 40 клеток, в зависимости от размера и типа клеток), объем/размер зоны наблюдения зависит от типа ткани и уровня гомеостатической активности вовлеченной ткани. Чем выше уровень гомеостаза или выше уровень восстановления или пролиферации, тем больше тканевых макрофагов нужно для удаления продуктов распада из вовлеченной ткани и избежания структурных изменений ткани с функциональной недостаточностью ткани. Следовательно, количество тканевых макрофагов на объем ткани может меняться в зависимости от типа ткани, активности ткани, возникновения воспаления или восстановления после повреждения и т.д. После того как тканевые макрофаги выполняют локальную задачу в их области действия, указанные зрелые макрофаги покидают свои области действия и мигрируют через лимфатические сосуды в кровь с целью дальнейшего удаления из организма, вероятно, в селезенке.
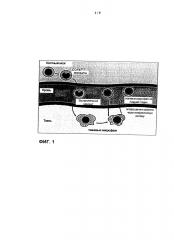
Посредством пути дифференцировки моноцитов в костном мозгу непрерывно продуцируетются классические моноциты CD14high/CD16- (моноциты, "поступающие в ткань"), которые становятся доступны в крови и могут рекрутироваться в качестве воспалительных моноцитов в пораженные ткани, где они созревают в гетерогенную (het) популяцию тканевых макрофагов с CD14high/CD16+ и CD14high/CD16high (Фигура 1). После того как указанные клетки выполняют свои задачи контроля и фагоцитоза, они становятся зрелыми макрофагами и мигрируют через систему лимфатических сосудов в виде CDl4het/CD16het СТМ в кровь (моноциты/макрофаги, "уходящие из ткани"), где они являются неустойчивыми клетками и обладают коротким временем жизни (Фигура 1).
По меньшей мере частично, СТМ обнаруживаются в периферической крови. В нормальной крови обнаруживается небольшая популяция СТМ, характеризующихся гетерогенной экспрессией CD14 и CD16. Уровень указанных СТМ увеличивается при старении и при определенных клинических состояниях, например, после трансплантации стволовых клеток (SCT) и в случае воспаления, сепсиса, рака и чрезмерных физических нагрузок (Фигура 2).
Предполагаемый процесс миграции и рециркуляции подтверждается тем фактом, что относительные частоты классических моноцитов и СТМ отличаются в зависимости от местоположения: низкая частота гетерогенных CD14+/CD16+ и CD14dim/CD16high СТМ в костном мозге и крови, но более высокая частота в лимфе (Таблица 1) (Orfao et al., неопубликованные результаты).
| Таблица 1.Относительные частоты классических моноцитов и СТМ* | ||
| Классические моноциты CD14high/CD16- | CD14+/CD16+и CD14dim/CD16high СТМ | |
| Костный мозг | ~95% | ~5% |
| Пуповинная кровь | 90-95% | 5-10% |
| Кровь взрослых | 80-90% | 10-20% |
| Лимфа | 5-35% | 65-95% |
| * Orfao et al., неопубликованные результаты |
Справедливо предположить, что и у здоровых лиц, и при лечении заболеваний, ряд фрагментов белков и пептидов в фагосомах каждого тканевого макрофага состоит из тканеспецифических пептидов, так как область контроля тканевых макрофагов, скорее всего, ограничена тканью одного типа, возможно, даже небольшим участком ткани в пределах некоторой ткани. Следовательно, общая популяция СТМ в крови в заданный момент времени отражает уровень гомеостаза всех тканей во всем организме. На основании набора фагосомальных пептидов каждый СТМ следует отнести по происхождению к своей ткани. Относительный состав циркулирующих тканеспецифических макрофагов (CTSM), вероятно, стабильней в отношении их относительного и абсолютного количества в крови, а также к содержания в них фрагментов белка и пептидов, происходящих из различных тканей, с учетом возрастных, связанных с полом, метаболизмом и активностью различий, поскольку такие различия влияют на клеточный гомеостаз. Существенно, что гомеостатические изменения (например, повреждение тканей) в любой области организма приводят к изменению относительного и абсолютного количества и относительного состава внутриклеточных уровней фрагментов белка и пептидов в популяции циркулирующих тканевых макрофагов. Такие изменения могут затрагивать одно или более из различных субпопуляций СТМ и CTSM, и могут включать отсутствие эпитопа, экспрессируемого в норме, аномальную экспрессию эпитопа, отсутствующего в норме, или измененные уровни экспрессии эпитопа, экспрессируемого в норме.
В соответствии с настоящим изобретением авторы разработали систему, использующую уникальное сочетание маркеров клеточной поверхности для обнаружения и идентификации циркулирующих тканевых макрофагов (СТМ) и их субпопуляций в крови, ориентированную на распознавание эпитопов в продуктах, полученных за счет внутриклеточного процессинга и деградации (например, одной или более протеазами) белков (например, пептидов), локально захваченных в ткани одиночным СТМ. Особые возможности новой системы касаются возможности скрининга всех СТМ в образце крови в отношении происхождения отдельных субпопуляций СТМ и определения указанных субпопуляций на основе комбинации множества фрагментов тканеспецифических белков или пептидов; кроме того, дальнейшее деление указанных циркулирующих тканеспецифических макрофагов (CTSM) на субпопуляции может быть основано на экспрессии других пептидов, например, происходящих от аномально экспрессируемых белков, например, онкобелков. Таким образом, вся совокупнасть СТМ отражает процессы, происходящие в различных тканях всего организма, как гомеостатических, так и нарушенных. Измерение этих субпопуляций СТМ позволяет контролировать состояние здоровья и выполнять скрининг конкретных заболеваний, в том числе тканевой локализации указанных заболеваний. После установления диагноза можно использовать мониторинг соответствующей субпопуляции СТМ для отслеживания индивидуального статуса с течением времени, например, для оценки исчезновения или стабильности течения заболевания и/или для оценки эффективности лечения.
Таким образом, в одном варианте реализации настоящее изобретение обеспечивает способ определения состояния здоровья субъекта, раннего обнаружения повреждения тканей, ранней диагностики и мониторинга заболевания и/или оценки эффективности лечения субъекта с использованием циркулирующих тканевых макрофагов (СТМ) как показателя нарушенного гомеостаза ткани и наличия заболевания, причем указанный способ включает этапы:
a) Обеспечения биологического образца для тестирования от субъекта, предпочтительно человека, причем указанный образец содержит циркулирующие тканевые макрофаги (СТМ);
b) окрашивания указанных СТМ панелью дифференциально меченных различных антител против набора опорных маркеров с целью идентификации и подсчета по меньшей мере одной, предпочтительно по меньшей мере двух субпопуляций СТМ, причем опорные маркеры представляют собой CD14, CD16 и IREM2 (CD300e), а также, предпочтительно, HLADR и/или CD45;
c) фиксации, пермеабилизации и окрашивания СТМ с использованием одного или нескольких антител для обнаружения против одного или более эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, полученного в результате внутриклеточной деградации белка, не принадлежащего СТМ, отдельными СТМ в тканях, из которых они происходят, тем самым идентифицируя по меньшей мере одна субпопуляция циркулирующих тканеспецифических макрофагов (CTSM);
d) анализа с применением многопараметрической проточной цитометрии указанных окрашенных СТМ и CTSM с целью определения количества сигналов каждого отдельного меченого антитела, связанного с отдельными клетками;
e) определения относительного и абсолютного количества отдельных клеток в субпопуляций СТМ и специфической(ких) субпопуляции (ях) CTSM, экспрессирующих каждый из измеренных внутриклеточных эпитопов;
f) расчета (i) относительного и абсолютного количества клеток в субпопуляции СТМ и специфической(ких) субпопуляции (ях) CTSM, каждое из которых происходит из различных нормальных и измененных тканей, что определяют с помощью оцениваемого набора отдельных протеазо-индуцированных фрагментов белка, и ii) количества связанного с антителами сигнала, ассоциированного с каждым отдельным оцениваемым внутриклеточным пептидом, с целью получения профиля окрашивания CTSM, а также;
g) сравнения тестируемого профиля окрашивания CTSM с нормальным профилем окрашивания CTSM для каждой оцениваемой ткани, причем аномальный профиль окрашивания свидетельствует о повреждении тканей, нарушенном гомеостазе ткани, наличии заболевания и/или эффективности лечения по сравнению с устойчивостью.
IREM2 означает "иммунный рецептор 2, экспрессируемый миелоидными клетками". В номенклатуре CD-антигенов этот белок обозначают как CD300E или CD300e. Этот белок также известен как CD300LE [член семейства LE, подобный молекуле CD300]. Экспрессия IREM2, по-видимому, ограничена моноцитами, макрофагами и дендритными клеткми и подавляется при дифференцировке.
HLADR представляет собой поверхностный МНС-рецептор II класса, кодируемый комплексом лейкоцитарных антигенов человека в области 6р21.31 хромосомы 6. HLADR является αβ-гетеродимерным рецептором клеточной поверхности, причем каждая субъединица содержит 2 внеклеточных доменов, мембранный домен и цитоплазматический хвост. Как α, так и β-цепи закреплены в мембране. Комплекс HLADR и его лиганда, пептида длиной 9 аминокислот или более, представляет собой лиганд для Т-клеточного рецептора (TCR).
В настоящем документе аббревиатура "СТМ" обозначает циркулирующие тканевые макрофаги. Термин " субпопуляции СТМ" относится к различным подмножествам СТМ, в том числе CD14high/CD16+, CD14high/CD16high СТМ, CD14+/CD16high, CD14low/CD16high, CD14-/CD16high, CD14-/CD16low СТМ, CD11c+/CD16+, CD11c+/CD16high, CD11c+/CD16low CTM, CD33high/CD16+, CD33high/CD16high, CD33+/CD16high, CD33+/CD16low CTM, CD300e+/CD16+, CD300e+/CD16high, CD300e+/CD16low CTM, CD16+, CD16high, CD16low CTM, CD 14high/CD 16+/CD300e+/HLADR+, CD14high/CD 16high/CD300e+/HLADR+, CD14+/CD16high/CD300e+/HLADR+, CD14-/CD16high/CD300e+/HLADR+ и CD14-/CD16low/CD300e+/HLADR+.
"CTSM" относится к циркулирующим тканеспецифическим макрофагам, для которых тканеспецифичность определяется внутриклеточным окрашиванием фрагментов (пептидов), полученных в результате расщепления тканеспецифических белков протеазами. "протеазо-индуцированные фрагменты белков" представляют собой фрагменты или пептиды, происходящие от белков, не принадлежащих СТМ, поглощенных, процесированных и расщепленных протеазами в фагосомах макрофагов. Выражение "опорные маркеры" относится к повторяющемуся набору маркеров для идентификации и подсчета совокупности СТМ и субпопуляций СТМ; в дополнение к указанным маркерам для идентификации субпопуляций СТМ, в частности, тканеспецифических макрофагов, так называемых субпопуляций CTSM, можно применять окрашивание дополнительных мембранных маркеров и о внутриклеточных компонентов.
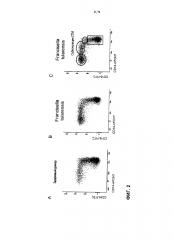
В соответствии с настоящим изобретением, набор опорных маркеров включает по меньшей мере антитела к маркерам CD14, CD16 и CD300e, предпочтительно дополненные антителами к HLADR и/или CD45. В одном варианте реализации применяют комбинацию CD14, CD16 и CD300e. В другом варианте реализации применяют комбинацию CD14, CD16, CD300e и HLADR. В предпочтительном случае дополнительно включают антитела к одному или более из маркеров CD11с, CD33, CD35, CD36, CD45 и CD64. Особенно предпочтительны антитела к CD45, CD36 и/или CD64. Очень полезные наборы (панели) антител включают или состоят из антител против CD14, CD16, CD300e и CD64; CD14, CD16, HLADR и CD64; CD14, CD16, CD300e, HLADR и CD64; CD14, CD16, CD300e, HLADR и CD45; CD14, CD16, CD300e, HLADR, CD64 и CD36. В одном аспекте окрашивание СТМ выполняют с помощью панели дифференциально меченных различных антител против маркеров CD14, CD16, CD11c, CD33, CD36, CD45, CD64, CD123, CD86, CD300e и HLA-DR. В специфическом аспекте окрашивание СТМ выполняют с помощью панели дифференциально меченных различных антител против маркеров CD14, CD16, CD300e, HLADR, CD45, CD64 и CD36. Это позволяет точно селективно пропускать (гейтировать) все моноциты и все СТМ, точно различать моноциты и СТМ и субпопуляции СТМ (Фигура 3).
В данной области техники описан анализ макрофагов для выявления поглощенных белков немакрофагального происхождения. В то же время, преимущества применения проточной цитометрии при выделении субпопуляций из популяции макрофагов на основе положительного отбора клеток, экспрессирующих по меньшей мере три специфических маркера поверхности (CD14, CD16, CD300e плюс HLA-DR и/или CD45), в соответствии с настоящим изобретением ранее не описывали или не предполагали.
Japink et al. (Gastroenterology, Elsevier, Vol.134, no. 4, (2008-04-01), page A-487) описывают определение внутриклеточного онкоэмбрионального антигена (СЕА) в CD14+/CD16+-клeткax из образцов крови с помощью проточной цитометрии с целью раннего обнаружения новообразований ободочной и прямой кишки или их рецидива.
Herwig et al. (European Urology Suppl., Vol. 5, No. 2, (2006-04-01), page 275, XP 005522982; and J. of Urology, Vol.181, No. 4 (2009-04-01), pg. 653, XP 025979386) описывают анализ мононуклеаров периферической крови CD14+/CD16+ с применением многоцветовой проточной цитометрии для определения внутриклеточного PSA (простатоспецифического антигена) при диагностике рака предстательной железы.
В WO 2010/015633 описан способ, позволяющий характеризовать молекулярные маркеры, которые внутриклеточно всасываются из ткани макрофагами крови, рециркулирующими из ткани в кровеносную систему. С этой целью определяют СD14/СD16-положительную популяцию-мишень, необязательно в комбинации с отрицательным отбором клеток, экспрессирующих CD56, CD57 и/или CD161.
WO 2009/1000953 относится к анализу активированных макрофагов (CD14/CD16) для выявления внутриклеточных фрагментов бета-амилоида. Фрагменты бета-амилоида обнаруживают с помощью MALDI-TOF-MS (масс-спектрометрией с времяпролетной ионизацией лазерной десорбцией и использованием матрицы) после лизиса клеток, для формирования пула клеточных лизатов, и иммунопреципитации. Комбинацию антител против CD45, CD14, CD16 и CD19 применяют для идентификации популяции активированных макрофагов и В-клеток.
Almeida et al. (Clin. Immunol. Vol. 100, No. 3, pp.325-338, 2001) провели сравнительный анализ морфологических, цитохимических, иммунофенотипическах и функциональных характеристик линий нормальных клеток периферической крови человека: клеток (-)/CD16(+)/HLA-DR(+)/CD14(low), моноцитов CD14(+) и дендритных клеток CD16(-). Описана сортировка мононуклеарных клеток с использованием комбинации антител против CD14, CD16 и HLADR, а также других маркеров, специфических для определенных направлений дифференцировки (например, CD3 для исключения Т-лимфоцитов, CD19 для исключения В-клеток и CD56 для исключения NK-клеток). Отсортированные клетки затем анализируют с помощью морфологического и цитохимического исследования моноцит-специфических характеристик. Внутриклеточное окрашивание процессированных тканеспецифических белков не было описано или не предлагалось.
Способ, основанный на применении многоцветной проточной цитометрии, представленный в настоящем документе, предпочтительно включает конкретные стратегии селективного пропускания (гейтирования) основанного поверхностной экспрессии CD14, CD16 и CD300e (IREM2), предпочтительно, CD14, CD16, CD300e (IREM2) и HLADR, в комбинации с анализом бокового светорассеяния (SSC) (Фигура 4). Стратегия селективного пропускания моноцитарно-макрофагальной клеточной популяции состоит из этапа включения (пропускания) и этапа идентификации субпопуляции. Целью этапа включения является пропускание как "классических моноцитов" (моноцитов, "поступающих в ткань"), так и тканевых макрофагов (моноциты/макрофаги, "уходящие из ткани" = циркулирующие тканевые макрофаги; СТМ). На последующих этапах следует различить классические моноциты и СТМ и, в частности, следует определить субпопуляции в популяции СТМ. Таким образом, в одном варианте реализации настоящего изобретения стратегия селективного пропускания включает (i) стратегию селективного пропускания для включения классических моноцитов и СТМ, с последующей (ii) стратегией селективного пропускания путем идентификации субпопуляций для различения классических моноцитов и СТМ и для идентификации одной или более субпопуляций в популяции СТМ.
Можно рассматривать различные стратегии селективного пропускания. Простейшая стратегия для обнаружения всех классических моноцитов и подавляющего большинства СТМ и некоторых субпопуляций СТМ включает окрашивание с использованием по меньшей мере CD14, CD16 и CD300e. Все классические моноциты и большинство (но не все) СТМ обнаруживают с помощью селективного пропускания (гейтирования) по комбинации бокового светорассеяния (SSC) и CD300e (IREM2)+-клеток (отбором клеток с низким и средним SSC, экспрессирующих CD300e). Более точная стратегия для обнаружения всех классических моноцитов и практически всех СТМ и некоторых субпопуляций СТМ включает окрашивание с использованием по меньшей мере CD14, CD16, CD300e и HLADR. Все классические моноциты, а также практически все СТМ обнаруживают посредством селективного пропускания по комбинации бокового светорассеяния (SSC) в комбинации с CD300e и HLADR (т.е. отбором клеток с низким и средним SSC, одновременно экспрессирующих CD300e и HLADR). Высокоточная стратегия для обнаружения всех классических моноцитов и всех СТМ и некоторых субпопуляций СТМ включает окрашивание с использованием по меньшей мере CD14, CD16, CD45, CD300e и HLADR. Все поступающие и все уходящие моноциты/макрофаги можно обнаружить посредством селективного пропускания по комбинации бокового светорассеяния (SSC) и CD45, CD300e и HLADR-положительных клеток. Конкретнее, отбирают клетки с CD45 и низким и средним SSC, одновременно экспрессирующие CD300e и HLADR (Фигура 4А и В). Соответственно, этап включения может включать один из следующих вариантов:
(i) окрашивание с использованием по меньшей мере CD14, CD16 и CD300e и селективное пропускание по комбинации SSC и СD300е+-клеток для отбора клеток с низким и средним SSC, экспрессирующих CD300e;
(ii) окрашивание с использованием по меньшей мере CD14, CD16, CD300e и HLADR и селективное пропускание по комбинации бокового светорассеяния (SSC) и CD300e и HLADR+-клеток для отбора клеток с низким и средним SSC, одновременно экспрессирующих CD300e и HLADR, либо
(iii) окрашивание с использованием по меньшей мере CD14, CD16, CD45, CD300e и HLADR
и селективное пропускание по комбинации SSC и CD45, CD300e и HLADR-положительных клеток, предпочтительно селективное пропускание клеток с CD45 и низким и средним SSC, одновременно экспрессирующих CD300e и HLADR (Фигура 4А-D).
Настоящее изобретение также обеспечивает несколько стратегий селективного пропускания для идентификации субпопуляций СТМ. В одном варианте реализации указанная стратегия позволяет идентифицировать классические моноциты (CD14+/CD16-) и некоторые субпопуляции СТМ. Субпопуляции СТМ определяют в пределах одного из вышеуказанных гейтов включения, предпочтительно с использованием по меньшей мере SSC, CD300e и HLADR, на основе дополнительного использования по меньшей мере CD14 и CD16. Соответственно, в одном варианте реализации стратегия селективного пропускания включает идентификацию классических (CD14+/CD16-) моноцитов и двух основных субпопуляций СТМ, идентифицируемых как CD14high/CD16low - CD14high/CD16high и CD14low/CD16high - CD14-/CD16high и CD14-/CD16low (Фигура 4D).
В еще одном варианте реализации стратегия селективного пропускания субпопуляций состоит из трех этапов, обеспечивающих более точное обнаружение классических моноцитов и нескольких субпопуляций СТМ в пределах одной из вышеуказанных комбинации параметров включения (предпочтительно с использованием по меньшей мере SSC, CD300e и HLADR), на основе дополнительного использования по меньшей мере CD14, CD16 и CD64.
На первом этапе идентифицируют классические моноциты и более зрелые стадии СТМ с помощью селективного пропускания по CD64low (СТМ поздней стадии) против CD64high (классические моноциты и СТМ ранней стадии). Целью второго этапа является различение моноцитов и СТМ путем отбора всех других ранних СТМ-клеток (по сравнению с классическими моноцитами) по фенотипу CD16+/CD14+. Следовательно, отобранные клетки, определяемые как CD64low и как CD16+/CD64high, должны составлять полную совокупность СТМ, а все остальные гейтированные клетки, отобранные на этапе общего селективного пропускания, должны соответствовать классическим моноцитам. На третьем этапе на основе уровней экспрессии CD64, CD14 и CD16 среди отобранных клеток СТМ можно далее подразделить на отдельные совокупности, связанные с функциональными свойствами или созреванием: от CD64high/CD14high/CD16low до CD64high/CD14high/CD16high, CD64high/CD14low/CD16high, CD64low/CD14-/CD16high и CD64low/CD14-/CD16low. Соответственно, в одном аспекте этап идентификации субпопуляций включает:
- селективное пропускание клеток CD64low, представляющих собой СТМ поздней стадии, в отличие CD64high, представляющих собой классические моноциты и СТМ ранней стадии, а затем
- различение моноцитов и СТМ путем отбора всех других СТМ-клеток ранней стадии (по сравнению с классическими моноцитами) по фенотипу CD16+/CD14+ и определение всей совокупности СТМ как CD64low и как CD 16+/CD64high, а затем
- дальнейшее подразделение отобранных СТМ на основе уровней экспрессии CD64, CD14 и CD16 на отдельные совокупности, связанные с функциональными свойствами или созреванием, причем предпочтительно указанные отдельные совокупности представляют собой CD64high/CD14high/CD16low - CD64high/CD14high/CD16high, CD64high/CDl4low/CD16high, CD64low/CD14-/CD16high и CD64low/CD14-/CD16low.
В еще одном варианте осуществления настоящее изобретение обеспечивает стратегию, обеспечивающую идентификацию дополнительных субпопуляций в популяции СТМ, что может быть полезным в случае определенных образцов (например, периферической крови детей или костного мозга взрослых), содержащих предшественники классических моноцитов. Использование CD36 в комбинации с CD64 способствует лучшей идентификации всех стадий созревания как классических моноцитов, так и СТМ на третьем этапе предшествующей стратегии в следующих субпопуляциях (Фигура 4Е-Н):
- Классические моноциты: от клеток CD64high/CD36lo (предшественники классических моноцитов) до CD64high/CD36high (реальные зрелые моноциты);
- субпопуляции СТМ: от CD64high/CD36high/CD14high/CD16low до CD64highCD36high/CD 14high/CD 16high, от CD64high/CD36highCD 14low/CD16high и CD64low/CD36high/CD14-/CD16high до CD64low/CD14-/CD16low/CD36- до клеток с низким содержанием антигенов.
Настоящее описание также обеспечивает способ, включающий этап дальнейшего подразделения отобранных СТМ на основе CD14, CD16, CD36 и CD64, предпочтительно включая идентификацию по меньшей мере одной из следующих субпопуляций СТМ: от CD64high/CD36high/CD14high/CD16low до CD64high/CD36high/CD 14high/CD 16high, CD64high/CD36high/CD14low/CD 16high, CD64low/CD36high/CD14-/CD16high и CD64low/CD14-/CD16low/CD36- до клеток с низким содержанием антигенов (Фигура 4 и Фигура 5).
Можно применять биологический образец любого типа, выделенный из организма субъекта-млекопитающего, обычно субъекта-человека, заведомо или предположительно содержащий циркулирующие тканевые макрофаги. Например, биологический образец для тестирования включает периферическую кровь, асцитную жидкость, плевральный выпот, спинномозговую жидкость, костный мозг, лимфатический узел, лимфатическую жидкость, синовиальную жидкость или суспензию одиночных клеток, полученную из плотной ткани. Особенно подходящей является периферическая кровь, так как ее легко получить от субъекта с помощью малоинвазивной процедуры, например, венепункции.
Способ согласно настоящему изобретению предпочтительно выполняют в формате с несколькими пробирками, который дает возможность объединить информацию о субпопуляциях CTSM. Это основано на справедливом предположении, что в условиях нормального гомеостаза каждый отдельный CTSM может быть положителен в отношении пептидов (фрагментов белков) только из одной ткани. Таким образом, также обеспечивается способ, при котором две или более аликвоты одного и того же биологического тестируемого образца параллельно к окраске на одни и те же опорные маркера для идентификации субпопуляций СТМ, окрашивают различными дополнительными антителами для более подробного выявления субпопуляций в отдельных популяциях CTSM, согласно ткани, из которой они происходят, на основе обнаружения протеазо-индуцированных фрагментов белка, происходящих от тканеспецифичных белков с целью сканирования гомеостатического состояния и возможного нарушения тканевого гомеостаза в тканях всего организма.
Herwig et al. (2004, 2005, ЕР 1516182) и Leers et al. (2008) описали обнаружение у больных раком предстательной железы циркулирующих CD14het/CD16het тканевых макрофагов, которые, как утверждалось, содержат внутриклеточный простата-специфический антиген (PSA). Leers et al. (2008) сделали вывод, что частота PSA-положительных тканевых макрофагов в крови постепенно возраствает при сравнении доброкачественной гиперплазии с локализованным раком предстательной железы и с метастатическим раком предстательной железы (Leers et al, Am J Clin Pathol 2008). В то же время, они представили данные проточной цитометрии, по-видимому, содержащие ложноположительные результаты по отношению к окрашиванию по PSA:
- PSA-положительные клетки не обнаруживались в виде отдельной популяции, помимо отделенной от популяции СТМ при установке "контролируемых" маркеров;
- Казалось бы, PSА-положительные CD14dim/CD16high тканевые макрофаги, встречающиеся с высокой частотой, находятся в необычном положении как на графике светорассеяния, так и на графике CD14 по сравнению с CD16, что указывает на образование дублетов и, следовательно, на потенциальные ложноположительные результаты по отношению к PSA.
Таким образом, несмотря на то, что СТМ, встречающиеся с повышенной частотой, вполне могут происходить из предстательной железы, окончательное доказательство этого за счет окрашивания на PSA не является убедительным. Скорее всего, это вызвано недостаточной реакционной способностью применявшихся антител в отношении пептидов PSA в популяции CTSM. В этом контексте следует отметить, что выбор примененных антител против PSA основывался на распознавании интактного белка PSA, а не эпитопов фрагментов или пептидов, полученных при внутриклеточном процессинге и деградации PSA. Следовательно, исходный эпитоп PSA, распознаваемый антителом против PSA, скорее всего, утрачивался в пептидах PSA, которые были представлены в CTSM, и поэтому не поддавался обнаружению.
Стратегии селективного пропускания по Herwig et al. (European Urology Suppl., Vol. 5, No. 2, (2006-04-01), page 275, XP 005522982; and J. of Urology, Vol. 181, No. 4 (2009-04-01), pg. 653, XP 025979386), Leers et al. (2008), Brozek (WO 2010/015633) и Japink et al. (Gastroenterology, Elsevier, Vol. 134, no. 4, (2008-04-01), page A-487) недостаточны для включения всех СТМ и недостаточны для исключения всех клеток, не являющихся СТМ. В основном это вызвано тем, что вышеупомянутые ученые выбрали селективное пропускание с включением на основании лишь SSC и CD45, или отрицательный отбор на основании CD19, CD56, CD57 или CD161 без подтверждения соответствующего исключения мультиплетов клеток. Такие стратегии селективного пропускания приводят к ложноположительным результатам, а также могут привести к ложноотрицательным результатам.
В отличие от предыдущих работ других авторов (Herwig et al., Leers et al. и Japink et al.) и нашей собственной группы, в настоящем документе мы предлагаем процедуру идентификации всех отдельных субпопуляций классических моноцитов и СТМ на основе отбора с применением дополнительных положительных маркеров (СD300е+-клетки и предпочтительно также HLADR+) без необходимости исключения других клеток, например, Т-, NK- и В-лимфоцитов. Такая процедура обеспечивает простое прямое исключение СD300е-лимфоцитов, в то же время облегчает идентификацию CD14-/CD16low СТМ поздней стадии, которые обычно исключаются, если выбор СТМ основан исключительно на CD14+- и/или СВ16+-клетках (Фигура 4 и Фигура 5).
Диагностический набор для СТМ без представленных в настоящем документе маркеров включения и маркеров субпопуляции СТМ невозможно надежно применять в рамках повседневной рутинной диагностики, где требуются точные относительные и абсолютные количественные показания клеточных популяций.
Этап с) способа, обеспечиваемого в настоящем документа, включает выявление по меньшей мере одной субпопуляции циркулирующих тканеспецифичных макрофагов (CTSM) с использованием одного или нескольких антител для обнаружения, направленных против одного или нескольких эпитопов по меньшей мере одного протеазо-индуцированного фрагмента белка, образованного при внутриклеточной деградации белка отдельными СТМ в тканях, из которых они происходят. Специалист в данной области техники должен понимать, что согласно концепции, лежащей в основе настоящего изобретения, могут применяться различные подходы. Например, антитела для обнаружения включают антитела для внутриклеточного окрашивания (Фигура 6):
a) одного или более эпитопов одиночного протеазо-индуцированного фрагмента белка, происходящего от процессируемого внутри клетки тканеспецифического белка;
b) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от одного процессируемого внутри клетки тканеспецифического белка;
c) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых клеток одиночного органа или ткани;
d) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков аномальных клеток одиночного органа или ткани;
e) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых и аномальных клеток одиночного органа или ткани, включая комбинацию по меньшей мере одного антитела против пептидных эпитопов нормального белка и по меньшей мере одного антитела против пептидных эпитопов аномального белка, а также;
f) одного или более эпитопов двух или более отдельных протеазо-индуцированных фрагментов белка, происходящих от двух или более процессированных внутри клетки тканеспецифических белков здоровых или аномальных клеток из двух или более органов или тканей;
В одном варианте реализации панель опорных реагентов, применяемых для выявления субпопуляций СТМ, объединяют с одним или несколькими реагентами, направленными против одного или нескольких эпитопов двух или более отдельных протеазо-индуци