Фармацевтическая композиция для предупреждения или лечения неалкогольной жировой болезни печени
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и медицины и касается фармацевтической композиции для предупреждения и лечения неалкогольной жировой болезни печени (НЖБП), включающей конъюгат, полученный путем ковалентного связывания инсулинотропного пептида и Fc-фрагмента иммуноглобулина посредством непептидильного полимера, в эффективном количестве и фармацевтически приемлемый носитель, где неалкогольная жировая болезнь печени выбрана из группы: простого стеатоза, жировых заболеваний печени, вызванных недостаточностью питания, голоданием, ожирением и диабетом, стеатогепатита, фиброза печени и цирроза печени. Раскрыт также способ лечения. Группа изобретений обеспечивает сохранение in-vivo активности пептида на относительно высоком уровне и заметно увеличивает период полувыведения из крови, предупреждая тем самым накопление триглицеридов, которое является характерной особенностью неалкогольной жировой болезни печени. 2 н. и 15 з.п. ф-лы, 2 ил., 1 табл., 3 пр.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции, включающей длительно действующий конъюгат инсулинотропного пептида, который можно применять для предупреждения или лечения неалкогольной жировой болезни печени. В частности, настоящее изобретение относится к конъюгату инсулинотропного пептида, в котором инсулинотропный пептид, непептидильный полимер и Fc-фрагмент иммуноглобулина ковалентно связывают друг с другом, для того чтобы заметно увеличивать период полувыведения из крови, эффективно предупреждать накопление триглицеридов и применять его для предупреждения или лечения неалкогольной жировой болезни печени.
Предшествующий уровень техники
Неалкогольная жировая болезнь печени относится к широкому спектру заболеваний в диапазоне от простого стеатоза, который не сопровождается воспалительным ответом у пациента, не употребляющего чрезмерно алкоголь, до фиброза печени и цирроза печени, которые являются результатом прогрессирования простого стеатоза и демонстрируют печеночно-клеточное воспаление.
Неалкогольную жировую болезнь печени можно классифицировать на первичные и вторичные неалкогольные жировые болезни печени в зависимости от патологической причины. Первичное заболевание вызывается гиперлипидемией, диабетом, ожирением или тому подобным, которое представляет собой признак метаболического синдрома. Вторичное заболевание является результатом причин, обусловленных питанием (внезапная потеря массы тела, голодание, операция шунтирования тонкой кишки), различными лекарственными средствами, токсическими веществами (ядовитые грибы, бактериальные токсины), метаболических причин и других факторов.
Известно, что коэффициент заболеваемости первичной неалкогольной жировой болезнью печени, при которой главным фактором являются диабет и ожирение, представляющие собой важные признаки метаболического синдрома, составляет примерно 50% у больных диабетом, примерно 76% у больных ожирением и самый высокий у больных с диабетом, страдающих ожирением (Gupte Ρ et al., 2004). Кроме того, при выполнении биопсии печени у больных диабетом и ожирением с повышенным уровнем аланинаминотрансферазы (ALT), коэффициент заболеваемости стеатогепатитом находится в диапазоне от 18 до 36% (Braillon A et al., 1985).
В настоящее время отсутствует общепринятый способ определения причины неалкогольной жировой болезни печени. Причина состоит в том, что коэффициент заболеваемости неалкогольной жировой болезнью печени связан с рядом факторов, таких как диабет, ожирение, ишемическая болезнь сердца и привычки, связанные с образом жизни. Имеются некоторые сообщения об эффектах лекарственных средств против диабета или ожирения, оказываемых на жировую болезнь печени. Орлистат, который применяют в качестве перорального лекарственного средства против ожирения, демонстрировал гистологические улучшения в печени пациентов со стеатогепатитом (Hussein et al., 2007), а метформин демонстрировал снижение уровней печеночных ферментов в крови и некротизирующего воспаления печени и фиброза при неалкогольной жировой болезни печени у пациентов без проявления диабета (Bugianesi et al., 2005). Кроме того, лекарственные средства класса тиазолидиндионов (TZD), которые представляют собой агонисты PPAR (рецептора, активирующего пролиферацию пероксисом), ингибируют накопление жира в печени и мышцах, и оказывают непосредственное противофиброзное воздействие на печень в животных моделях неалкогольных жировых заболеваний печени (Galli A et al., 2002).
В то же время, глюкагоноподобный пептид-1 (GLP-1) представляет собой эндогенный пептид, присутствующий в организме, и представляет собой гормон, секретируемый из L-клеток кишечника в ответ на стимулирование посредством питательных веществ или уровень глюкозы в крови в кишечнике. GLP-1 имеет разнообразие физиологических активностей, включая регулирование уровня глюкозы в крови путем стимулирования секреции инсулина, пролиферацию β-клеток поджелудочной железы, подавление моторики верхних отделов желудочно-кишечного тракта и подавление аппетита. Недавно в гепатоцитах обнаружили экспрессию рецепторов GLP-1, и GLP-1 демонстрирует хорошие эффекты в отношении неалкогольной жировой болезни печени путем активации фосфоинозитид-зависимой киназы-1 (PDK-1) и протеинкиназы С-(PKC-), которые являются главными белками в инсулиновом сигнальном пути, при помощи GLP-1-рецепторов гепатоцитов (Gupta NA et al., 2010). GLP-1 также работает на снижение накопления жирной кислоты или защищает гепатоциты от смерти, вызываемой стрессом эндоплазматического ретикулума, посредством активации как шаперон-опосредованной аутофагии (СМА), так и макроаутофагии (Sharma S et al., 2011). В недавнем исследовании сообщалось, что GLP-1 способствует окислению печеночных липидов для предупреждения накопления печеночного жира и способствует активности инсулина (Svegliati-Baroni G et al., 2011). Эти многочисленные сообщения наводят на мысль, что производное GLP-1 может быть важным кандидатом для создания профилактического и терапевтического агента для неалкогольной жировой болезни печени.
Однако основным препятствием для применения GLP-1 в качестве терапевтического агента для неалкогольной жировой болезни печени является его короткий период полувыведения из крови (максимальный период полувыведения: 2 минуты). Это объясняется потерей титров GLP-1 из-за расщепления между 8-ой аминокислотой (Ala) и 9-ой аминокислотой (Asp) посредством дипептидилпептидазы IV (DPP IV) в организме. По этой причине были выполнены различные исследования на аналоге GLP-1, имеющем устойчивость к DPP IV, и были выполнены испытания по замене Ala8 на Gly (Deacon et al., 1998; Burcelin et al., 1999), или на Leu или на D-Ala (Xiao et al., 2001), тем самым повышая устойчивость к DPP IV, сохраняя при этом активность. N-концевая аминокислота His7 GLP-1 имеет решающее значение для активности GLP-1 и служит в качестве мишени DPP IV. Таким образом, в патенте США №5545618 описано, что N-конец модифицируют алкильной или ацильной группой и Gallwitz, et al. описывает, что 7-ой His подвергали N-метилированию, или альфа-метилированию, или весь His заменяют на имидазол для увеличения устойчивости к DPP IV и сохранения физиологической активности.
В дополнение к этим модификациям эксендин-4, который представляет собой аналог GLP-1, выделенный из слюнной железы ящерицы-ядозуба (патент США №5424686), имеет устойчивость к DPP IV и более высокую физиологическую активность, чем GLP-1. В результате он имел период полувыведения in-vivo от 2 до 4 часов, промежуток времени, который длиннее, чем у GLP-1. Однако с помощью одного лишь способа повышения устойчивости к DPP IV, физиологическая активность не является достаточно длительной и, например, в случае имеющегося в продаже эксендина-4 (эксенатид), его необходимо инъецировать пациенту дважды в сутки. Такая частота все же сложна для пациентов. Пептид, полученный для решения проблемы, представляет собой эксендин-4, который устойчив к DPP IV и имеет период полувыведения из крови от 2 до 4 часов. Хотя его период полувыведения из крови дольше, чем для GLP-1, его также необходимо инъецировать ежедневно.
Описание изобретения
Техническая задача
Таким образом, авторы настоящего изобретения использовали способ сайт-специфического связывания Fc-фрагмента иммуноглобулина, непептидильного полимера и инсулинотропного пептида ковалентной связью для того, чтобы максимизировать эффекты увеличения периода полувыведения из крови для инсулинотропного пептида и сохранения активности in-vivo. В результате авторы настоящего изобретения обнаружили, что способ заметно увеличивал период полувыведения из крови конъюгата пептида и обеспечивал намного более длительный период полувыведения из крови, по сравнению с известным способом слияния в рамке считывания. Авторы настоящего изобретения также обнаружили, что конъюгат, полученный сайт-специфическим связыванием Fc-фрагмента иммуноглобулина с аминогруппой или тиоловой группой, присутствующей в аминокислотном остатке, который не является N-концевым остатком инсулинотропного пептида, сохраняет более высокие титры, чем конъюгат, полученный связыванием на N-конце инсулинотропного пептида. В результате было подтверждено, что конъюгат демонстрирует превосходные терапевтические эффекты на неалкогольную жировую болезнь печени, даже если его вводили реже, чем известные композиции эксендина-4, тем самым завершая настоящее изобретение.
Решение проблемы
Цель настоящего изобретения заключается в предложении длительно действующего конъюгата инсулинотропного пептида, который сохраняет пролонгированный in-vivo период полувыведения и эффективно предупреждает накопление триглицеридов и, таким образом, является полезным для предупреждения или лечения неалкогольной жировой болезни печени.
Полезные эффекты изобретения
Конъюгат инсулинотропного пептида по настоящему изобретению сохраняет in-vivo активность пептида на относительно высоком уровне, имеет заметно увеличенный период полувыведения из крови и эффективно активирует главные белки, вовлеченные в липолиз, для предупреждения накопления триглицеридов, тем самым оказываясь полезным для предупреждения и лечения неалкогольной жировой болезни печени.
Краткое описание графических материалов
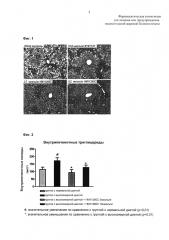
На ФИГ. 1 показаны изображения ткани печени мыши ob/ob, которой вводили длительно действующий конъюгат эксендина-4 согласно одному воплощению настоящего изобретения (окрашивание гематоксилином и эозином, Н&Е окрашивание, область, окрашенная в фиолетовый цвет: нормальная ткань печени; область, окрашенная в белый цвет: капли жира); и
На ФИГ. 2 показана диаграмма накопления внутрипеченочных триглицеридов у мышей с индуцированным ожирением, находящихся на высокожирной диете, которым вводили длительно действующий конъюгат эксендина-4 согласно одному воплощению настоящего изобретения (#: значимое повышение с доверительным интервалом 99%, по сравнению с группой с нормальной диетой (p<0,01), *: значимое снижение с доверительным интервалом 99%, по сравнению с группой с высокожирной диетой (p<0,01)).
Лучший вариант осуществления изобретения
В одном аспекте для достижения вышеупомянутых целей одно воплощение относится к фармацевтической композиции для предупреждения или лечения неалкогольной жировой болезни печени, включающей лекарственный конъюгат инсулинотропного пептида в качестве активного ингредиента, который получают ковалентным связыванием инсулинотропного пептида и Fc-фрагмента иммуноглобулина с помощью непептидильного полимера.
В фармацевтической композиции по настоящему изобретению инсулинотропный пептид выбирают из группы, состоящей из эксендина-4, производного эксендина-4, полученного путем удаления N-концевой аминогруппы эксендина-4, производного эксендина-4, полученного путем замены N-концевой аминогруппы эксендина-4 на гидроксильную группу, производного эксендина-4, полученного путем модифицирования N-концевой аминогруппы эксендина-4 диметильной группой, и производного эксендина-4, полученного путем удаления альфа-углерода N-концевого остатка гистидина эксендина-4 и N-концевой аминогруппы, связанной с альфа-углеродом.
Непептидильный полимер выбирают из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимеров этиленгликоль-пропиленгликоль, полиоксиэтилированных полиолов, поливинилового спирта, полисахаридов, декстрана, поливинилэтилового эфира, биоразлагаемых полимеров, полимеров липидов, хитинов, гиалуроновой кислоты и их комбинаций.
Инсулинотропный пептид по настоящему изобретению представляет собой пептид, обладающий инсулинотропной функцией для стимулирования синтеза и экспрессии инсулина в бета-клетках поджелудочной железы. Эти пептиды включают предшественники, производные, фрагменты, варианты или тому подобное и, предпочтительно, GLP (глюкагоноподобный пептид)-1, эксендин-3, эксендин-4 или тому подобное.
GLP-1 представляет собой гормон, который секретируется в тонком кишечнике. В общем случае он способствует биосинтезу и секреции инсулина, подавляет секрецию глюкагона и способствует абсорбции глюкозы в клетках. В тонком кишечнике предшественник глюкагона распадается на три пептида, а именно глюкагон, GLP-1 и GLP-2. Здесь GLP-1 обозначает GLP-1 (1-37), который изначально находится в форме, не имеющей инсулинотропной функции. Но затем он обрабатывается и превращается в активированную форму GLP-1 (7-37). Аминокислотная последовательность GLP-1 (7-37) является следующей:
GLP-1 (7-37)(SEQ ID NO: 1)
HAEGT FTSDV SSYLE GQAAK EPIAW LVKGR G
Производное GLP-1 обозначает пептид, который демонстрирует гомологию аминокислотных последовательностей с последовательностью GLP-1 по меньшей мере 80%, может находиться в химически модифицированной форме и демонстрирует инсулинотропную функцию, по меньшей мере эквивалентную таковой GLP-1 или большую.
Фрагмент GLP-1 обозначает форму, в которой одну или более аминокислот добавляют в N-конец или С-конец нативного GLP-1 или удаляют из них, и добавленная аминокислота возможно представляет собой аминокислоту неприродного происхождения (например, аминокислоту D-типа).
Вариант GLP-1 обозначает пептид, имеющий инсулинотропную функцию, который имеет одну или более аминокислотных последовательностей, отличных от последовательностей нативного GLP-1.
Эксендин-3 и эксендин-4 представляют собой инсулинотропные пептиды, состоящие из 39 аминокислот, которые имеют гомологию аминокислотных последовательностей с GLP-1 53%. Аминокислотные последовательности эксендина-3 и эксендина-4 являются следующими:
Эксендин-3 (SEQ ID NO: 2)
HSDGT FTSDL SKQME EEAVR LFIEW LKNGG PSSGA PPPS
Эксендин-4 (SEQ ID NO: 3)
HGEGT FTSDL SKQME EEAVR LFIEW LKNGG PSSGA PPPS
Производное эксендина означает пептид, имеющий гомологию аминокислотных последовательностей с нативным эксендином по меньшей мере 80%, который может иметь некоторые химически замещенные группы на аминокислотном остатке и демонстрирует инсулинотропную функцию, по меньшей мере эквивалентную таковой нативного эксендина или большую.
Фрагмент эксендина означает фрагмент, имеющий одну или более аминокислот, добавленных в N-конец или в С-конец нативного эксендина или удаленных из них, и добавленная аминокислота возможно представляет собой аминокислоту неприродного происхождения (например, аминокислоту D-типа).
Вариант эксендина означает пептид, обладающий инсулинотропной функцией, который имеет одну или более аминокислотных последовательностей, отличных от последовательностей нативного эксендина.
В конкретном воплощении нативный инсулинотропный пептид, применяемый в настоящем изобретении, и модифицированный инсулинотропный пептид можно синтезировать, используя способ твердофазного синтеза, и большую часть нативных пептидов, включая нативный инсулинотропный пептид, можно получать посредством технологии рекомбинации.
Кроме того, инсулинотропный пептид, применяемый в настоящем изобретении, может связываться с непептидильным полимером на различных участках.
Конъюгат, полученный в настоящем изобретении, может иметь активность, которая варьирует в зависимости от участков связывания инсулинотропного пептида.
Например, его можно соединять с N-концом и другим концом, включая С-конец, соответственно, которые показывают различие in-vitro активности. Альдегидная реакционноспособная группа избирательно связывается с N-концом при низком pH и может связываться с остатком лизина с образованием ковалентной связи при высоком pH, например pH 9,0. Реакция пегилирования дает возможность действовать при переменном pH, и затем для отделения позиционного изомера из реакционной смеси можно использовать ионообменную колонку.
Если инсулинотропный пептид подлежит соединению в участке, отличном от N-конца, который является важным участком для in-vivo активности, реакционноспособную тиоловую группу можно вводить в участок подлежащего модифицированию аминокислотного остатка в нативной аминокислотной последовательности, чтобы образовать ковалентную связь, используя малеимидный линкер в непептидильном полимере.
Если инсулинотропный пептид подлежит соединению в участке, отличном от N-конца, который является важным участком для in-vivo активности, реакционноспособную аминогруппу можно вводить в участок подлежащего модифицированию аминокислотного остатка в нативной аминокислотной последовательности, чтобы образовать ковалентную связь, используя альдегидный линкер в непептидильном полимере.
Когда используют альдегидный линкер в непептидильном полимере, его приводят во взаимодействие с аминогруппой на N-конце и остатком лизина, и модифицированную форму инсулинотропного пептида можно использовать для избирательного увеличения выхода реакции. Например, только одну аминогруппу для взаимодействия можно оставлять на желаемом участке, используя способ блокирования N-конца, способ замены остатка лизина, способ введения аминогруппы на карбоксильном конце или тому подобное, тем самым увеличивая выход пегилирования и реакций связывания. Способы защиты N-конца включают диметилирование, а также метилирование, дезаминирование, ацетилирование и так далее, но не ограничиваются такими способами алкилирования.
В одном предпочтительном воплощении конъюгат инсулинотропного пептида по настоящему изобретению представляет собой конъюгат инсулинотропного пептида, в котором Fc-фрагмент иммуноглобулина специфически связывается с аминогруппой, отличной от групп на N-конце инсулинотропного пептида.
В одном конкретном воплощении авторы настоящего изобретения индуцировали пегилирование нативного эксендина-4 при pH 9,0 для избирательного соединения ПЭГ с остатком лизина инсулинотропного пептида. Альтернативно, для соединения можно синтезировать производные эксендина-4, имеющие удаленный или защищенный N-конец. Пегилирование на N-конце можно блокировать либо путем удаления аминогруппы альфа N-концевого гистидина, либо путем модифицирования N-концевого гистидина двумя метильными группами. Такая N-концевая модификация не влияет на in-vitro активность (Таблица 1).
В отличие от N-концевого связывания эксендина-4, связывание на остатке лизина сохраняло приблизительно 6% in-vitro активности (Таблица 1). Кроме того, конъюгат эксендин-4-ПЭГ-Fc-фрагмент иммуноглобулина, полученный в настоящем изобретении, демонстрировал заметно увеличенный период полувыведения из крови 60~70 часов, что указывает на неожиданно высокий период эффективности. По этой причине также минимизировали снижение титра посредством связывания с остатком лизина, который не влияет на активность, и таким образом может быть получена новая композиция длительно действующего эксендина-4, способная к сохранению in-vivo активности.
Fc-фрагмент иммуноглобулина безопасен для применения в качестве носителя лекарственного средства, так как он представляет собой биоразлагаемый полипептид, который метаболизируется in vivo. Также Fc-фрагмент иммуноглобулина имеет относительно низкую молекулярную массу по сравнению с целыми молекулами иммуноглобулина и, таким образом, является полезным для получения, очистки и выхода конъюгата. Так как Fc-фрагмент иммуноглобулина не содержит Fab-фрагмент, аминокислотная последовательность которого отличается согласно подклассам антител и который, таким образом, является весьма негомогенным, можно ожидать, что Fc-фрагмент иммуноглобулина может значительно увеличивать гомогенность веществ и быть менее антигенным.
Термин «Fc-фрагмент иммуноглобулина» при использовании здесь относится к константной области тяжелых цепей 2 (CH2) и к константной области тяжелых цепей 3 (CH3) и не включает вариабельные области тяжелых и легких цепей, к константной области тяжелых цепей 1 (CH1) и к константной области легких цепей 1 (CL1) иммуноглобулина. Он может дополнительно включать шарнирную область в константной области тяжелых цепей. Также Fc-фрагмент иммуноглобулина по настоящему изобретению может содержать часть или весь Fc-фрагмент, включая константную область тяжелых цепей 1 (CH1) и/или константную область легких цепей 1 (CL1), за исключением вариабельных областей тяжелых и легких цепей, при условии, что он обладает эффектами, по существу аналогичными нативному белку или лучшими, чем у него. Также Fc-фрагмент иммуноглобулина может представлять собой фрагмент, имеющий делецию в относительно длинной части аминокислотной последовательности CH2 и/или CH3. То есть Fc-фрагмент иммуноглобулина по настоящему изобретению может включать 1) домен CH1, домен CH2, домен CH3 и домен CH4, 2) домен CH1 и домен CH2, 3) домен CH1 и домен CH3, 4) домен CH2 и домен CH3, 5) комбинацию одного или более доменов и шарнирной области иммуноглобулина (или часть шарнирной области) и 6) димер каждого домена константных областей тяжелых цепей и константной области легких цепей.
Fc-фрагмент иммуноглобулина по настоящему изобретению включает нативную аминокислотную последовательность и производное этой последовательности (мутант). Производное аминокислотной последовательности представляет собой последовательность, которая отличается от нативной аминокислотной последовательности вследствие делеции, вставки, неконсервативного или консервативного замещения одного или более аминокислотных остатков, или их комбинаций. Например, известно, что аминокислотные остатки в Fc IgG, важные для связывания, в положениях от 214 до 238, от 297 до 299, от 318 до 322 или от 327 до 331 можно использовать в качестве подходящей мишени для модифицирования. Также являются возможными другие различные производные, включая те, в которых фрагмент, способный к образованию дисульфидной связи, удаляют или конкретные аминокислотные остатки исключают из N-конца нативной формы Fc, или добавляют туда остаток метионина. Кроме того, для удаления эффекторных функций может иметь место делеция в участке связывания комплемента, таком как участок связывания C1q и участок ADCC (антителозависимая клеточно-опосредованная цитотоксичность). Методы получения таких производных последовательности Fc-фрагмента иммуноглобулина раскрыты в публикациях международных патентных заявок WO 97/34631 и WO 96/32478.
Аминокислотные замены в белках и пептидах, которые обычно не изменяют активность молекул, известны в данной области техники (H. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Обычно имеющие место замены представляют собой Ala/Ser, Val/lle, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/lle, Leu/Val, Ala/Glu, Asp/Gly в обоих направлениях.
Fc-фрагмент, если желательно, можно модифицировать путем фосфорилирования, сульфатирования, акрилирования, гликолизирования, метилирования, фарнезилирования, ацетилирования, амидирования и тому подобного.
Вышеупомянутые производные Fc представляют собой производные, которые имеют биологическую активность, идентичную Fc-фрагменту по настоящему изобретению, или улучшенную структурную устойчивость к нагреванию, pH или тому подобному.
Кроме того, эти Fc-фрагменты можно получать из нативных форм, выделенных из людей и других животных, включая крупный рогатый скот, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или они могут представлять собой их рекомбинанты или производные, полученные из трансформированных животных клеток или микроорганизмов. В данном описании изобретения они могут быть получены из нативного иммуноглобулина путем выделения целых иммуноглобулинов из организма человека или животного и их обработки протеолитическим ферментом. Папаин гидролизует нативный иммуноглобулин на фрагменты Fab и Fc, а обработка пепсином приводит к получению фрагментов pF'c и F(ab)2. Эти фрагменты можно подвергать гель-хроматографии для выделения Fc или pF'c.
Предпочтительно, Fc-фрагмент, полученный от человека, представляет собой Fc-фрагмент рекомбинантного иммуноглобулина, который получают из микроорганизма.
Кроме того, Fc-фрагмент иммуноглобулина может находиться в форме, содержащей нативные сахарные цепи, увеличенные сахарные цепи по сравнению с нативной формой, или уменьшенные сахарные цепи по сравнению с нативной формой, или может находиться в дегликолизированной форме. Увеличение, уменьшение или удаление сахарных цепей Fc-фрагмента иммуноглобулина может быть достигнуто способами, общепринятыми в данной области техники, такими как химический способ, ферментный способ и способ генной инженерии, использующий микроорганизм. Удаление сахарных цепей из Fc-фрагмента приводит к резкому уменьшению аффинности связывания с комплементом (c1q) и к уменьшению или потере антителозависимой клеточно-опосредованной цитотоксичности или комплементозависимой цитотоксичности, тем самым не индуцируя ненужные иммунные ответы in-vivo. В этом смысле, Fc-фрагмент иммуноглобулина в дегликолизированной или агликолизированной форме может быть более подходящим для цели настоящего изобретения в качестве носителя лекарственного средства.
При использовании здесь, термин «дегликолизирование» относится к ферментативно удаленным из Fc-фрагмента сахарным группировкам, а термин «агликолизирование» означает, что Fc-фрагмент продуцируется в негликолизированной форме прокариотом, предпочтительно Е. coli.
Хотя Fc-фрагмент иммуноглобулина можно предпочтительно получать от людей, его можно также получать от других животных, включая крупный рогатый скот, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок. Кроме того, Fc-фрагмент иммуноглобулина может представлять собой Fc-фрагмент, который получают из IgG, IgA, IgD, IgE и IgM, или который изготавливают посредством их комбинаций или их гибридов. Предпочтительно, его получают из IgG или IgM, который принадлежит к наиболее часто встречающимся белкам в крови человека, и наиболее предпочтительно получают из IgG, который, как известно, увеличивает периоды полувыведения лиганд-связывающих белков.
С другой стороны, термин «комбинация» при использовании здесь означает, что полипептиды, кодирующие одиночные цепи Fc-фрагментов иммуноглобулина одного и того же происхождения, связывают с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. То есть димер или мультимер можно образовывать из двух или более фрагментов, выбранных из группы, состоящей из фрагментов IgG Fc, IgA Fc, IgM Fc, IgD Fc, и IgE Fc.
Термин «гибрид», при использовании здесь, означает, что последовательности, кодирующие два или более Fc-фрагментов иммуноглобулина различного происхождения, присутствуют в одноцепочечном Fc-фрагменте иммуноглобулина. В настоящем изобретении возможны различные типы гибридов. То есть гибриды домена могут состоять из от одного до четырех доменов, выбранных из группы, состоящей из CH1, CH2, CH3 и CH4 из IgG Fc, IgM Fc, IgA Fc, IgE Fc и IgD Fc, и могут включать шарнирную область.
С другой стороны, IgG можно разделить на подклассы IgG1, IgG2, IgG3 и IgG4, и настоящее изобретение может включать их комбинации и гибриды. Предпочтительными являются подклассы IgG2 и IgG4, и наиболее предпочтительным является Fc-фрагмент из IgG4, редко обладающий эффекторными функциями, такими как CDC (комплементозависимая цитотоксичность).
То есть в качестве носителя лекарственного средства по настоящему изобретению наиболее предпочтительным Fc-фрагментом иммуноглобулина является негликолизированный Fc-фрагмент, полученный из IgG4 человека. Полученный от человека Fc-фрагмент является более предпочтительным, чем полученный от другого организма Fc-фрагмент, который может выступать в роли антигена в организме человека и вызывать нежелательные иммунные ответы, такие как продуцирование нового антитела против антигена.
Термин «непептидильный полимер» при использовании здесь относится к биосовместимому полимеру, включающему две или более повторяющихся единиц, связанных друг с другом посредством любой ковалентной связи, исключая пептидную связь.
Непептидильный полимер, который можно применять в настоящем изобретении, может быть выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимеров этиленгликоля и пропиленгликоля, полиоксиэтилированных полиолов, поливинилового спирта, полисахаридов, декстрана, поливинилэтилового эфира, биоразлагаемых полимеров, таких как PLA (полимолочная кислота) и PLGA (полимолочная-гликолевая кислота), полимеров липидов, хитинов, гиалуроновой кислоты и их комбинаций, из которых предпочтительным является полиэтиленгликоль. Их производные, хорошо известные в данной области техники и легко получаемые специалистом в данной области техники, также включены в объем настоящего изобретения.
Пептидный линкер, который используют в слитых белках, полученный посредством общепринятого способа слияния в рамке, имеет недостатки в том, что он легко расщепляется in-vivo протеолитическим ферментом и, таким образом, достаточный эффект увеличения периода полувыведения из крови активного лекарственного средства посредством носителя не может быть получен, как ожидалось. Однако в настоящем изобретении полимер, обладающий устойчивостью к протеолитическому ферменту, можно использовать, чтобы сохранить период полувыведения из крови пептида аналогичным таковому периоду для носителя. По этой причине любой непептидильный полимер для применения в настоящем изобретении можно использовать без какого-либо ограничения, пока он является полимером, обладающим вышеупомянутой функцией, то есть полимером, имеющим устойчивость к in-vivo протеолитическому ферменту. Непептидильный полимер предпочтительно имеет молекулярную массу в диапазоне от 1 до 100 кДа и предпочтительно от 1 до 20 кДа. Также непептидильный полимер по настоящему изобретению, связанный с Fc-фрагментом иммуноглобулина, может представлять собой один полимер или комбинацию различных типов полимеров.
Непептидильный полимер, используемый в настоящем изобретении, имеет реакционноспособную группу, способную связываться с Fc-фрагментом иммуноглобулина и белковым лекарственным средством.
Непептидильный полимер имеет на обоих концах реакционноспособную группу, которую предпочтительно выбирают из группы, состоящей из реакционноспособной альдегидной группы, группы пропиональдегида, группы бутиральдегида, группы малеимида и производного сукцинимида. Производное сукцинимида может представлять собой сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат. В частности, когда непептидильный полимер имеет на обоих концах реакционноспособную альдегидную группу, он эффективен в связывании на обоих концах с физиологически активным полипептидом и иммуноглобулином с минимальными неспецифическими реакциями. Конечный продукт, образованный путем восстановительного алкилирования с помощью альдегидной связи, является гораздо более устойчивым, чем при связывании посредством амидной связи. Альдегидная реакционноспособная группа избирательно связывается с N-концом при низком pH и может связываться с остатком лизина с образованием ковалентной связи при высоком pH, например при pH 9,0.
Реакционноспособные группы на обоих концах непептидильного полимера могут быть одинаковыми или разными. Например, непептидильный полимер может иметь группу малеимида на одном конце, а на другом конце он может иметь альдегидную группу, группу пропиональдегида или группу бутиральдегида. Когда в качестве непептидильного полимера используют полиэтиленгликоль, имеющий реакционноспособную гидроксигруппу на обоих концах, гидроксигруппа может быть включена в различные реакционноспособные группы путем известных химических реакций, или можно использовать полиэтиленгликоль, имеющий модифицированную реакционноспособную группу, имеющийся в продаже, для того чтобы получить конъюгат инсулинотропного пептида по настоящему изобретению.
В другом воплощении настоящего изобретения предложен способ получения конъюгата инсулинотропного пептида, включающий стадии:
1) ковалентного связывания непептидильного полимера, имеющего на обоих концах реакционноспособную группу альдегида, малеимида или производного сукцинимида, с аминогруппой или тиоловой группой инсулинотропного пептида;
2) выделения конъюгата, включающего инсулинотропный пептид, из реакционной смеси (1), в котором непептидильный полимер ковалентно связывают в участке, отличном от N-конца; и
3) ковалентного связывания Fc-фрагмента иммуноглобулина с другим концом непептидильного полимера выделенного конъюгата, чтобы получить конъюгат пептида, имеющий Fc-фрагмент иммуноглобулина и инсулинотропный пептид, которые связаны с каждым концом непептидильного полимера.
Термин «конъюгат» при использовании здесь относится к промежуточному соединению, полученному путем ковалентного связывания непептидильного полимера с инсулинотропным пептидом, и потом Fc-фрагмент иммуноглобулина связывают с другим концом непептидильного полимера в конъюгате.
В одном предпочтительном воплощении настоящего изобретения предложен способ получения, включающий стадии:
1) ковалентного связывания непептидильного полимера, имеющего на обоих концах альдегидную реакционноспособную группу с остатком лизина эксендина-4;
2) выделения конъюгата, включающего эксендин-4, из реакционной смеси (1), в котором непептидильный полимер ковалентно связывают с остатком лизина; и
3) ковалентного связывания Fc-фрагмента иммуноглобулина с другим концом непептидильного полимера выделенного конъюгата, чтобы получить конъюгат белка, включающий Fc-фрагмент иммуноглобулина и эксендин-4, которые связаны с каждым концом непептидильного полимера. Более предпочтительно, непептидильный полимер и остаток лизина эксендина-4 в (1) связывают при pH 9,0 или выше.
Конъюгат инсулинотропного пептида по настоящему изобретению активирует главные белки инсулинового сигнального пути с помощью рецепторов GLP-1 и, таким образом, может быть применен для предупреждения или лечения неалкогольной жировой болезни печени. В частности, конъюгат инсулинотропного пептида по настоящему изобретению увеличивает активность PKC-ζ (протеинкиназы C-ζ), которая регулирует ферментную активность, вовлеченную в липолиз, и сохраняет in-vivo активность известного инсулинотропного пептида, который увеличивает экспрессию Glut2 (белок-транспортер глюкозы 2) и увеличивает период полувыведения из крови инсулинотропного пептида, тем самым заметно увеличивая период in-vivo эффективности. Таким образом, можно получать превосходные терапевтические эффекты на неалкогольную жировую болезнь печени при меньшей частоте введения, чем известные композиции.
В настоящем изобретении неалкогольная жировая болезнь печени (НЖБП) включает первичные и вторичные неалкогольные жировые заболевания печени, и более конкретно означает неалкогольную жировую болезнь печени, вызванную первичной гиперлипидемией, диабетом или ожирением. Например, неалкогольная жировая болезнь печени включает простой стеатоз, жировые заболевания печени, вызванные недостаточностью питания, голоданием, ожирением и диабетом, стеатогепатит и фиброз печени, и цирроз печени имеет место из-за прогрессирования этих заболеваний.
Фармацевтическая композиция, включающая конъюгат инсулинотропного пептида по настоящему изобретению, может дополнительно включать фармацевтически приемлемый носитель. Для перорального введения фармацевтически приемлемый носитель может включать связующее вещество, смазывающее вещество, разрыхлитель, эксципиент, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель и ароматизатор. Для инъецируемых препаратов фармацевтически приемлемый носитель может включать буферный агент, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. Для препаратов для местного применения фармацевтически приемлемый носитель может включать основу, эксципиент, смазывающее вещество и консервант. Фармацевтическую композицию по настоящему изобретению можно изготовить в виде ряда лекарственных форм в комбинации с вышеупомянутыми фармацевтически приемлемыми носителями. Например, для перорального введения фармацевтическую композицию можно изготовить в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или облаток. Для инъецируемых препаратов фармацевтическую композицию можно изготовить в виде ампулы в качестве однодозовой лекарственной формы или в стандартной лекарственной форме, такой как