Человеческие антитела и конъюгаты антитело-препарат против cd74
Иллюстрации
Показать всеГруппа изобретений относится к области биотехнологии. Представлены варианты антител, которые связываются с вариантами 1 и 2 CD74 человека. Представлена рекомбинантная клетка-хозяин, которая вырабатывает указанный вариант антитела. Представлены композиции для лечения и профилактики рака, содержащие указанный вариант антитела. Группа изобретений позволяет эффективно и избирательно вызывать гибель опухолевых клеток, экспрессирующих CD74, что может быть использовано при лечении раковых заболеваний. 12 н. и 43 з. п. ф-лы., 15 ил., 14 табл., 25 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается специфичных к CD74 антител и их конъюгатов с лекарственными препаратами (ADCs), фармацевтических композиций таких антител или ADCs и их лечебного применения.
Уровень техники
Гамма-цепь лейкоцитарных антигенов человека (HLA) из комплекса гистосовместимости II класса, также известная как связанная с антигеном HLA-DR инвариантная цепь, связанная с антигеном Ia инвариантная цепь, Ii или CD74, представляет собой трансмембранный белок с коротким цитоплазматическим хвостом. Главной функцией CD74 является регулирование посадки пептидов на гетеродимеры главного комплекса гистосовместимости (МНС) II класса во внутриклеточных компартментах.
Лишь небольшая часть от общего содержания CD74 в клетках экспрессируется на клеточной поверхности. Находящийся на клеточной поверхности CD74 очень быстро интернализируется как с антителами к CD74, так и без них (Roche PA et al., PNAS 1993, 90:8581-8585; Hansen HJ et al., Biochem J 1996, 320:293-300; Ong GL et al., Immunology 1999, 98:296-302). Стационарный уровень CD74 на клеточной поверхности является довольно низким и колеблется у моноцитов от нескольких сотен до нескольких тысяч молекул на клетку.
Точная функция экспрессированного на клеточной поверхности CD74 не известна, но исследования показали, что CD74 является мембранным рецептором для провоспалительного цитокина - фактора, ингибирующего миграцию макрофагов (MIF). Связывание MIF с CD74 активирует нижележащую передачу сигнала через пути МАРК и Akt и способствует пролиферации и выживанию клеток. Это взаимодействие, вероятно, также регулируется наличием CD44, CXCR2 или CXCR4 в качестве корецепторов.
Усиление экспрессии CD74 наблюдалось при многих видах рака, а также при некоторых инфекциях и воспалительных заболеваниях. Для лечения положительных на CD74 опухолей предлагались различные форматы гуманизированного специфичного к CD74 моноклонального антитела - hLL1 (Chang CH et al., Blood 2005, 106:4308-4314; Sapra P et al., Clin Can Res 2005, 11:5257-5264; Stein R et al., Blood 2004, 104:3705-11; Govindan SV et al., J Nucl Med 2000, 41:2089-2097; Hertlein E et al., Blood 2010; 116:2554-2558; Stein R et al., Clin Cancer Res 2009, 15:2808-2817; Sharkey RM et al., J Nucl Med 2009, 50:444-453; Lundberg BB et al., Drug Deliv 2007, 14:171-175; Griffiths GL et al., Int J Cancer 1999, 81:985-992; Griffiths GL et al., Cancer Res 2003, 9:6567-6571; Ochakovskaya R et al., Clin Cancer Res 2001, 7:1505-1510; Shin L et al., Cancer Immunol Immunother; Burton JD et al., Clin Cancer Res 2004, 10:6606-6611; Lundberg BB et al., J Control Release 2004, 94:155-161).
Несмотря на то что уже достигнут значительный прогресс, все еще остается потребность в улучшении способов лечения серьезных заболеваний, например, улучшении лечения рака, на основе терапевтических антител и ADCs.
Сущность изобретения
Целью настоящего изобретения является получение новых высокоспецифичных и эффективных моноклональных специфичных к CD74 антител и ADCs из таких специфичных к CD74 антител. Антитела или ADCs по изобретению проявляют характеристики связывания CD74 или другие эффекты на экспрессирующие CD74 клетки, отличные от антител, описанных в данной области. В частности, антитела характеризуются быстрой интернализацией после связывания с антигеном CD74, что делает их пригодными для терапевтического применения в виде ADCs и для других применений, в которых быстрая интернализация является преимуществом. Новые ADCs характеризуются высокой эффективностью при уничтожении экспрессирующих CD74 опухолевых клеток.
Антитела и соответствующие ADCs могут быть представлены в различных форматах, включая, без ограничения, форматы фрагментов антител и биспецифических антител. В предпочтительных воплощениях антитела представляют собой человеческие антитела.
Также целью настоящего изобретения является получение ADCs на основе таких специфичных к CD74 антител для медицинского применения, обеспечивающих эффективный и избирательный способ причинения гибели опухолевых клеток.
Эти и другие аспекты настоящего изобретения описаны более подробно ниже.
Краткое описание фигур
Фиг.1. Аминокислотные последовательности рекомбинантных белков CD74, использовавшихся в примерах. CD74v1 и -v2, CD74de12-36v1 и -v2, HisCD74v1 и -v2 соответствуют SEQ ID NOs:1-6 соответственно.
Фиг.2. Совмещение последовательностей вариабельной области тяжелой (VH) и легкой (VL) цепи антител настоящего изобретения. SEQ ID NO:каждой последовательности VH/VL приведен в круглых скобках справа от последовательности. Участки, определяющие комплементарность (CDRs) по номенклатуре IMGT, выделены следующим образом: последовательности CDR1 выделены курсивом, последовательности CDR2 подчеркнуты, а последовательности CDR3 выделены жирным шрифтом.
Фиг.3. Связывание специфичных к CD74 антител с рекомбинантным белком, представляющим внеклеточный домен изоформ варианта 1 и 2 (CD74v1 и CD74v2), при определении методом ELISA. Все человеческие антитела были получены путем кратковременной котрансфекции клеток HEK-293F векторами, экспрессирующими соответствующие тяжелые и легкие цепи.
Фиг.4. Связывание специфичных к CD74 антител с клеточным CD74 на клетках Raji при определении методом FACS. Все человеческие антитела были получены путем кратковременной котрансфекции клеток HEK-293F векторами, экспрессирующими соответствующие тяжелые и легкие цепи.
Фиг.5. Перекрестная реактивность специфичных к CD74 антител с CD74 макаки яванской. Лимфатические узлы миндалин человека (верхняя панель) и яванской макаки (нижняя панель) окрашивали с помощью специфичных к CD74 антител. Зародышевый центр; Mf - макрофаги; # В-клетки области мантии.
Фиг.6. Дозозависимая индукция уничтожения клеток специфичными к CD74 антителами, предварительно проинкубированными с анти-каппа-ЕТА'. Представлен репрезентативный эксперимент. Данные представлены в виде среднего процента жизнеспособности по двойным лункам клеток, обработанных предварительно проинкубированными с анти-каппа-ЕТА' антителами HuMab к CD74. Процент жизнеспособности рассчитывали так, как описано в примере 14.
Фиг.7. Связывание антител HuMab к CD74 №005 и 006 (А) и 011 (В) и соответствующих ADCs с рекомбинантным белком внеклеточного домена CD74v1 при определении методом ELISA. Представлен один репрезентативный эксперимент.
Фиг.8. Связывание антител HuMab к CD74 №005 и 006 (А) и 011 (В) и соответствующих ADCs с экспрессированным на поверхности. CD74 при определении методом FACS на клетках Daudi. Данные представлены в виде средней интенсивности флуоресценции (MFI), рассчитанной из трех независимых экспериментов.
Фиг.9. Дозозависимая индукция уничтожения клеток специфичными к CD74 ADCs. Представлен один репрезентативный эксперимент для каждой из следующих клеточных линий: Daudi (А), Raji (В), М4А4 (С) и клетки NCI-H747 (D). Данные представлены в виде процента выживаемости по двойным лункам клеток, обработанных специфичными к CD74 ADCs.
Фиг.10. Эффективность in vivo специфичных к CD74 ADCs при терапевтическом лечении ксенотрансплантатов Daudi-luc у мышей SCID. Мышей с привитыми опухолями Daudi-luc обрабатывали специфичными к CD74 ADCs. Данные представлены в виде средних значений биолюминесценции на снимках (BLI)±S.E.M. на группу (n=7 мышей в группе).
Фиг.11. Эффективность in vivo специфичных к CD74 ADCs при терапевтическом лечении ксенотрансплантатов Raji-luc у мышей SCID. Мышей с привитыми опухолями Raji-luc обрабатывали специфичными к CD74 ADCs. Данные представлены в виде средних значений BLI±S.E.M. на группу (n=7 мышей в группе).
Фиг.12. Эффективность in vivo специфичных к CD74 ADCs при терапевтическом лечении ксенотрансплантатов Raji у мышей SCID. Мышей с привитыми s.c. опухолями Raji обрабатывали специфичными к CD74 ADCs. Данные представлены в виде среднего объема опухолей ± S.E.M. на группу (n=6 мышей в группе).
Фиг.13. Эффективность in vivo ADCs против CD74 при терапевтическом лечении ксенотрансплантатов М4А4 у мышей SCID. Мышей с привитыми опухолями М4А4 обрабатывали ADCs против CD74. Данные представлены в виде среднего объема опухолей ± S.E.M. на группу (n=7 мышей в группе).
Фиг.14. Определение значений koff у специфичных к CD74 антител HuMab. Представлен один репрезентативный эксперимент. Данные представлены в виде средней интенсивности флуоресценции (MFI) по тройным лункам клеток, инкубированных с меченными красителем Alexa Fluor 488® антителами HuMab к CD74, с последующей инкубацией с немечеными антителами HuMab к CD74 в течение указанных промежутков времени.
Фиг.15. Временная зависимость интернализации и накопления антител HuMab против CD74. Представлен один репрезентативный эксперимент для каждой линии клеток. Данные представлены в виде средней интенсивности флуоресценции (MFI) по двойным лункам клеток, инкубированных с меченными Alexa-488 антителами HuMab против CD74. Клетки Daudi инкубировали с меченными Alexa-488 антителами HuMab против CD74 при 4°С (А) или 37°С (В). Клетки Raji (С) и клетки М4А4 (D) инкубировали при 37°С.
Фиг.16. Эффективность in vivo антител HuMab против CD74 при профилактическом лечении ксенотрансплантатов Daudi-luc у мышей SCID. Мышей обрабатывали антителами HuMab против CD74 в пределах одного часа после внутривенной инокуляции опухолей Daudi-luc. Данные представлены в виде средних значений BLI±S.E.M. на группу (n=7 мышей в группе).
Раскрытие сущности изобретения Определения
Термины "CD74" и "антиген CD74" используются здесь взаимозаменяемо. Если не указано иначе, эти термины охватывают любые варианты, изоформы и видовые гомологи CD74 человека, которые экспрессируются клетками в природе или экспрессируются на клетках, трансфецированных геном CD74. Как известно, у человека существует по меньшей мере четыре изоформы: р43, р41, р35 и рр33 (Borghese F et al., Expert Opin Ther Targets 2011, 15(3):237-251). Они образуются в результате альтернативного сплайсинга транскриптов и двух сайтов начала трансляции. Белок р43 (также известный как изоформа 1, изоформа а или "длинная" изоформа CD74; см. запись Р04233-1 в UniProt и эталонную последовательность NP 001020330 в NCBI) содержит 296 аминокислот, при этом остатки 73-296 образуют внеклеточную часть. Белковые конструкции CD74, содержащие внеклеточную часть изоформы 1, обозначаются здесь как "вариант 1" или "CD74v1". Белок р35 (также известный как изоформа 2, изоформа b или "короткая" изоформа CD74; см. запись Р04233-2 в Uniprot и эталонную последовательность NP 004346 в NCBI) не содержит остатков 209-272 из внеклеточной части вследствие альтернативного сплайсинга. Белковые конструкции CD74, содержащие внеклеточную часть изоформы 2, обозначаются здесь как "вариант 2" или "CD74v2". Белки р41 и p33 возникают из альтернативного сайта начала трансляции (на 48 п.о. ниже; белок становится короче на 16 аминокислот), что приводит к вариантам, у которых отсутствует сигнал удержания в эндоплазматическом ретикулуме (ER), который находится в пределах этих 16 аминокислот, но имеется такая же внеклеточная часть, как у р43 и р35, соответственно. Последовательность еще одной изоформы (известной как изоформа 3 и изоформа с), в которой остатки 148-160 заменены, а остатки 161-296 отсутствуют, представлена в NP 001020329. Последовательности гомологов CD74 яванской макаки представлены, например, в NCBI: эталонная последовательность ХР_001099491.2 и эталонная последовательность ХР_002804б24.1.
Термином "иммуноглобулин" обозначается класс структурно родственных гликопротеинов, состоящих из двух пар полипептидных цепей: одной пары легких (L) низкомолекулярных цепей и одной пары тяжелых (Н) цепей, причем все четыре соединяются между собой дисульфидными связями. Структура иммуноглобулинов хорошо изучена. Например, см. Fundamental Immunology Ch. 7 (Paul W., ed., 2nd ed. Raven Press, N.Y. (1989)). Вкратце, каждая тяжелая цепь обычно состоит из вариабельной области тяжелой цепи (сокращенно VH или VH) и константной области тяжелой цепи (CH или СН). Константная область тяжелой цепи обычно состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь обычно состоит из вариабельной области легкой цепи (сокращенно VL или VL) и константной области легкой цепи. Константная области легкой цепи обычно состоит из одного домена, CL или CL. Как правило, нумерация аминокислотных остатков в константной области производится в соответствии с индексом EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). Области VH и VL дополнительно подразделяются на участки гипервариабельности (или гипервариабельные участки, которые могут быть гипервариабельными по последовательности и/или образовывать структурно определенные петли), именуемые определяющими комплементарность участками (CDRs), которые чередуются с более консервативными участками, называемыми каркасными участками (FRs). Каждый VH и VL, как правило, состоит из трех CDRs и четырех FRs, которые располагаются с N-конца к С-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (см. также Chothia and Lesk, J. Mol. Biol. 196, 901-917 (1987)).
Термин "антитело" или "Ab" в контексте настоящего изобретения относится к молекуле иммуноглобулина, фрагменту молекулы иммуноглобулина или производному того или другого, которые, обладают способностью к специфическому связыванию с антигеном при обычных физиологических условиях со временем полужизни, составляющим значительный промежуток времени, как то: по меньшей мере около 30 мин, по меньшей мере 45 мин, по меньшей мере 1 час, по меньшей мере 2 часа, по меньшей мере 4 часа, по меньшей мере 8 часов, по меньшей мере 12 часов, 24 часа или больше, 48 часов или больше, около 3, 4, 5, 6, 7 или больше дней и т.д., или любой другой соответствующий функционально определенный период (к примеру, время, достаточное, чтобы индуцировать, способствовать, усиливать и/или модулировать физиологическую реакцию, связанную со связыванием антитела с антигеном, и/или время, достаточное, чтобы антитело приобрело эффекторную активность). Вариабельные области тяжелых и легких цепей молекулы иммуноглобулина содержат связывающий домен, который взаимодействует с антигеном. Константные области антител (Abs) могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (как то эффекторные клетки) и такие компоненты системы комплемента, как C1q, первый компонент классического пути активации комплемента. Антитело также может быть мультиспецифическим, обладающим специфичностью к двум или нескольким разным эпитопам, обычно не перекрывающимся. Примеры мультиспецифических антител включают биспецифические антитела, диатела и подобные молекулы антител. Как указано выше, термин антитело, если здесь не оговорено иначе или четко не противоречит контексту, включает фрагменты антител, которые сохраняют способность к специфическому связыванию с антигеном. Было показано, что антигенсвязывающая функция антител может осуществляться фрагментами полноразмерных антител, например. Fab- и F(ab')2-фрагментами. Также следует иметь в виду, что термин антитело, если не указано иначе, также охватывает поликлональные антитела, моноклональные антитела (mAbs), антителоподобные полипептиды типа химерных антител и гуманизированных антител. Полученные антитела могут обладать любым изотипом.
Термины "человеческое антитело", "человеческое Ab" или "HuMab" в настоящем изобретении охватывают антитела, содержащие вариабельные и константные области, происходящие из гаметных последовательностей иммуноглобулинов человека. Человеческие антитела по изобретению могут включать аминокислотные остатки, которые не кодируются гаметными последовательностями иммуноглобулинов человека (например, мутации, введенные при случайном или сайт-специфичном мутагенезе in vitro либо при соматической мутации in vivo). Однако термин "человеческое антитело" в настоящем изобретении не должен включать такие антитела, у которых в каркасные последовательности человека были пересажены последовательности CDR, происходящие из зародышевой линии других видов млекопитающих, как то мыши.
В настоящем изобретении человеческое антитело "происходит из" определенной гаметной последовательности, если антитело получено из системы, в которой используются последовательности иммуноглобулинов человека, например, при иммунизации трансгенных мышей, несущих гены иммуноглобулинов человека, или при скрининге библиотеки генов иммуноглобулинов человека, причем выбранное человеческое антитело по меньшей мере на 90%, как то: по меньшей мере на 95%, например, по меньшей мере на 96%, как то: по меньшей мере на 97%, например, по меньшей мере на 98% или же 99% идентично аминокислотной последовательности, кодируемой гаметным геном иммуноглобулина. Как правило, за пределами CDR3 тяжелой цепи человеческое антитело, происходящее из определенной гаметной последовательности, должно отличаться не более чем по 20 аминокислотам, например, не более чем 10 аминокислотам, к примеру, не более чем по 9, 8, 7, 6 или 5, к примеру, не более чем по 4, 3, 2, или 1 аминокислоте от аминокислотой последовательности, кодируемой гаметным геном иммуноглобулина.
Термины "моноклональное антитело", "моноклинальное Ab", "композиция моноклонального антитела", "mAb" и т.п. в настоящем изобретении относятся к препаратам молекул антител, состоящим из одинаковых молекул. Композиция моноклонального антитела проявляет одинарную специфичность связывания и сродства к определенному эпитопу. Соответственно, термин "человеческое моноклональное антитело" относится к таким антителам, проявляющим одинарную специфичность связывания, у которых вариабельные и константные области происходят из гаметных последовательностей иммуноглобулинов человека. Человеческие моноклональные антитела могут вырабатываться гибридомой, включающей В-клетки, полученные из трансгенного или трансхромосомного животного, но не человека, к примеру, трансгенной мыши, геном которой содержит трансген тяжелой цепи и трансген легкой цепи человека, слитые с иммортализованными клетками.
В настоящем изобретении термин "изотип" относится к классу иммуноглобулина (например, IgG1, IgG2, IgG3, IgG4, IgD, IgA, IgE или IgM), который кодируется генами константной области тяжелой цепи.
Термин "полноразмерное антитело" в настоящем изобретении относится к таким антителам, которые содержат все константные и вариабельные домены тяжелой и легкой цепи, которые обычно встречаются в антителах данного изотипа.
В настоящем изобретении, если это не противоречит контексту, термин "Fab-плечо" или "плечо" относится к одной паре тяжелая цепь - легкая цепь.
В настоящем изобретении, если это не противоречит контексту, термин "Fc-участок" относится к участку антитела, содержащему по меньшей мере один шарнирный участок, домен CH2 и домен CH3.
"Антитело, дефектное по эффекторной функции" или "антитело с дефектом эффекторной функции" относится к таким антителам, у которых существенно понижена или отсутствует способность к активации одного или нескольких эффекторных механизмов, таких как активация комплемента или связывание с Fc-рецептором. Таким образом, антитела, дефектные по эффекторной функции, обладают значительно меньшей или не обладают способностью опосредовать зависимую от антител опосредованную клетками цитотоксичность (ADCC) и/или зависимую от комплемента цитотоксичность (CDC). Примером таких антител являются антитела изотипа IgG4 или их шарнирно-стабилизированные формы. Другим примером является введение мутаций в Fc-область, способных сильно уменьшить взаимодействие с белками комплемента и Fc-рецепторами. К примеру, см. Bolt S et al., Eur J Immunol 1993, 23:403-411; Oganesyan, Acta Crys. 2008, D64, 700-704; и Shields et al., JBC 2001, 276:6591-6604.
В настоящем изобретении термин "эффекторная клетка" относится к таким иммунным клеткам, которые вовлечены в эффекторную фазу иммунного ответа, в отличие от распознающей и активационной фаз иммунного ответа. Примеры иммунных клеток включают клетки миелоидного или лимфоидного происхождения, например лимфоциты (как то В-клетки и Т-клетки, в том числе цитолитические Т-клетки (CTLs)), клетки-киллеры, нормальные клетки-киллеры, макрофаги, моноциты, тучные клетки и гранулоциты, как то нейтрофилы, эозинофилы и базофилы. Некоторые эффекторные клетки экспрессируют специфические Fc-рецепторы (FcRs) и выполняют специфические иммунные функции. В некоторых воплощениях эффекторные клетки способны индуцировать ADCC, типа нормальных клеток-киллеров. Например, моноциты, макрофаги, экспрессирующие FcRs, участвуют в специфическом уничтожении клеток-мишеней и презентации антигенов другим компонентам иммунной системы. В некоторых воплощениях эффекторные клетки могут подвергать фагоцитозу антиген мишени или клетки мишени. Экспрессия определенных FcR на эффекторных клетках может регулироваться такими гуморальными факторами, как цитокины. Эффекторные клетки могут подвергать фагоцитозу антиген мишени либо подвергать фагоцитозу или лизису клетки мишени.
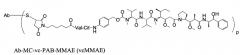
В контексте настоящего изобретения "ADC" означает конъюгат антитело-препарат, что в контексте настоящего изобретения обычно означает специфичное к CD74 антитело, которое соединено с другой молекулой, как описано в настоящей заявке.
"Антитело к CD74", "антитело против CD74", "Ab к CD74", "специфичное к CD74 антитело" или "Ab против CD74" означает такое антитело, описанное выше, которое специфически связывается с антигеном CD74.
В предпочтительном воплощении антитело по изобретению является выделенным. "Выделенное Ab" в настоящем изобретении служит для обозначения таких антител, которые практически не содержат других антител, имеющих другие антигенные специфичности (например, выделенное антитело, которое специфически связывается с CD74, практически не содержит антител, специфически связывающихся с другими антигенами, чем CD74). Однако выделенное антитело, которое специфически связывается с эпитопом, изоформой или вариантом CD74 человека, может обладать перекрестной реактивностью к другим родственным антигенам, к примеру, из других видов (типа видовых гомологов CD74). Более того, выделенное антитело может практически не содержать и других клеточных материалов и/или химических веществ. В одном воплощении настоящего изобретения в одной четко определенной композиции комбинируются два или несколько "выделенных" моноклональных антител с различными специфичностями связывания антигенов.
В применении к двум или нескольким антителам термин "конкурирует с" или "перекрестно конкурирует с" означает, что два или несколько антител конкурируют за связывание с CD74, например, с вариантом 1 или 2 CD74 или с обоими. Например, при таком анализе могут использоваться конструкции, описанные в примере 1. В одном типичном варианте анализа на планшет наносят CD74 и дают ему связаться с первым антителом, после чего добавляют второе, меченое антитело. Если в присутствии первого антитела снижается связывание второго антитела, это означает, что антитела конкурируют. Термин "конкурирует с" в настоящем изобретении охватывает и такие комбинации антител, в которых одно антитело снижает связывание другого антитела, но при добавлении их в обратном порядке конкуренция не наблюдается.
Термин "эпитоп" обозначает детерминанту белка, способную специфически связываться с антителом. Эпитопы обычно состоят из поверхностных группировок таких молекул, как аминокислоты или боковые цепи Сахаров, и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и не конформационные эпитопы отличаются тем, что связывание первых, но не последних, теряется в присутствии денатурирующих растворителей. Эпитоп может включать аминокислотные остатки, которые непосредственно участвуют в связывании, и другие аминокислотные остатки, которые прямо не участвуют в связывании, например, аминокислотные остатки, которые эффективно блокируются или покрываются пептидом, специфически связывающимся с антигеном (то есть те аминокислотные остатки, которые составляют "отпечаток" пептида, специфически связывающегося с антигеном).
В настоящем изобретении термин "связывание" в контексте связывания антитела с заданным антигеном или эпитопом обычно означает связывание со сродством, соответствующим KD примерно 10-7 М или меньше, как то 10-8 М или меньше, как то 10-9 М или меньше, 10-10 М или меньше или же 10-11 М и даже меньше при определении, к примеру, методом поверхностного плазменного резонанса (SPR) на приборе BIAcore 3000 с использованием растворимой формы антигена в качестве лиганда и антитела в качестве аналита. Как правило, антитело связывается с заданным антигеном со сродством, соответствующим значению KD, которое по меньшей мере в 10 раз меньше, как то по меньшей мере в 100 раз меньше, например, по меньшей мере в 1000 раз меньше, как то по меньшей мере в 10000 раз меньше, например, по меньшей мере в 100000 раз меньше, чем значение KD для связывания, с таким неспецифическим антигеном (например, BSA, казеином), который не является идентичным или близкородственным заданному антигену. Если значение KD у антитела очень низкое (т.е. антитело обладает высоким сродством), то значение KD, с которым оно связывается с антигеном, обычно по меньшей мере в 10000 раз меньше, чем значение KD для неспецифического антигена.
Термин "kd" (сек-1) в настоящем изобретении обозначает константу скорости диссоциации определенного взаимодействия Ab-антиген. Данная величина также известна как значение koff.
Термин "ka" (M-1×сек-1) в настоящем изобретении обозначает константу скорости ассоциации определенного взаимодействия Ab-антиген.
Термин "KD" (М) в настоящем изобретении обозначает равновесную константу диссоциации определенного взаимодействия Ab-антиген.
Термин "KA" (M-1) в настоящем изобретении обозначает равновесную константу ассоциации определенного взаимодействия Ab-антиген, которую получают делением ka на kd.
"Интернализация" в применении к антителам к CD74 означает любой механизм, посредством которого антитело подвергается интернализации из поверхности клетки в экспрессирующую CD74 клетку. Интернализацию антитела можно оценить косвенным методом путем измерения эффекта интернализованного конъюгата Ab-токсин или токсина, специфически связавшегося с антителом при предварительной инкубации (таким, например, как метод с анти-каппа-ЕТА' из примера 14).
В настоящем изобретении термин "ингибирует рост".(например, в отношении клеток, как то опухолевых клеток) охватывает любое измеримое снижение роста клеток при контакте с антителом к CD74 или ADC по сравнению с ростом тех же самых клеток, не находящихся в контакте с антителом к CD74 или ADC, например, ингибирование роста клеточной культуры по меньшей мере на 10, 20, 30, 40, 50, 60, 70, 80, 90, 99% или 100%. Такое снижение роста клеток может происходить по различным механизмам, например, интернализации, зависимого от антител клеточного фагоцитоза (ADCP), зависимой от антител опосредованной клетками цитотоксичности (ADCC), зависимой от комплемента цитотоксичности (CDC), опосредованной лекарственными препаратами гибели клеток и/или апоптоза.
Настоящим изобретением также предусмотрены антитела, содержащие функциональные варианты области VL, области VH либо одного или нескольких CDRs из антител из примеров. Функциональный вариант VL, VH или CDR в применении к антителам к CD74 означает, что у антитела все-таки сохраняется по крайней мере значительная часть (по меньшей мере 50, 60, 70, 80, 90, 95% или больше) сродства/авидности и/или специфичности/избирательности исходного антитела, а в некоторых случаях, такое антитело к CD74 может обладать большим сродством, избирательностью и/или специфичностью, чем исходное Ab.
Такие функциональные варианты, как правило, сохраняют значительную степень идентичности с последовательностью исходного Ab. Степень идентичности между двумя последовательностями является функцией от числа идентичных положений, общих для этих последовательностей (т.е. процент гомологии = число идентичных положений/общее число положений × 100), с учетом количества пробелов и длины каждого пробела, которые нужно ввести для оптимального совмещения двух последовательностей. Сравнение последовательностей и определение степени идентичности между двумя последовательностями может осуществляться с помощью математического алгоритма, как описано ниже в неограничивающих примерах.
Степень идентичности между двумя нуклеотидными последовательностями можно определить с помощью программы GAP в пакете программного обеспечения GCG (доступен на http://www.gcg.com), используя матрицу NWSgapdna.CMP, вес пробела = 40, 50, 60, 70 или 80 и вес длины = 1, 2, 3, 4, 5 или 6. Степень идентичности между двумя нуклеотидными последовательностями также можно определить с помощью алгоритма, описанного Е. Meyers and W. Miller (Comput. Appl. Biosci 4, 11-17 (1988)), который встроен в программу ALIGN (версия 2.0), используя таблицу весов остатков РАМ 120, пеню за длину пробела = 12 и пеню за пробел = 4. Кроме того, степень идентичности между двумя аминокислотными последовательностями можно определить при помощи алгоритма Needleman и Wunsch (Needleman and Wunsch, J. Mol. Biol. 48, 444-453 (1970)), который встроен в программу GAP в пакете программного обеспечения GCG (доступен на http://www.gcg.com), используя либо матрицу Blossum 62, либо матрицу РАМ250, вес пробела = 16, 14, 12, 10, 8, 6 или 4 и вес длины = 1, 2, 3, 4, 5 или 6.
Последовательности вариантов CDR могут отличаться от последовательностей CDR исходных антител в основном консервативными заменами; например, по меньшей мере 35%, 50% или больше, 60% или больше, 70% или больше, 75% или больше, 80% или больше, 85% или больше, 90% или больше (например, 65-95%, как то 92%, 93% или 94%) замен у варианта представлены консервативными заменами аминокислотных остатков.
Последовательности вариантов CDR могут отличаться от последовательностей CDR исходных антител в основном консервативными заменами; например, по меньшей мере 10, как то по меньшей мере 9, 8, 7, 6, 5, 4, 3, 2 или 1 замена у варианта представлены консервативными заменами аминокислотных остатков.
Термин "стабилизированное антитело типа IgG4" относится к таким антителам типа IgG4, которые были модифицированы для уменьшения обмена полумолекул (например, см. Международную патентную публикацию WO2008145142 или van der Neut Kolfschoten M et al. (2007) Science 14, 317(5844) и приведенные там ссылки.
В контексте настоящего изобретения консервативные замены можно определить как замены в пределах классов аминокислот, приведенных в одной или нескольких из трех следующих таблиц.
| Классы аминокислотных остатков для консервативных замен | |||
| Кислые остатки | Asp (D) и Glu (E) | ||
| Основные остатки | Lys (K), Arg (R) и His (Н) | ||
| Гидрофильные незаряженные остатки | Ser (S), Thr (Т), Asn (N) и Gln (Q) | ||
| Алифатические незаряженные остатки | Gly (G), Ala (A), Val (V), Leu (L) и Ile (I) | ||
| Неполярные незаряженные остатки | Cys (C), Met (M) и Pro (P) | ||
| Ароматические остатки | Phe (F), Tyr (Y) и Trp (W) | ||
| Альтернативные классы консервативных замен аминокислотных остатков | |||
| 1 | А | S | Т |
| 2 | D | E | |
| 3 | N | Q | |
| 4 | R | K | |
| 5 | I | L | M |
| 6 | F | Y | W |
| Альтернативная физическая и функциональная классификация аминокислотных остатков | |||
| Остатки, содержащие спиртовую группу | S и Т | ||
| Алифатические остатки | I, L, V и М | ||
| Остатки, связанные с циклоалкенилами | F, Н, W и Y | ||
| Гидрофобные остатки | А, С, F, G, Н, I, L, М, R, Т, V, W и Y | ||
| Отрицательно заряженные остатки | D и Е | ||
| Полярные остатки | С, D, E, Н, K, N, Q, R, S и Т | ||
| Положительно заряженные остатки | Н, K и R | ||
| Небольшие остатки | А, С, D, G, N, P, S, Т и V | ||
| Очень маленькие остатки | А, G и S | ||
| Остатки, участвующие в образовании складок | А, С, D, E, G, Н, K, N, Q, R, S, Р и Т | ||
| Гибкие остатки | Q, Т, K, S, G, Р, D, Е и R |
Другая разбивка консервативных замен на группы включает: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин.
Можно составить и другие группы аминокислот по принципам, изложенным, например, в Creighton (1984) Proteins: Structure and Molecular Properties (2nd Ed. 1993), W.H. Freeman and Company.
У вариантов CDR также в значительной степени сохраняется консервативность по гидрофобности/гидрофильности и весу/размеру остатков по сравнению с CDR у антител из примеров (например, весовая категория, индекс гидрофобности или то и другое у последовательностей сохраняется по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или больше (например, на 65-99%)). Например, консервативные замены остатков могут основываться и на заменах из сильно или слабо консервативных по весу групп, которые известны в этой области.
Консервативность аналогичных остатков можно измерить и по степени сходства, которая определяется при помощи программы BLAST (например, BLAST 2.2.8, доступной через NCBI), используя стандартные настройки: BLOSUM62, Open Gap=11 и Extended Gap=1. Подходящие варианты обычно проявляют сходство с исходным пептидом по меньшей мере на 45%, например, по меньшей мере на 55%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или больше (например, на 70-99%).
Термин "вектор" в настоящем изобретении служит для обозначения молекулы нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Одним из типов вектора является "плазмида", что означает кольцевую петлю двухцепочечной ДНК, в которую могут быть вставлены дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, при этом в вирусный геномом могут быть вставлены дополнительные сегменты ДНК. Некоторые векторы способны автономно реплицироваться в клетках хозяина, в которые они введены (к примеру, бактериальные векторы, содержащие бактериальное начало репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут встраиваться в геном клетки хозяина при введении в клетки хозяина и при этом реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию тех генов, с которыми они функционально связаны. Такие векторы именуются здесь как "рекомбинантные экспрессирующие векторы" (или просто "экспрессирующие векторы"). Вообще экспрессирующие векторы, используемые в технологии рекомбинантной ДНК, часто находятся в виде плазмид. В настоящем описании "плазмида" и "вектор" могут использоваться взаимозаменяемо, так как плазмида является наиболее распространенной формой вектора. Тем не менее, настоящее изобретение охватывает и другие формы экспрессирующих векторов типа вирусных векторов (как то дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции.
Термин "рекомбинантные клетки хозяина" (или просто "клетки хозяина") в настоящем изобретении служит для обозначения таких клеток, в которые был введен экспрессирующий вектор. Следует иметь в виду, что такие термины служат для обозначения не только каких-то конкретных клеток, но также и потомства таких клеток. Поскольку в последующих поколениях могут иметь место некоторые модификации вследствие мутации или же влияния окружающей среды, то такое