Синтетические транзитные пептиды хлоропласта из brassica
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к конструкту нуклеиновой кислоты и к химерному белку для локализации полипептида в хлоропласте, а также к вектору, содержащему вышеуказанный конструкт. Также раскрыты клетка трансгенного растения, содержащая вышеуказанный белок, а также растение, часть трансгенного растения, семя трансгенного растения и культура тканей клеток трансгенного растения, содержащие вышеуказанную клетку. Изобретение также относится к способу получения трансгенного растительного материала, который экспрессирует полипептиды в хлоропластах, с использованием вышеуказанного конструкта. Изобретение позволяет эффективно осуществлять локализацию полипептида в хлоропласте. 9 н. и 15 з.п. ф-лы, 44 ил., 34 табл., 5 пр.
Реферат
ЗАЯВЛЕНИЕ ОБ УСТАНОВЛЕНИИ ПРИОРИТЕТА
По данной заявке испрашивается приоритет по отношению к предварительной патентной заявке США серийный № 61/625222, поданной 17 апреля 2012 г.
ЗАЯВЛЕНИЕ В СООТВЕТСТВИИ С 37 C.F.R. § 1.821(c) или (e) -
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ ПРЕДСТАВЛЕН В ВИДЕ ТЕКСТОВОГО ФАЙЛА В ФОРМАТЕ ASCII
В соответствии с 37 C.F.R. § 1.821(c) или (e), файл, содержащий текстовую версию списка последовательностей в формате ASCII, предоставлен одновременно с данной заявкой.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к композициям и способам генетического кодирования и экспрессирования полипептидов, которые направлены в пластиды содержащих пластиды клеток. В некоторых вариантах осуществления изобретение относится к аминокислотным последовательностям, которые направляют полипептиды в хлоропласты (например, высших растений), и/или молекулам нуклеиновой кислоты, кодирующим их. В некоторых вариантах осуществления изобретение относится к химерным полипептидам, содержащим аминокислотную последовательность, которая контролирует транзит химерных полипептидов в пластиды, и/или молекулам нуклеиновой кислоты, кодирующим их.
УРОВЕНЬ ТЕХНИКИ
Растительные клетки содержат различные субклеточные органеллы, имеющие общее название «пластиды», которые ограничены характерными мембранными системами и выполняют специализированные функции в клетке. Конкретные пластиды отвечают за фотосинтез, а также синтез и хранение определенных химических соединений. Все пластиды происходят из пропластид, которые находятся в областях меристемы растений. Пропластиды могут развиваться, например, в: хлоропласты, этиопласты, хромопласты, геронтопласты, лейкопласты, амилопласты, элайопласты и протеинопласты. Пластиды существуют в клетке полуавтономно, имея собственную генетическую систему и аппарат синтеза белка, но при этом тесно взаимодействуя с ядерно-цитоплазматической системой в своем развитии и биосинтетических активностях.
В фотосинтезирующих клетках листьев высших растений наиболее заметными пластидами являются хлоропласты. Наиболее важной функцией хлоропластов является осуществление запускаемых светом реакций фотосинтеза. Однако хлоропласты также осуществляют многие другие биосинтетические процессы, важные для растительной клетки. Например, все жирные кислоты клетки создаются ферментами, локализованными в строме хлоропластов, с использованием АТФ, NAOPH и углеводов, которые там являются легкодоступными. Кроме того, восстановительная способность активируемых светом электронов приводит к восстановлению нитрита (NO2-) до аммиака (NH3) в хлоропласте; этот аммиак обеспечивает растение азотом, необходимым для синтеза аминокислот и нуклеотидов.
Хлоропласт также принимает участие в процессах, имеющих особое значение в агрохимической промышленности. Например, известно, что многие гербициды действуют, блокируя функции, которые осуществляются внутри хлоропласта. Недавние исследования выявили специфическую мишень некоторых гербицидов. Например, триазиновые гербициды ингибируют фотосинтез, вытесняя молекулу пластохинона из ее сайта связывания на 32-кДа полипептиде фотосистемы II. Этот 32-кДа полипептид кодируется в геноме хлоропласта и синтезируется аппаратом органеллы. Были получены мутантные растения, устойчивые к триазиновым гербицидам. Эти растения содержат мутантный 32-кДа полипептид, с которого пластохинон больше не может быть вытеснен триазиновыми гербицидами. Сульфонилмочевины ингибируют ацетолактатсинтазу в хлоропласте. Ацетолактатсинтаза участвует в синтезе изолейцина и валина. Глифосат ингибирует функцию 5-енолпирувил-3-фосфошикиматсинтазы (EPSPS), которая является ферментом, участвующим в синтезе ароматических аминокислот. Все эти ферменты кодируются ядерным геномом, но они перемещаются в хлоропласт, где фактически происходит синтез аминокислот.
Большинство хлоропластных белков кодируются в ядре растительной клетки, синтезируются в виде крупных белков-предшественников в цитозоле и после трансляции перемещаются в хлоропласт. Введение через внешние и внутренние мембраны оболочки в строму является основным способом поступления внутрь белков, предназначенных для стромы, тилакоидной мембраны и полости тилакоида. Локализация введенных извне белков-предшественников в тилакоидной мембране и полости тилакоида осуществляется четырьмя различными механизмами, включая два, которые гомологичны системам транспорта бактериальных белков. Таким образом, механизмы для локализации белков в хлоропласте частично происходят от прокариотического эндосимбионта. Cline and Henry (1996), Annu. Rev. Cell. Dev. Biol. 12: 1-26.
Белки-предшественники, предназначенные для экспрессии в хлоропластах, содержат N-концевые удлиняющие сегменты, известные как транзитные пептиды хлоропласта (ТПХ) (CTP). Транзитный пептид играет важную роль в специфическом узнавании поверхности хлоропласта и в опосредовании посттрансляционной транслокации белков-предшественников через оболочку хлоропласта и затем в различные субкомпартменты внутри хлоропласта (например, строму, тилакоид и тилакоидную мембрану). Эти N-концевые последовательности транзитного пептида содержат всю информацию, необходимую для поступления хлоропластного белка в пластиды; последовательности транзитного пептида необходимы и достаточны для поступления в пластиды.
Гены растений, которые, как известно, имеют природные последовательности, кодирующие транзитные пептиды, на их N-конце, включают гены хлоропластной малой субъединицы рибулоза-1,5-бисфосфат карбоксилазы (RuBisCo) (de Castro Silva-Filho et al. (1996), Plant Mol. Biol. 30: 769-80; Schnell et al. (1991), J. Biol. Chem. 266: 3335-42); EPSPS (смотри, например, Archer et al. (1990), J. Bioenerg. and Biomemb. 22: 789-810, и патенты США 6867293, 7045684 и Re. 36449); триптофан-синтазы (Zhao et al. (1995), J. Biol. Chem. 270: 6081-7); пластоцианина (Lawrence et al. (1997), J. Biol. Chem. 272: 20357-63); хоризмат-синтазы (Schmidt et al. (1993), J. Biol. Chem. 268: 27447-57); светособирающего хлорофилл a/b-связывающего белка (LHBP) (Lamppa et al. (1988), J. Biol. Chem. 263: 14996-14999); и хлоропластного белка из Arabidopsis thaliana (Lee et al. (2008), Plant Cell 20: 1603-22). В патентной публикации США № US 2010/0071090 приведены некоторые направляющие в хлоропласты пептиды из вида Chlamydomonas.
Однако структурные требования для информации, закодированной в направляющих в хлоропласт пептидах, остаются трудными для понимания из-за высокого уровня разнообразия их последовательностей и отсутствия общих или консенсусных мотивов в последовательностях, хотя вполне возможно, что существуют различные подгруппы направляющих в хлоропласт пептидов с самостоятельными структурными мотивами. Lee et al. (2008), выше. Кроме того, не все из этих последовательностей были полезны в гетерологичной экспрессии направляющих в хлоропласт белков в высших растениях.
ОПИСАНИЕ
В настоящем документе описаны композиции и способы для направления в пластиды полипептидов в растении. В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический транзитный пептид хлоропласта из Brassica (например, пептид TraP8 и пептид TraP9), функционально связанную с интересующей нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть полезны для экспрессии и направления полипептида, кодируемого интересующей нуклеотидной последовательностью, в однодольном или двудольном растении. Кроме того, описаны векторы, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический транзитный пептид хлоропласта из Brassica, функционально связанную с интересующей нуклеотидной последовательностью.
В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может представлять собой нуклеотидную последовательность, происходящую из эталонной нуклеотидной последовательности, полученной из гена вида Brassica (например, B. napus, B. rapa, B. juncea и B. carinata), или ее функционального варианта. В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может представлять собой химерную нуклеотидную последовательность, содержащую частичную кодирующую ТПХ нуклеотидную последовательность из гена вида Brassica, или ее функциональный вариант. В конкретных вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может содержать непрерывные нуклеотидные последовательности, полученные из каждого из эталонных ТПХ вида Brassica и ТПХ из другого гена вида Brassica, другого вида Brassica или другого организма (например, растения, прокариота и низшего фотосинтезирующего эукариота), или функциональные варианты любого из вышеперечисленных. В конкретных вариантах осуществления непрерывная нуклеотидная последовательность может быть получена из ортологичной нуклеотидной последовательности эталонного ТПХ Brassica, которая получена из принадлежащего другому организму ортолога эталонного гена вида Brassica (например, генома другого вида Brassica). В этих и других вариантах осуществления нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может быть химерной нуклеотидной последовательностью, содержащей более чем одну кодирующую ТПХ нуклеотидную последовательность.
В некоторых примерах нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может быть химерной нуклеотидной последовательностью, содержащей частичную нуклеотидную последовательность ТПХ из любого вида из B. napus и B. rapa, или ее функциональные варианты. В конкретных примерах нуклеотидная последовательность, кодирующая синтетический ТПХ из Brassica, может содержать непрерывные нуклеотидные последовательности, полученные из любого вида из B. napus и B. rapa, или их функциональные варианты.
В некоторых вариантах осуществления композиция содержит молекулу нуклеиновой кислоты, содержащую по меньшей мере один компонент из Brassica для направления полипептида в хлоропласт. Кроме того, описаны молекулы нуклеиновой кислоты, содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере один компонент из Brassica для направления полипептида в хлоропласт, функционально связанный с интересующей нуклеотидной последовательностью. В конкретных вариантах осуществления такие молекулы нуклеиновой кислоты могут быть полезны для экспрессии и направления полипептида, кодируемого интересующей нуклеотидной последовательностью, в однодольном или двудольном растении. Для целей настоящего изобретения компонент из Brassica для направления полипептида в хлоропласт означает конкретные синтетические нуклеотидные последовательности. В конкретных вариантах осуществления компонент из Brassica для направления полипептида в хлоропласт выбран из группы, состоящей из нуклеотидных последовательностей, кодирующих полипептиды, обозначенные в настоящем документе TraP8 и TraP9.
В настоящем документе также описаны растительные материалы (например, и без ограничений, растения, ткани растений и клетки растений), содержащие молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал может иметь такую молекулу нуклеиновой кислоты, стабильно интегрированную в его геноме. В некоторых вариантах осуществления растительный материал может временно экспрессировать продукт молекулы нуклеиновой кислоты, содержащей по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления растительный материал представляет собой клетку растения, из которой растение не может быть регенерировано.
Описаны также способы экспрессирования нуклеотидной последовательности в содержащей пластиду клетке (например, растения), в пластиде (например, хлоропласте) содержащей пластиду клетки. В конкретных вариантах осуществления молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью, можно использовать для трансформации клетки растения таким образом, что слитый полипептид-предшественник, содержащий синтетический ТПХ из Brassica, слитый с продуктом экспрессии интересующей нуклеотидной последовательности, образуется в цитоплазме клетки растения, и слитый полипептид затем транспортируется in vivo в хлоропласт клетки растения. В некоторых вариантах осуществления клетка растения не способна к регенерации в растение.
Кроме того, описаны способы получения трансгенного растения, содержащего молекулу нуклеиновой кислоты, содержащую по меньшей мере одну нуклеотидную последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. Также описаны растительные товарные продукты (например, семена), полученные от таких трансгенных растений. В некоторых вариантах осуществления эти трансгенные растения или растительные товарные продукты содержат трансгенные клетки, из которых растение не может быть регенерировано.
Вышеуказанные и другие признаки станут более очевидными из следующего далее подробного описания нескольких вариантов осуществления, которое изложено со ссылкой на сопроводительные фигуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 изображена молекула мРНК, которая является репрезентативной для конкретных примеров нуклеотидных последовательностей, кодирующих синтетические ТПХ из Brassica (например, для TraP8 и TraP9), функционально связанных с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления молекула мРНК (такая, как представленная) может транскрибироваться с молекулы ДНК, содержащей открытую рамку считывания, включающую последовательность, кодирующую синтетический ТПХ из Brassica, функционально связанную с интересующей нуклеотидной последовательностью. В некоторых вариантах осуществления интересующая нуклеотидная последовательность может представлять собой последовательность, кодирующую интересующий пептид, например, и без ограничений, продукт маркерного гена или пептид, который должен быть направлен в пластиду.
На фиг. 2 изображена плазмидная карта pDAB101977.
На фиг. 3 изображена плазмидная карта pDAB101908.
На фиг. 4 приведено микроскопическое изображение, показывающее, что TraP8-YFP, инфильтрированный в ткань табачного листа, был перемещен в хлоропласты ткани табачного листа.
На фиг. 5 приведено микроскопическое изображение, показывающее, что TraP9-YFP, инфильтрированный в ткань табачного листа, был перемещен в хлоропласты ткани табачного листа.
На фиг. 6 приведено микроскопическое изображение, показывающее, что ненаправленные контроли YFP, которые были инфильтрированы в ткань табачного листа, не были включены в хлоропласты ткани табачного листа.
На фиг. 7 изображена плазмидная карта pDAB106597.
На фиг. 8 приведено микроскопическое изображение конструкта TraP8-YFP, введенного трансформацией в протопласты кукурузы, показывающее перемещение в хлоропласты протопластов кукурузы.
На фиг. 9 изображена плазмидная карта pDAB105526.
На фиг. 10 изображена плазмидная карта pDAB105527.
На фиг. 11 изображена плазмидная карта pDAB109807.
На фиг. 12 изображена плазмидная карта pDAB107687.
На фиг. 13 изображена плазмидная карта pDAB111481.
На фиг. 14 изображена плазмидная карта pDAB111479.
На фиг. 15 изображена плазмидная карта pDAB111338.
На фиг. 16 изображена плазмидная карта pDAB112710.
На фиг. 17 показано выравнивание последовательностей предсказанных транзитных пептидов хлоропласта для белка EPSPS из Brassica napus (SEQ ID NO: 1) и Brassica rapa (SEQ ID NO: 2). Звездочкой указано, где последовательности разделяются и рекомбинируют, с образованием TraP8 и Trap9.
На фиг. 18 изображена плазмидная карта pDAB107527.
На фиг. 19 изображена плазмидная карта pDAB105530.
На фиг. 20 изображена плазмидная карта pDAB105531.
На фиг. 21 изображена плазмидная карта pDAB105532.
На фиг. 22 изображена плазмидная карта pDAB105533.
На фиг. 23 изображена плазмидная карта pDAB105534.
На фиг. 24 изображена плазмидная карта pDAB107532.
На фиг. 25 изображена плазмидная карта pDAB107534.
На фиг. 26 изображена плазмидная карта pDAB107533.
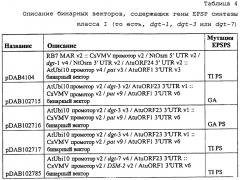
На фиг. 27 изображена плазмидная карта pDAB4104.
На фиг. 28 изображена плазмидная карта pDAB102715.
На фиг. 29 изображена плазмидная карта pDAB102716.
На фиг. 30 изображена плазмидная карта pDAB102717.
На фиг. 31 изображена плазмидная карта pDAB102785.
На фиг. 32 изображена плазмидная карта pDAB102719.
На фиг. 33 изображена плазмидная карта pDAB102718.
На фиг. 34 изображена плазмидная карта pDAB107663.
На фиг. 35 изображена плазмидная карта pDAB107664.
На фиг. 36 изображена плазмидная карта pDAB107665.
На фиг. 37 изображена плазмидная карта pDAB107666.
На фиг. 38 изображена плазмидная карта pDAB109812.
На фиг. 39 изображена плазмидная карта pDAB101556.
На фиг. 40 изображена плазмидная карта pDAB107698.
На фиг. 41 изображена плазмидная карта pDAB108384.
На фиг. 42 изображена плазмидная карта pDAB108385.
На фиг. 43 изображена плазмидная карта pDAB108386.
На фиг. 44 изображена плазмидная карта pDAB108387.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот, приведенные в прилагаемом списке последовательностей, изображены с использованием стандартных буквенных сокращений для нуклеотидных оснований, указанных в 37 C.F.R. § 1,822. Показана только одна цепь каждой последовательности нуклеиновой кислоты, однако понятно, что комплементарная цепь включена при каждой ссылке на изображенную цепь. В прилагаемом списке последовательностей:
SEQ ID NO: 1 изображает аминокислотную последовательность транзитного пептида хлоропласта EPSPS из Brassica napus.
SEQ ID NO: 2 изображает аминокислотную последовательность транзитного пептида хлоропласта EPSPS из Brassica rapa.
SEQ ID NO: 3 изображает аминокислотную последовательность химерного транзитного пептида хлоропласта TraP8.
SEQ ID NO: 4 изображает аминокислотную последовательность химерного транзитного пептида хлоропласта TraP9.
SEQ ID NO: 5 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP8.
SEQ ID NO: 6 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP9.
SEQ ID NO: 7 изображает полинуклеотидную последовательность, кодирующую последовательность линкера.
SEQ ID NO: 8 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP8 v2.
SEQ ID NO: 9 изображает полинуклеотидную последовательность, кодирующую химерный транзитный пептид хлоропласта TraP9 v2.
SEQ ID NO: 10 изображает полинуклеотидную последовательность, кодирующую ген cry2aa.
SEQ ID NO: 11 изображает полинуклеотидную последовательность, кодирующую ген vip3ab1v6.
SEQ ID NO: 12 изображает полинуклеотидную последовательность, кодирующую ген vip3ab1v7.
SEQ ID NO: 13 изображает пептид, имеющий аминокислотную последовательность Ser-Val-Ser-Leu.
SEQ ID NO: 14 изображает полинуклеотидную последовательность, кодирующую транзитный пептид хлоропласта EPSPS с SEQ ID NO: 1 из Brassica napus.
SEQ ID NO: 15 изображает полинуклеотидную последовательность, кодирующую транзитный пептид хлоропласта EPSPS с SEQ ID NO: 2 из Brassica rapa.
SEQ ID NO: 16 изображает полинуклеотидную последовательность, кодирующую dgt-28 v5.
SEQ ID NO: 17 изображает полинуклеотидную последовательность, кодирующую dgt-28 v6.
SEQ ID NO: 18 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-1.
SEQ ID NO: 19 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-3 v2 (G173A).
SEQ ID NO: 20 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-3 v3 (G173A; P178S).
SEQ ID NO: 21 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-3 v4 (T174I; P178S).
SEQ ID NO: 22 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-7 v4 (T168I; P172S).
SEQ ID NO: 23 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-32 v3.
SEQ ID NO: 24 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-33 v3.
SEQ ID NO: 25 изображает полинуклеотидную последовательность оптимизированного по кодонам dgt-31 v3.
SEQ ID NO: 26 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP4 v2.
SEQ ID NO: 27 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP5 v2.
SEQ ID NO: 28 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP8 v2.
SEQ ID NO: 29 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP9 v2.
SEQ ID NO: 30 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP12 v2.
SEQ ID NO: 31 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP13 v2.
SEQ ID NO: 32 изображает полинуклеотидную последовательность TraP4 v2:dgt-28 v5.
SEQ ID NO: 33 изображает полинуклеотидную последовательность TraP5 v2:dgt-28 v5.
SEQ ID NO: 34 изображает полинуклеотидную последовательность TraP8 v2:dgt-28 v5.
SEQ ID NO: 35 изображает полинуклеотидную последовательность TraP9 v2:dgt-28 v5.
SEQ ID NO: 36 изображает полинуклеотидную последовательность TraP12 v2:dgt-28 v5.
SEQ ID NO: 37 изображает полинуклеотидную последовательность TraP13 v2: dgt-28 v5.
SEQ ID NO: 38 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP14 v2.
SEQ ID NO: 39 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP23 v2.
SEQ ID NO: 40 изображает полинуклеотидную последовательность, кодирующую транзитный пептид TraP24 v2.
SEQ ID NO: 41 изображает полинуклеотидную последовательность, кодирующую транзитный пептид dgt-32 v3, слитый с TraP14 v2.
SEQ ID NO: 42 изображает полинуклеотидную последовательность, кодирующую транзитный пептид dgt-33 v3, слитый с TraP24 v2.
SEQ ID NO: 43 изображает полинуклеотидную последовательность, кодирующую транзитный пептид dgt-31 v3, слитый с TraP23 v2.
SEQ ID NO: 44 изображает олигонуклеотидную последовательность праймера DSM2A.
SEQ ID NO: 45 изображает олигонуклеотидную последовательность праймера DSM2S.
SEQ ID NO: 46 изображает олигонуклеотидную последовательность зонда DSM2 Cy5.
SEQ ID NO: 47 изображает олигонуклеотидную последовательность праймера DGT28F.
SEQ ID NO: 48 изображает олигонуклеотидную последовательность праймера DGT28R.
SEQ ID NO: 49 изображает олигонуклеотидную последовательность зонда TAFFY-HEX.
SEQ ID NO: 50 изображает олигонуклеотидную последовательность праймера TAFII15-F.
SEQ ID NO: 51 изображает олигонуклеотидную последовательность праймера TAFII15-R.
SEQ ID NO: 52 изображает олигонуклеотидную последовательность прямого олигонуклеотида, используемого для подтверждения экспрессионной кассеты гена dgt-28.
SEQ ID NO: 53 изображает олигонуклеотидную последовательность обратного олигонуклеотида, используемого для подтверждения экспрессионной кассеты гена dgt-28.
SEQ ID NO: 54 изображает олигонуклеотидную последовательность праймера AT26410LP.
SEQ ID NO: 55 изображает олигонуклеотидную последовательность праймера AT26410RP.
SEQ ID NO: 56 изображает олигонуклеотидную последовательность праймера DGT28F.
SEQ ID NO: 57 изображает олигонуклеотидную последовательность праймера DGT28R.
SEQ ID NO: 58 изображает олигонуклеотидную последовательность праймера GAAD1F.
SEQ ID NO: 59 изображает олигонуклеотидную последовательность зонда GAAD1P.
SEQ ID NO: 60 изображает олигонуклеотидную последовательность праймера GAAD1R.
SEQ ID NO: 61 изображает олигонуклеотидную последовательность IV-зонда.
SEQ ID NO: 62 изображает олигонуклеотидную последовательность праймера IVF-Taq.
SEQ ID NO: 63 изображает олигонуклеотидную последовательность праймера IVR-Taq.
SEQ ID NO: 64 изображает олигонуклеотидную последовательность праймера zmDGT28 F.
SEQ ID NO: 65 изображает олигонуклеотидную последовательность зонда zmDGT28 FAM.
SEQ ID NO: 66 изображает олигонуклеотидную последовательность праймера zmDGT28 R.
ПОДРОБНОЕ ОПИСАНИЕ
I. Обзор нескольких вариантов осуществления
Транзитный пептид хлоропласта (ТПХ) (или транзитный пептид пластиды) действует котрансляционно или посттрансляционно для направления полипептида, содержащего ТПХ, в пластиду (например, хлоропласт). В некоторых вариантах осуществления изобретения любые эндогенные хлоропластные белки или гетерологичные белки могут быть направлены в хлоропласт в результате экспрессии такого белка в виде большего по размеру полипептида-предшественника, содержащего ТПХ. В конкретных вариантах осуществления ТПХ может быть получен из нуклеотидной последовательности, полученной из гена вида Brassica, например, и без ограничений, путем включения по меньшей мере одной непрерывной последовательности из ортологичного гена, полученного из другого организма, или ее функционального варианта.
В иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует ТПХ, были выделены из последовательностей гена EPSPS, полученных из Brassica napus (регистрационный № базы данных NCBI P17688) и Brassica rapa (регистрационный № базы данных NCBI AAS80163). Кодирующие ТПХ нуклеотидные последовательности были выделены в результате анализа последовательности гена EPSPS с помощью предсказательного сервера ChloroP. Emanuelsson et al. (1999), Protein Science 8: 978-84 (доступно на сайте cbs.dtu.dk/services/ChloroP). Предсказанные белковые продукты выделенных кодирующих ТПХ последовательностей представляют собой транзитные пептиды длиной примерно 60-70 аминокислот. В этом примере использовали родной ТПХ B. napus в качестве эталонной последовательности для разработки иллюстративных синтетических ТПХ из Brassica путем слияния непрерывных последовательностей из других ТПХ в определенном положении в ТПХ B. napus. Этот процесс дизайна иллюстрирует разработку нового, в некоторых аспектах, синтетического ТПХ из нуклеотидной последовательности вида Brassica. Данные иллюстративные синтетические ТПХ из Brassica называются в данном описании TraP8 и TraP9. Эти иллюстративные синтетические TraP были протестированы на функцию направления в пластиду и было установлено, что они демонстрируют направляющую в пластиды способность, которая по меньшей мере не уступает таковой, наблюдаемой индивидуально у природных последовательностей Brassica.
В следующем иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует синтетический пептид по изобретению TraP, были синтезированы независимо и функционально связаны с нуклеотидной последовательностью, кодирующей желтый флуоресцентный белок (YFP), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:YFP. Все такие молекулы нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:YFP, были встроены в бинарный вектор так, что каждая кодирующая TraP:YFP нуклеотидная последовательность была функционально связана с промотором AtUbi 10.
В еще одном иллюстративном варианте осуществления каждый из бинарных векторов, содержащих кодирующую TraP:YFP нуклеотидную последовательность, функционально связанную с промотором AtUbi 10, был независимо временно введен трансформацией в растение табака (Nicotiana benthamiana) с использованием метода Agrobacterium-опосредованной трансформации. Анализ методом конфокальной микроскопии и вестерн-блоттинга подтвердил, что каждый TraP успешно направлял YFP в хлоропласты табака.
В следующем иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует синтетический пептид по изобретению TraP, были синтезированы независимо и функционально связаны с нуклеотидной последовательностью, кодирующей важную с агрономической точки зрения генную последовательность. Последовательности TraP были слиты с генами признаков толерантности к гербицидам (например, dgt-28 и dgt-14), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:DGT-28 или TraP:DGT-14. Все такие молекулы нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:DGT-28 или TraP:DGT-14, были встроены в бинарный вектор так, что каждая кодирующая TraP:dgt-28 или TraP:dgt-14 нуклеотидная последовательность была функционально связана с промотором и другими генными регуляторными элементами. Бинарные векторы, содержащие кодирующую TraP:dgt-28 или TraP:dgt-14 нуклеотидную последовательность, были использованы для трансформации различных видов растений. Трансгенные растения анализировали на толерантность к гербицидам в результате экспрессии и транслокации ферментов DGT-28 или DGT-14 в хлоропласт.
В следующем иллюстративном варианте осуществления нуклеотидные последовательности, каждая из которых кодирует синтетический пептид по изобретению TraP, были синтезированы независимо и функционально связаны с нуклеотидной последовательностью, кодирующей важную с агрономической точки зрения генную последовательность. Последовательности TraP были слиты с генами, придающими признаки толерантности к насекомым (например, cry2Aa и vip3ab1), с получением синтетических молекул нуклеиновой кислоты, каждая из которых кодирует химерный слитый полипептид TraP:Cry2Aa или TraP:Vip3Ab1. Все такие молекулы нуклеиновой кислоты, каждая из которых кодирует химерный полипептид TraP:Cry2Aa или TraP:Vip3Ab1, были встроены в бинарный вектор так, что каждая кодирующая TraP:Cry2Aa или TraP:Vip3Ab1 нуклеотидная последовательность была функционально связана с промотором и другими генными регуляторными элементами. Бинарные векторы, содержащие кодирующую TraP:Cry2Aa или TraP:Vip3Ab1 нуклеотидную последовательность, были использованы для трансформации различных видов растений. Трансгенные растения были биологически проанализированы на устойчивость к насекомым в результате экспрессии и транслокации ферментов Cry2Aa или Vip3Ab1 в хлоропласт.
С учетом вышеуказанных подробно описанных действующих образцов, синтетические последовательности ТПХ из Brassica по изобретению, а также нуклеиновые кислоты, кодирующие их, могут быть использованы для направления любого полипептида в пластиду в широком диапазоне содержащих пластиды клеток. Например, с помощью способов, ставших доступными для специалистов в данной области благодаря настоящему изобретению, химерный полипептид, содержащий синтетическую последовательность ТПХ из Brassica, слитую с N-концом любой второй пептидной последовательности, можно вводить в содержащую пластиду клетку-хозяина (или экспрессировать в ней) для направления в пластиду второй пептидной последовательности. Таким образом, в конкретных вариантах осуществления пептид TraP по изобретению может обеспечивать повышенную эффективность введения внутрь и процессинга пептида, для которого желательна экспрессия в пластиде, по сравнению с природным ТПХ.
II. Сокращения
ТПХ транзитный пептид хлоропласта
Bt Bacillus thuringiensis
EPSPS 3-енолпирувилшикимат-5-фосфатсинтетаза
YFP желтый флуоресцентный белок
Ti индуцирующие опухоль (плазмиды, полученные из A. tumefaciens)
T-ДНК трансферная ДНК
III. Термины
Для того чтобы облегчить обзор различных вариантов осуществления изобретения, приведены следующие объяснения специальных терминов:
Транзитный пептид хлоропласта: используемый в настоящем документе термин «транзитный пептид хлоропласта» (ТПХ) (или «транзитный пептид пластиды») может означать аминокислотную последовательность, которая, если присутствует на N-конце полипептида, направляет введение полипептида в пластиду содержащей пластиду клетки (например, клетки растения, например, целого растения или культуры клеток растения). ТПХ, как правило, необходим и достаточен для направленного введения белка в пластиду (например, первичную, вторичную или третичную пластиду, такую как хлоропласт) клетки-хозяина. Предполагаемый транзитный пептид хлоропласта можно идентифицировать с помощью одного из нескольких доступных алгоритмов (например, PSORT и ChloroP, (доступного на сайте cbs.dtu.dk/services/ChloroP)). ChloroP может, в частности, обеспечить хороший уровень предсказания ТПХ. Emanuelsson et al. (1999), Protein Science 8: 978-84. Однако предсказание функциональных ТПХ не достигается со 100% эффективностью любыми существующими алгоритмами. Следовательно, важно убедиться, что идентифицированный предполагаемый ТПХ действительно действует, как должен, например, с помощью in vitro или in vivo методологии.
Транзитные пептиды хлоропласта могут быть расположены на N-конце полипептида, который поступает в пластиду. ТПХ может облегчать ко- или посттрансляционный транспорт полипептида, содержащего ТПХ, в пластиду. Транзитные пептиды хлоропласта, как правило, содержат от примерно 40 до примерно 100 аминокислот и, как установлено, такие ТПХ обладают некоторыми общими характеристиками. Например: ТПХ содержат очень мало, если вообще содержат, отрицательно заряженных аминокислот (таких как аспарагиновая кислота, глютаминовая кислота, аспарагин или глютамин); в N-концевых областях ТПХ отсутствуют заряженные аминокислоты, глицин и пролин; центральная область ТПХ также, по-видимому, содержит в очень высокой пропорции основные или гидроксилированые аминокислоты (такие как серин и треонин); и C-концевая область ТПХ, по всей вероятности, богата аргинином и может содержать структуру амфипатического бета-листа. Пластидные протеазы могут отщеплять ТПХ от остатка полипептида, содержащего ТПХ, после введения полипептида в пластиду.
Контакт: используемый в настоящем документе термин «контакт с» или «поглощение» клеткой, тканью или организмом (например, клеткой растения, тканью растения и растением), применительно к молекуле нуклеиновой кислоты, включает интернализацию молекулы нуклеиновой кислоты в организм, например, и без ограничений: вступление в контакт организма с композицией, содержащей молекулу нуклеиновой кислоты; и вымачивание организмов в растворе, содержащем молекулу нуклеиновой кислоты.
Эндогенный: используемый в настоящем документе термин «эндогенный» относится к веществам (например, молекулам нуклеиновой кислоты и полипептидам), которые происходят из конкретного организма, ткани или клетки. Например, «эндогенный» полипептид, экспрессируемый в клетке растения, может означать полипептид, который обычно экспрессируется в клетках того же типа из генетически не модифицированных растений того же вида. В некоторых примерах эндогенный ген (например, ген EPSPS) из вида Brassica может быть использован для получения эталонной последовательности ТПХ Brassica.
Экспрессия: используемый в настоящем документе термин «экспрессия» кодирующей последовательности (например, гена или трансгена) означает процесс, посредством которого закодированная информация транскрипционной единицы нуклеиновой кислоты (включая, например, геномную ДНК или кДНК) преобразуется в операционную, не операционную или структурную часть клетки, часто включающий синтез белка. На экспрессию гена можно влиять с помощью внешних сигналов; например, подвергая клетку, ткань или организм воздействию средства, которое повышает или снижает экспрессию гена. Экспрессию гена также можно регулировать на любом этапе перехода от ДНК к РНК и к белку. Регуляция экспрессии гена происходит, например, через контрольные элементы, действующие на транскрипцию, трансляцию, транспорт и процессинг РНК, деградацию молекул-посредников, таких как мРНК, или через активацию, инактивацию, компартментализацию или деградацию определенных белковых молекул после их образования, или с помощью сочетаний вышеперечисленного. Экспрессию гена можно количественно определять на уровне РНК или на уровне белка любым методом, известным в данной области, например, и без ограничений: нозерн-блоттингом; ОТ-ПЦР; вестерн-блоттингом или анализом(ми) активности белка in vitro, in situ и in vivo.
Генетический материал: используемый в настоящем документе термин «генетический материал» включает все гены и молекулы нуклеиновой кислоты, такие как ДНК и РНК.
Гетерологичный: используемый в настоящем документе термин «гетерологичный» относится к веществам (например, молекулам нуклеиновой кислоты и полипептидам), которые не происходят из конкретного организма, ткани или клетки. Например, «гетерологичный» полипептид, экспрессируемый в клетке растения, может означать полипептид, который обычно не экспрессируется в клетках того же типа из генетически не модифицированных растений того же вида (например, полипептид, который экспрессируется в других кле