Выявление аффинно-зрелых человеческих антител
Иллюстрации
Показать всеИзобретения касаются способов для создания библиотеки нуклеотидных последовательностей человеческого иммуноглобулина для выявления последовательностей нуклеиновых кислот, кодирующих подвергшиеся соматической гипермутации вариабельные области иммуноглобулина, которые способствуют связыванию с представляющим интерес антигеном, и наборов для использования в указанных способах. Способ для создания библиотеки включает: этап ПЦР для амплификации нуклеотидных последовательностей лидерной и V-области тяжелых и легких цепей человеческого иммуноглобулина из кДНК библиотеки, созданной из образца человеческих мононуклеарных клеток периферической крови, полученных из донора-человека, у которого ранее было выявлено наличие антител, специфичных к представляющему интерес антигену, где для ПЦР-амплификации применяют набор специфических по отношению к лидерной последовательности праймеров, включающий специфические по отношению к 90% всех лидерных последовательностей праймеров. Выделение продуктов амплификации, полученных на этапе ПЦР. Создание набора конструктов путем встраивания выделенных продуктов амплификации, полученных на этапе ПЦР, в векторы экспрессии. Введение набора конструктов в набор клеток-хозяев для создания библиотеки нуклеотидных последовательностей человеческого иммуноглобулина. Способ выявления последовательностей включает: в качестве первого этапа получение библиотеки нуклеотидных последовательностей по предыдущему способу. Второй этап ПЦР для амплификации нуклеотидных последовательностей человеческого иммуноглобулина из полученной библиотеки или образца человеческой ткани. Выделение второго набора продуктов амплификации. Создание второго набора. Введение второго набора конструктов во второй набор клеток-хозяев. Проведение скрининга второй библиотеки. Получение нуклеотидной последовательности, кодирующей вариабельную область, которая специфически связывается с целевым антигеном. Создание обратного праймера и его применение на третьем этапе ПЦР. Изобретения обеспечивают выявление более полных библиотек V–областей, кодирующих последовательности антител, содержащие критически важные соматические мутации для получения высокоаффинных антител. 6 н.п. ф-лы, 5 ил., 4 табл., 3 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет предварительной заявки на патент США под номером 61/506749, поданной 12 июля 2011 года.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит перечень последовательностей, который был подан в формате ASCII через EFS-Web и, таким образом, посредством ссылки включен в полном объеме. Вышеназванная копия в формате ASCII, созданная 12 июля 2012 года, названа 54070121.txt и имеет размер 40628 байт.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0003] Настоящее изобретение относится в целом к областям иммунологии и молекулярной биологии. Более конкретно, настоящее изобретение относится к способам, композициям и наборам для выявление "аффинно-зрелых" человеческих антител (Ab), содержащих соматические гипермутации.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0004] На протяжении 19 и 20 веков ученые и врачи мечтали получить возможность создавать индивидуализированные терапевтические средства, которые обладали бы высокой специфичностью в отношении единственной биологической мишени. Благодаря селективному воздействию на заболевание, при котором щадится здоровая ткань, эти "волшебные средства" считались идеальными терапевтическими средствами. Однако эта мечта начала воплощаться в жизнь только в начале 1970-х годов, когда Kohler и Milstein (Nature 256: 495, 1975) разработали новаторский способ создания антиген (Ag)-специфических моноклональных антител (mAb). Это было, возможно, одним из наиболее существенных событий в истории современной иммунологии. С применением этого нового подхода были разработаны многочисленные исследовательские, диагностические и терапевтические продукты, с общим объемом рынка в сотни миллиардов долларов.
[0005] Согласно способу Kohler и Milstein, В-клетки грызунов, каждая из которых экспрессирует уникальный иммуноглобулин (Ig), (т.е. mAb) иммортализировали путем слияния с клеткой миеломы. Способность этих mAb-секретирующих "гибридом" к репликации ad mfinitum позволяла провести отбор тех клеток, которые секретировали mAb с высокой аффинностью к данному антигену для того, чтобы использовать их в качестве фабрики для производства больших количеств идентичных mAb. MAb, полученные данным способом, в конечном счете применяли в качестве терапевтических средств для человека. Несмотря на эффективность, вскоре было обнаружено, что применение терапевтических mAb грызунов являются далеко не идеальным средством, потому что после нескольких введений они вызывали иммунные реакции по отношению к Ig грызунов, которые нейтрализовали активность mAb и часто становились причиной серьезных побочных реакций у пациентов, получавших лечение.
[0006] Для этого были предприняты попытки адаптировать способ Kohler и Milstein, использующий mAb грызунов, для получения человеческих mAb путем слияния человеческих В-клеток с клетками миеломы. Этот метод "человеческой гибридомы" оказался более сложным, чем ожидалось, по ряду различных причин. Во-первых, по этическим или медицинским причинам, часто было трудно увеличить количество антиген-специфических В-клеток путем многократной иммунизации субъектов-людей Ag. Во-вторых, также по этическим или медицинским причинам, было не осуществляемым выделение ткани селезенки человека для получения В-клеток, как это делали у грызунов. В-третьих, было нелегко получить иммортализированные mAb-продуцирующие клеточные линии человека, и эти линии, как правило, производили очень небольшие количества mAb. И, в-четвертых, поскольку разнообразие человеческих иммуноглобулинов, или репертуар индивидуальных специфичностей АЬ, намного выше, чем репертуар грызунов (~1012 по сравнению с ~107 индивидуальных специфичностей), и поскольку применяемая методология скрининга была ограничена количеством специфичностей не более чем примерно 104 в данной выборке, технически намного труднее выделить человеческие mAb-секретирующие клетки требуемой специфичности. Таким образом, выявление mAb, имеющих специфичности низкой частоты встречаемости, с применением этого способа остается сложной задачей по принципу "найти иголку в стоге сена".
|0007] Параллельно с разработкой способов "человеческих гибридом", ученые также начали предпринимать попытки "гуманизировать" антитела грызунов, заменяя различные аминокислотные последовательности грызунов последовательностями человеческих антител. В типичном применении, вариабельные области мышиного Ig объединяют с человеческими константными доменами, или мышиные участки, определяющие комплементарность (CDR) прививают на каркасный участок человеческого Ig. Этот новый рекомбинантный конструкт нуклеиновой кислоты вставляют в вектор экспрессии, который трансфицируют в клетки-хозяева, которые могут продуцировать большие количества химерных mAb при культивировании. Хотя этот метод произвел большой вклад в повышение практической значимости mAb в терапевтических применениях (за счет уменьшения ответа, развивающегося у человека против иммуноглобулинов грызунов), оставшиеся последовательности грызунов все еще могут вызвать развитие нежелательного ответа по отношению к mAb [например, ответа на НАМА (на человеческое антитело к антителу мыши)], который может нейтрализовать mAb или даже вызвать серьезные побочные реакции у пациента.
[0008] Другой подход к получению человеческих mAb включал использование химерных животных, где гены Ig животного-хозяина были частично заменены их человеческими аналогами. После вакцинации эти нокаутные/нокиновые животные продуцируют человеческие АЬ, и селезенки этих животных, содержащие В-клетки, могут использоваться для получения человеческих mAb с использованием обычного метода гибридом. Недостатки, которые были связаны с этим методом, включают: снижение разнообразия (специфичности) и аффинности вследствие неполного репертуара человеческих генов, связанных с Ig; гуморальные ответы, которые не были чисто человеческими ("гуманизированные" трансгенные животные сохраняют свои нативные Т-клетки и обладают остаточной экспрессией мышиных антител в ответ на различные антигены); характер гликозилирования продуцируемых антител отличался от человеческого (например, Galα 1-3Gal-содержащие олигосахариды в гуманизированных животных обычно не встречаются у человека и, таким образом, распознаются как чужеродные); а в отношении антител, которые проходят развитие в организме животного, не проводится "селекция" относительно толерантности у человека - таким образом, даже притом, что они происходят от частично человеческих последовательностей, они не обязательно являются неиммуногенными в организме человека (т.е. не являются истинно человеческими).
[0009] Появление способов полимеразной цепной реакции (ПЦР) сделало возможным амплификацию всех или части генов Ig, и позволило создать библиотеки плазмид, содержащих молекулы кДНК, кодирующих вариабельные области (V-области) тяжелых и легких цепей Ig из лейкоцитов периферической крови (PBL), которые необходимо получить. Традиционно, создание библиотеки для фагового дисплея включало набор из 6 праймеров в вариабельной области тяжелой цепи, 4 праймера в вариабельной области каппа-цепи и 9 праймеров в вариабельной области лямбда-цепи (как описано в Barbas et al., Phage Display: A Laboratory Manual. Cold Spring Harbor, 2001). Плазмиды из этих библиотек могут применяться для трансфекции бактерий или других клеток-хозяев (например, дрожжей), которые затем могут подвергаться скринингу на Ag-специфические компоненты Ig. В подходе фагового дисплея гены V-области человеческого Ig клонируют в бактериофаг для отображения фрагментов Ab на поверхности частиц бактериофагов. Гены из обширных библиотек генов человеческих Ab встраивают в библиотеку фага. Каждый фаг может потенциально нести ген для другой V-области и отображает другую V-область на своей поверхности. Обычно эти фаги применяют для отображения на поверхности бактериофага конструкта АЬ, состоящего из V-областей тяжелых и легких цепей Ig, разделенных линкером (одноцепочечный фрагмент вариабельной области Ab или scFv), таким образом, что каждая из V-областей тяжелых и легких цепей могла бы связаться с целевым антигеном таким образом, чтобы точно имитировать связывание mAb с Ag. Подобно фаговому дисплею, в дрожжевом дисплее компоненты Ig экспонируются на поверхности дрожжевой клетки в виде гибрида с белком Aga2p таким образом, что белок слияния выступает по отношению к клеточной поверхности. Затем может применяться проточная цитометрия для того, чтобы провести отбор тех дрожжевых клеток, которые экспрессируют компонент Ig, который реагирует с целевым Ag. После выявления с применением фагового или дрожжевого дисплея экспрессирущиеся гены V-областей тяжелых и/или легких цепей выделяют и встраивают в векторы экспрессии тяжелой и/или легкой цепи полной длины. Культивирование клеток-хозяев, трансфицированных такими векторами, позволяет получить большие количества mAb.
[0010] Основное преимущество методов фагового или дрожжевого дисплея заключается в том, что огромные библиотеки, включающие примерно 100 млрд. отдельных V-областей, могут быть подвергнуты скринингу для определения реактивности Ag. Недостатком этих методов является то, что V-области, выделенные на первом этапе дисплея, как правило, обладают очень низкой аффинностью. Распространенной причиной формирования низкоаффинных антител является потеря при использовании этого способа критически важных подвергшихся гипермутациям последовательностей (которые создают зрелые высокоаффинные антитела). В-лимфоциты, которые продуцируют высокоаффинные антитела, в целом претерпели процесс, известный как соматическая гипермутация. В этом процессе последовательности V-областей, кодируемые в зародышевой линии, подвергаются генетическим мутациям, таким образом, что генная последовательность V-области изменяется. Это может привести к получению "зрелой" последовательности V-области, которая имеет значительно более высокую аффинность по отношению к заданному антигену. В целом понимается, что соматическая гипермутация является принципиально важным явлением для создания разнообразия антител и высокоаффинных антитела. Эта соматическая гипермутация не может обнаруживаться в геномных последовательностях зародышевой линии, и представлена только в уникальном клоне В-лимфоцитов.
[0011] Создание низкоаффинных антител с применением подхода фагового дисплея является одним из основных ограничений этого способа. Это затруднение в действительности привело к разработке многих других комплексных подходов, включая гуманизированных мышей и соматическую гипермутацию in vitro, как описано выше. Антитела у человека проходят процесс селекции, который делает их переносимыми человеческим организмом. Эти методы приводят к применению последовательностей антител, которые не основаны на in vivo процессах селекции у человека, и таким образом, эти антитела могут быть иммуногенными у человека. В любом случае, преодоление продукции низкоаффинных антител стало серьезной проблемой для этих способов.
[0012] Причина, по которой фаговый дисплей обычно генерирует низкоаффинные антитела, заключается в том, что он включает использование последовательностей праймера, которые основанына последовательностях V-областей зародышевого типа. Применение праймеров V-области на основании последовательностей зародышевого типа может привести к двум возможным результатам: (1) праймеры не смогут гибридизоваться с подвергшимися соматическим мутациям последовательностями, поскольку несовпадение между праймером и подвергшимися гипермутациям последовательностями не может привести к отжигу праймера; или (2) несовпадение между праймером и подвергшимися гипермутациям последовательностями является консервативным, благодаря чему отжиг имеет место, но амплификация приводит к повторению последовательности зародышевого типа, кодируемой праймером, а не соответствующей подвергшейся гипермутациям последовательности. В любом случае, так как методология фагового дисплея включает критически важные этапы ПЦР-амплификации с применением последовательностей праймера для ГЩР, которые кодируют последовательности V-областей зародышевого типа, и так как эти праймеры амплифицируют последовательности Ig, расположенные внутри V-областей антитела, библиотеки кДНК, созданные с применением праймерных последовательностей зародышевого типа не будут содержать полный репертуар подвергшихся соматическим гипермутациям последовательностей. Кроме того, и что важно, репертуар будет полностью лишен антител с гипермутацией на 5'-конце V-области, т.е. области, кодируемой праймером, кодируемым зародышевой линией.
[0013] Другими словами, применение праймеров, основанных на последовательности зародышевого типа, повторяет последовательности V-областей зародышевого типа, таким образом, приводя к утрате гипермутаций в участке, кодируемой праймерной последовательностью. Таким образом, этот способ систематически ликвидирует гипермутацию в этих участках V-области и приводит к общей потере подвергшихся гипермутациям последовательностей подвергшегося гипермутациям антитела. В случае Ab низкой частоты встречаемости (т.е. менее 0,1; 0,01; 0,001; 0,0001 или 0,00001% от суммарного репертуара Ag специфичностей субъекта), для которых система фаговогого дисплея, возможно, подходит больше всего, нахождение генов V-областей, которые могут применяться для получения высокоаффинных mAb, становится все более сложной задачей.
КРАТКОЕ ОПИСАНИЕ
[0014] Настоящее изобретение основано на разработке улучшенного способа выявления Ag-специфических V-областей Ig, которые встречаются с низкой частотой в репертуарах человеческих Ab, таким образом, чтобы эти V-области могли применяться для получения Ag-специфических человеческих mAb или других Ag-направленных конструктов. Настоящее изобретение также позволяет выявление более полных библиотек V-областей, в частности тех, которые кодируют последовательности антител, содержащие критически важные соматические мутации для получения высокоаффинных антител.
[0015] Разработка этого улучшенного способа была основана на неожиданном открытии, касающемся того, что традиционные способы фагового и дрожжевого дисплея позволяют многим V-областям в человеческих мононуклеарных клетках периферической крови (РВМС), которые обладают высокой аффинностью к целевому антигену, избегать выявления. В традиционных способах фагового и дрожжевого дисплея ПЦР применяют для амплификации последовательностей нуклеиновых кислот, соответствующих V-областям тяжелых и/или легких цепей Ig. Прямые праймеры, которые инициируют процесс ПЦР-амплификации, имеют последовательность нуклеиновой кислоты, которая комплементарна последовательности-зародышевого типа, расположенной на 5'-конце каждой V-области, чтобы молекулы кДНК, кодирующие V-области, подвергались амплифицикации.
[0016] Благодаря нескольким процессам, отвечающим за создание разнообразия Ab, аминокислотные последовательности V-областей зрелых Ab отличаются от последовательностей зародышевого типа и друг от друга. Генные сегменты Ig у млекопитающих организованы в группы вариабельных (V), обеспечивающих разнообразие (D), соединительных (J) и константных (С) экзонов. ДНК, кодирующая тяжелую цепь человека включает приблизительно 50 функциональных VH сегментов, 30 DH сегментов и 6 JH сегментов. Каппа-цепь включает приблизительно 40 функциональных VΚ сегментов, пять Jκ сегментов и 1 Сκ сегмент. Лямбда-цепь ДНК содержит 30 Vλ сегментов и по 4 Jλ и Сλ сегмента. Разнообразие соединений является результатом неточного соединения генных сегментов, и в процессе рекомбинации не-шаблонные нуклеотиды могут вставляться между прилегающими генными сегментами с помощью терминальной дезоксинуклеотидилтрансферазы, и становиться частью участка, определяющего комплементарность (CDR). Разнообразие собранных V-D-J или V-J сегментов затем достигается путем поэтапного включения однонуклеотидных замен (соматическая гипермутация), приводящих к более широкому разнообразию антител и созреванию аффинности.
[0017] Три CDR-участка в каждой тяжелой и легкой цепях с V-областью демонстрируют наибольшее разнообразие последовательностей. В связи с этим разнообразием, эти участки также называются гипервариабельными участками. Шесть CDR тяжелых и легких цепей критически важны для определения Ag-связывающей специфичности Ab. Поскольку 5'-конец зародышевого типа каждой V-области не располагается внутри гапервариабельного участка, традиционный способ применения прямых праймеров, направленный на последовательности зародышевого типа в этом сайте, не считался проблематичным. Более того, для выявления этих V-областей в человеческих Ab высокой частоты встречаемости, была доказана высокая целесообразность применения этого способа.
[0018] Во время выполнения работ, ведущих к разработке настоящего изобретения, были предприняты попытки выявить Ab низкой частоты встречаемости. Хотя Ab с необходимой специфичностью могли быть выявлены в образцах периферической крови с применением таких методов как ELISA (иммуноферментный твердофазный анализ), когда эти образцы использовали в традиционных способах фагового дисплея, высокоаффинные Ab не могли быть получены. Это общая проблема в индустрии, и поэтому были разработаны комплексные in vitro способы индуцирования мутаций для создания комбинаторных библиотек V-областей. Эти способы являются сложными, трудоемкими и не обязательно приводят к получению антител, которые сохраняют нативные человеческие последовательности.
[0019] Настоящее изобретение проистекает из устранения причин невозможности фаговой системы генерировать высокоаффинные антитела для этих антител низкой частоты встречаемости. Рассматривая предыдущие эксперименты, которые показывали, что (а) существует значительная частота возникновения мутаций относительно зародышевой линии в аминокислотной последовательности, располагающейся на 5'-конце V-областей и (b) две аминокислотные замены в районе V-областей, расположенных за пределами CDR, оказывали значительное влияние на аффинность Ab к Ag, было сделано поразительное наблюдение, касающееся того, что традиционный способ амплифицирования последовательностей V-областей с применением праймеров для последовательностей 5'-конца зародышевого типа привел к созданию библиотек, в которых отсутствовали многие из тех V-областей, которые имеют мутации на их 5'-конце, и также вносил ошибки последовательностей в этом участке в ходе процесса ПЦР. Даже при строгих условиях ПЦР праймеры последовательности зародышевого типа подвергались кросс-гибридизации с V-областями, которые содержат некоторое число соматических мутаций. Таким образом, праймеры, при амплификации V-области, повторяют последовательность зародышевого типа в кДНК. Соматические гипермутации V-области с истинно высокой аффинностью, таким образом, будут утрачены. Важно, что также было обнаружено, что именно эти утраченные V-области, как ожидалось, должны включаться в Ab с наивысшей аффинностью. Первые десять аминокислот в V-области могут содержать и часто содержат соматические гипермутации. Изменение единичной аминокислоты в этой области может повлиять на связывание антител.
[0020] В инновационном подходе, который описывается в данном документе, вместо амплификации V-областей с применением ПЦР-праймеров для последовательностей 5'-концов V-областей, V-области амплифицируют с применением прямых праймеров, специфических по отношению к лидерной последовательности. Поскольку лидерная последовательность располагается чуть выше генов V-области, амплифицируются все последовательности V-области, в том числе с мутациями на 5'-конце. Поэтому получаемая в результате библиотека содержит более полный репертуар V-областей, чем полученная с применением традиционного способа (который приводит к потере всех последовательностей V-области, которые подверглись соматическим гипермутациям). Таким образом, возможно выделить V-области низкой частоты встречаемости, которые подверглись соматическим мутациям. Обратные праймеры могут быть выбраны для того, чтобы амплифицировать все подклассы изотипа Ig (например, гамма, мю, альфа, каппа, лямбда и т.д.) или отдельные подклассы тяжелых цепей (например, гамма 3 или гамма 4) для получения более направленных библиотек.
[0021] Экспрессия нуклеиновых кислот V-области, усиленная с применением праймеров лидерной последовательности, приводит к включению лидерных пептидов в белковый продукт V-области. Когда клетки млекопитающих, такие как СНО-клетки, используются для экспрессии этих нуклеиновых кислот, эндогенные посттрансляционные механизмы процессинга приводят к удалению лидерного пептида, обеспечивая экспрессию конструктов V-области или нескольких V-областей (например, тяжелой и легкой цепей) без лидерных пептидов, которые мешают проведению скрининговых исследований связывания с Ag. Однако при выполнении методов бактериального фагового дисплея лидерные пептиды не удаляются. Наличие лидерных пептидов может нарушать проведение скрининговых исследований связывания с Ag и тем самым предотвратить обнаружение V-областей, обладающих высокой аффинностью к целевому антигену.
[0022] Чтобы преодолеть эту проблему, настоящее изобретение также предусматривает создание второй библиотеки V-областей, которая создается с применением большего набора праймеров для 5'-конца V-области, чем традиционный набор (амплификация "Второго этапа"). Этот больший набор праймеров позволяет амплифицировать большее число последовательностей V-области, по сравнению с количеством, которое амплифицируется с применением традиционного набора праймеров. Конечно, поскольку эти праймеры предназначены для амплификации последовательностей зародышевого типа, а не тех последовательностей, которые подверглись соматическим мутациям, праймеры сами по себе будут вносить ошибки последовательностей в продукты амплификации (т.е. таким образом, что соматические мутации будут удалены и замещены последовательностями зародышевого типа). После применения фагового дисплея для изоляции тех V-областей в фаге, экспрессирующем scFv, которые связывают целевой Ag, нуклеиновые кислоты, кодирующие выявляемые V-области, затем секвенируют. С применением этой информации о последовательности, создают обратные праймеры, которые специфически амплифицируют эти нуклеиновые кислоты, и используют их наряду с прямыми праймерами лидерной последовательности для амплификации V-областей из первой библиотеки для того, чтобы выявить действительные и полные (подвергшиеся соматическим гипермутациям) последовательности Ag-специфических V-областей, которые возникают у донора, на основании которого была создана первая библиотека.
[0023] В дополнение к вышеизложенному, такой подход как протеомика, также используется там, где выделяют IgG плазмы (например, с применением хроматографии с выделением G-белка с последующей Ag-аффинной хроматографией). Полученную в результате Ag-специфическую смесь IgG дополнительно разделяют с применением капиллярного изоэлектрического фокусирования. IgG затем подвергают расщеплению под действием протеаз, а аминокислотные последовательности пептидного фрагмента определяют масс-спектрометрией (MS). В том случае, если амплификация второго этапа не может привести к созданию соответствующих подвергшихся соматической гипермутации последовательностей V-области (т.е. праймеры V-области зародышевого типа не были способны к кросс-гибридизации/отжигу с необходимой последовательностью 5'-конца V-области, которая содержала подвергшуюся соматической мутации последовательность, полученную в результате амплификации в первом цикле), информация, полученная при de novo секвенировании выделенных Ag-специфических IgG может применяться для выполнения секвенирования нуклеиновых кислот продуктов V-области кДНК, полученной на первом цикле. Более определенно, данные частичного секвенирования, полученные на основании de novo секвенирования белка способом MS, используются для конструирования обратных праймеров V-области. Эти обратные праймеры могут применяться вместе с прямыми праймерами лидерной последовательности для выявления и секвенирования 5'-концов V-области. После того, как эти подвергшиеся гипермутациям области выявлены, полные последовательности V-областей могут быть амплифицированы с применением традиционной ПЦР. Эти V-области могут быть собраны в полные, подвергшиеся соматической гипермутации антитела. Информация о последовательности пептида, полученная с применением MS, также может применяться для подтверждения того, что Ag-специфические V-области были корректно выявлены в процессе скрининга библиотеки.
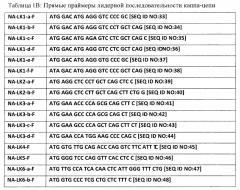
[0024] Соответственно, настоящее изобретение представляет специфические по отношению к лидерной последовательности праймеры для амплификации нуклеиновой кислоты, кодирующей V-область человеческого иммуноглобулина. Праймеры могут включать (а) последовательность нуклеиновой кислоты, которая связывается при строгих условиях гибридизации с комплементарной цепью нуклеотидной последовательности, выбранной из SEQ ID NO:1-76, или (b) последовательность нуклеиновой кислоты, выбранную из SEQ ID NO:1-76.
[0025] В другом аспекте настоящее изобретение представляет набор специфических по отношению к лидерной последовательности праймеров для амплификации по меньшей мере 90% (например, по меньшей мере 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) нуклеиновых кислот, кодирующих V-область человеческого иммуноглобулина в образце человеческой ткани (например, периферической крови). Набор может быть таким, который амплифицирует 100% нуклеиновых кислот, кодирующих V-область человеческого иммуноглобулина в образце человеческой ткани. Набор может включать по меньшей мере 50 различных праймеров, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:1-76. Набор может также включать по меньшей мере 32 различных праймера, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:1-32. Набор может включать по меньшей мере 15 различных праймеров, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:33-48. Набор может включать по меньшей мере 27 различных праймеров, и каждый из различных праймеров может включать отличающуюся последовательность нуклеиновой кислоты, например, одну из SEQ ID NO:49-76.
[0026] Также настоящее изобретение включает фаговую библиотеку, которая содержит по меньшей мере 105 (например, по меньшей мере 105, 106 или 107) молекул нуклеиновых кислот, кодирующих тяжелые цепи иммуноглобулина, содержащих соматические гипермутации в первых 8 аминокислотах вариабельной области.
[0027] Настоящее изобретение дополнительно включает очищенное антитело, которое содержит последовательность вариабельной области, определенную путем скрининга библиотеки фагового дисплея, включая последовательности нуклеиновых кислот, кодирующие вариабельную область, выделенные путем ПЦР-амплификации В-лимфоцитов, выделенных из человеческого субъекта с применением специфических по отношению к лидерной последовательности праймеров.
[0028] В другом аспекте настоящее изобретение представляет способ, который включает этапы (а) применения первой ПЦР для амплификации нуклеотидных последовательностей тяжелых и легких цепей человеческого иммуноглобулина из образца человеческой ткани, содержащей В-лимфоциты, где для ПЦР-амплификации применяют специфические по отношению к лидерной последовательности праймеры; (b) выделения продуктов амплификации, полученных на первом этапе ПЦР; (с) создание первого набора конструктов путем встраивания выделенных продуктов амплификации, полученных на первом этапе ПЦР, в векторы экспрессии; и (d) введения первого набора конструктов в первый набор клеток-хозяев для создания первой библиотеки нуклеотидных последовательностей человеческого иммуноглобулина. В этом способе специфические по отношению к лидерной последовательности праймеры могут включать набор различных полинуклеотидов, каждый из которых связывается при строгих условиях гибридизации с комплементарной цепью отличающейся последовательности нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO:1-76. Способ может также включать один или несколько этапов (е) применения второй ПЦР для амплификации нуклеотидных последовательностей человеческого иммуноглобулина из первой библиотеки или образца человеческой ткани, где для ПЦР-амплификации применяют специфические по отношению к вариабельной области праймеры; (f) выделения второго набора продуктов амплификации, полученных на втором этапе ПЦР; (g) создания второго набора конструктов путем встраивания второго набора выделенных продуктов амплификации в векторы экспрессии; (h) введения второго набора конструктов во второй набор клеток-хозяев для создания второй библиотеки нуклеотидных последовательностей человеческого иммуноглобулина; (i) проведения скрининга второй библиотеки в отношении нуклеотидной последовательности, которая кодирует вариабельную область, которая специфически связывается с целевым антигеном; (j) получения последовательности нуклеотидной последовательности, кодирующую вариабельную область, которая специфически связывается с целевым антигеном; (k) применение полученной информации о последовательности для создания обратного праймера, специфического по отношению к нуклеотидной последовательности, кодирующей вариабельную область, которая специфически связывается с целевым антигеном; и (l) применения обратного праймера и специфических по отношению к лидерной последовательности праймеров на третьем этапе ПЦР для амплификации нуклеотидной последовательности из первой библиотеки, которая соответствует последовательности иммуноглобулина в В-лимфоците в образце человеческой ткани, которая способствует связыванию иммуноглобулина с целевым антигеном. Протеомика также может применяться в способах настоящего изобретения, которые описаны в данном документе.
[0029] Дополнительно настоящее изобретение включает библиотеку кДНК человеческих иммуноглобулинов, которая включает полный набор подвергшихся соматическим гипермутациям последовательностей V-областей.
[0030] Если не указано иное, то все технические термины, которые используются в данном документе, имеют то же значение, которое обычно понимается специалистом в той области техники, к которой относится настоящее изобретение. Обычно подразумеваемые определения биологических терминов можно найти в Rieger et al., Glossary of Genetics: Classical and Molecular, 5th edition, Springer-Verlag: New York, 1991; и Lewin, Genes V, Oxford University Press: New York, 1994. Обычно подразумеваемые определения медицинских терминов можно найти в Stedman's Medical Dictionary, 27th Edition, Lippincott, Williams & Wilkins, 2000.
[0031] Используемый в данном документе термин "антитело" или "АЬ" относится к иммуноглобулину (Ig), раствору идентичных или гетерогенных Ig или смеси Ig. Термин "антитело" также может относиться к фрагментам и сконструированным версиям Ig, таким как Fab, Fab' и F(ab')2 фрагменты; и scFv-фрагменты, гетероконъюгированные Ab и подобные искусственно созданные молекулы, которые задействуют CDR, полученные из Ig, для того, чтобы придать антигенную специфичность. Термином "моноклональное антитело" или "mAb" обозначается Ab, которое экспрессируется одной клональной линией В-клеток, или популяция молекул Ab, которые содержат только один вид антиген-связывающих сайтов, способных к иммунной реакции с определенным эпитопом определенного антигена. Термином "поликлональное антитело" или "поликлональное Ab" обозначают смесь гетерогенных антител. В типичном случае, поликлональное Ab будет включать множество различных молекул Ab, которые связываются с определенным антигеном, и при этом по меньшей мере некоторые из этих различных Ab вступают в иммунную реакцию с различными эпитопами антигена. Как используется в данном документе поликлональное антитело может быть смесью двух или нескольких mAb.
[0032] "Антиген-связывающий фрагмент" Ab содержится внутри вариабельной области Fab-фрагмента Ab и является фрагментом Ab, который придает Ab антиген-специфичность (т.е. типично трехмерный карман, сформированный CDR тяжелых и легких цепей Ab). "Fab-фрагмент" или "Fab область" представляет собой протеолитическую часть расщепляемого папином Ig, которая содержит антиген-связывающий фрагмент этого Ig. ''He-Fab-фрагмент" представляет собой тот фрагмент Ab, который находится вне Fab-фрагмента, например, "Fc-фрагмент" или "Fc-область." "Константная область" Ab представляет собой фрагмент Ab, расположенный вне вариабельной области.
[0033] В отношении белковой молекулы, такой как Ab, термин "очищенный" означает отделенный от компонентов, которые в естественных условиях сопутствуют таким молекулам. Обычно Ab или белок называют очищенным, когда по меньшей мере приблизительно 10% (например, 9%, 10%, 20%, 30% 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99%, 99,9% и 100%) по весу свободно от белков отличных от Ab или других встречающихся в природе органических молекул, с которыми Ab или белок связаны в естественных условиях. Чистоту можно измерить любым подходящим способом, например, путем колоночной хроматографии, электрофореза в полиакриламидном геле или HPLC-анализа. Химически синтезированный белок или другой рекомбинантный белок, продуцирован в типе клеток, отличном от типа клеток, в котором он встречается в природе, является "очищенным".
[0034] Под термином "связывать", "связываться" или "вступать в реакцию с" подразумевают, что одна молекула узнает и присоединяется к определенной второй молекуле в образце, но, по существу, не узнает или присоединяется к другим молекулам в образце. В целом, Ab, которое "специфически связывается" с другой молекулой, имеет Kd более чем приблизительно 103, 106, 107, 108, 109, 1010, 10" или 1012 литров/моль в отношении этой другой молекулы.
[0035] Как используется в данном документе термин "процент идентичности последовательности" по отношению к нуклеиновым кислотам и аминокислотам означает количество точных совпадений между двумя выровненными последовательностями, деленное на длину более короткой последовательности и умноженное на 100. Выравнивание последовательностей нуклеиновых кислот может быть выполнено, как описано в Smith and Waterman, Advances in Applied Mathematics 2:482-489 (1981), а в отношении аминокислотных последовательностей - как описано в Dayhoff, Atlas of Protein Sequences and Structure, M. 0. Dayhoff ed., 5 suppl. 3:353-358, National Biomedical Research Foundation, Washington, D.C., USA, и Gribskov (1986) Nucl. Acids Res. 14:6745. Две последовательности ДНК или две полипептидные последовательности являются "существенно гомологичными" друг другу, когда последовательности проявляют по меньшей мере приблизительно 80%-85%, по меньшей мере приблизительно 85%-90%, по меньшей мере приблизительно 90%-95% или по меньшей мере приблизительно 95%-98% идентичности последовательности в пределах заданной длины молекул, как определено с применением способов, описанных выше. Как используется в данном документе "существенно гомологичные" также относится к последовательностям, демонстрирующим полную идентичность по отношению к указанной последовательности ДНК или полипептидной последовательности. Последовательности ДНК, которые являются существенно гомологичными, могут быть выявлены в эксперименте, включающем Саузерн-гибридизацию, например, при жестких условиях, как определено для этой определенной системы. Определение соответствующих условий гибридизации находится в пределах знаний специалиста в данной области техники. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.; Nucleic Acid Hybridization: A Practical Approach, editors B. D. Hames and S. J. Higgins, (1985) Oxford; Washington, D.C.; IRL Press.
[0036] Как используется в данном документе термин "строгие условия гибридизации" означает гибридизацию в 6× натрия хлорида/натрия цитрата (SSC) при 45°С, с последующим отмыванием в 0,2×SSC, 0,1% SDS при по меньшей мере 60°С.
[0037] Хотя способы и материалы, аналогичные или эквивалентные тем, которые описываются в данном документе, могут применяться в практике или при тестировании настоящего изобретения, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые здесь, включены в полном объеме путем ссылки на них. В случае возникновения конфликта, контрольным документом будет выступать