Способ моделирования ограниченной хронической эмпиемы плевры
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к экспериментальной торакальной хирургии, и может быть использовано для изучения механизмов образования остаточных плевральных полостей и разработки новых методов ликвидации остаточных полостей при хронической эмпиеме в условиях эксперимента. Для моделирования остаточной полости при хронической эмпиеме плевры крысам самцам линии Вистар создают асептическую ограниченную полость путем имплантации стерильного латексного шарика диаметром 0,8-1,0 см, заполненного воздухом и обработанного снаружи 70% раствором этилового спирта с тальком. Шарик фиксируют викриловой лигатурой к грудной стенке. К началу 4-й недели шарик удаляют и инфицируют созданную полость путем введения 0,5 мл взвеси суточной культуры Klebsiella pneumonia 105 КОЕ. Для обеспечения хронизации процесса в течение 10 дней с момента инфицирования проводят терапию, включающую пункции инфицированной полости, промывание ее 1% раствором диоксидина и внутримышечное введение субтерапевтической дозы антибиотика цефазолина в дозе 20 мг/кг 2 раза в сутки. На 38-42 сутки животных выводят из эксперимента. Способ обеспечивает создание модели ограниченной хронической эмпиемы плевры путем хронизации воспалительного процесса при высокой частоте выживаемости животных. 4 ил., 1 табл.
Реферат
Изобретение относится к медицине, к экспериментальной торакальной хирургии, и может быть использовано для изучения механизмов образования остаточных плевральных полостей и разработки новых методов ликвидации остаточных полостей при хронической эмпиеме в условиях эксперимента.
Эмпиема плевры остается актуальной медицинской проблемой из-за значительной заболеваемости, длительной госпитализации больных, повышенного риска смертности. У большей части больных эмпиема плевры возникает из-за воспалительных процессов в легких: на фоне острой пневмонии - 4%, абсцесса легкого - 9-11%, при гангрене легкого - 80-95%, как следствие ранений и травм органов грудной клетки - 6-12% (Чугалина А.Г. с соавт., 2009; Light R.W., 2006). При неэффективности лечения эмпиема плевры приобретает хроническое течение (В.Н. Перепилицын, 1996; В.А. Черкасов с соавт., 2003), создается ригидная остаточная полость, в которой сохраняется гнойный процесс. Задачи хирургического лечения сводятся к устранению очага инфекционного процесса и ликвидации стойкой остаточной плевральной полости (Sahu S.A., 2003; Filardo F.A. et al., 2002; Г.И. Лукомский, 1976; В.Н. Перепилицын, 1996).
Изучение ригидной остаточной плевральной полости важно как для понимания основных механизмов образования самой полости, так и для разработки новых методов лечения этой патологии. В доступной литературе не были обнаружены данные относительно морфологических изменений легких и плевры у экспериментальных животных при хронической эмпиеме плевры.
Уровень техники
Моделирование ограниченной хронической эмпиемы плевры довольно сложный процесс.
Известны способы моделирования острой эмпиемы плевры путем введения инфицированных инородных тел (Саркисов Д.С., Ремезов П.И., 1960) в плевральную полость. Недостатком данного способа является жидкий гной в плевральной полости, а париетальная и висцеральная плевры покрывались фибринозно-гнойным налетом.
Эмпиему плевры создавали путем введения лабораторным животным-кроликам в плевральную полость культуры синегнойной палочки (West J.В., 1998). Данный метод позволяет получить только острую эмпиему и порой процесс носит генерализованный характер, животные часто погибают.
Известен способ двухэтапного создания послеоперационной эмпиемы плевры (Ситко Л.А., Козлов К.К., Папулов В.Г., 1982). После торакотомии плевру обрабатывали тальком, что приводило к образованию спаек между листками плевры, затем через 14 дней выполняли повторную торакотомию с резекцией доли легкого на ограниченном участке. По замыслу в этом месте должна была формироваться ограниченная полость. Но часто полость заполнялась гнойным содержимым; животные трудно переносили реторакотомию и погибали.
Прототип
В качестве прототипа выбран способ моделирования ограниченной туберкулезной эмпиемы плевры (патент SU №1624504 А1), при котором экспериментальному животному после анестезии проводят послойную торакотомию в 6-м межреберье, делают 4-5 подкожно-чрезлегочных шва длиною 2-3 см, обрабатывают 5%-ной настойкой йода и вводят тампон, пропитанный йодолиполом. Через 10-14 дней после вскрытия раны в образовавшуюся полость вводят 25-35 мг микобактерий туберкулеза. Существенным недостатком указанного способа является необходимость введения смеси микобактерий туберкулеза, которые более устойчивы к лекарственной терапии, животные часто погибают, не достигая уровня формирования хронической эмпиемы.
Новизна предлагаемого изобретения заключается в том, что моделируется ограниченная хроническая эмпиема плевры для последующего изучения возможности ликвидации данной патологии новыми лекарственными средствами или хирургическими приемами. Также эта модель позволяет достичь высокой частоты выживаемости при эксперименте.
Раскрытие изобретения
Принципиальным отличием предложенного способа является то, что крысам самцам линии Вистар создают асептическую ограниченную полость плевры путем имплантации стерильного латексного шарика в грудную клетку диаметром 0,8-1,0 см, к началу 4-й недели шарик удаляют и инфицируют созданную полость путем введения 0,5 мл взвеси суточной культуры Klebsiella pneumonia 105 КОЕ, для хронизации процесса в течение 10 дней с момента инфицирования проводят поддерживающую антибиотикотерапию и на 38-42 сутки животных выводят из эксперимента.
Пример получения эксперимента
Основанием для предлагаемого способа являются результаты экспериментального исследования, выполненного на 30 белых крысах самцах линии Вистар, массой 180-220 г. Проведение исследований разрешено локальным этическим комитетом ГБОУ ВПО ОрГМА МЗ России от 01.10.2014 г.
Операции по созданию модели ограниченной хронической эмпиемы плевры в правой половине грудной клетки проводились под эфирным эндотрахеальным наркозом с искусственной вентиляцией легких. Необходимость ИВЛ обусловлена отсутствием герметичного разделения плевральной полости крыс на правую и левую части. Выполнение торакотомии без ИВЛ в таких условиях приводит к коллапсу обоих легких и смерти животного. Интубация проводилась путем введения подключичного катетера диаметром 1,2 мм через отверстие в средней трети трахеи крысы (наложенного под ингаляционным эфирным наркозом), на глубину 0,6-1,0 см. Вентиляция легких проводилась дыхательным объемом 2,5 мл3 с частотой 20-25 вдохов в минуту, аппаратом с открытым контуром.
Выполнялась боковая торакотомия в 7-8 межреберьях справа. Длина разреза составляла 1,5-2,0 см. По вскрытию плевральной полости в реберно-диафрагмальный синус вводился латексный шарик диаметром 1,0 см, заполненный воздухом и обработанный снаружи 70% раствором этилового спирта с тальком. Шарик фиксировался викриловой лигатурой к грудной стенке. После чего производилась реэкспансия легких увеличением дыхательного объема до 4-4,5 мл3, и выполнялось послойное ушивание торакотомической раны непрерывными обвивными викриловыми швами с восстановлением герметичности плевральной полости.
Трахеостомическая трубка извлекалась. Отверстие в трахее при необходимости ушивалось узловыми швами нитью пролен 4/0 на атравматической игле. Рана на нижней поверхности шеи послойно ушивалась непрерывными викриловыми швами.
Имплантирование латексного шарика длилось в течение 3 недель.
Животных выводили из опыта путем передозировки эфира: 1-й серии (создание асептической полости) на 3, 7, 14 и 21 сутки; 2 серии (создание модели хронической эмпиемы плевры) - на 3, 7, 14 и 21 сутки с момента инфицирования. Полученный материал исследовали с использованием обзорных гистологических методов (гематоксилин Майера и эозин по Ван Гизону). Также производили взятие образцов для бактериологического исследования из полости эмпиемы, ткани легкого и крови из полости сердца с определением уровня бактериальной обсемененности. Способность формировать биопленки изолятов K. pneumonia определяли фотометрическим методом у 10 изогенных клонов каждого изолята в трех повторах.
Анализ гистологических препаратов 1-й серии экспериментов показал, что введение в плевральную полость латексного шарика для формирования ограниченной остаточной полости приводит к возникновению воспалительного процесса в тканях легкого, прилежащих к области расположения шарика. В первые трое суток в тканях, контактирующих с латексным шариком, отмечаются явления отека и формирования демаркационно-некротического вала, ограничивающего формирующуюся полость. В зону, окружающую формирующуюся полость, происходит миграция лейкоцитов из сосудов микроциркуляторного русла в результате резкой вазодилятации и усиления экстравазации плазмы и форменных элементов из них. Клеточные элементы, наблюдаемые здесь, представлены в эти сроки гранулоцитами (в основном нейтрофилами и эозинофилами), макрофагами, лимфоцитами.
Наличие зоны некротически измененной ткани и очаговых кровоизлияний отмечалось в течение первой-второй недель.
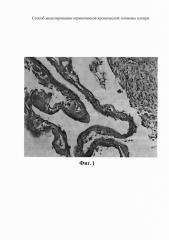
К концу первой недели происходило формирование соединительнотканной капсулы вокруг латексного шарика. Наиболее активно процессы фибриллогенеза в формирующейся капсуле отмечались в течение 2-й и 3-й недель. К началу 4-й недели вокруг латексного шарика была сформирована хорошо выраженная соединительнотканная фиброзная капсула (см. фиг. 1).
Через 20 суток после введения латексного шарика в плевральную полость выполнялся второй этап операции. Формирование к этому сроку ограниченной полости в грудной клетке позволяло проводить операции под ингаляционным эфирным наркозом без искусственной вентиляции легких.
Выполнялась реторакотомия разрезом 0,5-1,0 см, латексный шарик пунктировался шприцом с иглой, воздух из него удалялся. После отсечения лигатуры шарик извлекался из полости. Торакотомическая рана ушивалась непрерывным викриловым швом без оставления дренажей.
В сформированную по вышеописанной методике полость, на стадии 20 суток эксперимента пункционно вводилось 0,5 мл взвеси суточной культуры Klebsiella pneumonia 105 КОЕ (штамм ГИСК №278 из музейной коллекции Института клеточного и внутриклеточного симбиоза УрО РАН). Местное лечение эмпиемы этим животным проводилось традиционным способом - пункциями инфицированной полости, промыванием ее 1% раствором диоксидина и введением внутримышечно антибиотика цефазолина в дозе 20 мг/кг 2 раза в сутки в течение 10 дней. Для стойкого формирования остаточной полости животные наблюдаются 7-10 дней без медикаментозного воздействия после окончания курса приема антибиотиков.
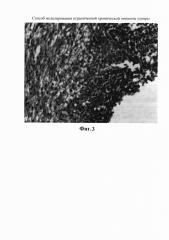
При гистологическом исследовании процесса формирования ограниченной хронической эмпиемы плевры обнаружено, что в ходе формирования ограниченной остаточной полости плевры в образованной соединительнотканной фиброзной капсуле на 3-й сутки после инфицирования наблюдается обширная инфильтрация лейкоцитами, представленными нейтрофилами, лимфоцитами, макрофагами, эозинофилами, также отмечаются микрокровоизлияния и пленки за счет фибринозной экссудации и некробиоза неполноценных грануляций (Фиг. 2).
К 7 суткам эксперимента после инфицирования, на фоне выраженной лейкоцитарной инфильтрации, ближе к поверхности, обращенной в полость эмпиемы, наблюдается активная пролиферация фибробластов, их дифференцировка и синтез ими компонентов межклеточного вещества, прежде всего коллагеновых волокон, что приводит к увеличению толщины капсулы, ограничивающей полость. При этом отмечено постепенное уменьшение лейкоцитарной инфильтрации в более глубоких слоях капсулы (фиг. 3).
К 14 суткам эксперимента после инфицирования и окончания курса приема антибиотиков и местных промываний 1% раствором диоксидина отмечается стихание воспаления, однако в соединительной ткани капсулы сохраняются выраженные диффузные клеточные инфильтраты из лимфоцитов, плазматических клеток, эозинофилов. Это сопровождается усилением пролиферативных процессов клеток фибробластического дифферона, что приводит к завершению формирования в капсуле плотной неоформленной соединительной ткани. В этой стадии толщина стенок полости увеличивается в 2-3 раза (по сравнению с таковой в начале эксперимента по инфицированию). Стенки полости ригидные, плотные, на внутренней поверхности выявляется налет фибрина и гноя (Фиг. 4).
В стенке хронической эмпиемы выявляются два слоя: пиогенный и рубцовый. Пиогенный слой состоит из грануляционной ткани и интимно с ней связанной фибринозно-гнойной пленки. Фибринозные пленки на поверхности пиогенного слоя тонки и немногочисленны. Второй слой образован из рубцовой ткани. Он составляет основную массу стенки полости. Коллагеновые волокна в нем расположены в разных направлениях: либо повторяют ход капилляров, либо они беспорядочно ориентированы или могут идти параллельно поверхности плевры. Волокна в соединительной ткани лежат компактно, в промежутках располагаются немногочисленные капилляры и лимфоклеточные инфильтраты.
При бактериологическом исследовании содержимого полости хронической эмпиемы было установлено, что уровень бактериальной обсемененности K. Pneumonia в срок 3 суток (106 КОЕ/г), и 7 суток (105 КОЕ/г) оставался высоким, т.е. характерным для активно протекающего гнойного процесса. На 21 сутки процесс сопровождается более низким уровнем бактериальной обсемененности (103 КОЕ/г) полости (см. таблицу №1).
К 42 суткам эксперимента (к 21 суткам после инфицирования и окончания курса приема антибиотиков и местных промываний 1% раствором диоксидина) достигался намеченный результат.
Технический результат
Таким образом, предлагаемым способом авторы создают модель ограниченной хронической эмпиемы плевры путем хронизации воспалительного процесса. Возникает асептическая воспалительная реакция в плевре вследствие нахождения в ней инородного тела. Хронизация процесса достигается за счет инфицирования асептической остаточной полости плевры Klebsiella pneumonia и последующего проведения противовоспалительной терапии путем использования антисептика и субтерапевтической дозы антибиотика. Для стойкого формирования ограниченной хронической эмпиемы плевры животные наблюдаются в течение 7-10 дней после проведенной противовоспалительной терапии без медикаментозного воздействия. Экспериментальная модель ограниченной хронической эмпиемы плевры формируется через 38-42 дня от начала эксперимента у всех животных.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Абрамзон О.М. Биологические свойства возбудителей и их коррекция при острых гнойных заболеваниях легких и плевры. Автореф. Дис. д-ра мед. наук. Оренбург, 2004. - с. 18.
2. Атлас грудной хирургии в 2-х томах. Под редакцией академика Петровского Б.В. М.: Медицина 1971, 1974 г., 440 с., 335 с.
3. Кабанов А.Н., Ситко Л.А. Эмпиема плевры. - Иркутск, 2000. - 206 с.
4. Ситко Л.А., Козлов К.К., Папулов В.Г. Моделирование хронической послеоперационной эмпиемы плевры с бронхиальным свищем // Журнал экспериментальной и клинической медицины. 1982. - Т. 22. - №1. - С. 80-82.
5. Саркисов Д.С., Ремезов П.И. Воспроизведение болезней человека в эксперименте. - М., 1960. - 780 с.
6. Цеймах Е.А., Левин А.В., Зимонин П.Е., Самуйленков A.M. Эмпиемы плевры. Частота возникновения, пункционная терапия, закрытое дренирование плевральной полости. Часть I. // Туберкулез и болезни легких. - 2009. - №8. - С. 3-9
7. Filardo F.A., Farensin S.M., Fernandes A.L. Validade de para de pulmonares de cirurgia abdominal alta // Rev. Assoc. Med. Bras. - 2002. - Vol. 48. - №3. - P. 209-216.
8. H. Hamm and R.W. Light Paraneumonic effusions and empyema // European Respiratory Journal. - 1997. - №10. - P. 1150-1156.
9. Light, R.W. Parapneumonic Effusions and Empyema // Proceedings of the American Thoracic Society. - Vol. 3, No. 1. - 2006, pp. 75-80.
10. Sahn S.A. Clinical value of pleural fluid pH // International Pleural Newsletter. – 2003. - Vol. 1, №2. - P. 4-5.
11. West J.B. Pulmonary pathophysiology.- Baltimore: Williams & Wilkins, 1998. - P. 5-13.
12. Патент SU №1624504 A1.
Способ моделирования остаточной полости при хронической эмпиеме плевры путем введения в плевральную полость экспериментального животного инородного тела, отличающийся тем, что крысам самцам линии Вистар создают асептическую ограниченную полость путем имплантации стерильного латексного шарика диаметром 0,8-1,0 см, заполненного воздухом и обработанного снаружи 70% раствором этилового спирта с тальком, который фиксируют викриловой лигатурой к грудной стенке, к началу 4-й недели шарик удаляют и инфицируют созданную полость путем введения 0,5 мл взвеси суточной культуры Klebsiella pneumonia 105 КОЕ, для хронизации процесса в течение 10 дней с момента инфицирования проводят терапию, включающую пункции инфицированной полости, промывание ее 1% раствором диоксидина и внутримышечное введение субтерапевтической дозы антибиотика цефазолина в дозе 20 мг/кг 2 раза в сутки, на 38-42 сутки животных выводят из эксперимента.