Прокаспазная комбинированная терапия при глиобластоме
Иллюстрации
Показать всеГруппа изобретений относится к композиции для комбинированной прокаспазной терапии, содержащей соединение формулы (I) и соединение PAC-1:
;
а также к способу подавления роста и/или пролиферации клеток глиобластомы, олигодендроглиомы или остеосаркомы; к способу индукции апоптоза раковых клеток мозга или костных раковых клеток; к способу лечения рака мозга или костного рака; и к применению композиции для получения медикамента для лечения рака мозга или костного рака. Техническим результатом является синергетическое действие компонентов композиции. 5 н. и 17 з.п. ф-лы, 4 ил., 2 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
В соответствии с параграфом 119(e) Кодекса законов США 35, эта заявка притязает на приоритет в отношении Предварительной патентной заявки США №61/607,103, поданной 6 марта 2012 года, которая включена в этот документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Апоптоз, или запрограммированная смерть клеток, играет центральную роль в развитии и гомеостазе всех многоклеточных организмов. Частым отличительным признаком рака является устойчивость к естественным апоптотическим сигналам. В зависимости от типа рака, эта устойчивость типично вызвана повышением или понижением количества и/или активности ключевых белков в апоптотическом каскаде или мутациями в генах, кодирующих эти белки. Подобные изменения возникают как во внутреннем пути регуляции апоптоза, связанном с митохондриями и каспазой-9, так и во внешнем пути регуляции апоптоза, включающем в себя действие "рецепторов смерти" и каспазы-8. Например, в раковых клетках наблюдалось изменение нормальных уровней белков, например, р53, Bim, Вах, Apaf-1, FLIP и многих других. Эти изменения могут приводить к нарушениям в апоптотическом каскаде, в результате которых исходные проапоптотические сигналы не передаются должным образом по каскаду и не приводят к активации исполнительных каспаз, каспазы-3 и каспазы-7.
Поскольку большинство путей регуляции апоптоза в итоге включают в себя активацию прокаспазы-3, генетические аномалии в их ранее действующих компонентах по существу являются «разрывами» апоптотических сигнальных цепей, и в результате подобные клетки пролиферируют аномально. С учетом центральной роли апоптоза в развитии рака, были предприняты усилия по разработке терапевтических средств, воздействующих на конкретные белки в апоптотическом каскаде. Например, пептидные или небольшие молекулярные биндеры, связывающиеся с членами апоптотического каскада, например, с р53 и белками в семействе Bcl, или с семейством белков-ингибиторов апоптоза (IAP), обладают проапоптотической активностью, как и соединения, способствующие олигомеризации Apaf-1. При этом, однако, поскольку подобные соединения воздействуют на ранние (или на средние и высокие) позиции апоптотического каскада, формы рака с мутациями, воздействующими на белки, находящиеся ближе к концу каскада, чем его вышеупомянутые члены, могут по-прежнему быть устойчивыми к возможным положительным эффектам этих соединений.
Было бы желательно в терапевтических целях выявить небольшие молекулы, которые напрямую активируют проапоптотический белок, радикально задний по ходу в апоптотическом каскаде. Этот подход мог бы затрагивать относительно низкое положение в каскаде, что позволило бы убивать даже те клетки, которые имеют мутации, затрагивающие передние по ходу элементы апоптотического механизма. Более того, подобные терапевтические стратегии имели бы более высокую вероятность успеха, если бы этот проапоптотический белок присутствовал в раковых клетках в повышенных количествах, и/или если бы его активность в них была повышена. Таким образом, идентичность небольших молекул, способных воздействовать на передний по ходу белок-эффектор апоптоза, прокаспазу-3, оказало бы существенную помощь современной противораковой терапии.
Конверсия или активация прокаспазы-3 с образованием каспазы-3 приводит к образованию активной формы каспазы «убийцы», в дальнейшем катализирующей гидролиз многочисленных белковых субстратов. Активная каспаза-3 является гомодимером гетеродимеров и образуется в результате протеолиза прокаспазы-3. Эта протеолитическая активация in vivo типично происходит под действием каспазы-8 или каспазы-9. Для того, чтобы предотвратить преждевременную активацию зимогена (профермента), прокаспаза-3 содержит "предохранительную защелку" из 12 аминокислотных остатков, которая блокирует доступ к сайту протеолиза ETD (аминокислотной последовательности Ile-Glu-Thr-Asp). Эта "предохранительная защелка" дает возможность прокаспазе-3 противостоять автокаталитической активации и протеолизу под действием каспазы-9. Мутагенные исследования показывают, что три последовательных остатка аспарагиновой кислоты, по-видимому, являются критическими компонентами этой "предохранительной защелки". Положение "предохранительной защелки" чувствительно к pH, поэтому, как считается, после закисления внутриклеточной среды (которое возникает во время апоптоза) "предохранительная защелка" открывает доступ к сайту протеолиза, и активная каспаза-3 может образовываться либо под действием каспазы-9, либо с помощью механизма самоактивации.
В определенных типах рака уровни прокаспазы-3 повышены по сравнению с нормальными тканями. Исследование первичных изолятов от 20 пациентов с раком толстой кишки показало, что в среднем количество прокаспазы-3 в подобных изолятах было повышено в шесть раз по сравнению с соседними нераковыми тканями. Кроме того, уровень прокаспазы-3 повышен в некоторых нейробластомах, лимфомах и некоторых видах рака печени. Кроме того, была проведена систематическая оценка уровней прокаспазы-3 в панели из 60 клеточных линий, используемой при скрининге на рак в Экспериментальной Терапевтической Программе Национального института рака США (NCI), которая показала, что некоторые виды рака легких, рака почек, рака молочных желез и меланом демонстрируют значительно повышенные уровни экспрессии прокаспазы-3.
Вследствие роли активной каспазы-3 в осуществлении апоптоза, относительно высоких уровней прокаспазы-3 в некоторых типах раковых клеток и интригующего механизма подавления ее самоактивации с помощью "предохранительной защелки", небольшие молекулы, которые напрямую модифицируют прокаспазу-3, могут найти самое широкое применение в таргетной противораковой терапии.
Комбинированная терапия стала стандартным подходом при лечении раковых пациентов. Целью режимов применения лекарственных коктейлей при проведении комбинированной терапии является достижение синергического или аддитивного эффекта между используемыми химиотерапевтическими средствами, что должно способствовать сокращению длительности лечения, снижению их токсичности и повышению выживаемости пациентов. Лекарственные средства, воздействующие на один определенный биохимический путь, являются особенно подходящими кандидатами для синергии или потенциации, поскольку их действие может имитировать «синтетические летальные» генетические комбинации. Например, ингибиторы полимеразы-1 поли(АДФ-рибозы) (PARP-1), фермента, способствующего исправлению повреждений ДНК, потенциально способны давать синергический эффект при их использовании в комбинации со средствами, повреждающими ДНК, как это было показано на клеточных культурах, на животных моделях и в клинических испытаниях на людях. Однако при лечении многих форм рака по-прежнему существует потребность в более эффективных способах лечения, и новые синергические комбинации противораковых лекарственных средств помогут в достижении этой цели. Соответственно, существует потребность в выявлении новых цитотоксических средств, которые эффективно убивают раковые клетки и в то же время защищают нормальные ткани пациента от нежелательного токсического действия цитотоксического средства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В широком смысле это изобретение описывает соединения, композиции и способы терапевтического лечения. В различных способах осуществления изобретение применимо для лечения различных раковых заболеваний и различных типов раковых клеток, в частности, рака молочных желез, лимфом, рака надпочечников, рака почек, меланом, лейкемий, нейробластом, рака легких, опухолей мозга и других известных науке. В настоящем изобретении описываются, в числе прочего, композиции и способы, включающие использование, небольших молекул, способных индуцировать смерть клеток. В некоторых воплощениях эти композиции и способы включают в себя использование соединений, способных прямо или опосредованно взаимодействовать с членами путей регуляции запрограммированной смерти клеток, например, прокаспазой-3. В некоторых воплощениях эти композиции и способы обладают пониженной нейротоксичностью по сравнению с другими соединениями, которые прямо или опосредованно взаимодействуют с членами путей регуляции запрограммированной смерти клеток, например, с прокаспазой-3.
Комбинированная противораковая терапия может состоять из лекарственных средств, воздействующих на различные биохимические пути или на различные мишени в пределах одного пути, имитируя синтетические летальные генетические комбинации. Комбинация активатора прокаспазы-3 РАС-1 и алкилирующего средства темозоломид (TMZ) демонстрирует значительный синергический эффект в отношении индукции апоптотической смерти раковых клеток, в степени, значительно превосходящей аддитивное действие. Комбинация РАС-1 и TMZ эффективно снижает опухолевую нагрузку в опухолевых моделях, в которых эти соединения сами по себе дают лишь минимальный эффект или вообще не дают никакого эффекта. Эти данные свидетельствуют об эффективности комбинации РАС-1 /TMZ в лечении рака, и, в более широком смысле, демонстрируют, что эта синергическая комбинация может обеспечивать значительно более благоприятные результаты лечения.
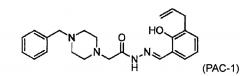
Соответственно, в настоящем изобретении предложено использовать композицию, включающую в себя (а) соединение формулы (I):
;
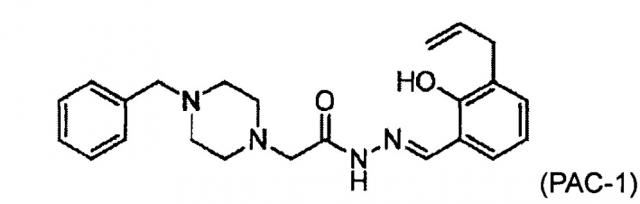
(b) соединение РАС-1:
;
и (с) фармацевтически приемлемый разбавитель, наполнитель или носитель. Соединение Формулы (I) может быть темозоломидом (TMZ). В других воплощениях структура соединения с Формулой (I) может быть заменена производным TMZ или его предлекарственной формой. Носитель может включать в себя воду и вспомогательные компоненты для улучшения доставки активных веществ, например, буфер, сахар, циклодекстрин или их различные комбинации. В одном из способов осуществления этого изобретения циклодекстрин является 2-гидроксипропил-β-циклодекстрином.
Концентрация соединения Формулы I может составлять от приблизительно 100 мкМ до приблизительно 1 мМ, обычно приблизительно 250 мкМ, приблизительно 500 мкМ или приблизительно 750 мкМ. Концентрация РАС-1 может быть от приблизительно 2 мкМ до приблизительно 50 мкМ, обычно приблизительно 2,5 мкМ, приблизительно 5 мкМ, приблизительно 7,5 мкМ, приблизительно 10 мкМ, приблизительно 12,5 мкМ, приблизительно 15 мкМ, приблизительно 20 мкМ, приблизительно 25 мкМ, приблизительно 30 мкМ, приблизительно 40 мкМ или приблизительно 50 мкМ. Например, в одном из способов осуществления настоящего изобретения концентрация соединения Формулы I может быть от приблизительно 250 мкМ до приблизительно 750 мкМ, а концентрация РАС-1 может быть от приблизительно 5 мкМ до приблизительно 30 мкМ.
В настоящем изобретении также предложен способ подавления роста и/или пролиферации раковых клеток. Этот способ включает в себя воздействие на раковые клетки эффективным количеством композиции, описанной в настоящем изобретении, причем эта композиция может включать РАС-1, TMZ или их комбинацию. Когда композиция включает в себя только РАС-1 или только TMZ, вышеупомянутый способ в дальнейшем включает в себя воздействие на раковые клетки другим веществом из этой пары. Воздействие на раковые клетки этими активными веществами (РАС-1 и TMZ) подавляет рост и/или пролиферацию этих клеток.
Кроме того, в настоящем изобретении также предложен способ индукции апоптоза в раковых клетках, включающий в себя воздействие на раковые клетки эффективным количеством соединения Формулы (I):
;
и эффективным количеством соединения РАС-1:
;
отличающийся тем, что это приводит к индукции апоптоза в раковых клетках. Это воздействие может осуществляться in vitro или in vivo. В одном из способов осуществления настоящего изобретения на раковые клетки можно одновременно воздействовать и соединением Формулы (I), и РАС-1. В другом способе осуществления изобретения воздействие на раковые клетки соединением Формулы (I) может осуществляться до воздействия на эти клетки РАС-1. В еще одном способе осуществления изобретения воздействие на раковые клетки РАС-1 может осуществляться до воздействия на эти клетки соединением Формулы (I).
В настоящем изобретении также предложен способ лечения рака у пациента, которому необходимо такое лечение. Этот способ включает в себя введение пациенту, одновременное или последовательное, терапевтически эффективного количества соединения Формулы (I):
;
и эффективного количества соединения РАС-1:
;
и отличается тем, что это приводит к лечению рака. В одном из способов осуществления настоящего изобретения соединение Формулы (I) и соединение РАС-1 могут вводиться пациенту одновременно. В другом его воплощении соединение с Формулой (I) и соединение РАС-1 вводятся последовательно. При последовательном введении соединение Формулы (I) может вводиться перед соединением РАС-1, или соединение с Формулой (I) может вводиться после соединения РАС-1.
В различных способах осуществления настоящего изобретения раковые клетки могут являться раковыми клетками в мозговой ткани или раковыми клетками в костной ткани. Например, раковые клетки могут быть клетками глиобластомы или клетками олигодендроглиомы. В другом способе осуществления настоящего изобретения раковые клетки могут быть клетками остеосаркомы. Другие типы раковых клеток, рост и/или пролиферация которых могут ингибироваться, и раковые заболевания, которые можно лечить, дополнительно описаны ниже.
Таким образом, это изобретение позволяет использовать описанные в нем композиции в медикаментозной терапии. Эта терапия может быть направлена на лечение рака, например, рака молочных желез, рака легких, рака поджелудочной железы, рака простаты, рака толстой кишки и других типов рака, содержащихся в настоящем изобретении. Это изобретение также позволяет использовать описанную в нем композицию для производства медикаментов для лечения заболеваний у млекопитающих, например, рака у людей. Таким образом, это изобретение позволяет использовать описанные в нем соединения для производства медикаментов, которые могут быть полезными при лечении рака у млекопитающих, в частности, у людей. Эти медикаменты могут включать в себя фармацевтически приемлемые разбавители, наполнители и/или носители.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Приведенные ниже чертежи являются частью описания изобретения; они включены для того, чтобы дополнительно продемонстрировать определенные способы осуществления или различные аспекты настоящего изобретения. В некоторых случаях способы осуществления изобретения могут быть наилучшим образом поняты после изучения прилагающихся чертежей в сочетании с их полным описанием, представленным в этом документе. Описания и прилагаемые чертежи могут подчеркивать определенный конкретный пример или определенные аспекты настоящего изобретения. Однако специалист в данной области поймет, что частично такой пример или такие аспекты могут использоваться в комбинации с другими примерами или аспектами настоящего изобретения.
Фиг. 1. РАС-1 оказывает синергическое действие с TMZ на увеличение длительности выживания в крысиной модели глиобластомы: График выживания в четырех группах сингенных модельных крыс, которым интракраниально были имплантированы клетки линии 9L (крысиной глиомы). РАС-1 (50 мг/кг в воде) вводился через оральный зонд в дни 0-4, а TMZ (50 мг/кг в воде) вводился через оральный зонд в дни 5-9; 8 точек на группу. Р-значение вычислялось только относительно применения TMZ. Медианное время выживания: Контроль, 14,5 дней; РАС-1, 13,5 дней; TMZ, 20 дней; Комбинация, 28 дней. Общее р-значение для графика для комбинации было р=0,0001. Только TMZ по отношению к Комбинации, р=0,0007 (логарифмический ранговый критерий) и р=0,001 (критерий Гехана-Бреслоу-Уилкоксона).
Фиг. 2. РАС-1 оказывает синергическое действие с TMZ при индукции смерти клеток глиобластомы в культуре. А) Глиобластомные клетки линии 9L были подвернуты воздействию указанных концентраций РАС-1+TMZ, и через 48 часов проводилась оценка смерти клеток (отсутствие обнаруживаемой смерти клеток при 0 мкМ TMZ с 0 мкМ РАС-1). В) Человеческие глиобластомные клетки линии D-54 были подвернуты воздействию указанных концентраций РАС-1+TMZ, и через 24 часа проводилась оценка смерти клеток (отсутствие обнаруживаемой смерти клеток при 0 мкМ TMZ с 0 мкМ РАС-1). Горизонтальными пунктирными линиями указаны уровни смерти клеток, ожидаемые при чисто аддитивном эффекте от воздействия соединений. Подписи соответствуют столбцам на столбчатой диаграмме - верхняя подпись соответствует самому левому столбцу, а остальные подписи соответствуют оставшимся столбцам, при этом их расположение сверху вниз соответствует расположению столбцов слева направо.
Фиг. 3. РАС-1 оказывает синергическое действие с TMZ при индукции смерти клеток остеосаркомы в культуре. А) Клетки линии HOS были подвернуты воздействию указанных концентраций РАС-1+TMZ, и через 24 часа проводилась оценка смерти клеток (отсутствие обнаруживаемой смерти клеток при 0 мкМ TMZ с 0 мкМ РАС-1). В) Клетки линии 143 В были подвернуты воздействию указанных концентраций РАС-1+TMZ, и через 24 часа проводилась оценка смерти клеток (отсутствие обнаруживаемой смерти клеток при 0 мкМ TMZ или 250 мкМ TMZ с 0 мкМ РАС-1). Подписи соответствуют столбцам на столбчатой диаграмме - верхняя подпись соответствует самому левому столбцу, а остальные подписи соответствуют оставшимся столбцам, при этом их расположение сверху вниз соответствует расположению столбцов слева направо.
Фиг. 4. РАС-1 оказывает синергическое действие с TMZ на увеличение длительности выживания в мышиной модели метастатической остеосаркомы. Через семь дней после инъекции клеток K7M2 мыши получали лечение оральным введением РАС-1 (100 мг/кг в ΗΡβCD), TMZ (50 мг/кг орально с подслащением) или последовательное лечение обоими соединениями ежедневно в течение пяти последовательных дней; n=8 мышей на группу.
ПОЛНОЕ ОПИСАНИЕ
В качестве дополнительного введения были открыты соединения, способные активировать фермент, который часто сверхэкспрессируется или просто присутствует в повышенных количествах в его неактивной форме в раковых клетках. Эти соединения способны индуцировать запрограммированную смерть клеток (апоптоз) в раковых клетках, включая те из них, в которых имеются повышенные уровни прокаспазы-3 или ее повышенная активность. Многие типы рака устойчивы к стандартной химиотерапии. Комбинированная терапия, описанная в настоящем изобретении, основана на активации прокаспазы-3 под действием РАС-1, которая дает синергический эффект в сочетании со способностью ΤΜΖ к алкилированию ДНК, для обеспечения эффективности лечения в условиях, когда одно из активных соединений в одиночку было бы менее эффективно или совершенно неэффективно. Эти соединения могут также успешно применяться в таргетной противораковой терапии, где они могут обеспечивать преимущества в виде селективного убийства раковых клеток при сравнительно слабых отрицательных побочных воздействиях на нераковые клетки с более низкими уровнями прокаспазы-3. Эти отрицательные побочные действия могут включать в себя токсичность, в частности, нейротоксичность.
Комбинация соединений, композиций и способов, описанных в настоящем изобретении, может оказывать действие путем модуляции апоптоза или запрограммированной смерти клеток и алкилирования ДНК для обеспечения эффективности при лечении раковых клеток. В одном из способов осуществления настоящего изобретения модуляция апоптоза осуществляется с помощью индукции или активации апоптоза. В различных способах осуществления настоящего изобретения введение соединений может быть одновременным или, вместо этого, последовательным.
Таким образом, в настоящем изобретении предложены способы потенциации действия темозоломида (TMZ) с помощью РАС-1, например, для лечения глиобластом или остеосарком. Во время апоптоза зимогенная форма прокаспазы-3 активируется с помощью протеолиза с образованием каспазы-3, и эта активная каспаза-3 затем расщепляет большое количество клеточных субстратов, осуществляя программу апоптоза. Поскольку уровни белка прокаспазы-3 повышены в опухолях различных гистологических типов, прямая активация прокаспазы-3 с помощью лекарственных средств может быть высокоэффективной стратегией селективного противоракового лечения.
Некоторые соединения могут усиливать активность прокаспазы-3 и ее способность к самоактивации и индуцировать апоптоз в раковых клетках. РАС-1 (активирующее прокаспазу соединение-1) повышает активность прокаспазы-3 за счет образования хелатных комплексов с ионами цинка, обладающими ингибирующими свойствами, индуцирует апоптоз в раковых клетках в культуре и обладает эффективностью в многочисленных мышиных моделях опухолей. Было выявлено, что новая комбинация терапевтических средств, РАС-1 и TMZ характеризуется синергической эффективностью при лечении раковых клеток, в особенности глиобластомных клеток и остеосаркомных клеток.
Модельные эксперименты с использованием клеточной линии 9L крысиной глиобластомы дали результаты, четко подтверждающие данные о синергическом действии и эффективной активности этой комбинации лекарственных средств. В этих экспериментах на крысах in vivo использовались клетки линии 9L, очень агрессивной опухолевой модели, имплантировавшиеся интракраниально крысам в трех группах, получавших в качестве лечения только РАС-1, только TMZ и комбинацию РАС-1 и TMZ, соответственно, и одной контрольной группе.
РАС-1 суспендировался в воде и вводился крысам через оральный зонд в дозировке 50 мг/кг (относительно низкая доза) на протяжении 5 дней, после чего на протяжении 5 последующих дней крысы получали дозы TMZ. При использовании РАС-1 на мышах признаков нейротоксичности не наблюдалось при оральном введении этого соединения в дозировках до 200 мг/кг, и в одноразовых экспериментах по его введению нейротоксичности тоже не наблюдалось. Повышение выживаемости у крыс, получавших лечение этой комбинацией, было значительным и неожиданно сильно выраженным (см. Фиг. 1).
На Фиг. 1 схематично представлены данные, полученные после интракраниальной имплантации крысам клеток линии 9L. РАС-1 (50 мг/кг в воде) вводился через оральный зонд в дни 0-4, а TMZ (50 мг/кг в H2O) вводился через оральный зонд в дни 5-9. В каждой группе было по 8 крыс; было получено р-значение р = 0,001 относительно применения только TMZ (критерий Гехана-Бреслоу-Уилкоксона).
Начальная оценка для IC50 для РАС-1 и клеток линии 9L составила около 7 мкМ (72 ч эксперимент). Мозговые опухоли из клеток линии 9L обычно являются геморрагическими, но у крыс, прошедших лечение РАС-1ДМг, эти опухоли не были геморрагическими, что указывает на наличие антиангиогенного эффекта.
На Фиг. 2 показаны три примера синергического действия РАС-1 и TMZ при индукции смерти глиобластомных клеток в культуре. На Фиг. 3 показаны два примера синергического действия РАС-1 и TMZ при индукции смерти остеосаркомных клеток в культуре. На Фиг. 4 показан пример синергического действия РАС-1 и TMZ на увеличение длительности выживания в мышиной модели метастатической остеосаркомы.
Максимальная переносимая доза для комбинации PAC-1/TMZ устанавливается, и проводится оценка применения более длительных периодов лечения (10 дней одновременного введения обоих лекарственных средств) и использования режимов их последовательного и одновременного введения. В качестве меры уровней прокаспазы-3 и каспазы-3 до и после лечения проводится оценка улучшения выживания. Комбинационная терапия также может быть эффективной при лечении нейросферических клеточных линий, полученных от пациентов с глиобластомой Хопкинса, например, в моделях ксенотрансплантатов и на модельных млекопитающих.
Терапевтические средства и их активность
РАС-1
(2-(4-бензилпиперазин-I-ил)-N-[(2-гидрокси-3-проп-2-енилфенил)метилиденамино]ацетамид) селективно индуцирует апоптоз в раковых клетках. Способы получения РАС-1 описаны в Публикации патента США №2012/0040995 (Hergenrother et al. / Хергенротер и др.).
Темозоломид (TMZ) является цитотоксическим химиотерапевтическим лекарственным средством, классифицируемым как алкилирующее средство. TMZ является производным имидазотетразина, а также является пролекарственной формой 3-метил-(триазен-1-ил)имидазол-4-карбоксамида (MTIC). Получение TMZ и его производных описано в Патенте США №5,260,291 (Lunt et al.)
Терапевтическое действие темозоломида основано на его способности алкилировать/метилировать ДНК в положениях N-7 или 0-6 гуаниновых оснований. Это метилирование повреждает ДНК и вызывает смерть опухолевых клеток. Некоторые опухолевые клетки способны исправлять повреждения ДНК этого типа, и это снижает терапевтическую эффективность темозоломида. Механизм подобной устойчивости может заключаться в экспрессии белков O-6-метилгуанин-ДНК метилтрансферазы (MGMT) или O-6-алкил гуанин-ДНК алкилтрансферазы (AGT или AG AT). Присутствие белка O-6-метилгуанин-ДНК метилтрансферазы (MGMT) в опухолях мозга определяет слабый иммунный ответ на применение темозоломида, и такие пациенты получают малую пользу от химиотерапии с использованием темозоломида. Соответственно, для лечения опухолей мозга и родственных им состояний необходимы новые способы лечения.
TMZ применяется для лечения четвертой стадии астроцитомы VI степени, также известной как мультиформная глиобластома, агрессивной опухоли мозга, а также олигодендроглиомных опухолей мозга. TMZ также применяется для лечения меланомы, и он дополнительно показан при лечении анапластической астроцитомы III степени в состоянии ремиссии.
Хотя имеется очевидная польза для стратегий противоракового лечения, использующих комбинации лекарственных средств, которые воздействуют на различные мишени, работа, описанная в настоящем изобретении, демонстрирует, что при использовании соединений, действующих через совершенно различные механизмы, может наблюдаться крайне сильный эффект синергии. Этот многоцелевой подход к терапии может приносить особенные преимущества в том случае, когда его целью является активация фермента.
Применение РАС-1 безопасно у млекопитающих, и производное РАС-1 было эффективным в клиническом испытании фазы I на домашних собаках с лимфомами (Peterson et al., Cancer Res 70, 7232-7241 (2010) / Питерсон и др., Исследование рака, 2010. Т. 70, стр. 7232-7241), поэтому наблюдаемая синергия при использовании в сочетании с TMZ должна дать значительный клинический эффект. Интерес к активации ферментов с помощью небольших молекул быстро возрастает. Данные, описанные в настоящем изобретении, свидетельствуют, что стратегии целенаправленного воздействия с использованием РАС-1 и TMZ являются общим подходом, позволяющим многократно усилить предполагаемый биологический эффект, и они должны дать значительный клинический эффект благодаря их эффективности.
Способы, предлагаемые в изобретении
В настоящем изобретении предложены способы селективной индукции апоптоза в раковых клетках, включающие в себя воздействие на раковые клетки комбинацией соединений, способной модифицировать молекулы прокаспазы-3 в этих раковых клетках, отличающиеся тем, что эта комбинация соединений является комбинацией РАС-1 и TMZ. Также предложен способ селективной индукции апоптоза в раковых клетках, включающий в себя воздействие на раковые клетки комбинацией соединений, способной модифицировать молекулы прокаспазы-3 в раковых клетках, отличающийся тем, что эта комбинация соединений является комбинацией РАС-1 и TMZ, и, например, отличающийся тем, что эти раковые клетки находятся в организме пациента, нуждающегося в лечении.
Настоящее изобретение предлагает дополнительные способы, в которых упоминавшаяся выше комбинация соединений является комбинацией РАС-1 и TMZ, и, например, используется в качестве способа лечения раковой клетки, включающего в себя (а) выявление потенциальной чувствительности к лечению раковых клеток с использованием соединения-активатора прокаспазы; и (b) воздействие на раковые клетки эффективным количеством комбинации соединения-активатора прокаспазы и TMZ. Настоящее изобретение также предлагает способ лечения раковой клетки, включающий в себя (а) выявление потенциальной чувствительности к лечению раковых клеток с использованием соединения-активатора прокаспазы; и (b) воздействие на раковые клетки эффективным количеством РАС-1 и TMZ, отличающийся тем, что РАС-1 способно, по меньшей мере, одну из прокаспаз, прокаспазу-3 и/или прокаспазу-7. Настоящее изобретение также предлагает способ индукции смерти раковых клеток (т.е. их убийства), включающий в себя воздействие на раковые клетки TMZ и соединением, способным активировать молекулы прокаспазы-3 в этих раковых клетках.
Настоящее изобретение также описывает медикамент, включающий в себя эффективное количество комбинации РАС-1 и TMZ. Этот медикамент может использоваться в способе индукции апоптоза в клетках. В некоторых способах осуществления настоящего изобретения эта комбинация соединений не проходит сквозь гематоэнцефалический барьер в степени, способной вызывать заметные нейротоксические эффекты у пациента. Способы, предлагаемые в настоящем изобретении, включают в себя контакт одной или нескольких клеток с эффективным количеством комбинации соединений, описанных в настоящем изобретении, in vivo или in vitro. Таким образом, настоящее изобретение также предлагает способы лечения клеток, включающие в себя воздействие на эти клетки эффективным количеством комбинации соединений, описанных в настоящем изобретении.
Определения
При использовании в настоящем документе перечисленные ниже термины имеют указанные далее значения. Все прочие термины и фразы, используемые в данном описании, имеют свои обычные значения, понятные специалистам в данной области. Эти обычные значения можно найти в технических словарях, например, в Hawley's Condensed Chemical Dictionary 14th Edition, by R.J. Lewis, John Wiley & Sons, New York, N.Y., 2001 (Кратком химическом словаре Хоули, 14-я редакция, под редакцией Р.Дж. Льюиса, издательство "Джон Уайли и сыновья", Нью-Йорк, штат Нью-Йорк, 2001).
Ссылки в описании на "один из способов осуществления", "способ осуществления" и т.д. указывают, что описанный способ осуществления может включать в себя определенный аспект, особенность, структуру, группу или характеристику, однако не обязательно, что каждый из способов осуществления обязательно должен включать в себя этот аспект, особенность, структуру, группу или характеристику. Более того, подобные фразы могут ссылаться на тот же способ осуществления, который упоминается в других частях настоящего описания, однако это не обязательно так. Кроме того, когда определенный аспект, особенность, структура, группа или характеристика описывается в связи с каким-либо способом осуществления, специалист в данной области должен быть способны отразить или связать этот аспект, особенность, структуру, группу или характеристику с другими способами осуществления, независимо от того, описаны ли они явно или нет.
Существительные в единственном числе также включают в себя соответствующие существительные во множественном числе, и наоборот, за исключением случаев, когда из контекста четко следует обратное. Таким образом, термин "соединение" может также подразумевать множество подобных соединений, т.е. под соединением X может подразумеваться множество соединений типа X. Необходимо дополнительно отметить, что элементы формулы изобретения могут быть сформулированы таким образом, чтобы исключить любые опциональные элементы. Таким образом, это утверждение предназначено для того, чтобы служить в качестве антецедентного основания для использования исключительной терминологии, например, "исключительно", "только" и т.п., в связи с перечислением элементов формулы изобретения или использованием "отрицательных" ограничений.
Термин "и/или" означает любой из далее перечисленных вариантов, любую их комбинацию или их всех. Фраза "один или более" легко понятна для специалистов в данной области, в особенности, в контексте ее использования. Например, "одна или более замещающая группа на фенильном кольце" может подразумевать от одной до пяти замещающих групп или, например, от одной до четырех, если две его связи уже участвуют в образовании основных структурных связей.
Термины "около" и "приблизительно" могут означать вариацию ±5%, ±10%, ±20% или ±25% относительно указанного далее значения. Например, "около 50%" в некоторых способах осуществления настоящего изобретения может означать вариацию от 45% до 55%. Для целочисленных диапазонов термины "около" и "приблизительно" могут означать вариацию их границ в большую или меньшую сторону на одну или две единицы относительно их указанных значений. Если в данном описании не оговорено иное, в данном документе термины "около" и "приблизительно" могут подразумевать значения, например, весовых процентов, примыкающие к указанным диапазонам, эквивалентные им в контексте функциональности индивидуальных ингредиентов, композиции или способа осуществления.
Опытным специалистам будет понятно, что все числа, включая те, что выражают количества ингредиентов, свойства (например, молекулярную массу), условия реакции и т.д., являются приближенными значениями, и подразумевается, что во всех случаях они опционально дополнены терминами "около" и "приблизительно". Эти значения могут варьироваться в зависимости от того, каких необходимых свойств пытаются достичь специалисты в данной области при использовании сведений из описания данного изобретения. Также подразумевается, что подобным значениям заведомо присуща изменчивость, автоматически возникающая на основе стандартных отклонений при проведении соответствующих тестовых измерений.
Как будет понятно специалистам в этой области, во всех случаях, особенно в случае предоставления письменного описания, все диапазоны, указанные в настоящем изобретении, также включают в себя любые их возможные поддиапазоны и их комбинации, а также индивидуальные значения, составляющие эти диапазоны, в особенности целочисленные значения. Указанный диапазон (например, весовых процентов или углеводородных групп) включает в себя каждое конкретное значение, целое число, десятичную дробь или член в пределах этого диапазона. Можно легко понять, что любой указанный диапазон в достаточной мере описывает его содержимое, и этот диапазон может быть разбит, по меньшей мере, на равные половины, трети, четверти, пятые доли или десятые доли. В качестве примера, не имеющего ограничительного характера, каждый диапазон, обсуждаемый в настоящем изобретении, может быть легко подразделен на его нижнюю треть, среднюю треть и верхнюю треть, и т.д. Как будет понятно специалистам в этой области, все термины, подобные "вплоть до", "по меньшей мере", "больше чем", "меньше чем", "более чем", "или более" и т.п., включают в себя указанные числа, и подобные термины обозначают диапазоны, которые в дальнейшем могут подразделяться на поддиапазоны, как это было обсуждено выше. Аналогичным образом, все соотношения, указанные в настоящем изобретении, также включают с себя все прочие соотношения, попадающие в пределы исходного более широкого соотношения.
Соответственно, конкретные значения, указываемые для радикалов, заместителей и диапазонов, приводятся исключительно в иллюстративных целях, и они не исключают другие определенные значения или иные значения в пределах указанных диапазонов для радикалов и заместителей.
Специалисты в этой области также смогут легко понять, что когда члены сгруппированы неким общим образом, например, в форме группы Маркуша, то изобретение включает в себя не только всю указанную группу в целом, но и каждый член этой группы по отдельности, а также все возможные подгруппы основной группы. Кроме того, во всех отношениях, это изобретение включает в себя не только основную группу,