Нацеленные/иммуномодулирующие слитые белки и способы их получения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению слитых белков, ингибирующих пролиферацию раковых клеток, что может быть использовано в медицине. Рекомбинантным путем получают химерный слитый белок, содержащий направляющую группировку для нацеливания на раковую клетку, иммуномодулирующую группировку, противодействующую иммунной толерантности раковых клеток, и аминокислотный спейсер. Изобретение позволяет повысить эффективность лечения раковых заболеваний. 4 н. и 5 з.п. ф-лы, 65 ил., 1 табл., 12 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Заявка притязает на приоритет заявки на патент Индии №1689/СНЕ/2012, поданной 30 апреля 2012 г., и заявки на патент Индии №1690/СНЕ/2012, поданной 30 апреля 2012 г., содержание которых, таким образом, включено сюда посредством ссылки для любых задач.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится, в целом, к области получения слитых белков для использования в терапии рака и, конкретнее, к нуклеотидным последовательностям, кодирующим слитые белки, где слитые или химерные полипептиды содержат по меньшей мере одну направляющую группировку и по меньшей мере одну иммуномодулирующую группировку, противодействующую иммунной толерантности раковых клеток.
Предшествующий уровень техники
Иммунная система обеспечивает организму человека средства для распознавания и защиты от микроорганизмов и веществ, распознаваемых как чужеродные или потенциально вредные. В то время как пассивная иммунотерапия рака моноклональными антителами и пассивным переносом Т-клеток, атакующих раковые клетки, продемонстрировали клиническую эффективность, задача активной терапевтической вакцинации, заключающаяся в индуцировании этих иммунных эффекторов и формировании иммунологической памяти против опухолевых клеток, остается трудновыполнимой. Идентифицировано несколько опухолеспецифических и опухоль-ассоциированных антигенов, но эти антигены обычно обладают слабой иммуногенностью, и опухоли используют различные механизмы для создания среды, вызывающей толерантость, позволяющей им избегать иммунологической атаки. Способы преодоления такой иммунной толерантности и активации высоких уровней антител и/или Т-клеточных ответов являются ключевыми для эффективной иммунотерапии рака. Еще важнее, необходимо исследовать отдельные белки и пути создания активного химерного полипептида с активной третичной структурой.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложены полинуклеотиды, а также кодируемые ими полипептиды, экспрессируемые в раковых клетках. Эти полинуклеотиды и экспрессируемые полипептиды полезны во множестве терапевтических способов лечения рака. Согласно настоящему изобретению также предложены способы уменьшения роста раковых клеток посредством противодействия иммунной толерантности раковых клеток, где Т-клетки остаются активными и ингибируют рекрутинг Т-регуляторных клеток, которые, как известно, подавляют ответ иммунной системы на опухоль. Таким образом, химерные полипептиды, образованные полинуклеотидными последовательностями по настоящему изобретению, полезны для лечения рака, благодаря экспрессированным слитым или химерным полипептидам.
В одном аспекте согласно настоящему изобретению предложены химерные полипептиды, содержащие по меньшей мере одну направляющую группировку для нацеливания на раковую клетку и по меньшей мере одну иммуномодулирующую группировку, противодействующую иммунной толерантности раковой клетки, где направляющая группировка и иммуномодулирующая группировка соединены аминокислотным спейсером с достаточной длиной, измеряемой количеством аминокислотных остатков, так, что обе группировки могут успешно связываться с их отдельными мишенями. Альтернативно, направляющая группировка и иммуномодулирующая группировка, противодействующая иммунной толерантности раковой клетки, могут быть непосредственно связаны друг с другом. Химерные/слитые полипептиды по изобретению полезны для связывания с рецептором раковой клетки и уменьшения способности раковых клеток избегать иммунного ответа.
Настоящее изобретение основано на получении химерных/слитых белков посредством экспрессии полинуклеотидов, кодирующих слитые белки, противодействующие иммунной толерантности раковых клеток или приводящие к ее обратному развитию. Раковые клетки могут избегать устранения химиотерапевтическими агентами или нацеленными на опухоль антителами посредством определенных иммуносупрессивных механизмов в микроокружении опухоли, и такую способность раковых клеток называют иммунной толерантностью. Такие иммуносупрессивные механизмы включают иммуносупрессивные цитокины (например, трансформирующий фактор роста-бета (TGFβ)) и регуляторные Т-клетки и/или иммуносупрессивные миелоидные дендритные клетки (DC). Благодаря противодействию опухоль-индуцированной иммунной толерантности, согласно настоящему изобретению предложены эффективные композиции и способы для лечения рака, возможно в комбинации с другим существующим лечением рака. Согласно настоящему изобретению предложены способы противодействия опухоль-индуцированной иммунной толерантности и повышения противоопухолевой эффективности химиотерапии посредством активации и применения опосредованного Т-клетками адаптивного противоопухолевого действия на резистентные или диссеминированные раковые клетки.
В другом аспекте согласно настоящему изобретению предложена молекула, содержащая по меньшей мере одну направляющую группировку, слитую с по меньшей мере одной иммуномодулирующей группировкой. Направляющая группировка специфически связывается с молекулой-мишенью, а иммуномодулирующая группировка специфически связывается с одной из следующих молекул: (1) трансформирующий фактор роста-бета (TGFβ); (2) лиганд-1 запрограммированной гибели-1 (PD-L1) или лиганд-2 запрограммированной гибели-1 (PD-L2); (3) лиганд активатора рецептора ядерного фактора-КВ (RANK) (RANKL); (4) рецептор трансформирующего фактора роста-бета (TGFβR); (5) молекула запрограммированной гибели-1 (PD1); (6) рецептор 4-1ВВ; или (7) активатор рецептора ядерного фактора-κВ (RANK).
В другом аспекте направляющая группировка включает антитело, фрагмент антитела, включая легкие или тяжелые цепи антитела, scFv или Fc-содержащий полипептид, специфически связывающиеся с компонентом опухолевой клетки, опухолевым антигеном, сосудистой сетью опухоли, микроокружением опухоли или инфильтрирующей опухоль иммунокомпетентной клеткой. Предпочтительно, направляющая группировка представляет собой антитело или его фрагмент, имеющие аффинность связывания в отношении компонента опухолевой клетки. Следует отметить, что каждая из тяжелой цепи и легкой цепи может по отдельности быть соединена с отдельной и отличной иммуномодулирующей группировкой. Кроме того, тяжелая или легкая цепь антительной направляющей группировки может быть соединена с иммуномодулирующей группировкой, которая, в свою очередь, может быть дополнительно соединена со второй иммуномодулирующей группировкой, где между двумя иммуномодулирующими группировками присутствует линкер.
В еще одном аспекте предложен химерный полипептид, содержащий опухоль-направляющую группировку и иммуномодулирующую группировку, содержащую молекулу, связывающуюся с трансформирующим фактором роста-бета (TGFβ), где опухоль-направляющая группировка представляет собой антитело, связывающееся с EGFR1 (рецептор эпидермального фактора роста 1), где антитело может представлять собой полноразмерное антитело, тяжелую цепь или легкую цепь. Опухоль-направляющая группировка может включать моноклональные антитела, нацеленные на раковую клетку, включая, без ограничения, цетуксимаб, трастузумаб, ритубксимаб, ипилимумаб, тремелимумаб, муромонаб-СD3, абциксимаб, даклизумаб, базиликсимаб, паливизумаб, инфликсимаб, гемтузумаб озогамицин, алемтузумаб, ибритумомаб тиуксетан, адалимумаб, омализумаб, тозитумомаб, 1-131 тозитумомаб, эфализумаб, бевацизумаб, панитумумаб, пертузумаб, натализумаб, этанерцепт, IGN101 (Aphton), волоциксимаб (Biogen Idee и PDL BioPharm), mAb против CD80 (Biogen Idee), mAb против CD23 (Biogen Idel), CAT-3888 (Cambridge Antibody Technology), CDP-791 (Imclone), эраптузумаб (Immunomedics), MDX-010 (Medarex и BMS), MDX-060 (Medarex), MDX-070 (Medarex), матузумаб (Merck), CP-675,206 (Pfizer), CAL (Roche), SGN-30 (Seattle Genetics), занолимумаб (zanolimumab) (Serono и Genmab), адекатумумаб (Sereno), ореговомаб (oregovomab) (United Therapeutics), нимотузумаб (YM Bioscience), ABT-874 (Abbott Laboratories), деносумаб (Amgen), AM 108 (Amgen), AMG 714 (Amgen), фонтолизумаб (Biogen Idee и PDL BioPharm), даклизумаб (Biogent Idee и PDL BioPharm), голимумаб (Centocor и Schering-Plough), CNTO 1275 (Centocor), окрелизумаб (Genetech и Roche), HuMax-CD20 (Genmab), белимумаб (HGS и GSK), эпратузумаб (Immunomedics), MLN1202 (Millennium Pharmaceuticals), визилизумаб (PDL BioPharm), тоцилизумаб (Roche), окрелизумаб (Roche), цертолизумаб пегол (UCB, ранее Celltech), экулизумаб (Alexion Pharmaceuticals), пекселизумаб (Alexion Pharmaceuticals и Procter & Gamble), абциксимаб (Centocor), ранибизимумаб (ranibizimumab) (Genetech), меполизумаб (GSK), TNX-355 (Tanox) или MYO-029 (Wyeth).
В другом аспекте опухоль-направляющая группировка представляет собой моноклональное антитело, связывающееся с HER2/Neu (рецептор эпидермального фактора роста человека 2), CD20, CTLA4, EGFR1, где антитело может представлять собой полноразмерное антитело, тяжелую цепь или легкую цепь.
В еще одном аспекте направляющая группировка представляет собой молекулу, специфически связывающуюся с рецептором эпидермального фактора роста (EGFR1, Erb-B1), HER2/neu (Erb-B2), CD20, антигеном-4 цитотоксических Т-лимфоцитов (CTLA-4), необходимым для функционирования Treg-клеток (CD152), Н-1 и интерлейкином-6 (IL-6).
В еще одном аспекте направляющая группировка специфически связывается с компонентом регуляторной Т-клетки (Treg), миелоидной супрессорной клетки или дендритной клетки. В другом аспекте направляющая группировка специфически связывается с одной из следующих молекул: (1) CD4; (2) CD25 (рецептор IL-2a; IL-2aR); (3) рецептор трансформирующего фактора роста-бета (TGFβR); (6) трансформирующий фактор роста-бета (TGFβ); (7) молекула запрограммированной гибели-1 (PD1); (8) лиганд запрограммированной гибели-1 (PD-L1 или PD-L2).
В другом аспекте иммуномодулирующая группировка специфически связывается с одной из следующих молекул: (1) трансформирующий фактор роста-бета (TGFβ); (2) лиганд запрограммированной гибели-1 (PD-L1 или PD-L2); или рецептор 4-1ВВ.
В еще одном аспекте иммуномодулирующая группировка включает молекулу, связывающуюся с TGFβ и ингибирующую его функцию. Конкретно, иммуномодулирующая группировка включает внеклеточный лиганд-связывающий домен рецептора трансформирующего фактора роста-бета TGFβRII, TGFβRIIb или TGFβRIII. В другом аспекте иммуномодулирующая группировка включает внеклеточный лиганд-связывающий домен (ECD) TGFβRII. Кроме того, иммуномодулирующая группировка может включать лиганд Н-4-1ВВ, связывающийся с рецептором 4-1ВВ, для стимуляции Т-клеток для помощи в эрадиации опухоли.
В еще одном аспекте направляющая группировка включает антитело, фрагмент антитела или полипептид, специфически связывающиеся с HER2/neu, EGFR1, CD20 или антигеном-4 цитотоксических Т-лимфоцитов (CTLA-4), и где иммуномодулирующая группировка включает внеклеточный лиганд-связывающий домен TGF-βRII.
В еще одном аспекте иммуномодулирующая группировка включает молекулу, специфически связывающуюся с лигандом-1 молекулы запрограммированной гибели-1 (PD-L1) или лигандом-2 молекулы запрограммированной гибели-1 (PD-L2) и ингибирующую их активность. В другом аспекте иммуномодулирующая группировка включает внеклеточный лиганд-связывающий домен или эктодомен молекулы запрограммированной гибели-1 (PD1).
В другом аспекте направляющая группировка включает антитело, фрагмент антитела или полипептид, специфически связывающиеся с HER2/neu, EGFR1, CD20, антигеном-4 цитотоксических Т-лимфоцитов (CTLA-4), CD25 (рецептором IL-2a; IL-2aR) или CD4, и где иммуномодулирующая группировка включает внеклеточный лиганд-связывающий домен или эктодомен молекулы запрограммированной гибели-1 (PD1).
В еще одном аспекте направляющая группировка включает антитело или фрагмент антитела, специфически связывающиеся с CD20, и иммуномодулирующая группировка включает последовательность трансформирующего фактора роста-β (TGFβ).
В одном аспекте согласно настоящему изобретению предложены оптимизированные гены, кодирующие слитый полипептид, содержащий по меньшей мере одну направляющую группировку и по меньшей мере одну иммуномодулирующую группировку, для лечения рака у субъекта-человека, где оптимизированные гены модифицированы для повышения их экспрессии у субъекта-человека, предпочтительно, оптимизированные гены содержат последовательности, кодирующие направляющую группировку или иммуномодулирующую группировку, выбранные из SEQ ID NO: 12-28.
В другом аспекте согласно настоящему изобретению предложен вектор, содержащий оптимизированные гены для лечения рака у субъекта-человека, модифицированные для увеличения содержания CG-последовательностей. Предпочтительно, вектор содержит последовательности, кодирующие по меньшей мере одну направляющую группировку и по меньшей мере одну иммуномодулирующую группировку, выбранные из SEQ ID NO: 12-28.
В еще одном аспекте согласно настоящему изобретению предложен способ лечения рака у субъекта, включающий:
а) обеспечение по меньшей мере одного рекомбинантного вектора, содержащего нуклеотидные последовательности, кодирующие по меньшей мере одну направляющую группировку и по меньшей мере одну иммуномодулирующую группировку, выбранные из SEQ ID NO: 12-28; и
б) введение рекомбинантного вектора субъекту в таких условиях, что указанные нуклеотидные последовательности экспрессируются на уровне, обеспечивающем терапевтически эффективное количество кодируемых слитых белков у субъекта.
В альтернативном аспекте согласно настоящему изобретению предложен вектор экспрессии, содержащий полинуклеотиды оптимизированных генов, кодирующих по меньшей мере одну направляющую группировку и по меньшей мере одну иммуномодулирующую группировку, выбранных из SEQ ID NO: 12-28.
В еще одном аспекте согласно настоящему изобретению предложена рекомбинантная клетка-хозяин, трансфицированная полинуклеотидом, кодирующим пептид слитого белка по настоящему изобретению.
В еще одном аспекте согласно настоящему изобретению предложен способ получения слитого белка по настоящему изобретению, включающий:
а) трансфицирование клетки-хозяина полинуклеотидными последовательностями, кодирующими химерные слитые белки, с получением трансформированной клетки-хозяина, где полинуклеотидные последовательности кодируют по меньшей мере одну направляющую группировку и по меньшей мере одну иммуномодулирующую группировку и выбраны из SEQ ID NO: 12-28; и
б) содержание трансформированной клетки-хозяина в биологических условиях, достаточных для экспрессии пептида.
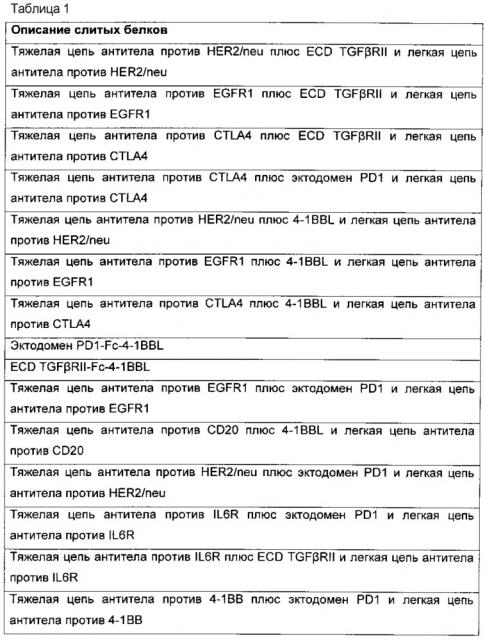
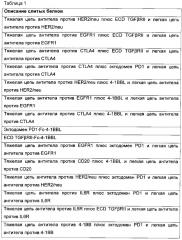
В другом аспекте настоящее изобретение относится к применению химерного слитого белка, как показано на Фиг. 1-15, в применении лекарственного средства для лечения рака. Предпочтительно, слитый белок экспрессирован в клетке-хозяине и такие экспрессированные белки вводят в терапевтическом количестве для уменьшения эффектов рака у субъекта, нуждающегося в этом.
В еще одном аспекте согласно настоящему изобретению предложен способ предотвращения или лечения опухолевого заболевания. Способ включает введение субъекту, нуждающемуся в этом, одного или более слитых белков по изобретению, в различных аспектах субъекту вводят одну или более молекул по изобретению в комбинации с другой противораковой терапией, в одном аспекте противораковая терапия включает химиотерапевтическую молекулу, антитело, низкомолекулярный ингибитор киназ, гормональный агент или цитотоксический агент. Противораковая терапия может также включать ионизирующее излучение, ультрафиолетовое излучение, криоабляцию, термическую абляцию или радиочастотную абляцию.
В еще одном аспекте согласно настоящему изобретению предложен способ получения терапевтически активных слитых белков «антитело-пептид», включающий:
а) получение кодон-оптимизированной последовательности указанного слитого белка;
б) клонирование оптимизированной последовательности указанного слитого белка в клетке-хозяине, способной к временной или продолжительной экспрессии;
в) выращивание клетки-хозяина в среде в условиях, подходящих для роста и предоставление клетке-хозяину возможности экспрессировать клонированный белок; и
г) очистку экспрессированного белка и, возможно, проверку способности белка к биспецифическому связыванию с его мишенями.
В предпочтительном воплощении терапевтически активные слитые белки «антитело-пептид» представляют собой направляющее антитело, слитое с одной или более иммуномодулирующими группировками, противодействующими иммунной толерантности раковой клетки. В одном аспекте иммуномодулирующая группировка может быть присоединена аминокислотным спейсером, длина которого достаточна для обеспечения возможности биспецифического связывания молекулы. Иммуномодулирующая группировка может быть связана с С-концом тяжелой или легкой цепи антитела.
В предпочтительном способе, как описано выше, иммуномодулирующая группировка представляет собой (1) трансформирующий фактор роста-бета (ΤGFβ), (2) молекулу запрограммированной гибели-1 (PD1), (3) CTLA-4 или (4) 4-1ВВ или их части, и направляющее антитело связывается с рецептором эпидермального фактора роста (EGFR1, Erb-B1), HER2/neu (Erb-B2), CD20, CD6, CTLA-4, муцином-1 (MUC-1), интерлейкином-2 (IL-2) или интерлейкином-6 (IL-6).
Способ по настоящему изобретению обеспечивает нуклеотидные последовательности, кодирующие терапевтически активные слитые белки «антитело-пептид», и такая экспрессия может быть проведена в транзиторной клеточной линии или стабильной клеточной линии. Временную экспрессию осуществляют посредством трансфицирования или трансформирования хозяина векторами, переносящими слитые белки в клетки-хозяева, являющиеся клетками млекопитающих.
После экспрессии слитых пептидов предпочтительно подвергают их очистке и анализируют их in vitro для проверки их биспецифичности, то есть способности связываться как направляющей группировкой, так и иммуномодулирующей группировкой. Такие анализы могут включать анализ in vitro, такой как ELISA (иммуноферментный твердофазный анализ) или анализы связывания с NК/T-клетками для подтверждения бифункционального связывания с мишенями или стимуляции иммунокомпетентных клеток.
Следует отметить, что, если определенные слитые пептиды демонстрируют желаемую биспецифичность, такие слитые пептиды отбирают для субклонирования в стабильную клеточную линию для экспрессии и очистки в большем масштабе. Такие стабильные клеточные линии раскрыты ранее, например линии клеток млекопитающих, включая, без ограничения, НЕК293 (клетки почек эмбриона человека), СНО (клетки яичников китайского хомячка) или NSO.
В другом аспекте культуральная среда может быть улучшена дополнением такой среды. Например, культуральная среда может содержать соль двухвалентного переходного металла, которую добавляют в клеточную культуру изначально или в режиме подпитки, для уменьшения накопления лактата во время культивирования и/или для уменьшения неоднородности слитых белков. Желаемая соль переходного металла содержит ион цинка, и добавление иона металла может быть проведено на разных фазах получения.
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания, графических материалов и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показаны аминокислотные последовательности слитого белка «антитело против HER2/neu-TGFβRII» в константной области LC (легкая цепь) с аминокислотной последовательностью тяжелой цепи антитела против HER2/neu (SEQ ID NO: 1) и легкой цепи антитела против HER2/neu (SEQ ID NO: 2), присоединенной к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью антитела против HER2/neu и TGFβRII и показан курсивом.
На Фиг. 2 показаны аминокислотные последовательности слитого белка «антитело против EGFR1-TGFβRII» в константной области LC с аминокислотной последовательностью тяжелой цепи антитела против EGFR1 (SEQ ID NO: 5) и аминокислотной последовательностью легкой цепи антитела против EGFR1 (SEQ ID NO: 6), присоединенной к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью антитела против EGFR1 и TGFβRII и показан курсивом.
На Фиг. 3 показаны аминокислотные последовательности слитого белка «антитело против CTLA4-TGFβRII» в константной области LC с аминокислотной последовательностью тяжелой цепи антитела против CTLA4 (SEQ ID NO: 7) и аминокислотной последовательностью легкой цепи антитела против CTLA4 (SEQ ID NO: 8), присоединенной к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью антитела против CTLA4 и TGFβRII и показан курсивом.
На Фиг. 4 показаны аминокислотные последовательности слитого белка «НС (тяжелая цепь) антитела против HER2/neu-4-1BB» и «LC-TGFβRII» с аминокислотной последовательностью слитого белка «НС антитела против HER2/neu-4-1BB», где аминокислотная последовательность тяжелой цепи антитела против HER2/neu (SEQ ID NO: 1) присоединена клинкеру (SEQ ID NO: 3), показанному курсивом, и последовательность 4-1ВВ (иммуномодулирующая группировка) (SEQ ID NO: 9) показана прописными буквами, и аминокислотная последовательность легкой цепи антитела против HER2/neu (SEQ ID NO: 2) присоединена к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью антитела против HER2/neu и TGFβRII и показан курсивом.
На Фиг. 5 показана аминокислотная последовательность слитого белка «НС антитела против EGFR1-4-1BB» и «LC-TGFβRII» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против EGFR1-4-1ВВ», где аминокислотная последовательность тяжелой цепи антитела против EGFR1 (SEQ ID NO: 5) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность 4-1ВВ (иммуномодулирующая группировка) (SEQ ID NO: 9) показана прописными буквами, и аминокислотная последовательность легкой цепи антитела против EGFR1 (SEQ ID NO: 6) присоединена к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, с линкером (SEQ ID NO: 3) между ними.
На Фиг. 6 показана аминокислотная последовательность слитого белка «НС антитела против CTLA4-4-1BB» и «LC-TGFβRII» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против CTLA4-4-1ВВ», где аминокислотная последовательность тяжелой цепи антитела против CTLA4 (SEQ ID NO: 7) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность 4-1ВВ (иммуномодулирующая группировка) (SEQ ID NO: 9) показана прописными буквами, и аминокислотная последовательность легкой цепи антитела против CTLA4 (SEQ ID NO: 8) присоединена к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, с линкером (SEQ ID NO: 3) между ними.
На Фиг. 7 показана аминокислотная последовательность слитого белка «НС антитела против HER2/neu-PD1» и «LC-TGFβRII» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против HER2/neu-PD1», где аминокислотная последовательность тяжелой цепи антитела против HER2/neu (SEQ ID NO: 1) присоединена клинкеру (SEQ ID NO: 3), показанному курсивом, и последовательность PD1 (иммуномодулирующая группировка) (SEQ ID NO:10) показана прописными буквами, и аминокислотная последовательность легкой цепи антитела против HER2/neu (SEQ ID NO: 2) присоединена к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, с линкером (SEQ ID NO: 3) между ними.
На Фиг. 8 показана аминокислотная последовательность слитого белка «НС антитела против EGFR1-PD1» и «LC-TGFβRII» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против EGFR1-PD1», где аминокислотная последовательность тяжелой цепи антитела против EGFR1 (SEQ ID NO: 5) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность PD1 (иммуномодулирующая группировка) (SEQ ID NO:10) показана прописными буквами, и аминокислотная последовательность легкой цепи антитела против EGFR1 (SEQ ID NO: 6) присоединена к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, с линкером (SEQ ID NO: 3) между ними.
На Фиг. 9 показана аминокислотная последовательность слитого белка «НС антитела против CTLA4-PD1» и «LC-TGFβRII» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против CTLA4-PD1», где аминокислотная последовательность тяжелой цепи антитела против CTLA4 (SEQ ID NO: 7) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность PD1 (иммуномодулирующая группировка) (SEQ ID NO: 10) показана прописными буквами, и аминокислотная последовательность легкой цепи антитела против CTLA4 (SEQ ID NO: 8) присоединена к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, с линкером (SEQ ID NO: 3) между ними.
На Фиг. 10 показана аминокислотная последовательность слитого белка «НС антитела против HER2/neu-TGFβRII-4-1BB» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против HER2/neu-TGFβRII-4-1BB», где аминокислотная последовательность тяжелой цепи антитела против HER2/neu (SEQ ID NO: 1) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4) показана жирным шрифтом, и аминокислотная последовательность 4-1ВВ (иммуномодулирующая группировка) (SEQ ID NO: 9) показана прописными буквами, с линкером между ними (SEQ ID NO: 11), включая аминокислотную последовательность легкой цепи антитела против HER2/neu (SEQ ID NO: 2).
На Фиг. 11 показана аминокислотная последовательность слитого белка «НС антитела против EGFR1-TGFβRII-4-1BB» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против EGFR1-TGFβRII-4-1BB», где аминокислотная последовательность тяжелой цепи антитела против EGFR1 (SEQ ID NO: 5) последовательность присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4) показана жирным шрифтом, и аминокислотная последовательность 4-1ВВ (иммуномодулирующая группировка) (SEQ ID NO: 9) показана прописными буквами, с линкером между ними (SEQ ID NO: 11), включая аминокислотную последовательность легкой цепи антитела против EGFR1 (SEQ ID NO: 6).
На Фиг. 12 показана аминокислотная последовательность слитого белка «НС антитела против CTLA4-TGFβRII-4-1ВВ» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против CTLA4-ΤGΡβRΙΙ-4-1ΒΒ», где аминокислотная последовательность тяжелой цепи антитела против CTLA4 (SEQ ID NO: 7) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4) показана жирным шрифтом, и аминокислотная последовательность 4-1ВВ (иммуномодулирующая группировка) (SEQ ID NO: 9) показана прописными буквами, с линкером между ними (SEQ ID NO: 11), включая аминокислотную последовательность легкой цепи антитела против CTLA4 (SEQ ID NO: 8).
На Фиг. 13 показана аминокислотная последовательность слитого белка «НС антитела против HER2/neu-TGFβRII-PD1» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против HER2/neu-TGFβRII-PD1», где аминокислотная последовательность тяжелой цепи антитела против HER2/neu (SEQ ID NO: 1) присоединена клинкеру (SEQ ID NO: 3), показанному курсивом, и последовательность TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4) показана жирным шрифтом, и аминокислотная последовательность PD1 (иммуномодулирующая группировка) (SEQ ID NO: 10) показана прописными буквами, с линкером между ними (SEQ ID NO: 11), включая аминокислотную последовательность легкой цепи антитела против HER2/neu (SEQ ID NO: 2).
На Фиг. 14 показана аминокислотная последовательность слитого белка «НС антитела против EGFR1-PD1» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против EGFR1-TGFβRII-PD1», где аминокислотная последовательность тяжелой цепи антитела против EGFR1 (SEQ ID NO: 5) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4) показана жирным шрифтом, и аминокислотная последовательность PD1 (иммуномодулирующая группировка) (SEQ ID NO: 10) показана прописными буквами, с линкером между ними (SEQ ID NO: 11), включая аминокислотную последовательность легкой цепи антитела против EGFR1 (SEQ ID NO: 6).
На Фиг. 15 показан слитый белок «НС антитела против CTLA4-TGFβRII-PD1» с аминокислотной последовательностью слитого белка «тяжелая цепь антитела против CTLA4-TGFβRII-PD1», где аминокислотная последовательность тяжелой цепи антитела против CTLA4 (SEQ ID NO: 7) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4) показана жирным шрифтом, и аминокислотная последовательность PD1 (иммуномодулирующая группировка) (SEQ ID NO: 8) показана прописными буквами, с линкером между ними (SEQ ID NO: 11), включая аминокислотную последовательность легкой цепи антитела против CTLA4 (SEQ ID NO: 8).
На Фиг. 16 показаны нуклеотидные последовательности константной области тяжелой цепи антитела против HER2/neu с линкером (SEQ ID NO: 12) и ECD TGFβRII (SEQ ID NO: 13), кодон-оптимизированные для экспрессии в клетке СНО.
На Фиг. 17 показаны нуклеотидные последовательности вариабельной области тяжелой цепи антитела против HER2/neu (SEQ ID NO: 14), вариабельной области легкой цепи антитела против HER2/neu (SEQ ID NO: 15) и константной области тяжелой цепи антитела против EGFR1 с линкером (SEQ ID NO: 16), кодон-оптимизированные для экспрессии в клетке СНО.
На Фиг. 18 показаны нуклеотидные последовательности вариабельной области тяжелой цепи антитела против EGFR1 (SEQ ID NO: 17), вариабельной области легкой цепи антитела против EGFR1 (SEQ ID NO: 18), вариабельной области тяжелой цепи антитела против CTLA4 (SEQ ID NO: 19) и вариабельной области легкой цепи антитела против CTLA4 (SEQ ID NO: 20), кодон-оптимизированные для экспрессии в клетке СНО.
На Фиг. 19 показаны нуклеотидные последовательности молекулы lgG1 против CD20 (SEQ ID NO: 21), вариабельной области тяжелой цепи антитела против CD20 (SEQ ID NO: 22) и вариабельной области легкой цепи антитела против CD20 (SEQ ID NO: 23), кодон-оптимизированные для экспрессии в клетке СНО.
На Фиг. 20 показаны нуклеотидные последовательности 4-1ВВ (SEQ ID NO: 24) и тяжелой цепи антитела против IL-6R (SEQ ID NO: 25), кодон-оптимизированные для экспрессии в клетке СНО.
На Фиг. 21 показаны нуклеотидные последовательности вариабельной области легкой цепи антитела против IL-6R (SEQ ID NO: 26), тяжелой цепи антитела против 4-1ВВ (SEQ ID NO: 27) и вариабельной области легкой цепи антитела против 4-1ВВ (SEQ ID NO: 28), кодон-оптимизированные для экспрессии в клетке СНО.
На Фиг. 22 показан анализ антитела против HER2/neu-TGFβRII и антитела против EGFR1-TGFβRII, очищенных с использованием белка А, в 12%-м PAGE (электрофорез в полиакриламидном геле).
На Фиг. 23А показаны образцы антитела против HER2/neu-TGFβRII, проанализированные посредством хроматографии с белком A/SEC, и на Фиг. 23В показаны образцы антитела против EGFR1-TGFβRII, проанализированные посредством хроматографии с белком A/SEC.
На Фиг. 24А показано, что молекулы антитела против HER2/neu-TGFβRII и антитела против EGFR1-TGFβRII связываются с ΤGFβ, указывая на функциональность слитого белка, и на Фиг. 24 В показано, что антитело против HER2-TGFβRII ингибирует пролиферацию клеточной линии ВТ474 аналогично Bmab200 (герцептину).
На Фиг. 25 показано, что антитело против EGFR1-TGFβRII ингибирует пролиферацию клеточной линии А431 аналогично цетуксимабу.
На Фиг. 26 показана АDСС(антителозависимая клеточно-опосредованная цитотоксичность)-активность антитела против HER2-TGFβRII на клетках ВТ474, аналогичная ADCC-активности Bmab200 (герцептина).
На Фиг. 27 показана ADCC-активность антитела против EGFR1-TGFβRII на клетках А431, аналогичная ADCC-активности цетуксимаба.
На Фиг. 28 показана ADCC-активность антитела против EGFR1-4-1BB в сравнении с антителом против EGFR1-TGFβRII и цетуксимабом.
На Фиг. 29А показано, что связывающая активность антитела против CTLA4-TGFβRII в отношении TGFβ1 сопоставима с антителом против EGFR1-TGFβRII, и на Фиг. 29В показана связывающая активность антитела против CTLA4-TGFβRII в отношении CTLA4.
На Фиг. 30А показана связывающая активность антитела против CTLA4-TGFβRII, определяющая уровень связывания с PD1-Fc, и на Фиг. 30В показана связывающая активность антитела против EGFR1-4-1BB, определяющая связывание с 4-1BBL.
На Фиг. 31 показана связывающая активность антитела против EGFR1-4-1ВВ в отношении EGFR, и на Фиг. 31В показана связывающая активность PD1-FC-4-1BB в отношении PDLI-Fc.
На Фиг. 32 показана связывающая активность антитела против EGFR1-PD1 в отношении EGFR (рецептор эпидермального фактора роста) и PD1.
На Фиг. 33 показаны фотографии экспрессированных белков и их восстановительное алкилирование.
На Фиг. 34А показан массовый спектр легкой цепи (LC) (восстановленной) слитого белка «антитело против HER2/neu-ECD TGFPRII», и на Фиг. 34В показан развернутый массовый спектр LC (восстановленной) слитого белка «антитело против HER2/neu-ECD TGFβRII».
На Фиг. 35 показан массовый спектр тяжелой цепи (НС) (восстановленной) слитого белка «антитело против HER2/neu-ECD TGFβRII».
На Фиг. 36А показан массовый спектр LC (восстановленной) антитела против EGFR1-ECD TGFβRII, и на Фиг. 36В показан развернутый массовый спектр LC (восстановленной) антитела против EGFR1-ECD TGFβRII.
На Фиг. 37 показан массовый спектр НС (восстановленной) антитела против EGFR1-ECD TGFβRII.
На Фиг. 38А показана UV-хроматограмма триптических пептидов слитого белка «антитело против HER2/neu-ECD TGFβRII», и на Фиг. 38В показана общая ионная хроматограмма (TIC) триптических пептидов слитого белка «антитело против HER2/neu-ECD TGFβRII».
На Фиг. 39, 40 и 41 приведены перечни прогнозируемых/наблюдаемых триптических пептидов легкой цепи, тяжелой цепи и соединительного мотива слитого белка «антитело против HER2/neu-ECD TGFβRII», соответственно.
На Фиг. 42А показана UV-хроматограмма триптических пептидов слитого белка «антитело против EGFR1-ECD TGFβRII», и на Фиг. 38В показана общая ионная хроматограмма (TIC) триптических пептидов слитого белка «антитело против EGFR1-ECD TGFβRII».
На Фиг. 43 приведен перечень прогнозируемых/наблюдаемых триптических пептидов легкой цепи слитого белка «антитело против EGFR1-ECD TGFβRII».
На Фиг. 44 показан перечень прогнозируемых/наблюдаемых триптических пептидов тяжелой цепи слитого белка «антитело против EGFR1-ECD TGFβRII».
На Фиг. 45 показан перечень прогнозируемых/наблюдаемых триптических пептидов тяжелой цепи слитого белка «антитело против EGFR1-ECD TGFβRII».
На Фиг. 46 показаны аминокислотные последовательности слитого белка «кантузумаб-TGFβRII» в константной области LC с аминокислотной последовательностью тяжелой цепи кантузумаба (SEQ ID NO: 29) и аминокислотной последовательностью легкой цепи кантузумаба (SEQ ID NO: 30), присоединенной к аминокислотным остаткам ΤGFβRΙΙ (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью кантузумаба и TGFβRII и показан курсивом.
На Фиг. 47 показаны аминокислотные последовательности слитого белка «циксутумумаб-TGFβRII» в константной области LC с аминокислотной последовательностью тяжелой цепи циксутумумаба (SEQ ID NO: 31) и аминокислотной последовательностью легкой цепи циксутумумаба (SEQ ID NO: 32), присоединенной к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью циксутумумаба и TGFβRII и показан курсивом.
На Фиг. 48 показаны аминокислотные последовательности слитого белка «кливатузумаб-TGFβRII» в константной области LC с аминокислотной последовательностью тяжелой цепи кливатузумаба (SEQ ID NO: 33) и аминокислотной последовательностью легкой цепи кливатузумаба (SEQ ID NO: 34), присоединенной к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью кливатузумаба и TGFβRII и показан курсивом.
На Фиг. 49 показаны аминокислотные последовательности слитого белка «притумумаб-TGFβRII» в константной области LC с аминокислотной последовательностью тяжелой цепи притумумаба (SEQ ID NO: 35) и аминокислотной последовательностью легкой цепи притумумаба (SEQ ID NO: 36), присоединенной к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка) (SEQ ID NO: 4), показанным жирным шрифтом, и где линкер (SEQ ID NO: 3) расположен между легкой цепью притумумаба и TGFβRII и показан курсивом.
На Фиг. 50 показана аминокислотная последовательность слитого белка «НС кантузумаба-4-1ВВ» и «LC-TGFβRII», где аминокислотная последовательность тяжелой цепи кантузумаба (SEQ ID NO: 29) присоединена к линкеру (SEQ ID NO: 3), показанному курсивом, и последовательность 4-1ВВ (иммуномодулирующая группировка) (SEQ ID NO: 9) показана прописными буквами, и аминокислотная последовательность легкой цепи кантузумаба (SEQ ID NO: 30) присоединена к аминокислотным остаткам TGFβRII (иммуномодулирующая группировка)