Гликозилированный полипептид и содержащая его фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к композиции для лечения или профилактики интерферон-β-зависимого заболевания, и может быть использовано в медицине.
Синтетическим путем получают гликозилированный полипептид, имеющий однородную структуру сахарной цепи и обладающий активностью интерферона-β. Однородность структуры сахарной цепи и наличие сиаловой кислоты на невосстанавливающем конце сахарной цепи увеличивает время полужизни гликозилированной формы интерферона в крови и улучшает его фармакокинетические свойства. 3 н. и 9 з.п. ф-лы, 50 ил., 2 табл., 12 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к гликозилированному полипептиду и к фармацевтической композиции, содержащей указанный полипептид.
Предшествующий уровень техники
Природный человеческий интерферон-бета (ИФН-β) является гликопротеином, состоящим из 166 аминокислотных остатков. Интерферон-β принадлежит к семейству цитокинов, и, как известно, обладает иммуномодулирующим эффектом, антивирусной активностью и супрессирующим эффектом в отношении клеточной пролиферации. Далее, человеческий интерферон-β содержит три Цис в положениях 17, 31 и 141 аминокислотной последовательности, и содержит N-связанный олигосахарид типа комплекса с одинарным ветвлением на аспарагине в положении 80. Далее, известно, что он имеет дисульфидную связь на Цис в положениях 31 и 141. Интерферон-β в качестве фармацевтического средства производят с применением системы клеточной экспрессии и подразделяют на ИФН-β-1а или ИФН-β-1b, в зависимости от разницы в источнике экспрессии. В то время как ИФН-β-1а является гликопротеином, ИФН-β-1b не содержит олигосахарида. Далее известно, что ИФН-β-1а, содержащий сахарную цепь, обладает более мощным эффектом в отношении иммуногенности, антивирусной активности и противоопухолевой активности по сравнению с ИФН-β-1b.
Известно, что структура сахарной цепи, содержащаяся в гликопротеине, оказывает выраженное влияние на фармакокинетику. В частности, известно, что присутствие или отсутствие сиаловой кислоты на невосстанавливающем конце сахарной цепи оказывает влияние на увеличение времени полужизни в крови. Однако отмечалось, что предварительно биосинтезированный ИФН-β-1а имеет однородную структуру сахарной цепи в полипептиде (например, результат анализа однородности структуры сахарной цепи путем CE-TOF-MS (капиллярного электрофореза в сочетании с времяпролетной масс-спектрометрией) описан в не-патентной литературе 1). Далее, до настоящего времени не сообщалось о выделении IFN-β, имеющего по существу однородную структуру сахарной цепи, из синтезированного IFN-β или природного IFN-β. Таким образом, имеется препятствие к установлению того, что структура сахарной цепи важна для биологической активности.
В последние годы биотехнология применения системы клеточной экспрессии обеспечила производство рецептур биологически активных белков, включая интерфероны, таких как инсулин, эритропоэтин, и Г-КСФ. Сообщалось, что в этих белковых рецептурах тип гликозилирования белка обеспечивает разнообразие физических или химических свойств белка, таких как степень фолдинга или свойства конформации, стабильность, иммунная реакция, время полужизни в крови, и функция белка в биологической системе (He-патентная литература 2). Далее, с учетом критической иммуногенности, вызванной сахарной цепью нечеловеческого типа, структура сахарной цепи, добавленной к этим белковым рецептурам, предпочтительно является сахарной цепью человеческого типа.
Такие гликопротеиновые рецептуры получают посредством системы клеточной экспрессии в качестве единственного способа. Однако, как описано выше, технология такой системы клеточной экспрессии не обеспечивает контроля структуры сахарной цепи, таким образом, вызывая неоднородность в структуре сахарной цепи произведенного гликопротеина (например, Heпатентная литература 3). По этой причине имеются проблемы, такие как вариабельность качества производственных серий или неспособность оптимизации сахарной цепи. Соответственно, давно требуется способ приготовления однородного гликопротеина, в котором структура сахарной цепи легко регулируется, но в настоящее время нет сообщений о синтезе однородного гликопротеина человеческого типа, демонстрирующего биологическую активность in vivo, путем химического синтеза.
Далее, биоактивный гликопротеин, производимый посредством технологии с такой системой клеточной экспрессии, может содержать вирус или генетический материал. Далее, существует возможность контаминации таким генетическим материалом и т.д., также в случае синтеза биоактивного гликопротеина с применением сахарной цепи, приготовленной из образца биологического происхождения. Применение тепловой обработки, которая позволяет разрушить эти генетические материалы, необходимо для получения безопасной белковой рецептуры. Однако в настоящее время тепловая обработка рецептуры биоактивного гликопротеина приводит к инактивации гликопротеина, и о применении тепловой обработки не сообщалось.
Перечень цитированной литературы
Heпатентная литература
[Heпатентная литература 1] Anal Bioanall Chem (2011) 400:295-303
[Heпатентная литература 2] Nat. Biotechnol., 2006, 24, 1241-1252
[Heпатентная литература 3] J. Biotechnol, 42,117-131 (1995)
Изложение сущности изобретения
Проблемы, решаемые настоящим изобретением
Задачей, решаемой настоящим изобретением, является обеспечение гликозилированного полипептида, имеющего однородную структуру сахарной цепи, обладающего активностью интерферона-β.
Средства решения проблем
В результате повторных исследований для решения вышеуказанных проблем авторы настоящего изобретения преуспели в получении гликозилированного полипептида, имеющего однородную структуру сахарной цепи, обладающего активностью интерферона-β.
Другими словами, настоящее изобретение относится к гликозилированному полипептиду, характеризующемуся тем, что указанный гликозилированный полипептид является полипептидом, выбранным из группы, состоящей из:
(a) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1;
(b) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1, в которой одна или несколько аминокислот удалены, заменены или добавлены;
(c) аналога интерферона-β; и
(d) полипептида, имеющего 80% или более гомологии с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID №: 1;
где полипептид имеет сахарную цепь на аминокислоте, соответствующей положению 80 в интерфероне-β и обладает активностью интерферона-β, и
указанный гликозилированный полипептид имеет по существу однородные сахарные цепи.
Таким образом, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что указанный гликозилированный полипептид приготовлен путем химического синтеза.
Далее, другой аспект настоящего изобретения относится к гликозилированному полипептиду, полученному посредством способа, включающего этап синтеза гликозилированного пептидного фрагмента и по меньшей мере двух пептидных фрагментов, и этап связывания указанного гликозилированного пептидного фрагмента и указанных по меньшей мере двух пептидных фрагментов, характеризующемуся тем, что указанный гликозилированный полипептид является полипептидом, выбранным из группы, состоящей из:
(а) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1;
(b) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1, в которой одна или несколько аминокислот удалены, заменены или добавлены;
(c) аналога интерферона-β; и
(d) полипептида, имеющего 80% или более гомологии с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID №: 1;
где полипептид имеет сахарную цепь на аминокислоте, соответствующей положению 80 в интерфероне-β, и обладает активностью интерферона-β.
Далее, в одном варианте осуществления гликозилированного полипептида из настоящего изобретения, гликозилированный полипептид относится к гликозилированному полипептиду, полученному посредством способа, включающего этап синтеза гликозилированного пептидного фрагмента и по меньшей мере двух пептидных фрагментов, и этап связывания указанного гликозилированного пептидного фрагмента и указанных по меньшей мере двух пептидных фрагментов, характеризующемуся тем, что указанный гликозилированный полипептид является полипептидом, выбранным из группы, состоящей из:
(a) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1;
(b) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1, в которой одна или несколько аминокислот удалены, заменены или добавлены;
(c) аналога интерферона-β; и
(d) гликозилированного полипептида, имеющего 80% или более гомологии с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID №: 1;
где полипептид имеет сахарную цепь на аминокислоте, соответствующей положению 80 в интерфероне-β, и обладает активностью интерферона-β.
Так, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что сахарная цепь в указанном гликозилированном полипептиде является связанной с аспарагином сахарной цепью.
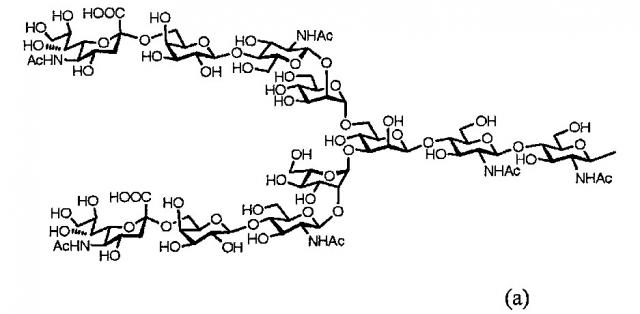
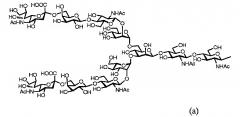
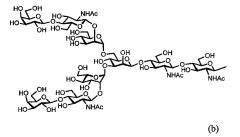
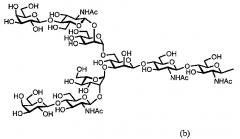
Далее, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что сахарная цепь в указанном гликозилированном полипептиде является дисиало-сахарной цепью, представленной следующей формулой (а), или асиало-сахарной цепью, представленной следующей формулой (b).
[Химическая формула1]
[Химическая формула2]
Далее, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что Цис, соответствующий положениям 31 и 141 интерферона-β, образует дисульфидную связь в указанном гликозилированном полипептиде.
Далее, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что указанный гликозилированный полипептид подвергнут тепловой обработке.
Далее, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что указанный гликозилированный полипептид имеет чистоту 90% или более.
Далее, другой аспект настоящего изобретения относится к композиции, содержащей указанный гликозилированный полипептид, характеризующийся тем, гликозилированные полипептиды в указанной композиции являются по существу однородными.
Таким образом, в одном варианте осуществления композиция из настоящего изобретения характеризуется тем, что гликозилированные полипептиды в указанной композиции являются однородными на 90% или более.
Далее, в одном варианте композиция из настоящего изобретения характеризуется тем, что указанный гликозилированный полипептид имеет чистоту 90% или более.
Далее, композиция из настоящего изобретения характеризуется тем, что она является композицией, содержащей гликозилированный полипептид, характеризующийся тем, что указанный гликозилированный полипептид является полипептидом, выбранным из группы, состоящей из следующих полипептидов (a)-(d):
(a) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1;
(b) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1, в которой одна или несколько аминокислот удалены, заменены или добавлены;
(c) аналога интерферона-β; и
(d) гликозилированного полипептида, имеющего 80% или более гомологии с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID №: 1;
где полипептид имеет сахарную цепь на аминокислоте, соответствующей положению 80 в интерфероне-β, и обладает активностью интерферона-β, и
гликозилированные полипептиды в указанной композиции являются по существу однородными.
Далее, другой аспект настоящего изобретения относится к фармацевтической композиции, характеризующейся тем, что она содержит (I) гликозилированный полипептид по любому из п.п. 1-7 и/или его фармацевтически пригодную соль, и (И) фармацевтически пригодный носитель.
Так, в одном варианте осуществления фармацевтическая композиция из настоящего изобретения характеризуется тем, что указанные сахарные цепи являются по существу однородными в указанном гликозилированном полипептиде.
Далее, в одном варианте осуществления фармацевтическая композиция из настоящего изобретения характеризуется тем, что сахарные цепи являются на 90% или более однородными в указанном гликозилированном полипептиде.
Далее, в одном варианте осуществления фармацевтическая композиция из настоящего изобретения характеризуется тем, что указанный гликозилированный полипептид имеет чистоту 90% или более.
Далее, в одном варианте осуществления фармацевтическая композиция из настоящего изобретения характеризуется тем, что ее применяют для лечения или профилактики интерферон-β-зависимого заболевания.
Далее, в одном варианте осуществления фармацевтическая композиция из настоящего изобретения характеризуется тем, что указанное интерферон-β-зависимое заболевание является по меньшей мере одним заболеванием, выбранным из группы, состоящей из опухоли головного мозга, включая мультиформную глиобластому, медуллобластому и астроцитому; кожной злокачественной меланомы, хронического активного гепатита В, хронического гепатита С, подострого склерозирующего панэнцефалита, компенсированного цирроза С и рассеянного склероза.
Далее, другой аспект настоящего изобретения относится к способу лечения или профилактики интерферон-β-зависимого заболевания, характеризующемуся применением эффективного количества указанного гликозилированного полипептида.
Так, в одном варианте осуществления способ из настоящего изобретения для лечения или профилактики интерферон-β-зависимого заболевания характеризуется тем, что указанное интерферон-β-зависимое заболевание является по меньшей мере одним заболеванием, выбранным из группы, состоящей из опухоли головного мозга, включая мультиформную глиобластому, медуллобластому, и астроцитому; кожной злокачественной меланомы, хронического активного гепатита В, хронического гепатита С, подострого склерозирующего панэнцефалита, компенсированного цирроза С, и рассеянного склероза.
Далее, другой аспект настоящего изобретения относится к гликозилированному полипептиду, характеризующемуся тем, что гликозилированный полипептид является полипептидом, выбранным из группы, состоящей из:
(a) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1;
(b) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1, в которой одна или несколько аминокислот удалены, заменены или добавлены;
(c) аналога интерферона-β; и
(d) полипептида, имеющего 80% или более гомологии с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID №: 1;
где полипептид имеет сахарную цепь на аминокислоте, соответствующей положению 80 в интерфероне-β, и имеет Цис, соответствующим положениям 17, 31 и 141 в интерфероне-β, защищенную защитной группой.
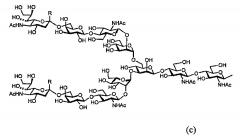
Так, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что указанная сахарная цепь в указанном гликозилированном полипептиде является дисиало-сахарной цепью, имеющей карбоксигруппу сиаловой кислоты, присутствующую на защищенном невосстанавливающем конце сахарной цепи, представленной следующей формулой (с) или асиало-сахарной цепью, представленной следующей формулой (b).
[Химическая формула 3]
(где R представлено -COOBn, -COOEt, -СООМе, -COOCH2COPh, -COOCH2PhOMe, -COOCH2Ph(OMe)2, -COOCH2PhNO2, или -COOCH2Ph(NO2)2. Bn указывает бензильную группу, Et указывают этильную групп, Me указывает метальную группу, a Ph указывает фенильную группу).
[Химическая формула 4]
Далее, в одном варианте осуществления гликозилированный полипептид из настоящего изобретения характеризуется тем, что Цис, соответствующие указанным положениям 17, 31 и 141 в интерфероне-β, защищены одной или несколькими защитными группами, состоящими из Аст группы, алкоксиметильной группы, трифенилметильной группы, т-бутильной группы, бензильной группы, и этильной группы, находящейся в β-положении в указанном гликозилированном полипептиде.
Далее, другой аспект настоящего изобретения относится к способу производства гликозилированного полипептида, характеризующемуся тем, что он включает этап снятия защиты с Цис, соответствующего указанным положениям 17, 31 и 141 в интерфероне-β, защищенного защитной группой в указанном гликозилированном полипептиде, имеющем защищенный Цис.
Таким образом, один вариант осуществления способа получения гликозилированного полипептида из настоящего изобретения характеризуется тем, что он дополнительно включает этап приготовления указанного гликозилированного полипептида, имеющего Цис, соответствующий положениям 17, 31 и 141 в интерфероне-β, защищенный защитной группой, перед указанным этапом снятия защиты Цис.
Далее, в одном варианте осуществления способ получения гликозилированного полипептида из настоящего изобретения характеризуется тем, что гликозилированный полипептид подвергают тепловой обработке перед этапом удаления защитной группы с Цис.
Далее, другой аспект из настоящего изобретения относится к гликозилированному полипептиду, характеризующемуся тем, что гликозилированный полипептид является полипептидом, выбранным из группы, состоящей из:
(a) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1;
(b) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID №: 1, в которой одна или несколько аминокислот удалены, заменены или добавлены;
(c) аналога интерферона-β; и
(d) гликозилированного полипептида, имеющего 80% или более гомологии с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID №: 1;
где полипептид имеет сахарную цепь на аминокислоте, соответствующей положению 80 в интерфероне-β, и
указанная сахарная цепь является дисиало-сахарной цепью, имеющей карбоксигруппу из сиаловой кислоты, присутствующую на невосстанавливающем конце сахарной цепи, представленной следующей формулой (с).
[Химическая формула 5]
(где R представлено -COOBn, -COOEt, -COOMe, -COOCH2COPh, -COOCH2PhOMe, -COOCH2Ph(OMe)2, -COOCH2PhNO2, или -COOCH2Ph(NO2)2. Bn указьюает бензильную группу, Et указьшает этильную группу, Me указывает метальную группу, a Ph указывает фенильную группу).
Далее, другой аспект настоящего изобретения относится к способу получения гликозилированного полипептида, характеризующемуся тем, что он включает этап удаления защитной группы из карбоксигруппы сиаловой кислоты, присутствующей на невосстанавливающем конце сахарной цепи в указанном гликозилированном полипептиде, имеющем сахарную цепь, содержащую защищенную карбоксигруппу сиаловой кислоты.
Так, в одном варианте осуществления способ получения гликозилированного полипептида из настоящего изобретения характеризуется тем, что он дополнительно включает этап приготовления указанного гликозилированного полипептида, имеющего сахарную цепь, содержащую защищенную карбоксигруппу сиаловой кислоты перед этапом снятия защиты указанной карбоксигруппы указанной сиаловой кислоты.
Далее, гликозилированный полипептид из способа получения из настоящего изобретения характеризуется тем, что он дополнительно включает этап фолдинга указанного гликозилированного полипептида.
Эффекты, достигаемые настоящим изобретением
Поскольку гликозилированный полипептид из настоящего изобретения имеет однородную структуру сахарной цепи, имеется малая вариация между сериями, и можно обеспечить гликозилированный полипептид, обладающий активностью интерферона-β, со стабильным качеством. Далее, можно сделать однородным тип связи сахарной цепи, и можно оптимизировать структуру сахарной цепи, в соответствии с заданной целью.
Далее, поскольку гликозилированный полипептид из настоящего изобретения можно подвергать тепловой обработке, можно предотвратить контаминацию вирусом или неизвестным генетическим материалом. Краткое описание чертежей
Фигура 1 является схематической диаграммой этапа сшивания гликопептидного фрагмента В, имеющего аминокислоты в положениях 68-88, и пептидного фрагмента С, имеющего аминокислоты в положениях 89-166 в аминокислотной последовательности интерферона-β в одном варианте получения гликозилированного полипептида из настоящего изобретения.
Фигура 2 является схематической диаграммой этапа сшивания пептидного фрагмента А, имеющего аминокислоты в положениях 1-67, и гликопептидного фрагмента (В+С), имеющего аминокислоты в положениях 68-166 в аминокислотной последовательности интерферона-β в одном варианте получения гликозилированного полипептида из настоящего изобретения.
Фигура 3 является схематической диаграммой этапа восстановления частного цистеина гликопептидного фрагмента (А+В+С), содержащего аминокислоты в положениях 1-166 в аминокислотной последовательности интерферона-β, приготовленного путем сшивания в аланине в одном варианте получения гликозилированного полипептида из настоящего изобретения.
Фигура 4 является схематической диаграммой, показывающей этап удаления защитной группы с цистеина, выполненного на гликопептидном фрагменте (А+В+С), содержащем аминокислоты в положениях 1-166 в аминокислотной последовательности интерферона-β, приготовленной путем сшивания после этапа восстановления в аланин в одном варианте получения гликозилированного полипептида из настоящего изобретения.
Фигура 5 демонстрирует данные ВЭЖХ (А) и масс-спектрометрии с ионизацией электрораспылением (ИЭР-МС) (В) для гликопептидного фрагмента (11), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 6 демонстрирует аминокислотную последовательность гликопептидного фрагмента (11), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 7 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (12), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 8 демонстрирует аминокислотную последовательность гликопептидного фрагмента (12), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 9 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (13), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 10 демонстрирует аминокислотную последовательность гликопептидного фрагмента (13), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 11 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (14), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 12 демонстрирует аминокислотную последовательность гликопептидного фрагмента (14), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 13 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (15), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 14 демонстрирует аминокислотную последовательность гликопептидного фрагмента (15), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 15 демонстрирует данные по чистоте гликопептидного фрагмента (15), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения по результатам ВЭЖХ.
Фигура 16 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (5), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 17 демонстрирует аминокислотную последовательность гликопептидного фрагмента (5), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 18 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (6), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 19 демонстрирует аминокислотную последовательность гликопептидного фрагмента (6), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 20 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (7), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 21 демонстрирует аминокислотную последовательность гликопептидного фрагмента (7), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 22 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (8), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 23 демонстрирует аминокислотную последовательность гликопептидного фрагмента (8), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 24 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (9), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 25 демонстрирует аминокислотную последовательность гликопептидного фрагмента (9), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 26 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (10), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 27 демонстрирует аминокислотную последовательность гликопептидного фрагмента (10), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 28 демонстрирует данные по чистоте гликопептидного фрагмента (10), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 29 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (18), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 30 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (19), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 31 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (20), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 32 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (21), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 33 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (22), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 34 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (23), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 35 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (24), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 36 демонстрирует схематическую диаграмму аминокислотной последовательности полипептида (7) с присоединенной дибензил-дисиало-сахарной цепью, имеющего Цис в положениях 17, 31 и 141, защищенные Аст группой, которая является одним вариантом осуществления гликозилированного полипептида из настоящего изобретения, и данные ВЭЖХ и ИЭР-МС анализа указанного полипептида (7) с присоединенной дибензил-дисиало-сахарной цепью до и после тепловой обработки. Фигуры 36а и 36с показывают данные ИЭР-МС до тепловой обработки, а Фигуры 36b и 36е показывают данные ИЭР-МС после тепловой обработки. Далее, Фигура 36d демонстрирует данные ВЭЖХ анализа до тепловой обработки, а Фигура 36f демонстрирует данные ВЭЖХ анализа после тепловой обработки.
Фигура 37 демонстрирует схематическую диаграмму аминокислотной последовательности полипептида (8) с присоединенной дибензил-дисиало-сахарной цепью, имеющего Цис в положениях 17, 31 и 141, защищенные Аст группой, которая является одним вариантом осуществления гликозилированного полипептида из настоящего изобретения, и данные ВЭЖХ и ИЭР-МС анализа указанного полипептида (8) с присоединенной дибензил-дисиало-сахарной цепью до и после тепловой обработки. Фигуры 37а и 37 с показывают данные ИЭР-МС до тепловой обработки, а Фигуры 37b и 37е показывают данные ИЭР-МС после тепловой обработки. Далее, Фигура 37d демонстрирует данные ВЭЖХ анализа до тепловой обработки, а Фигура 37f демонстрирует данные ВЭЖХ анализа после тепловой обработки.
Фигура 38 показывает данные анализа аффинности по отношению к рецептору ИФН- α/β 2 для химически синтезированного гликозилированного полипептида (не подвергнутого тепловой обработке), являющегося одним вариантом осуществления настоящего изобретения.
Фигура 39 показывает данные анализа аффинности по отношению к рецептору ИФН- α/β 2 для химически синтезированного гликозилированного полипептида (подвергнутого тепловой обработке), являющегося одним вариантом осуществления настоящего изобретения.
Фигура 40 демонстрирует данные фармакокинетического анализа, когда химически синтезированный гликозилированный полипептид, являющийся одним вариантом осуществления настоящего изобретения, применяли у мышей. ИФН-β Mochida, приготовленный посредством биосинтеза, использовали в качестве контроля. На Фигуре 40А показаны данные, полученные при внутривенном введении, а на 40В показаны данные, полученные при подкожном введении.
Фигура 41 демонстрирует противоопухолевую активность химически синтезированного гликозилированного полипептида, являющегося одним вариантом осуществления настоящего изобретения. В качестве контроля использовали ФБР (группа для контроля с растворителем) и ИФН-β Mochida, приготовленный посредством биосинтеза.
Фигура 42 демонстрирует данные, сравнивающие супрессорную активность в отношении клеточной пролиферации для химически синтезированного гликозилированного полипептида, который является одним вариантом осуществления настоящего изобретения, между полипептидом, прошедшим и не прошедшим тепловую обработку.
Фигура 43 является схематической диаграммой, демонстрирующей этап сшивания пептидного фрагмента В2, содержащего аминокислоты в положениях 68-75, и гликопептидного фрагмента В1, содержащего аминокислоты в положениях 76-88 в аминокислотной последовательности интерферона-β в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 44 является схематической диаграммой, демонстрирующей этап метилирования тиоловой группы (-SH) частного цистеина из гликопептидного фрагмента (В1+В2), содержащего аминокислоты в положениях 68-88 в аминокислотной последовательности интерферона-β, приготовленного путем сшивки в метилтиогруппу (-SMe) в одном варианте получения гликозилированного полипептида из настоящего изобретения.
Фигура 45 является схематической диаграммой, демонстрирующей этап интрамолекулярной ацильной транслокации, в которой цистеин, содержащий метилированную тиоловую группу (-SMe) на гликопептидном фрагменте (В1+В2), превращается в серии в одном варианте получения гликозилированного полипептида из настоящего изобретения.
Фигура 46 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (25), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 47 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (26), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 48 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (27), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 49 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (28), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Фигура 50 демонстрирует данные ВЭЖХ (А) и ИЭР-МС (В) для гликопептидного фрагмента (29), полученного в одном варианте производства гликозилированного полипептида из настоящего изобретения.
Описание вариантов осуществления
«Интерферон-β» или «ИФН-β» означает полипептид, содержащий последовательность из 166 аминокислот, представленных SEQ ID №1. Интерферон-β содержит дисульфидную связь между цистеинами в положениях 31 и 141 в аминокислотной последовательности, указанной ниже. Далее, «интерферон-β» предпочтительно имеет аминокислотную последовательность, указанную ниже (SEQ ID №1), и соответствует интерферону-β-1а человеческого типа, имеющему сахарную цепь. Интерферон-β-1а имеет сахарную цепь, добавленную к аспарагину в положении 80 аминокислотной последовательности, указанной ниже.
Термин «аминокислота» в настоящей заявке применяется в самом широком значении, и включает не только природные аминокислоты, но также неприродные аминокислоты, такие как варианты и производные аминокислот. Специалисту в данной области техники понятно в свете этого широкого определения, что примеры аминокислот включают, например, природные протеиногенные L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как варианты и производные аминокислот; природные непротеиногенные аминокислоты, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, обладающие свойствами, хорошо известными в области характеристик аминокислот. Примеры неприродных аминокислот включают α-метиламинокислоту (такую, как α-метилаланин), D-аминокислоту, гистидино-подобную аминокислоту (такую как 2-аминогистидин, β-гидроксигистидин, гомогистидин, α-фторметилгистидин и α-метилгистидин), аминокислоту, имеющую избыток метиленов на боковой цепи («гомо» аминокислоту), и аминокислоту, в которой аминокислота с карбоксильной функциональной группой в боковой цепи замещена сульфонатной группой (такой как цистеиновая кислота). В предпочтительном аспекте аминокислота, содержащаяся в соединении из настоящего изобретения, состоит только из природных аминокислот.
Как применяется в настоящей заявке, когда одна или несколько аминокислот в аминокислотной последовательности удаляются, замещаются или добавляются, число замещенных и т.д. аминокислот не ограничивается конкретно, с тем условием, чтобы сохранялась активность интерферона-β, но означает, что, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот различаются. Альтернативно, также включается случай, когда 20% или менее, или предпочтительно 10% или менее аминокислот по длине полной аминокислотной последовательности являются различными. Замещаемая или добавляемая аминокислота может быть природной аминокислотой, неприродной аминокислотой, или аналогом аминокислоты, предпочтительно природной аминокислотой.
«Пептидный фрагмент» означает пептидный фрагмент, имеющий последовательность части аминокислотной последовательности окончательного гликозилированного полипептида при получении гликозилированного пептида из настоящего изобретения. Далее, «гликозилированный пептидный фрагмент» или «гликопептидный фрагмент» в настоящей заявке означает пептидный фрагмент, содержащий гликозилированную аминокислоту в аминокислотной последовательности такого пептидного фрагмента. Гликозилир