Новый пептид, имеющий 4 связанных ctl-эпитопа
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к иммунологии, и может быть использовано в медицине для индуцирования противоопухолевого иммунитета против экспрессирующего Lck, WHSC2, SART2, SART3, UBE2V, EGFR, PTHrP или MRP3 рака. Получают пептид из 4 эпитопов CTL раковых антигенов, соединенных через аминокислотные линкеры. Полученный пептид используют для стимуляции лимфоцитов периферической крови с целью получения комбинации CTL, специфичных к раковому антигену. Изобретение позволяет получить пептидную вакцину для лечения рака у широкого ряда раковых пациентов без необходимости HLA-типирования и независимо от типов HLA у пациентов. 6 н. и 5 з.п. ф-лы, 17 ил., 4 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому пептиду, который полезен в качестве ракового антигенного пептида. Более конкретно, настоящее изобретение относится к новому раковому антигенному пептиду, имеющему 4 связанных пептида, способных к индукции CTL-ответов, ограниченных HLA-A, и к фармацевтической композиции, в которой он используется.
Уровень техники
Рак является ведущей причиной смерти в Японии. Около 350 000 пациентов умирают каждый год от рака, и в настоящее время рак по-прежнему представляет собой тяжелое заболевание. Принятыми на сегодняшний день подходами к лечению рака являются хирургическая резекция, химиотерапия и лучевая терапия. Однако такие стратегии лечения являются проблематичными с точки зрения, например, рецидивов заболевания, снижения качества жизни, а также отсутствия вариантов лечения в случае поздних стадий рака, которые не могут быть вылечены с использованием стратегий, описанных выше.
Иммунотерапия рака (противораковые вакцины) является долгожданной новой терапевтической методикой, а клинические исследования противораковых пептидных вакцин повсеместно были начаты в 1990 году, когда стали идентифицировать эпитопные пептиды в опухолевых антигенах человека. По результатам анализа клинических исследований, проведенных путем введения пептида, одного или в комбинации с другими агентами, уровень ответа однако составлял всего лишь 2,7% на 1000 или более случаев (Rosenberg SA et al., Nature Med., 2004, 10 (9): 909-15). Таким образом были выявлены трудности в практическом применении этого подхода.
При этом в Японии уже в течение длительного периода времени продолжаются клинические исследования, включающие использование конкретных пептидных вакцин против рака, а достижения таких исследований постепенно публикуются. В последние годы с целью улучшения результатов была предпринята попытка использования стратегии введения нескольких раковых пептидов вместо одного типа ракового пептида. Например, заранее исследовали тип HLA и специфические иммунные реакции у пациента с целью проведения персонализированного лечения рака с использованием пептидных вакцин, включающего в себя выбор нескольких соответствующих пептидов для введения, и были проверены их безопасность и противоопухолевое действие. Посредством введения персонализированных пептидных вакцин по отдельности или в комбинации с противораковыми препаратами, в частности, были достигнуты превосходные клинические эффекты и безопасность в случаях опухоли головного мозга, рака шейки матки, рака предстательной железы и рака поджелудочной железы Клеточный иммунитет, опосредуемый эпитоп-специфичными цитотоксическими Т-лимфоцитами (далее сокращенно именуемыми «CTL»), которые считаются основными эффекторными клетками при лечении рака с использованием пептидных вакцин, является HLA-ограниченным. Соответственно, была предпринята попытка создания противораковых пептидных вакцин, избирательно направленных на пациентов с определенным типом HLA, в частности с HLA-A2 или HLA-A24, из-за большого числа пациентов с данными типами HLA.
Однако японцы с двумя такими типами HLA составляют примерно 40% и 60%, соответственно (Sette, A. et al., Immunogenetics, 1999, 50 (3-4): 201-12). К сожалению, пациенты с другими типами HLA не могут получить выгоды от таких пептидных противораковых вакцин. Кроме того, начало лечения будет отложено из-за выполнения HLA-типирования до начала лечения, и это приведет к увеличению нагрузки на пациентов. Соответственно, желательно проведение исследований и создание пептидных противораковых вакцин, которые можно использовать у всех раковых пациентов без HLA-типирования.
В отношении лечения рака с использованием пептидных вакцин, кроме активации CTL как одного из составляющих клеточного иммунитета, известно, что с выживаемостью связана индукция синтеза иммуноглобулинов, известная как гуморальный иммунитет (Noguchi, M. et al., Cancer Biol. Ther., 2011, 10 (12):1266-79).
Краткое изложение сущности изобретения
Цели, которые должны быть достигнуты с помощью изобретения
Целью настоящего изобретения является создание ракового антигенного пептида, который может быть введен в качестве противораковой пептидной вакцины широкому кругу раковых пациентов и который может вызывать сильный гуморальный ответ, независимо от типов HLA у пациентов.
Средства достижения целей
Авторы настоящего изобретения получили пептид, содержащий от 4 связанных CTL-эпитопа, путем связывания через линкеры 4 пептидов, выбранных из числа CTL-эпитопных пептидов, которые, как сообщалось, способны индуцировать CTL-ответ, ограниченный супертипом HLA-A2, HLA-A24, HLA-A26 или HLA-A3, или множество CTL-ответов, ограниченных HLA-A. Авторы настоящего изобретения провели направленное исследование подобного пептида, имеющего 4 связанных CTL-эпитопа, для достижения вышеуказанных целей. В результате они обнаружили, что пептид, имеющий 4 связанных CTL-эпитопа, состоящих из определенных 13 видов пептидов, выбранных из числа CTL-эпитопных пептидов, полученных из известных молекул опухолевых антигенов, могут быть введены широкому кругу раковых пациентов без необходимости типирования HLA и независимо от HLA-типа пациентов. Они также обнаружили, что введение такого пептида, имеющего 4 связанных CTL-эпитопа, может вызвать сильный гуморальный ответ в дополнение к индукции CTL, специфичных к CTL-эпитопным пептидам, составляющим такой пептид. Это привело к завершению настоящего изобретения.
Более конкретно, настоящее изобретение имеет следующие признаки.
[1] пептид, имеющий 4 связанных эпитопа, где 4 эпитопных пептида выбраны, необязательно, с дублированием, из группы, состоящей из CTL-эпитопных пептидов: пептида, приведенного в SEQ ID NO:1 (PEP1); пептида, приведенного в SEQ ID NO:2 (PEP2); пептида, приведенного в SEQ ID NO:4 (PEP4); пептида, приведенного в SEQ ID NO:5 (PEP5); пептида, приведенного в SEQ ID NO:6 (PEP6); пептида, приведенного в SEQ ID NO:7 (PEP7); пептида, приведенного в SEQ ID NO:8 (PEP8); пептида, приведенного в SEQ ID NO:9 (PEP9); пептида, приведенного в SEQ ID NO:10 (PEP10); пептида, приведенного в SEQ ID NO:13 (PEP13); пептида, приведенного в SEQ ID NO:15 (PEP15); пептида, приведенного в SEQ ID NO:17 (PEP17); и пептида, приведенного в SEQ ID NO:18 (PEP18), связанных с помощью линкеров, причем пептид, имеющий 4 связанных эпитопа, необязательно, содержит другие пептидные последовательности, состоящие из гидрофильных аминокислот, и пептид, имеющий 4 связанных эпитопа, имеет один или несколько признаков, выбранных из признаков (1)-(5) ниже:
(1) пептид содержит PEP2 на С-конце (за исключением пептида, содержащего PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке с N-конца через линкер);
(2) пептид содержит PEP4 на С-конце;
(3) пептид содержит PEP10 на С-конце;
(4) пептид содержит PEP6 и PEP5 на С-конце, последовательно расположенных в таком порядке с N-конца через линкер; и
(5) пептид содержит PEP5, PEP6, PEP9 и PEP18.
[2] Пептид, имеющий 4 связанных эпитопа по п.[1], который содержит 4 недублированных пептида, выбранных из PEP1, PEP2, PEP4, PEP5, PEP6, PEP7, PEP8, PEP9, PEP10, PEP13, PEP15, PEP17 и PEP18.
[3] Пептид, имеющий 4 связанных эпитопа по п.[1] или [2], имеющий любой один из признаков, выбранных из признаков (1)-(5) ниже:
(1) пептид содержит 3 CTL-эпитопных пептида, выбранных из PEP1, PEP7, PEP8 и PEP13, а PEP2 расположен на С-конце пептида (за исключением пептида, содержащего PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке с N-конца через линкер);
(2) пептид содержит 3 CTL-эпитопных пептида, PEP5, PEP6 и PEP9, а РЕР4 расположен на С-конце пептида;
(3) пептид содержит 3 CTL-эпитопных пептида, выбранных из PEP1, PEP13, PEP15, PEP17 и PEP18, а PEP10 расположен на С-конце пептида;
(4) пептид содержит 2 CTL-эпитопных пептида, PEP1 и PEP7, а PEP6 и PEP5 последовательно расположены на C-конце в таком порядке с N-конца через линкер; и
(5) пептид содержит 3 CTL-эпитопных пептида, PEP5, PEP6 и PEP18, а PEP9 расположен на С-конце пептида.
[4] Пептид, имеющий 4 связанных эпитопа по любому из пп.[1]-[3], который содержит последовательность, выбранную из нижеследующих последовательностей, в которых «-(L)-» представляет собой линкер:
- PEP5-(L)-PEP6-(L)-PEP9-(L)-PEP4;
- PEP9-(L)-PEP5-(L)-PEP6-(L)-PEP4;
- PEP6-(L)-PEP5-(L)-PEP9-(L)-PEP4;
- PEP6-(L)-PEP9-(L)-PEP5-(L)-PEP4;
- PEP9-(L)-PEP6-(L)-PEP5-(L)-PEP4;
- PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP4;
- PEP1-(L)-PEP7-(L)-PEP8-(L)-PEP2;
- PEP1-(L)-PEP8-(L)-PEP7-(L)-PEP2;
- PEP7-(L)-PEP1-(L)-PEP8-(L)-PEP2;
- PEP8-(L)-PEP7-(L)-PEP1-(L)-PEP2;
- PEP8-(L)-PEP1-(L)-PEP7-(L)-PEP2;
- PEP7-(L)-PEP13-(L)-PEP8-(L)-PEP2;
- PEP8-(L)-PEP13-(L)-PEP7-(L)-PEP2;
- PEP13-(L)-PEP7-(L)-PEP8-(L)-PEP2;
- PEP8-(L)-PEP7-(L)-PEP13-(L)-PEP2;
- PEP13-(L)-PEP8-(L)-PEP7-(L)-PEP2;
- PEP13-(L)-PEP15-(L)-PEP18-(L)-PEP10;
- PEP13-(L)-PEP18-(L)-PEP15-(L)-PEP10;
- PEP15-(L)-PEP13-(L)-PEP18-(L)-PEP10;
- PEP15-(L)-PEP18-(L)-PEP13-(L)-PEP10;
- PEP18-(L)-PEP13-(L)-PEP15-(L)-PEP10;
- PEP18-(L)-PEP15-(L)-PEP13-(L)-PEP10;
- PEP1-(L)-PEP15-(L)-PEP18-(L)-PEP10;
- PEP1-(L)-PEP18-(L)-PEP15-(L)-PEP10;
- PEP15-(L)-PEP1-(L)-PEP18-(L)-PEP10;
- PEP15-(L)-PEP18-(L)-PEP1-(L)-PEP10;
- PEP18-(L)-PEP1-(L)-PEP15-(L)-PEP10;
- PEP18-(L)-PEP15-(L)-PEP1-(L)-PEP10;
- PEP15-(L)-PEP17-(L)-PEP13-(L)-PEP10;
- PEP15-(L)-PEP13-(L)-PEP17-(L)-PEP10;
- PEP17-(L)-PEP15-(L)-PEP13-(L)-PEP10;
- PEP17-(L)-PEP13-(L)-PEP15-(L)-PEP10;
- PEP13-(L)-PEP17-(L)-PEP15-(L)-PEP10;
- PEP13-(L)-PEP15-(L)-PEP17-(L)-PEP10;
- PEP6-(L)-PEP18-(L)-PEP5-(L)-PEP9;
- PEP6-(L)-PEP5-(L)-PEP18-(L)-PEP9;
- PEP1-(L)-PEP7-(L)-PEP6-(L)-PEP5; и
- PEP7-(L)-PEP1-(L)-PEP6-(L)-PEP5.
[5] Пептид, имеющий 4 связанных эпитопа по любому из пп.[1]-[4], где линкер представляет собой аминокислотный линкер.
[6] Пептид, имеющий 4 связанных эпитопа по любому из пп.[1]-[5], в котором аминокислотный линкер представляет собой аргининовый димер или аргининовый тример, состоящий из двух или трех остатков аргинина, связанных друг с другом.
[7] Пептид, имеющий 4 связанных эпитопа по любому из пп.[1]-[6], где другая пептидная последовательность, состоящая из гидрофильных аминокислот связана с N-концом.
[8] Пептид, имеющий 4 связанных эпитопа по любому из пп.[1]-[7], в котором другая пептидная последовательность, состоящая из гидрофильных аминокислот, состоит из аргининового тримера или аргининового тетрамера, состоящего из трех или четырех остатков аргинина, связанных друг с другом.
[9] Пептид, имеющий 4 связанных эпитопа по любому из пп.[1]-[8], который состоит из аминокислотной последовательности, приведенной в SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65 или SEQ ID NO:66.
[10] CTL, полученный путем стимуляции лимфоцитов периферической крови с использованием пептида, содержащего 4 связанных эпитопа по любому из пп.[1]-[9].
[11] Фармацевтическая композиция, содержащая в качестве действующего ингредиента пептид, имеющий 4 связанных эпитопа по любому из пп.[1]-[9}, или CTL по п.[10].
[12] Фармацевтическая композиция, содержащая два или несколько пептидов, выбранных из числа пептидов, имеющих 4 связанных эпитопа по любому из пп.[1]-[9].
[13] Фармацевтическая композиция по п.[11] или [12], которая представляет собой иммунотерапевтический агент.
[14] Способ лечения рака, включающий введение раковому пациенту пептида, содержащего 4 связанных эпитопа по любому из пп.[1]-[9], CTL по п.[10] или фармацевтическую композицию по любому из пп.[11]-[13].
Это описание включает часть или все содержание, раскрытые в описаниях и/или чертежах патентных заявок Японии № 2013-218524 и 2014-155132, которые являются приоритетными документами настоящей заявки.
Эффекты изобретения
В настоящем изобретении предложен раковый антигенный пептид, который может быть введен широкому кругу раковых пациентов в качестве пептидной вакцины против рака, и который может индуцировать сильный гуморальный ответ, независимо от HLA-типа пациентов.
Пептид, имеющий 4 связанных CTL-эпитопа по настоящему изобретению, может быть введен широкому кругу раковых пациентов без необходимости типирования HLA. Примеры таких пациентов включают в себя HLA-A2-положительных пациентов, HLA-A24-положительных пациентов, HLA-A26-положительных пациентов и HLA-A3 супертип-положительных пациентов. Пептид, как описано выше, может быть использован для лечения и/или профилактики рака или заболеваний, им вызванных, у таких пациентов. Кроме того, экспрессия опухолевых антигенов, составляющих пептид, имеющий 4 связанных CTL-эпитопа по настоящему изобретению, наблюдается во множестве типов раков. Таким образом, пептид, имеющий 4 связанных CTL-эпитопа по настоящему изобретению, может быть использован в качестве фармацевтической композиции (и, более конкретно, в качестве иммунотерапевтического агента) для лечения и/или профилактики различных видов рака. Посредством введения пептида, имеющего 4 связанных CTL-эпитопа по настоящему изобретению, дополнительно можно индуцировать специфичные к CTL-эпитопному пептиду CTL и синтез иммуноглобулинов в более сильной степени по сравнению с введением смеси эквивалентного количества CTL-эпитопных пептидов, и можно более эффективно активировать противоопухолевый иммунитет.
Краткое описание чертежей
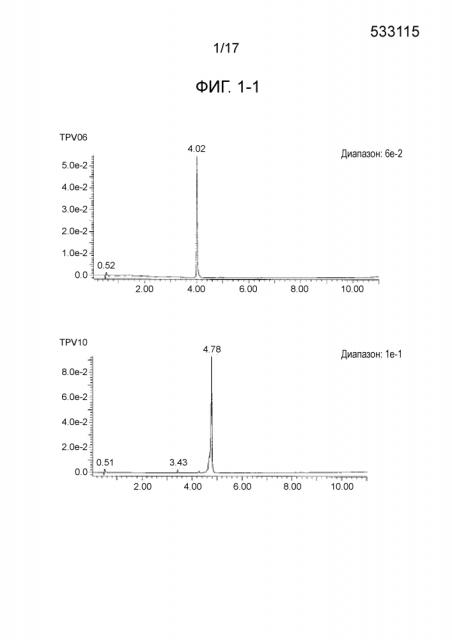
На фиг. 1-1 показаны результаты ВЭЖХ для пептидов, имеющих 4 связанных эпитопа, полученных в примере 1 (TPV06, TPV10, TPV12, TPV21, TPV26, TPV30, TPV35,TPV37, TPV39, TPV40, TPV41, TPV43 и TPV45).
Фиг. 1-2 является продолжением фиг. 1-1.
Фиг. 1-3 является продолжением фиг. 1-2.
Фиг. 1-4 является продолжением фиг. 1-3.
Фиг. 1-5 является продолжением фиг. 1-4.
Фиг. 1-6 является продолжением фиг. 1-5.
Фиг. 1-7 является продолжением фиг. 1-6.
На фиг. 2-1 показаны результаты масс-спектрометрии (MS) для пептидов, имеющих 4 связанных эпитопа, полученных в примере 1 (TPV39, TPV40, TPV41, TPV43 и TPV45).
Фиг. 2-2 является продолжением фиг. 2-1.
Фиг. 2-3 является продолжением фиг. 2-2.
На фиг. 3-1 показаны результаты индукции эпитоп-специфичных CTL в мышах, которым был введен пептид, имеющий 4 связанных эпитопы (*: неисследованные). На фиг. 3-1 дополнительно показаны результаты оценки, достигнутые расщеплением пептида, имеющего 4 связанных эпитопа, человеческими иммунопротеасомами и изучением расщепления С-конца идентифицированных эпитопных пептидов PEP2 или PEP10.
Фиг. 3-2 является продолжением фиг. 3-1.
Фиг. 3-3 является продолжением фиг. 3-2.
На фиг. 3-4 показаны результаты индукции эпитоп-специфичных CTL в мышах, которым были введены пептид, имеющий 4 связанных эпитопа, содержащий пептидную последовательность остатков аргинина на N-конце, или пептид, имеющий 4 связанных эпитопа, содержащий аргининовый тример в качестве пептид-пептидного линкера (*: неисследованные). На фиг. 3-4 дополнительно показаны результаты оценки, достигнутые расщеплением пептида, имеющего 4 связанных эпитопа, человеческими иммунопротеасомами и изучением расщепления С-конца идентифицированных эпитопных пептидов PEP2 или PEP10.
На фиг. 4-1 показаны результаты анализа титра эпитоп-специфичных IgG антител в сыворотке мышиных моделей, которым вводили пептид, имеющий 4 связанных эпитопа.
Фиг. 4-2 является продолжением фиг. 4-1.
На фиг. 4-3 приведены результаты анализа титра эпитоп-специфичных IgG антител в сыворотке мышиных моделей, которым вводили пептид, имеющий 4 связанных эпитопа, содержащий пептидную последовательность остатков аргинина на N-конце, или пептид, имеющий 4 связанных эпитопа, содержащий аргининовый тример в качестве пептид-пептидного линкера.
Варианты осуществления изобретения
Далее настоящее изобретение будет описано более подробно.
1. Пептид, имеющий 4 связанных CTL-эпитопа
В настоящем изобретении термин «пептид, имеющий 4 связанных CTL-эпитопа» означает 4 пептида, выбранных из числа CTL-эпитопных пептидов, полученных из одной и/или разных молекул опухолевых антигенов, линейно связанных через линкеры в качестве единой молекулы.
«CTL-эпитопный пептид, полученный из молекул опухолевых антигенов» представляет собой пептид, получаемый в результате деградации опухолевых антигенов внутри опухолевых клеток, и он связан с молекулой HLA I класса и представлен на клеточной поверхности. Таким образом, он распознается опухоль-специфичными CTL, и/или он может индуцировать и/или активировать опухоль-специфичные CTL. «Индукция опухоль-специфических CTL» относится к дифференцировке и/или пролиферации CTL, которые специфично распознают CTL-эпитопные пептиды, полученные из молекул опухолевых антигенов in vitro or in vivo. Кроме того, «активация опухоль-специфичных CTL» относится к продукции интерферона-γ (IFN-γ) и/или проявлению цитотоксической активности путем высвобождения цитотоксических веществ или аналогичных соединений, когда CTL распознает антиген, представленный молекулой HLA I класса. «CTL-эпитопный пептид, полученный из молекулы опухолевого антигена» в контексте данного изобретения иногда называют «CTL-эпитопным пептидом».
В качестве CTL-эпитопных пептидов, полученных из молекул опухолевых антигенов, известны приведенные ниже:
PEP1: KLVERLGAA (SEQ ID NO:1 [WO 200l/0l1044]);
PEP2: ASLDSDPWV (SEQ ID NO:2 [WO 2002/010369]);
PEP3: ALVEFEDVL (SEQ ID NO:3 [WO 2002/010369]);
PEP4: LLQAEAPRL (SEQ ID NO:4 [WO 2000/12701]);
PEP5: DYSARWNEI (SEQ ID NO:5 [JP H11-318455 A (1999)]);
PEP6: VYDYNCHVDL (SEQ ID NO:6 [WO 2000/12701]);
PEP7: LYAWEPSFL (SEQ ID NO:7 [JP 2000-000270 A]);
PEP8: DYLRSVLEDF (SEQ ID NO:8 [WO 2001/011044]);
PEP9: QIRPIFSNR (SEQ ID NO:9 [WO 2008/007711]);
PEP10: ILEQSGEWWK (SEQ ID NO:10 [WO 2009/022652]);
PEP11: VIQNLERGYR (SEQ ID NO:11 [WO 2009/022652]);
PEP12: KLKHYGPGWV (SEQ ID NO:12 [WO 1999/067288]);
PEP13: RLQEWCSVI (SEQ ID NO:13 [WO 2002/010369]);
PEP14: ILGELREKV (SEQ ID NO:14 [WO 2002/010369]);
PEP15: DYVREHKDNI (SEQ ID NO:15 [WO 2005/071075]);
PEP16: HYTNASDGL (SEQ ID NO:16 [WO 2001/011044]);
PEP17: NYSVRYRPGL (SEQ ID NO:17 [JP 2000-000270 A]);
PEP18: RYLTQETNKV (SEQ ID NO:18 [JP 2007-145715 A]); and
PEP19: TFDYLRSVL (SEQ ID NO:19 [WO 2001/011044]).
PEP1, PEP2, PEP3, PEP4, PEP5, PEP8, PEP10, PEP12, PEP13, PEP14 и PEP15 ограничены HLA-A2, и CTL тогда могут быть индуцированы и/или активированы. PEP2, PEP5, PEP6, PEP7, PEP8, PEP12, PEP13, PEP15, PEP16, PEP17, PEP18 и PEP19 ограничены HLA-A24, и CTL тогда могут быть индуцированы и/или активированы. PEP1, PEP2, PEP4, PEP5, PEP6, PEP9, PEP10, PEP11, PEP12, PEP13, PEP15 и PEP16 ограничены супертипом HLA-A3, и CTL тогда могут быть индуцированы и/или активированы. Дополнительно, PEP2 и PEP6 ограничены HLA-A26, и CTL затем могут быть индуцированы и/или активированы. Экспрессия генов, кодирующих такие CTL-эпитопные пептиды, наблюдается в множестве типов раков (Yang, D. et al., Cancer Res., 1999, 59: 4056-63; Harashima, N. et al., Eur. J. Immunol., 2001, 31 (2), 323-32).
Различные типы пептидов, имеющих 4 связанных CTL-эпитопа, которые получены путем линейного связывания 4 типов CTL-эпитопных пептидов, выбранных из конкретных 13 видов CTL-эпитопных пептидов, описанных выше, с помощью линкеров в виде единой молекулы могут служить в качестве «пептидов, имеющих 4 связанных CTL-эпитопа» по настоящему изобретению. Три из больше CTL, специфичных к соответствующим CTL-эпитопным пептидам, могут быть индуцированы и/или активированы. Пептиды, которые невозможно напрямую оценить в отношении индукции CTL, специфичных к эпитопному пептиду (а именно, PEP2 и PEP10), могут быть подвергнуты расщеплению иммунопротеасомами (пример 3), для того чтобы определить возникновение индукции CTL, специфичных к эпитопному пептиду. В общем, антигенные белки, которые находятся в антиген-представляющих клетках, как известно, расщепляются с помощью протеасом или иммунопротеасом, и такая процедура, как известно, необходима антигенным белкам для опосредованного HLA представления антигенов (например, Rock K.L., York, I.A., Goldberg, A.L., Nat. Immunol., 2004, 5(7): 670-677). Необходимо, чтобы CTL-эпитопные пептиды расщеплялись в соответствующих участках, что позволяет таким эпитопным пептидам связываться с карманами в HLA. Необходимо, чтобы С-концевые аминокислоты CTL-эпитопных пептидов определялись в результате расщепления протеасомами или иммунопротеасомами (Rock K.L., York, I.A., Goldberg, A.L., Nat. Immunol., 2004, 5(7): 670-677). Предполагается, что при введении человеку пептидов, имеющих 4 связанных эпитопа, CTL-эпитопные пептиды будут представляться дендритными клетками. Исходя из такого предположения, картина расщепления пептидов, имеющих 4 связанных эпитопа, была проанализирована in vitro с использованием иммунопротеасом, экспрессируемых в дендритных клетках на высоком уровне. Когда CTL-эпитопные пептиды появляются в результате расщепления иммунопротеасомами, можно определить, что индуцируются CTL, специфичные к таким эпитопным пептидам.
В настоящем описании выбраны 4 типа CTL-эпитопных пептидов выбранных из конкретных 13 видов CTL-эпитопных пептидов, необязательно дублировано, из пептида, приведенного в SEQ ID NO:1 (PEP1), пептида, приведенного в SEQ ID NO:2 (PEP2), пептида, приведенного SEQ ID NO:4 (PEP4), пептида, приведенного SEQ ID NO:5 (PEP5), пептида, приведенного SEQ ID NO: 6 (PEP6), пептида, приведенного SEQ ID NO:7 (PEP7), пептида, приведенного SEQ ID NO:8 (PEP8), пептида, приведенного SEQ ID NO:9 (PEP9), пептида, приведенного в SEQ ID NO:10 (PEP10), пептида, приведенного SEQ ID NO:13 (PEP13), пептида, приведенного SEQ ID NO:15 (PEP15), пептида, приведенного в SEQ ID NO:17 (PEP17), и пептида, приведенного в SEQ ID NO:18 (PEP18).
В настоящем изобретении, пептид, имеющий аминокислотную последовательность, имеющую замену, вставку, удаление и/или добавление одной или нескольких аминокислот в аминокислотной последовательности PEP1, PEP2, PEP4, PEP5, PEP6, PEP7, PEP8, PEP9, PEP10, PEP13, PEP15, PEP17 или PEP18, и имеющий способность к индукции CTL и способность к индукции синтеза иммуноглобулинов, равную или более высокие, чем у исходного пептида, может быть использован в качестве «CTL-эпитопного пептида». Термин «несколько», используемый в данном описании, относится к числам от 1 до 3 и, предпочтительно, к числу 1 или 2. Примером такого пептида является пептид, полученный путем замены аминокислот, обладающих свойствами, аналогичными свойствам исходной аминокислоты (то есть пептид, полученный консервативной аминокислотной заменой).
Пептид, имеющий 4 связанных CTL-эпитопа по настоящему изобретению включает в себя 4 эпитопных пептида, которые выбраны, необязательно дублировано, из PEP1, PEP2, PEP4, PEP5, PEP6, PEP7, PEP8, PEP9, PEP10, PEP13, PEP15, PEP17 и PEP18, линейно связанных через линкеры.
Может использоваться любой линкер, при условии, что он расщепляется при введении в организм пептида, имеющего 4 связанных CTL-эпитопа, а связанные CTL-эпитопные пептиды могут быть отделены друг от друга. Примеры включают сложноэфирную связь, связь через простой эфир, амидную связь, связь через сахарную цепь, полиэтиленгликолевый линкер и аминокислотный линкер. Примеры аминокислотных последовательностей, используемых в качестве аминокислотных линкеров, включают аргининовый димер, аргининовый тример, аргининовый тетрамер, лизиновый димер, лизиновый тример, лизиновый тетрамер, глициновый димер, глициновый тример, глициновый тетрамер, глициновый пентамер, глициновый гексамер, аланин-аланин-тирозин (AAY), изолейцин-лейцин-аланин (АМП) и аргинин-валин-лизин-аргинин (RVKR), причем аргининовый димер или тример являются предпочтительными.
CTL-эпитопные пептиды, которые будут выбраны, и их расположение могут быть определены путем введения пептида, имеющего 4 связанных эпитопа, полученного путем синтеза эпитопов в заданных комбинациях и в заданном порядке, мышам, несущим трансгенный HLA-A человека, и путем оценки возникновения индукции CTL, специфичных к CTL-эпитопным пептидам, in vivo.
Предпочтительно, чтобы пептид, имеющий 4 связанных эпитопа по настоящему изобретению, имел один или несколько признаков, выбранных из признаков (1)-(5) ниже:
(1) пептид содержит PEP2 на С-конце (за исключением пептида, содержащего PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке с N-конца через линкер);
(2) пептид содержит PEP4 на С-конце;
(3) пептид содержит PEP10 на С-конце;
(4) пептид содержит PEP6 и PEP5 на С-конце, последовательно расположенных в таком порядке с N-конца через линкер; и
(5) пептид содержит PEP5, PEP6, PEP9 и PEP18.
Более предпочтительно, чтобы пептид, имеющий 4 связанных эпитопа по настоящему изобретению, имел признак, выбранный из признаков (1)-(5) ниже:
(1) пептид содержит 3 CTL-эпитопных пептида, выбранных из PEP1, PEP7, PEP8 и PEP13, а PEP2 расположен на С-конце пептида (за исключением пептида, содержащего PEP7 и PEP8 на N-конце, последовательно расположенных в таком порядке с N-конца через линкер);
(2) пептид содержит 3 CTL-эпитопных пептида, PEP5, PEP6 и PEP9, а РЕР4 расположен на С-конце пептида;
(3) пептид содержит 3 CTL-эпитопных пептида, выбранных из PEP1, PEP13, PEP15, PEP17 и PEP18, а PEP10 расположен на С-конце пептида;
(4) пептид содержит 2 CTL-эпитопных пептида, PEP1 и PEP7, а PEP6 и PEP5 последовательно расположены на C-конце в таком порядке с N-конца через линкер; и
(5) пептид содержит 3 CTL-эпитопных пептида, PEP5, PEP6 и PEP18, а PEP9 расположен на С-конце пептида.
Кроме того, предпочтительно, чтобы пептид, имеющий 4 связанных эпитопа по настоящему изобретению, содержал или состоял из последовательности, выбранной из нижеследующих последовательностей, в которых «-(L)-» представляет собой линкер:
- PEP5-(L)-PEP6-(L)-PEP9-(L)-PEP4 (TPV01);
- PEP9-(L)-PEP5-(L)-PEP6-(L)-PEP4 (TPV02);
- PEP6-(L)-PEP5-(L)-PEP9-(L)-PEP4 (TPV03);
- PEP6-(L)-PEP9-(L)-PEP5-(L)-PEP4 (TPV04);
- PEP9-(L)-PEP6-(L)-PEP5-(L)-PEP4 (TPV05);
- PEP5-(L)-PEP9-(L)-PEP6-(L)-PEP4 (TPV06);
- PEP1-(L)-PEP7-(L)-PEP8-(L)-PEP2 (TPV07);
- PEP1-(L)-PEP8-(L)-PEP7-(L)-PEP2 (TPV08);
- PEP7-(L)-PEP1-(L)-PEP8-(L)-PEP2 (TPV09);
- PEP8-(L)-PEP7-(L)-PEP1-(L)-PEP2 (TPV10);
- PEP8-(L)-PEP1-(L)-PEP7-(L)-PEP2 (TPV11);
- PEP7-(L)-PEP13-(L)-PEP8-(L)-PEP2 (TPV12);
- PEP8-(L)-PEP13-(L)-PEP7-(L)-PEP2 (TPV13);
- PEP13-(L)-PEP7-(L)-PEP8-(L)-PEP2 (TPV14);
- PEP8-(L)-PEP7-(L)-PEP13-(L)-PEP2 (TPV15);
- PEP13-(L)-PEP8-(L)-PEP7-(L)-PEP2 (TPV16);
- PEP13-(L)-PEP15-(L)-PEP18-(L)-PEP10 (TPV17);
- PEP13-(L)-PEP18-(L)-PEP15-(L)-PEP10 (TPV18);
- PEP15-(L)-PEP13-(L)-PEP18-(L)-PEP10 (TPV19);
- PEP15-(L)-PEP18-(L)-PEP13-(L)-PEP10 (TPV20);
- PEP18-(L)-PEP13-(L)-PEP15-(L)-PEP10 (TPV21);
- PEP18-(L)-PEP15-(L)-PEP13-(L)-PEP10 (TPV22);
- PEP1-(L)-PEP15-(L)-PEP18-(L)-PEP10 (TPV23);
- PEP1-(L)-PEP18-(L)-PEP15-(L)-PEP10 (TPV24);
- PEP15-(L)-PEP1-(L)-PEP18-(L)-PEP10 (TPV25);
- PEP15-(L)-PEP18-(L)-PEP1-(L)-PEP10 (TPV26);
- PEP18-(L)-PEP1-(L)-PEP15-(L)-PEP10 (TPV27);
- PEP18-(L)-PEP15-(L)-PEP1-(L)-PEP10 (TPV28);
- PEP15-(L)-PEP17-(L)-PEP13-(L)-PEP10 (TPV29);
- PEP15-(L)-PEP13-(L)-PEP17-(L)-PEP10 (TPV30);
- PEP17-(L)-PEP15-(L)-PEP13-(L)-PEP10 (TPV31);
- PEP17-(L)-PEP13-(L)-PEP15-(L)-PEP10 (TPV32);
- PEP13-(L)-PEP17-(L)-PEP15-(L)-PEP10 (TPV33);
- PEP13-(L)-PEP15-(L)-PEP17-(L)-PEP10 (TPV34);
- PEP6-(L)-PEP18-(L)-PEP5-(L)-PEP9 (TPV35);
- PEP6-(L)-PEP5-(L)-PEP18-(L)-PEP9 (TPV36);
- PEP1-(L)-PEP7-(L)-PEP6-(L)-PEP5 (TPV37); и
- PEP7-(L)-PEP1-(L)-PEP6-(L)-PEP5 (TPV38).
Пептид, имеющий 4 связанных CTL-эпитопа по настоящему изобретению, может дополнительно содержать пептидную последовательность, состоящий из гидрофильных аминокислот. Такая пептидная последовательность может быть добавлена на N-конце и/или С-конце пептида, имеющего 4 связанных CTL-эпитопа, и, предпочтительно, добавлена на N-конце. Такая пептидная последовательность состоит из 1-15, предпочтительно, из 2-10 и, более предпочтительно, из 3-5 гидрофильных аминокислот, выбранных из группы, состоящей из аргинина, гистидина, лизина, треонина, тирозина, серина, аспарагина, глутамина, аспарагиновой кислоты и глутаминовой кислоты. Например, аргининовый тример (РРР) или аргининовый тетрамер (RRRR) могут быть использованы в качестве такой пептидной последовательности. Примеры пептидов, имеющих 4 связанных CTL-эпитопа, содержащие такие добавленные к ним пептидные последовательности включают RRR-TPV06, RRRR-TPV06, TPV06-RRR, TPV06-RRRR, RRR-TPV10, RRRR-TPV10, TPV10-RRR, TPV10-RRRR, RRR-TPV12, RRRR-TPV12, TPV12-RRR, TPV12-RRRR, RRR-TPV21, RRRR-TPV21, TPV21-RRR, TPV21-RRRR, RRR-TPV26, RRRR-TPV26, TPV26-RRR, TPV26-RRRR, RRR-TPV30, RRRR-TPV30, TPV30-RRR, TPV30-RRRR, KKK-TPV06, KKKK-TPV06, TPV06-KKK, TPV06-KKKK, KKK-TPV10, KKKK-TPV10, TPV10-KKK, TPV10-KKKK, KKK-TPV12, KKKK-TPV12, TPV12-KKK, TPV12-KKKK, KKK-TPV21, KKKK-TPV21, TPV21-KKK, TPV21-KKKK, KKK-TPV26, KKKK-TPV26, TPV26-KKK, TPV26-KKKK, KKK-TPV30, KKKK-TPV30, TPV30-KKK, TPV30-KKKK, HHH-TPV06, HHHH-TPV06, TPV06-HHH, TPV06-HHHH, HHH-TPV10, HHHH-TPV10, TPV10-HHH, TPV10-HHHH, HHH-TPV12, HHHH-TPV12, TPV12-HHH, TPV12-HHHH, HHH-TPV21, HHHH-TPV21, TPV21-HHH, TPV21-HHHH, HHH-TPV26, HHHH-TPV26, TPV26-HHH, TPV26-HHHH, HHH-TPV30, HHHH-TPV30, TPV30-HHH, TPV30-HHHH, RRKK-TPV12, RKRK-TPV12, RHRH-TPV12, RRHH-TPV12, KKHH-TPV12, and KHKH-TPV12, with KKK-TPV06, KKKK-TPV06, KKK-TPV10, KKKK-TPV10, KKK-TPV12, KKKK-TPV12, KKK-TPV21, KKKK-TPV21, KKK-TPV26, KKKK-TPV26, KKK-TPV30, KKKK-TPV30, HHH-TPV06, HHHH-TPV06, HHH-TPV10, HHHH-TPV10, HHH-TPV12, HHHH-TPV12, HHH-TPV21, HHHH-TPV21, HHH-TPV26, HHHH-TPV26, HHH-TPV30, HHHH-TPV30, RRKK-TPV12, RKRK-TPV12, RHRH-TPV12, RRHH-TPV12, KKHH-TPV12, причем KHKH-TPV12 является предпочтительной, а RRR-TPV06, RRRR-TPV06, RRR-TPV10, RRRR-TPV10, RRR-TPV12, RRRR-TPV12, TRRR-TPV21, RRRR-TPV21, RRR-TPV26, RRRR-TPV26, RRR-TPV30, и RRRR-TPV30 являются более предпочтительными. Пептид, содержащий такую пептидную последовательность, как известно, лучше растворяется в водном растворителе (Abdelkrim Alileche et al., Peptides 38, 2012, 302-311; JP 2006-188507 A). После добавления такой пептидной последовательности к пептиду, имеющему 4 связанных CTL-эпитопа по настоящему изобретению, степень растворимости пептида, имеющего 4 связанных CTL-эпитопа, в водном растворителе может быть увеличина.
В случае пептида, имеющего 4 связанных эпитопа по настоящему изобретению, CTL, специфичные к CTL-эпитопным пептидам, могут индуцироваться и/или активироваться по меньшей мере к трем типам и, предпочтительно, к четырем типам CTL-эпитопных пептидов из 4 связанных типов CTL-эпитопных пептидов. Кроме того, может индуцироваться продукция иммуноглобулина, специфичного к каждому CTL-эпитопному пептиду. В настоящем изобретении термин «иммуноглобулины» относится к IgG, IgM, IgA или IgD.
Пептид, имеющий 4 связанных эпитопа по настоящему изобретению, может представлять собой кислотно-аддитивную соль или основно-аддитивную соль. Примерами кислот, которые обычно используются для образования кислотно-аддитивных солей, включают органические кислоты, такие как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, карбоновая кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и трифторуксусная кислота. Примеры основно-аддитивных солей включают соли, полученные с неорганическими основаниями, такими как гидроксид аммония, гидроксид щелочного металла, гидроксид карбонат и бикарбонат щелочноземельного металла.
2. Получение пептида, имеющего 4 связанных CTL-эпитопа
Пептид, имеющий 4 связанных CTL-эпитопа по настоящему изобретению, может быть получен с помощью обычных методик, например, пептидного синтеза, например, жидкофазного синтеза или твердофазного синтеза, или пептидного синтеза, включающего использование автоматизированного пептидного синтезатора (Kelley et al., Genetics Engineering Principles and Methods, Setlow, J. K. eds., Plenum Press NY., 1990, Vol. 12, pp. 1-19; Stewart et al., Solid-Phase Peptide Synthesis, 1989, W. H. Freeman Co.; Houghten, Proc. Natl. Acad. Sci., U.S.A., 1985, 82: p. 5132, "Shin Seikagaku Jikken Kouza (New Biochemical Experiment) 1, Protein IV, 1992, the Japanese Biochemical Society (ed.), Tokyo Kagaku Doujin). Пептидный синтез осуществляют путем получения аминокислот, в которых функциональные группы кроме α-аминогрупп и α-карбоксильных групп, которые будут связываться в аминокислотах, являются защищенными, и путем образования пептидных связей между α-аминогруппами и α-карбоксильными группами в аминокислотах. Обычно, карбоксильная группа аминокислотного остатка, расположенная на С-конце пептида связана с твердой фазой с помощью соответствующего спейсера или линкера. Защитную группу на аминоконце дипептида, полученного выше, селективно удаляют, и пептидная связь образуется между аминоконцом и α-карбоксильной группой следующего аминокислотного остатка. Эту процедуру продолжают, получая пептид с защищенными боковыми группами, и все защитные группы удаляют и отделяют от твердой фазы в конце синтеза. Типы защитных групп, способы их защиты и способы связывания пептида подробно описаны в документах, указанных выше.
В качестве альтернативы, пептид может быть получен с помощью генетической рекомбинации, фагового дисплея или другими методами с использованием нуклеиновой кислоты, кодирующей пептид, содержащий 4 связанных эпитопа по настоящему изобретению.
Методика генетический рекомбинации включает встраивание ДНК, кодирующей пептид, содержащий 4 связанных эпитопа по настоящему изобретению в соответствующий экспрессионный вектор, введение вектора в соответствующие клетки-хозяева, культивирование клеток и выделение целевых пептидов из клеток или внеклеточной жидкости. Примеры векторов включают в себя, но не ограничиваются ими, плазмиду, фаг, космиду, фагмиду и вирусные векторы. Векторы вводят в клетки-хозяева, такие как бактериальные клетки-хозяева (например, E. coli и Bacillus subtilis), дрожжевые клетки, клетки насекомых, клетки животных (например, клетки млекопитающих) и клетки растений. Трансформация или трансфекция в такие клетки осуществляется с помощью, например, фосфатнокальциевого способа, электропорации, липофекции, способа с использованием пушки для обстрела частицами или способа с использованием ПЭГ. Трансформированные клетки культивируют в соответствии с традиционной технологией культивирования организма-хозяина. Для того, чтобы облегчить выделение пептида по настоящему изобретению, предпочтительно, чтобы пептид, генерируемый с помощью экспрессии, секретировался во внеклеточное пространство. С этой целью, с 5'-концевой стороной ДНК, кодирующей целевой пептид, связывают ДНК, кодирующую пептидную последовательность, которая позволяет секрецию пептида из клеток. В альтернативном варианте можно выделить целевой пептид, накапливающийся в клетках. В таком случае, клетки физически или химически разрушают, и целевой пептид выделяют с помощью методики очистки белка.
Полученный таким образом пептид может быть выделен или очищен с помощью обычной методики, например, хроматографических методов, таких как гель-фильтрационная хроматография, ионообменная колоночная хроматография, аффинная хроматография, обращеннофазовая колоночная хроматография или ВЭЖХ, фракционирование с сульфатом аммония, ультрафильтрация или иммуноадсорбция.
3. Цитотоксические Т-лимфоциты
С использованием пептида, имеющего 4 связанных эпитопа по настоящему изобретению, in vitro и/или ex vivo могут быть получены специфичные к CTL-эпитопным пептидам CTL, которые повреждают раковые клетки. Способ индукции CTL с использованием CTL-пептидного эпитопа in vitro и/или ex vivo известен (например, JP 2006-14637 А), и такой метод может быть использован в настоящем изобретении. Например, адгезионные клетки из мононуклеарных клеток периферической крови (РВМС), полученных от здоровых индивидуумов или раковых пациентов, культивируют в присутствии цитокинов, таких как GM-CSF или IL-4, с тем, чтобы индуцировать дендритные клетки (DC). После того, как дендритные клетки обрабатываются пептидом, имеющим 4 связанных эпитопа по настоящему изобретению, их подвергают действию рентгеновского излучения, чтобы получить антиген-представляющие клетки (стимуляторы). При невозможности использования DC, мононуклеарные клетки периферической крови (PBMC), полученные от здоровых лиц или тех же раковых пациентов, можно обработать пептидом, имеющим 4 связанных эпитопа по настоящему изобретению, облучить их рентгеновским излучением, и можно использовать полученные в результате клетки. После чего, добавляют мононуклеарные клетки периферической крови (PBMC), полученные от здоровых лиц, или мононуклеарные клетки периферической крови (РВМС), полученные от раковых пациентов, или лимфоциты из соответствующих лимфатических узлов (т.е. респондеры), а затем культивируют в присутствии цитокинов, таких как IL-2, IL-4, или IL-7. После этого, антигенпредставляющие клетки, полученные с помощью обработки, описанной выше, снова стимулируют добавлением пептида, имеющего 4 связанных эпитопа по настоящему изобретению, и дополнительно культивируют в присутствии цитокинов, таких как IL-2.
Любая среда, в которой Т-лимфоциты могут выжить, может использоваться в качестве клеточной культуральной среды, используемой для индукции CTL. Например, может быть использована среда, полученная путем добавления различных цитокинов (например, IL-2) и фетальной телячьей сыворотки (FCS) в среду RHAMα (среда LAK, описанная в Kawai, K., Sasaki, T., Saijo-Kurita, K., Akaza, H., Koiso, K., and Ohno, T., Cancer Immunol. Immunother., 35, 225-229, 1992), среду AIMV (GIBCO BRL, Life Technologies, INC.) или среду RPMI 1640.
Культивирование может быть проведено при условиях, хорошо известных в данной области. Например, при температуре культивирования, составляющей от 33°C до 41°C, и предпочтительно 37°C. В качестве газовой фазы может быть использован инертный газ, содержащий воздух или кислород в соответствующей концентрации и двуокись углерода в соответствующей концентрации (например, 5% CO2) для подведения рН среды до 7,4. Культивирование предпочтительно проводить в течение 4-10 дней и, более предпочтительно, в течение 7-8 дней. Некоторые CTL, индуцированные посредством такого культивирования, являются специфичными к CTL-эпитопным пептидам для каждого из по меньшей мере трех типов и, предпочтительно, четырех типов CTL-эпитопных пептидов, из четырех типов CTL-эпитопных пептидов, составляющих пептид, содержащий 4 связанных эпитопа, и, таким образом, они могут специфично повреждать раковые клетки.
4. Фармацевтическая композиция
Пептид, имеющий 4 связанных эпитопа по настоящему изобретению, может быть использован в качестве действующего ингредиента фармацевтической композиции, используемой для иммунотерапии рака.
Фармацевтическая композиция по настоящему изобретению может содержать в качестве действующего ингредиента(ов), один или несколько пептидов, имеющих 4 связанных эпитопа. За счет включения множество пептидов, имеющих 4 связанных эпитопа, можно ожидать более сильных эффектов. Кроме того, полученная фармацевтическая композиция может являться более универсальной, так что ее можно вводить в качестве противораковой пептидной вакцины более широкому кругу раковых пациентов, независимо от их HLA-типа.
Обнаружено, что гены, кодирующие PEP1, PEP2, PEP4, PEP5, PEP6, PEP7, PEP8, PEP9, PEP10, PEP13, PEP15, PEP17 и PEP18, включенные в пептид, имеющий 4 связанных эпитопа по настоящему изобретению, экспрессируются во множестве типы солидных раков и раковых заболеваний крови. Пр