Способы получения гликосфинголипидов и их применение
Иллюстрации
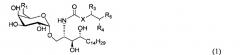
Показать всеИзобретение относится к способам получения альфа-гликосфинголипидов и новым альфа-гликосфинголипидам, фармацевтическим композициям на их основе, применимым в фармацевтической промышленности. Способ получения соединения формулы (1)
где R1 представляет собой ОН, X представляет собой С8 алкилен, R3 представляет собой ОН или Н, R4 представляет собой ОН или Н, R5 представляет собой арил, замещенный арил, гетероарил или замещенный гетероарил, при условии, что когда R3 представляет собой Н и R4 представляет собой Н, то R5 представляет собой фенил, замещенный одной или двумя группами, независимо выбранными из -F, -Cl, -Br, -ОСН3, -ОСН(СН3)2, -OPh, -OPh(4-F), 2-(5-F)-пиридинил, -CF3, -NO2, -N(CH3)2 и 3-(6-F)-O-пиридинил; или R5 представляет собой пиридинил, замещенный группой, независимо выбранной из -F- или -OPh(4-F); когда R3 представляет собой Н и R4 представляет собой ОН, то R5 представляет собой фенил, замещенный группой, независимо выбранной из -F- или -ОСН3, или R5 представляет собой фенил, замещенный двумя -F; когда R3 представляет собой ОН и R4 представляет собой ОН, то R5 представляет собой фенил, замещенный одной или двумя группами, независимо выбранными из -F или -ОСН3; включает:
(а) реакцию соединения формулы (6) с соединением формулы (7) в присутствии кислоты Льюиса с образованием соединения формулы (5):
,
где PG является защитной группой гидроксила и LG является тиолсодержащей уходящей группой формулы:
, , или ;
(b) восстановление соединения формулы (5) с получением соединения формулы (3):
;
(c) сочетание соединения формулы (3) с соединением формулы (4):
,
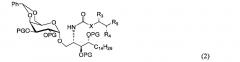
где X означает C8 алкилен или C8 алкенилен, с получением соединения формулы (2):
и удаление защитной группы с соединения формулы (2):
,
где PG является защитной группой гидроксила, водородом в условиях гидрогенизационного катализа с получением соединения формулы (1). Предложены новые соединения, эффективные в качестве лигандов для естественных киллерных Т-клеток, новые эффективные способы их получения и новые антивирусные, антибактериальные, противоопухолевые средства на их основе. 7 н. и 16 з.п. ф-лы, 39 пр., 1 табл., 9 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым аналогам гликосфинголипидов, являющимся промежуточными продуктами при их получении. Более конкретно, изобретение относится к новым способам получения гликосфинголипидов. В частности, изобретение относится к способам синтеза и применению новых альфа-связанных гликосфинголипидных соединений.
Уровень техники
Исследования показывают, что естественные киллерные Т-клетки (NKT-клетки), уникальная субпопуляция лимфоцитов, характеризуются коэкспрессией инвариантного антигенного рецептора и рецепторов естественных киллеров. Естественные киллерные Т-клетки человека (Vα24-Jα18) активируются специфическим гликолипидным антигеном, CD1d-зависимым способом. Молекулы CD1d представляют собой гетеродимеры, состоящие из тяжелой полипептидной цепи, нековалентно связанной с 2-микроглобулином, и обладают существенным структурным сходством с протеинами главного комплекса гистосовместимости (МНС) класса I. После активации естественные киллерные Т-клетки проявляют МНС-независимую противоопухолевую активность в отношении опухолевых клеток in vitro и in vivo по нескольким механизмам. Активированные Vα24 NKT-клетки продуцируют значительное количество цитокинов, таких как интерферон-гамма (IFN-γ), тем самым объединяя врожденный и приобретенный иммунитет активацией других эффекторных клеток, включая дендритные клетки (DC), естественные киллерные клетки (NK-клетки) и CD8+ Т-клетки. NKT-клетки играют регуляторную роль в иммунной системе, следовательно, они являются перспективными целями в иммунотерапии.
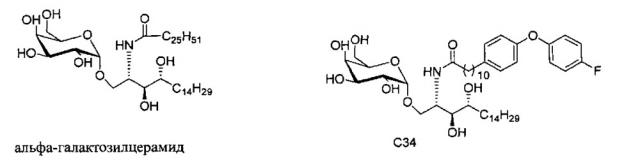
В настоящее время альфа-галактозилцерамид (αGalCer, KRN-7000) является наиболее полно изученным CD1d презентируемым антигеном. Первоначально он вызвал интерес, когда были продемонстрированы новые противоопухолевые свойства экстрактов из морской губки, Agelas mauritianus. Фармацевтическая компания Kirin Beer (патент США №5849716). Позже эта выраженная активность была отмечена у группы альфа-связанных гликосфинголипидов (GSLs), от которых структурной оптимизацией был получен αGalCer. Гликосфинголипиды состоят из сахаридной группы альфа-связанной с церамидом, образованным амидной связью жирной кислоты с длинноцепочечным основанием.
При активации αGalCer естественные киллерные Т-клетки высвобождают провоспалительный (Th1) и иммуномодулирующий (Th2) цитокин. Считается, что выработка ТН1 цитокинов коррелирует с противоопухолевым, противовирусным/антибактериальным и адъювантным действием, тогда как выработка ТН2 цитокина считается подавляющей аутоиммунные заболевания. αGalCer был объектом клинических испытаний в связи с его противораковым потенциалом, но они были прекращены на этапе I. Неспецифическая природа профиля цитокина, индуцированного αGalCer , а также обоих Th1 и Th2, делает его менее эффективным в плане терапевтического лечения. Это объяснение побудило многих исследователей сосредоточить свое внимание на поиске соединений которые повышают селективность в отношении ответной реакции на TH1 или на TH2 цитокины. Уонг и коллеги (Wong et al.) синтезировали ряд гликолипидов, несущих ароматические группы в ацильной цепи и установили, что эти молекулы смещают профиль высвобождения цитокина в сторону ответной реакции на TH1 (J. Am. Chem. Soc. 2006, 128, 9022-9023. US 2007/0238871). В эксперименте in vivo на мышах с агрессивными раковыми опухолями легкого (клеточная линия ТС1) и раковыми опухолями молочной железы (клеточная линия 4Т1) было показано, что у мышей с раком легкого, которых лечили новыми гликолипидами, значительно увеличилось время жизни по сравнению с мышами, которых лечили αGalCer. У мышей, пораженных раком молочной железы, лечение новыми гликолипидами замедляло темп роста опухоли на 75% относительно группы, не получавшей лечения, по сравнению с 50% замедлением у мышей, которых лечили α-GalCer (Proc. Natl. Acad. Sci. U.S.A. 2007, 104, 10299-10304).
Следовательно, существует потребность в эффективном средстве для синтеза альфа-гликосфинголипидов, таких как соединения αGalCer, а также потребность в синтезе новых альфа-гликосфинголипидных соединений, обладающих иммуномодулирующим эффектом.
Раскрытие изобретения
Настоящее изобретение предоставляет новые способы синтеза галактозилсфинголипидов, включая новые соединения, относящиеся к альфа-галактозилцерамидам и их активным аналогам, таким как С34.
По одному из вариантов осуществления изобретение предоставляет соединение структурной формулы (1):
где R1=OH, NH2, NHCOR2; R2=Н или алкил, алкенил или алкил с концевой арильной группой, замещенный арил, гетероарил, или замещенный гетероарил; X = алкильная группа, алкенил; R3, R4=H, ОН; R5 = арил, замещенный арил, гетероарил или замещенный гетероарил.
По одному из вариантов осуществления изобретения соединение формулы 1 может быть получено способом, включающим в числе прочих этап удаления бензилиденовой защитной группы и гидрогенизации соединения структурной формулы (2):
где PG является защитной группой гидроксила.
По другому варианту осуществления изобретения защитной группой гидроксила может быть бензил.
По одному из вариантов осуществления изобретения соединение формулы 2, где X=(CH2)8, R3=H, R4=H, R5=4-F-фенокси-фенил, может быть получено способом, включающим в числе прочих этап образования амидной связи между соединениями формулы (3) и формулы (4).
где по одному из вариантов осуществления PG является бензилом
где по одному из вариантов осуществления, X = алкильная группа, алкенил, R3=H, ОН, R4=Н, OH, R5 = арил, замещенный арил, гетероарил, или замещенный гетероарил.
По одному из вариантов осуществления изобретения соединение формулы (3), где R является бензилом, может быть получено способом, включающим в числе прочих этап восстановления азидной группы соединения структурной формулы (5):
По одному из вариантов осуществления изобретения соединение формулы 5, где PG является бензилом, может быть получено способом, включающим в числе прочих этап реакции соединения структурной формулы (6)
где PG является защитной группой гидроксила и LG является уходящей группой, с соединением структурной формулы (7)
где PG является защитной группой гидроксила, с образованием альфа-гликозидной связи, с получением, таким образом, соединения формулы (5). По другому варианту осуществления изобретения замещаемой группой из формулы (6) может быть любая группа из числа:
По одному из вариантов осуществления изобретения соединение формулы 1 может быть получено способом, включающим в числе прочих этап удаления бензилиденовой защитной группы и гидрогенизации соединения структурной формулы (8):
где PG является защитной группой гидроксила. По другому варианту осуществления изобретения PG может быть в числе прочих бензилом.
По одному из вариантов осуществления изобретения соединение формулы (8) может быть получено способом, включающим в числе прочих этап реакции соединения структурной формулы (9) с соединением, представленным алкановой кислотой, арильной кислотой, арил-алкановой кислотой, замещенной арил-алкановой кислотой и гетероциклической кислотой.
где PG является защитной группой гидроксила.
По одному из вариантов осуществления изобретения соединение (9) может быть получено способом, включающим в числе прочих этап восстановления азида структурной формулы (10)
где PG является защитной группой гидроксила.
По одному из вариантов осуществления изобретения соединение (10) может быть получено способом, включающим в числе прочих этап замещения соединения структурной формулы (11)
где R является уходящей группой, с получением, таким образом, соединения формулы (11).
По другому варианту осуществления изобретения R может быть в числе прочих метансульфонилом или толуолсульфонилом. По одному из вариантов осуществления изобретения соединение формулы (11) может быть получено способом, включающим в числе прочих этап проведения замещения гидроксильной группы соединения структурной формулы (12)
По другому варианту осуществления изобретения замещение может проводиться в присутствии основания и метансульфонил хлорида или толуолсульфонил хлорида.
По одному из вариантов осуществления изобретения соединение (12) может быть получено способом, включающим в числе прочих этап гидролиза соединения структурной формулы (13)
где R является защитной группой гидроксила, по одному из вариантов осуществления изобретения R является сложным эфиром алкила. По другому варианту осуществления изобретения R является ацетатом.
По одному из вариантов осуществления изобретения соединение (13) может быть получено способом, включающим в числе прочих этап образования амидной связи между соединением структурной формулы (14),
и соединением структурной формулы (4).
По одному из вариантов осуществления изобретения соединение (14) может быть получено способом, включающим в числе прочих этап восстановления азида структурной формулы (15).
По одному из вариантов осуществления изобретения соединение (15) может быть получено способом, включающим в числе прочих этап реакции соединения структурной формулы (16)
где PG является защитной группой гидроксила, LG является уходящей группой и R является сложным эфиром, с соединением структурной формулы (7), где PG является защитной группой гидроксила с образованием альфа-гликозидной связи, с получением, таким образом, соединения формулы (15).
По другому варианту осуществления изобретения уходящей группой может быть любая группа из числа:
По одному из вариантов осуществления изобретения соединение формулы (17) может быть получено способом, включающим в числе прочих этап удаления защитной группы гидроксила PG1, с получением, таким образом, соединения формулы (17), при этом PG1 может быть в числе прочих тритилом.
Эти и другие аспекты станут очевидными из следующего описания предпочтительных вариантов осуществления в сочетании с приведенными ниже чертежами, причем очевидно, что могут быть осуществлены другие реализации и модификации в рамках изобретения без отступления от существа и объема новых концепций раскрытия.
Краткое описание чертежей
Следующие чертежи являются частью настоящего описания, они были включены для дополнительной демонстрации некоторых аспектов настоящего раскрытия, изобретения в рамках которого будут более понятными при наличии ссылок на один или несколько этих чертежей в сочетании с подробным описанием конкретных вариантов осуществления, представленных в настоящем документе.
Фиг.1 является схематической иллюстрацией, описывающей синтез С34, А15-21. Схема 1. Реактивы и условия: (a) TfN3, K2CO3, CuSO4, дихлорметан, МеОН, H2O; (b) тритил хлорид, триэтиламин, толуол; (c) бензилхлорид (BnCl), NaH, диметилформамид, толуол; (d) HCl, толуол, МеОН; (е) А5, Me2S2-Tf2O, тетрагидрофуран, 4 Å MS; (f) LiAlH4, тетрагидрофуран; (g) RCO2H, HBTU, N-метилморфолин, дихлорметан; (h) Pd(OH)2, H2, МеОН, дихлорметан.
Фиг.2 является схематической иллюстрацией, описывающей синтез соединения А23-А25. Схема 2. Реактивы и условия: (a) Pd(OH)2, Н2 (80 фунтов/кв. дюйм), МеОН, дихлорметан, АсОН; (b) RCO2H, HBTU, N-метилморфолин, дихлорметан МеОН.
Фиг.3 является схематической иллюстрацией, описывающей синтез соединения формулы (4). Схема 3.
Фиг.4 является схематической иллюстрацией, описывающей синтез соединений C5-C7. Схема 4. Реактивы и условия: (a) PPh3, тетрагидрофуран, H2O; (b) Ph(CH2)nCO2H, HBTU, N-метилморфолин, дихлорметан; (c) Pd(OH)2, Н2, дихлорметан, МеОН.
Фиг.5 является схематической иллюстрацией, описывающей синтез соединений C20-C31. Схема 5. Реактивы и условия: (a) TsCl, пиридин; (b) NaN3, диметилформамид; (c) PPh3, тетрагидрофуран, H2O; (d) RCH2CO2H, HBTU, N-метилморфолин, МеОН, дихлорметан.
Фиг.6 показывает индуцированную гликосфинголипидами секрецию IL-2 в клеточной системе A20CD1d и mNK1,2. Данные приведены как среднее ± среднеквадратическое отклонение; "-" указывает на отсутствие соединения.
Фиг.7 показывает секрецию INF-гамма цитокина спленоцитами самки мыши C57BL/6.
Фиг.8 показывает секрецию IL-4 цитокина спленоцитами самки мыши C57BL/6.
Фиг.9 показывает соотношения секреции цитокина, полученные при сравнении фиг.7 и 8.
Осуществление изобретения
Термины, использованные в этом описании, как правило, имеют свое обычное значение в данной области в контексте изобретения и в конкретном контексте, в котором использован каждый термин. Некоторые термины, которые были использованы для описания изобретения, обсуждаются ниже или в других местах описания для предоставления дополнительных указаний практикам применительно к описанию изобретения. Для удобства некоторые термины могут быть выделены, например, курсивом и/или кавычками. Использование выделения не влияет на объем и значение термина; объем и значение термина остаются теми же в том же контексте, независимо от того, был он выделен или нет. Следует понимать, что одно и то же может быть выражено несколькими способами. Следовательно, для любого или нескольких обсуждаемых здесь терминов могут быть использованы альтернативные выражения и синонимы, независимо от того, развивается или обсуждается термин в настоящем документе или нет, он не принимает никакого специального значения. Для некоторых терминов приведены синонимы. Указание одного или нескольких синонимов не исключает использование других синонимов. Использование примеров в любой части этого описания, включая примеры любых обсуждаемых здесь терминов, приведено только для иллюстрации, и ни в коей мере не ограничивает объем и значение изобретения или любого термина, представленного в качестве примера. Аналогично, изобретение не ограничивается различными вариантами осуществления, приведенными в этом описании.
Если не определено иное, все технические и научные термины, использованные в настоящем документе, имеют такое значение, в котором их обычно понимает специалист в области, к которой относится изобретение. При возникновении споров, преимущественной силой будет обладать настоящий документ, включая определения.
Новые способы синтеза соединений формулы (1) в целом включают связывание церамида с сахаридом, но также существует возможность сначала провести связывание с фитосфингозином, а затем преобразовать аминогруппу в амидогруппу для формирования соединения формулы 1.
Примером такого синтеза может служить синтез соединения формулы (1), в котором галактоза C6' является гидроксильной группой во время последовательных этапов (см. Фиг.1-3).
Исходным материалом является фитосфингозин гидрохлорид ((2S,3S,4R)-2-амино-1,3,4-октадекантриол), хотя существует ряд способов синтеза фитосфингозина согласно описанию в Curr. Org. Chem. 2002, 6, 365-391. Промышленно выпускаемый источник - фитосфингозин гидрохлорид готовят из соответствующего дрожжевого ферментативного бульона, который можно получать в больших количествах по разумной цене (Evonik Degussa Taiwan Ltd.). Изомерные сфингозины, конфигурация которых отличается от таковой природного сфингозина, можно приготовить в соответствии с методами, описанными в Helvetica Chimica Acta 1957, 470, 1145; или в Chem. Commun. 1991, 820.
На первом этапе аминогруппа фитосфингозина была преобразована в азидогруппу реакцией диазопереноса свежеприготовленным TfN3 с получением А1. С приготовлением TfN3 можно ознакомиться в Tetrahedron Lett 1996, 37, 6029-6032. Защита тритилом первичного спирта А1 дала неочищенный А2, который был напрямую подвергнут воздействию условий бензилирования NaH и BnCl с получением соединения A3. В данном методе, когда бензильная группа применяется как защитная группа гидроксильной группы, можно также применять другие соответствующие группы, такие как бензоат, (p-метокси)-бензил или изопропилиден. Для синтеза соединения с А1 по A3 в качестве растворителя был выбран толуол. Реакцию бензилирования вторичных спиртов не удавалось провести в толуоле, если он был единственным растворителем. Для решения проблемы низкой химической активности реакции бензилирования в толуоле была использована система сорастворителей из 10% диметилформамида в толуоле с целью повышения растворимости NaH и промежуточного алкоксида. После промывания водой был получен неочищенный A3 в виде раствора в толуоле, и было проведено удаление защитной группы кислотой с получением акцептора гликозила А4. Для удаления защитной тритиловой группы можно использовать разные кислоты, такие как соляная кислота, серная кислота, бромистый водород, трифторуксусная кислота, BF3.OEt, азотная кислота, смоляная кислота (например, амберлит (Amberlite IR120®)) и тому подобные.
Раньше при синтезе гликолипидов применяли различные способы гликозилирования, включая использование гликозил фторида, гликозил трихлорацетоимидата, гликозил бромида и гликозил иодида20-23. Tetrahedron 1998, 54, 3141-3150; J Org Chem 2005, 70, 10260-10270; J Org Chem 2002, 67, 4559-4564; Chem Commun 2007, 2336-2338. Первоначально в нашем синтезе применяли гликозил имидат, который обеспечивал отличный выход (89%) и селективность по отношению к аномерам (α/β=9/1). В связи с тем, что имидат легко подвергается гидролизу, и обычно необходимо применять свежеприготовленный раствор, при применении этой замещаемой группы для гликозилирования при проведении синтеза в большом масштабе могут возникать проблемы с хранением и очисткой. В качестве альтернативы можно в качестве донора получить тиогликозид А5 с использованием кислоты Льюиса, такой как TMSOTf, Tf2O, BF3⋅OEt2, TfOH, Me2S2-Tf2O, в качестве катализаторов и с применением молекулярных сит для дегидратации. Соединение А5 содержит азидо-группу, которая способствует гликозилированию, тогда как аминогруппа фитосфингозина защищена амидом или карбаматом (t-бутил карбаматом) как показано в US 5849716; US 2007/0238871; J. Am. Chem. Soc. 2004, 126, 13602-13603; J. Org. Chem. 2005, 70, 10260-10270; Tetrahedron 1998, 54, 3141-3150; Synthesis 2004, 847-850; Bioorg. Med. Chem. Lett. 2006, 16, 2195-2199. 2-NH и 1-OH могут образовывать внутримолекулярную водородную связь, которая мешает ему как нуклеофилу вступать в реакцию с активированным гликозидом, результатом этого является низкий выход реакции гликозилирования. После гликозилирования между А4 и А5 очистка в колонне может дать А6 в чистой α-форме и в чистой β-форме.
Соединение А6, которое содержит азидо-группу, можно восстановить с помощью любого из: алюмогидрида лития, борогидрида натрия, боранового комплекса, фосфинового комплекса, ферментного восстановления, гидрогенизации или трансферной гидрогенизации. Вместо использования фосфинового комплекса, образующего побочный продукт - оксид фосфина, который трудно удалить, восстановление азида алюмогидридом лития (LiAlH4) давало высокочистый амин А7. Соединение А7 сочетали с различными полученными карбоновыми кислотами (способы получения, см. Фиг. 3) с образованием соответствующих амидных соединений. В целом, снятие защитных групп у этих соединений достигалось в условиях гидрогенолиза в присутствии катализатора гидрогенизации, выбранного из Pd/C, Pd(OH)2 или ренеевского никелевого катализатора, и Н2 в смешанных растворителях МеОН и CH2CI2 с получением аналогов С34, соединений А15-21.
Восстановительное дегалогенирование арил галидов на ацильной цепи проводится реакцией гидрогенизации хлоро- и бромо-ацил содержащих соединений. Поэтому для предупреждения реакции дегалогенирования с А6 удаляли защитные группы и восстанавливали гидрогенизацией в присутствии каталитического Pd(OH)2 и Н2. После этого образовавшийся амин А22 сочетали с соответствующими кислотами (способы приготовления, см. Фиг. 3) в условиях сочетания с получением аналогов А23-25 (Фиг. 2).
Для этого процесса известен ряд способов проведения реакций, в частности для амидирования. Можно также использовать ацил хлорид и ангидрид кислоты или карбоновую кислоту. Карбоновая кислота используется в реакции конденсации в присутствии соответствующего конденсирующего реагента. Соответствующие конденсирующие реагенты, используемые в этой реакции, включают дициклогексилкарбодиимид (DCC), 1-этил-3-(3'диметиламинопропил)карбодиимин (EDC), а также 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурониум гексафторфосфат (HBTU), гидроксибензотриазол (HOBt) или тому подобные. Для обеспечения быстрого протекания реакции добавляют органическое основание, такое как триэтиламин, пиридин, N-метилморфолин, диметиланилин, 4-диметиламинопиридин, N-метилпиперидин, N-метилпирролидин. Растворителем может быть любой инертный растворитель, который не будет вовлечен в реакцию, такой как тетрагидрофуран, простой этиловый эфир, толуол, хлороформ, метилен хлорид, этилацетат, ацетон или тому подобные.
Как можно видеть на Фиг.3 для получения различных замещенных фенилалкановых кислот применяется реакция Виттига. В этом способе ω-бромо-алкановые кислоты смешивают с трифенил фосфином в присутствии растворителя. Реакцию обычно проводят с соответствующим растворителем, но если реакция протекает вяло, ее можно усилить проведением реакции в отсутствие растворителя. Растворителем может быть любой инертный растворитель, который не будет вовлечен в реакцию, например, толуол, бензол, диглим, диметилсульфид или тому подобные.
В качестве еще одного примера синтеза, можно также синтезировать соединение формулы (1) проведением различных замещений в позиции галактозы С6', выполнив следующие этапы (см. Фиг.4-5).
Синтез модифицированных аналогов С6 был начат с соединения С1 согласно описанию в Org Lett 2002, 4, 1267-1270. Восстановление азида, затем амидирование с различными выпускаемыми ароматическими кислотами и полное снятие защитных групп дало С5-С6 (Фиг.4, схема 4). Кроме того, для предотвращения трудоемкого взаимного преобразования защитных групп для приготовления из соединения C1 при синтезе С6'' и би-модифицированных соединений с ацильной цепью (Фиг.5) была применена иная стратегия. Гидроксильную группу C6'' А15 можно тозилировать или мезилировать толуол сульфонил хлоридом или метан сульфонил хлоридом в присутствии основания, такого как пиридин, диметилпиридин, триэтиламин, диэтилпропиламин, DBU или тому подобных, и затем соответствующую группу тозилата или мезилата можно заместить азидом реакцией с азидом натрия с получением С18. Восстановление азида по Штаудингеру, амидирование с различными кислотами дает C20-31.
Применение соединения по настоящему изобретению
Соединения формулы (1), обладающие следующей физиологической активностью, можно применять в качестве иммунотерапевтического средства против рака или в качестве иммуностимулирующего средства против других болезней.
Активность по активации АРС: секрецию IL-2 можно измерить в системе клеток A20CD1d и mNK1,2 как АРС и эффекторных клеток, как показано в примере 2.
Иммуностимулирующая активность: секрецию цитокина IFN-γ и Il-4 можно измерить, как показано в примере 2, в котором самка мыши C57BL/6 (16w4d) была забита, и селезенка использована для анализа.
Противоопухолевое средство: соединение по настоящему изобретению обладает смещенным в сторону Th1 профилем секреции цитокина и может быть использовано как вещество, обладающее противоопухолевой активностью и иммуностимулирующим действием.
Наряду с тем, что соединения в настоящем изобретении могут применяться как иммунотерапевтическое средство против опухолей, их можно применять отдельно или в сочетании с химиотерапией или радиотерапией.
Соединения по настоящему изобретению в качестве противоопухолевого средства или иммуностимулирующего средства можно вводить любыми соответствующими способами введения дозы. Соединение обычно превращают в препарат, в растворенной форме или сформованный с фармацевтически приемлемым носителем (липосома или мицелла). При применении соединения по настоящему изобретению, его можно вводить перорально или парентерально человеку или млекопитающему. Например, соединения по настоящему изобретению при применении в форме инъекции, можно вводить внутривенно, внутримышечно, подкожно или в виде ингаляций в форме раствора, суспензии или эмульсии с соответствующим растворителем. В этом случае при необходимости можно добавить в качестве солюбилизирующего вещества полисорбаты или макрогол, холестерол. При пероральном приеме соединений по настоящему изобретению они могут быть в форме таблетки, порошка, гранулы, или сухого сиропа в соответствующем разбавителе.
ПРИМЕРЫ
Без намерения ограничить объем изобретения ниже приведены типовые приборы, аппарат, способы и связанные с ними результаты, соответствующие вариантам осуществления настоящего изобретения. Следует иметь в виду, что для удобства читателя в примерах могут быть использованы заглавия или подзаголовки, которые ни в коей мере не будут ограничивать объем изобретения. Кроме того, в документе предложены и раскрыты некоторые теории; однако, независимо от того, являются ли они правильными или нет, они ни в коем случае не будут ограничивать объем изобретения, поскольку изобретение воплощается на практике по изобретению без учета какой бы то ни было конкретной теории или плана действий.
Пример 1
Ниже описаны методы синтеза и физико-химические свойства соединений по настоящему изобретению (номера соединений, участвующих в процессе синтеза, приведены на схемах реакций, которые показаны на Фиг.1-5).
На приведенных в настоящем документе схемах использованы следующие сокращения:
| THF: | тетрагидрофуран |
| DMF: | N,N-диметилформамид |
| MS-4А: | молекулярные сита - 4А (дегидратирующее средство) |
| CH2Cl2: | дихлорметан |
| NMM: | N-метилморфолин |
| HBTU: | О-бензотриазол-N,N,N',N'-тетраметил-урониум-гексафторо-фосфат |
| TMSOTf: | триметилсилил трифторметансульфонат |
| Tf2O: | трифторметансульфоновый ангидрид |
| CDCl3: | d1-хлороформ |
| NMR: | ядерно-магнитный резонанс |
| HRMS: | масс-спектрометрия высокого разрешения |
| ESI: | ионизация электрораспылением |
Другие сокращения имеют те же значения, как и сокращения на схемах, приведенные выше.
Схема синтеза 1 (Фиг.1)
Пути конкретно показывают способ получения соединения С34, А13, А14, А15, А16, А18, А19, А20, А21, этим способом можно также синтезировать соединения по настоящему изобретению.
Синтез (2S,3S,4R)-2-азидо-D-рибо-октадекан-1,3,4-триола (А1)
К раствору азида натрия (64,3 г, 989 мМоль) в 250 мл воды добавили дихлорметан (350 мл). Двухфазную смесь охладили до 5°C в ледяной бане и в течение 20 мин добавляли трифторметансульфоновый ангидрид (47,5 мл, 283 мМоль), поддерживая температуру на уровне ниже 10°C. После перемешивания в течение 2,5 часов в ледяной бане реакцию в реакционной смеси остановили добавлением 70 мл насыщенного раствора K2CO3. Органическую фазу отделили, а водную фазу экстрагировали CH2Cl2 (200 мл). Органические фазы соединили и получили раствор азида трифторметансульфоновой кислоты в дихлорметане. [Осторожно! Азид трифторметансульфоновой кислоты является взрывчатым веществом, его необходимо хранить с растворителем.]
К раствору сульфата меди (0,35 г, 1,4 мМоль) в воде (150 мл) добавили фитосфингозин гидрохлорид (фитосфингозин гидрохлорид высокой степени очистки [(2S,3S,4R)-2-амино-1,3,4-октадекантриол] из соответствующего дрожжевого ферментативного бульона, который производят для продажи в больших количествах по разумной цене, 50,0 г, 141 мМоль), карбонат калия (29,28 г, 211,9 мМоль) и метанол (1,0 л). Суспензию охладили до 0-5°C в льдосоляной бане и в течение 10 мин добавляли раствор азида трифторметансульфоновой кислоты (в 550 мл CH2Cl2). После перемешивания реакционной смеси в течение 12 часов при комнатной температуре, смесь концентрировали. Остаток развели в воде (1,0 л) и перемешивали при комнатной температуре в течение 12 часов. Осадок отфильтровали и промыли водой (500 мл×2). Осадок высушили азеотропной дистилляцией (70-80°C, 200-250 мм рт.ст.) с толуолом (1,5 л) и получили (2S,3S,4R)-2-азидо-D-рибо-октадекан-1,3,4-триол (А1) (47,0 г, 137 мМоль, 97%) в виде белого твердого вещества с сероватым или желтоватым оттенком, точка плавления: 87°C. 1H-NMR (CD3OD, 400 мГц) δ 3,85 (dd, J=11,6, 3,3 Гц, 1Н), 3,69 (dd, J=11,6, 7,9 Гц, 1H), 3,50-3,55 (m, 1Н), 3,43-3,47 (m, 2Н), 1,22-1,60 (m, 26Н), 0,83 (t, J=6,4 Гц, 3Н). 13C-NMR (CD3OD, 100 МГц) δ 74,6, 71,5, 65,3, 61,2, 32,5, 31,7, 29,4, 29,4, 29,1, 25,4, 22,4, 13,1. HRMS (ESI) в пересчете на O18H37N3O3Na [M+Na]+: 366,2733, установлено: 366,2729.
Синтез (2S,3S,4R)-2-азидо-3,4-ди-O-бензил-D-рибо-октадекан-1,3,4-триола (А4)
К смеси (2S,3S,4R)-2-азидо-D-рибо-октадекан-1,3,4-триола (47,0 г, 137 мМоль) в толуоле (1,0 л) добавили триэтиламин (46 мл, 332 мМоль) и тритил хлорид (42,0 г, 151 мМоль). После перемешивания при 50-55°C в течение 6 часов добавили триэтиламин (4,6 мл, 33 мМоль) и трифенилметил хлорид (4,20 г, 15,1 мМоль), затем смесь перемешивали еще 15 часов. К смеси добавили воду (1,0 л) и перемешали в течение 3 мин. Органическую фазу вымыли водой (1,0 л, 500 мл) провели концентрацию и получили неочищенный (2S,3S,4R)-2-азидо-1-тритил-D-рибо-октадекан-1,3,4-триол (А2). Очистку образца для анализа методом NMR провели колоночной хроматографией. 1Н-NMR (CDCl3, 400 МГц) δ 7,22-7,47 (m, 15Н), 3,62 (dd, J=3,7, 10,1 Гц, 2Н), 3,53 (m, 2Н), 3,40 (dd, J=6, 10,1 Гц, 1H), 2,35 (brs, 1H), 1,83 (brs, 1H), 1,20-1,52 (m, 26Н), 0,87 (t, J=6,8 Гц, 3Н). 13C-NMR (CDCl3, 100 МГц) δ 143,35, 128,54, 128,01, 127,27, 87,78, 74,19, 72,18, 63,48, 62,31, 31,90, 31,74, 29,67, 29,64, 29,60, 29,55, 29,34, 25,59, 22,67, 14,10.
К раствору неочищенного (2S,3S,4R)-2-азидо-1-тритил-D-рибо-октадекан-1,3,4-триола (А2) в толуоле (750 мл) и диметилформамида (75 мл) добавили гидрид натрия (60% в минеральном масле, 21,9 г, 548 мМоль) тремя порциями в течение 10 мин. Смесь перемешивали в течение 30 мин., после чего в реакционную смесь добавили бензилхлорид (50,5 мл, 0,438 мМоль). Смесь нагрели до 50-60°C и перемешивали в течение 18 часов. Затем смесь охладили до 0°C и по каплям добавили воду (50 мл). Органическую фазу промыли насыщенным раствором хлорида аммония (500 мл×2) и водой (500 мл×2). Органическую фазу профильтровали через целитовую подушку, и провели концентрацию фильтрата для получения неочищенного (2S,3S,4R)-2-азидо-2,3-ди-бензил-1-тритил-D-рибо-октадекан-1,3,4-триола (A3).
К раствору A3 в смеси толуол/метанол (600 мл, 1/1) добавили водный раствор HCl (33%, 6,0 мл). Смесь нагрели до 50-60°C и перемешивали в течение 20 часов. Реакцию в реакционной смеси остановили добавлением 1,0 N NaOH (55 мл) и провели концентрацию. Остаток разделили толуолом (500 мл) и водой (500 мл). Провели концентрацию органической фазы, и очистку остатка провели колоночной хроматографией (неочищенная фаза 100 г, силикагель 500 г, этилацетат/n-гексан = 1/10) с получением (2S,3S,4R)-2-азидо-2,3-ди-бензил-D-рибо-октадекан-1,3,4-триола (А4) (27,5 г, 52,5 мМоль, 38% за 4 этапа) в форме желтого жидкого масла. 1H-NMR (CDCl3, 200 МГц) δ 7,26-7,39 (m, 10Н), 4,69 (d, J=1,4 Гц, 2Н), 4,59 (d, J=4,3 Гц, 2Н), 3,59-3,94 (m, 5Н), 1,26-1,61 (m, 26Н), 0,88 (t, J=6,4 Гц, 3Н). 13C-NMR (CDCl3, 50 МГц) δ 137,9, 137,6, 128,5, 128,4, 128,1, 127,97, 127,81, 127,10, 80,38, 78,96, 73,59, 72,49, 63,03, 62,20, 21,90, 30,16, 29,66, 29,35, 25,43, 22,67, 14,11. HRMS (ESI) в пересчете на C32H49N3O3Na [M+Na]+: 546,3672, установлено: 546,3689.
Синтез 4-метилфенил 2,3-O-дибензил-4,6-O-бензилиден 1-тиол-D-галактопиранозида (А5)
Соединение А5 может быть получено методом, описанным в Plettenburg, О. et al. J. Org. chem. 2002, 67, 4559-4564.
Данные о соединении А5: 1Н-NMR (CDCl3, 400 МГц) δ 7,58 (d, J=8,1 Гц, 1Н), 7,50 (m, 2Н), 7,23-7,42 (m, 15Н), 6,98 (d, J=8,0 Гц, 1H), 5,46 (s, 1Н), 4,69 (m, 4Н), 3,54 (d, J=9,5 Гц, 1Н), 4,35 (dd, J=12,3, 1,5 Гц, 1H), 4,12 (d, J=3,2 Гц, 1Н), 4,03 (dd, J=9,8, 3,6 Гц, 1Н), 3,82 (t, J=9,3 Гц, 1H), 3,60 (dd, J=9,2, 3,4 Гц, 1H), 3,39 (s, 1Н), 2,28 (s, 3Н).
Синтез 2-азидо-3,4-ди-O-бензил-1-O-(2,3-ди-O-бензил-4,6-O-бензилиден-α-D-галактопиранозил)-D-рибо-октадекан-1,3,4-триола (А6)
К раствору диметил дисульфида (10,0 мл, 113 мМоль) в дихлорметане (75 мл) добавили трифторметансульфоновый ангидрид (17 мл, 100 мМоль) при 0-5°C в льдосоляной бане. После перемешивания реакционной смеси в льдосоляной бане в течение 30 мин получили Me2S2-Tf2O в виде 1,0 М раствора в дихлорметане, его можно хранить в ледяной бане в течение 3 часов.
Соединение А4 (27,3 г, 52,2 мМоль), А5 (34,7 г, 62,6 мМоль) и молекулярное сито 4 Å (33 г) смешали и высушили под вакуумом в течение 1 часа, затем к смеси добавили тетрагидрофуран (520 мл). Смесь охладили до -10°C в льдосоляной бане перед добавлением Me2S2Tf2O (1,0 М раствор в CH2Cl2, 94 мл, 94 мМоль). После перемешивания в течение 20 мин реакцию в реакционной смеси остановили добавлением триэтиламина (22 мл), затем разбавили дихлорметаном (200 мл). Смесь профильтровали через целитовую подушку и промыли дихлорметаном (50 мл). Провели концентрацию объединенного фильтрата и разделили его дихлорметаном (500 мл) и водой (500 мл). Провели концентрацию органической фазы, и остаток очистили колоночной хроматографией (вес неочищенной фазы = 153 г, 600 г силикагеля, этилацетат : n-гексан = 1:15 до 1:12 до 1:10) и получили 2-азидо-3,4-ди-O-бензил-1-O-(2,3-ди-O-бензил-4,6-O-бензилиден-α-D-галактопиранозил)-D-рибо-октадекан-1,3,4-триол (А6) (32,07 г, 33,60 мМоль, 64%) в виде белого воска с сероватым или желтоватым оттенком, точка плавления: 59°C. 1H-NMR (CDCl3, 400 МГц) δ 7,22-7,50 (m, 25Н), 5,44 (s, 1H), 4,96 (d, J=3,4 Гц, 1Н), 4,85 (d, J=11,9 Гц, 1Н), 4,79 (d, J=12,3 Гц, 1H), 4,73 (d, J=12,3 Гц, 1H), 4,66-4,69 (m, 2Н), 4,59 (d, J=8,5 Гц, 1H), 4,56 (d, J=12,8 Гц, 1H), 4,48 (d, J=11,5 Гц, 1Н), 4,15 (d, J=2,8 Гц, 1H), 4,06-4,12 (m, 1H), 3,98-4,04 (m, 3Н), 3,86 (dd, J=12,5, 1,5 Гц, 1H), 3,68-3,73 (m, 3H), 3,60-3,62 (m, 1H), 3,55 (s, 1H), 1,25-1,55 (m, 26H), 0,87 (t, J=7,1 Гц, 3H). 13C-NMR (CDCl3, 100 МГц) δ 138,75, 138,36, 138,01, 137,82, 128,85, 128,37, 128,34, 128,26, 128,22, 128,09, 127,90, 127,79, 127,75, 127,70, 127,66, 127,61, 127,50, 127,45, 126,33, 101,05, 99,13, 79,41, 78,95, 76,68, 75,80, 75,44, 74,66, 73,77, 73,49, 72,06, 72,03, 69,31, 68,43, 62,97, 61,80, 31,91, 30,01, 29,75, 29,69, 29,67, 29,65, 29,63, 29,60, 29,35, 25,44, 22,68, 14,10. +63,1 (c 1,0, CHCl3). HRMS (ESI) в пересчете на C59H75N3O8Na [M+Na]+: 976,5452, установлено: 976,5483.
Синтез 3,4-ди-O-бензил-1-O-(2,3-ди-O-бензил-4,6-O-бензилиден-α-D-галактопиранозил)-2-(11-(4-(4-фторфенокси)фенил)ундеканоил)амино-D-рибо-октадекан-1,3,4-триола (А8)
К раствору соединения А7 (32,07 г, 33,61 мМоль) в тетрагидрофуране (340 мл), охлажденному в ледяной бане, за два приема добавили алюмогидрид лития (1,910 г, 50,33 мМоль). Смесь была возвращена к комнатной температуре, и ее перемешивали в течение 70 мин. Смесь охладили до 0°C перед тем, как последовательно остановить реакцию добавлением воды (1,9 мл), 1,0 N NaOH (3,8 мл) и воды (1,9 мл). Смесь профильтровали через целитовую подушку и промыли дихлорметаном (100 мл). Фильтрат концентрировали и разделили дихлорметаном (350 мл) и водой (350 мл).
К выделенной органической фазе добавили 11-(4-(4-фторфенокси)фенил)) ундекановую кислоту (В4) (11,27 г, 30,26 мМоль), затем N-метилморфолин (9,2 мл, 84 мМоль) и HBTU (19,12 г, 50,