Микробиома корня языка как прогностическая модель дисбиотического состояния генитального тракта у беременных
Иллюстрации
Показать всеИзобретение относится к медицине, а именно медицинской микробиологии, акушерству, гинекологии и стоматологии. Способ исследования микробиома корня языка как прогностической модели дисбиотического состояния генитального тракта у беременных осуществляют следующим образом. Забор биоматериала с поверхности языка проводится не ранее чем через час после еды и гигиенических процедур. Делают широкий зигзагообразный мазок с поверхности всей слизистой оболочки по ширине и длине средней трети (спинки) и задней трети (корня) языка стерильным вискозным тампоном на пластиковом зонде, при этом во время забора тампон поворачивают по часовой стрелке. Делают посев на 5% кровяной агар и тем же тампоном сразу делают первичный секторный посев, выполняемый отрывистыми штрихами в пределах границ сектора, до 10-12 штрихов, на чашки Петри диаметром 100 мм, на среды Уриселект 4, маннитол-солевой агар, энтерококк-агар, Эндо и Сабуро. Первичные посевы культивируют в термостате при температуре 35°С. Учитывая, что при дисбиозе выделяется от одного до четырех видов условно-патогенных микроорганизмов и из генитального тракта, и из полости рта и что совпадение культур по титру и видам достигает 95%, результат бактериологического исследования микробиома корня языка прогнозирует дисбиоз генитального тракта беременной женщины и его тяжесть, зависящую от числа выделенных культур условных патогенов и обсемененности ими слизистых оболочек. Изобретение обеспечивает возможность опосредованной диагностики дисбиотического состояния генитоуринарного тракта у беременных женщин, отсутствие психогенных реакций, стресса у беременных на заявляемый способ; получение результата в течение 2-3 суток. 1 табл., 5 пр.
Реферат
Изобретение относится к медицине, а именно медицинской микробиологии, акушерству и гинекологии, стоматологии, и может быть использовано в бактериологии в качестве бактериологического метода определения условно-патогенных микроорганизмов полости рта путем культивирования биологического материала с поверхности корня языка, а также в практическом акушерстве и гинекологии в качестве ориентировочного метода определения дисбиоза генитального тракта у беременных женщин по состоянию их оромикробиоценоза.
В 1984 году на I Международном симпозиуме по вагинитам в Стокгольме было, наконец, выделено в самостоятельную нозологическую форму одно из самых распространенных патологических состояний женской половой сферы - бактериальный вагиноз. Это событие подвело итоговую черту под почти вековыми научными изысканиями. Таким образом, представление о «некоем» дисбалансе влагалищной микрофлоры трансформировалось в конкретный диагноз, который требует четкой программы действий по результативному лечению (В.Е. Радзинский, заслуженный деятель науки РФ, доктор медицинских наук, профессор, зав. кафедрой акушерства и гинекологии с курсом перинатологии Российского университета дружбы народов, вице-президент Российского общества акушеров-гинекологов, г.Москва).
Как известно, естественная микрофлора влагалища и наружных половых органов представлена широким спектром сапрофитной и условно-патогенной микрофлоры. Основным представителем нормальной вагинальной флоры женщин являются бактерии рода Lactobacillus spp., содержание которых в норме должно составлять 95-98% биотопа генитального тракта.
В различные периоды у женщины может происходить изменение образа жизни, интимной гигиены, сексуального поведения, может возникнуть ослабление иммунной системы организма, в результате чего будет возникать риск замещения нормальной микробиоты органов репродуктивной системы женщины индигенной условно-патогенной микрофлорой из других биотопов, что может повысить вероятность развития воспалительных и невоспалительных процессов бактериального генеза.
Сложным периодом в жизни женщины является беременность, которая проходит при физиологической иммуносупрессии материнского организма, как природного механизма, во избежание отторжения плодного яйца, эмбриона, плода как аллотрансплантанта («Состояние иммунной системы у беременных и новорожденных группы высокого риска по внутриутробному инфицированию» И.С. Сидорова, В.А. Алешкин, С.С. Афанасьев, Н.А. Матвиенко. Кафедра акушерства и гинекологии Факультета послевузовского профессионального образования Московской медицинской академии им. И.М. Сеченова; Центр иммунокоррекции Московского НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского; Российский вестник перинатологии и педиатрии, №6. - 1999. - С. 10-16). Именно данный период является шансом для усиленного развития условно-патогенной флоры из числа нормофлоры тела человека, которая способна повлиять как на состояние организма матери, так и плода.
Развитие рецидивирующих воспалительных процессов на слизистых оболочках полости рта и генитального тракта может быть связано с активизацией условно-патогенных микроорганизмов - нормальных обитателей различных биотопов тела человека, таких, как энтеробактерии, энтерококки, стафилококки, кандиды и др. при снижении иммунной резистентности макроорганизма с реализацией эндогенного механизма возникновения оппортунистических инфекций, хотя не исключена и экзогенная передача инфекта из патологического очага больного здоровому.
Одним из наиболее распространенных видов невоспалительной инфекционной патологии внутренних половых органов женщин является бактериальный вагиноз. По данным В.Н. Серова, 2010 г., частота бактериального вагиноза (БВ) колеблется в пределах 15-19% в амбулаторной гинекологической практике, 10-30% - среди беременных женщин, 30-70% - среди женщин, имеющих инфекции, передающиеся половым путем (ИППП). По данным эпидемиологических исследований, 25-40% пациенток акушерско-гинекологических клиник страдают вагинитами. Выраженные нарушения вагинальной микрофлоры при БВ являются фактором риска последующего развития эндометрита, сальпингоофорита, хориоамнионита и связанных с ними нарушений фертильности женщин и здоровья новорожденных. Генитальная инфекция при беременности служит причиной 1/3 мертворождений, в 92,7% развиваются те или иные проявления фетоплацентарной недостаточности.
В настоящее время одной из основных причин обращения пациенток к акушеру-гинекологу являются патологические выделения из половых путей (Diseases Characterized by Vaginal Discharge), которые, по данным различных руководств и рекомендаций, ассоциируются с такими заболеваниями, как бактериальный вагиноз или вагиниты различной этиологии (1. Workowski K.A., Bolan G.A. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep. 2015; 64 (RR-03): 1-137. 2. Прилепская В.H., Мирзабалаева А.К., Кира Е.Ф., Гомберг М.А., Аполихина И.А., Байрамова Г.Р. Диагностика и лечение заболеваний, сопровождающихся патологическими выделениями из половых путей женщин. Федеральные клинические рекомендации. М., 2013. - 50 с.).
Клиническая важность своевременной эффективной диагностики инфекционно-воспалительных заболеваний репродуктивной системы определяется высокой распространенностью данной патологии, влиянием на репродуктивную функцию и качество жизни женщин, а также ассоциацией с акушерскими и неонатальными осложнениями (Donders G., 2009-2012, Кира Е.Ф., 2012, Анкирская А.С., 2005, Серова О.Ф., 2009, Гомберг М.А., 2011, Laxmi U., 2012, Wen А., 2014).
Стертая клиническая картина, отсутствие как таковых дифференциальных патогномоничных клинических признаков, бессимптомное течение данных заболеваний делают затруднительной, а порой и невозможной постановку точного этиологического диагноза на основании клинико-анамнестических данных и требуют обязательного применения лабораторных микробиологических методов исследования.
В случае, если этиологическим фактором выступают дрожжеподобные грибы кандиды, и/или грампозитивные бактерии стафилококки, энтерококки, и/или грамнегативные бактерии из семейства энтеробактерий, этиотропное лечение будет существенно отличаться. Особенно учитывая необходимую осторожность при применении антимикробной химиотерапии у беременных женщин. Среди существенных осложнений, которые могут вызвать антибиотики, доказаны следующие: иммуносупрессивное действие, тератогенное действие, токсическое, аллергизирующее действие, нарушение синтеза витаминов, дисбиотические состояния, приобретение микробами лекарственной устойчивости, согласно данным сайта: http://microbiologu.ru/mikroorganizmyi/himioterapevticheskie-preparatyi.-antibiotiki/spektr-i-mehanizm-deystviya-antibio-2.html. Лечение бактериального вагиноза только с учетом клинических признаков, с применением антибиотиков широкого спектра действия, может привести к нарушению врачебного принципа «Non посеге» - не навреди.
Кроме этого в Стандартах качества оказания медицинских услуг беременным женщинам, согласно приказу Министерства здравоохранения РФ от 1 ноября 2012 г. №572н "Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)", следует проводить микробиологическое исследование отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы и чувствительность к антибиотикам в комплексном обследовании женщин на инфекции различного генеза (в базовом спектре обследования беременных женщин, согласно рубрике В - комплекс исследований на инфекции, в разделе диагностических мероприятий в амбулаторных условиях).
Известно, что нормальная резидентная микрофлора полости рта и генитального тракта является составляющей здоровья человека, обеспечивая колонизационную резистентность как важнейший элемент в системе неспецифических факторов иммунной защиты.
Киническая диагностика воспалительных процессов в полости рта, а также и генитального тракта, при вагинитах и вагинозах, сопряжена и нуждается в точной этиологической диагностике, которая играет ведущую роль в определении тактики дальнейшего лечения и профилактики рецидивов заболевания, индивидуальной у каждого конкретного пациента.
Глобальные неблагоприятные изменения в состоянии окружающей среды привели к изменениям в факторах колонизационной резистентности организма человека и способствовали развитию дисбиозов (Бухарин О.В. и соавт., 2000). Это отражается проявлением у условно-патогенных бактерий факторов потенциальной патогенности (Бондаренко В.Т., 1999). Наряду с действием неблагоприятных экологических факторов окружающей среды широкое и не всегда рациональное использование в клинической практике более 4300 антибактериальных препаратов вызвало появление и селекцию полирезистентных штаммов возбудителей (Покровский В.И. и совт., 1991; Таточенко В.К. и соавт., 2000; Николаева И.В., 2001 и др.). Появляются и панрезистентные штаммы бактерий.
В данном исследовании основное внимание уделено культивированию таких условно-патогенных бактерий, как грамотрицательные палочки Е. coli, Emterobacter cloaceae, Klebsiella pneumoniae, Citrobacter freundii, Proteus mirabilis и других представителей семейства энтеробактерий, грамположительные кокки S. aureus, S. epidermidis, S. saprophyticus, энтерококки видов Enterococcus faecalis, E. faecium, β-гемолитические стрептококки группы A S. pyogenes, дрожжеподобные грибы рода Candida, неферментирующих бактерий и других микроорганизмов. Не принималось в расчет выявление хламидий и микоплазм, роль которых в развитии патологии урогенитального тракта, по мнению исследователей, по-прежнему дискутабельна, одни авторы расценивают хламидий и микоплазмы как облигатные патогены, при этом назначается этиотропное лечение, а другие - как представителей нормальной флоры урогенитального микробиоценоза.
В настоящее время в регионе Хабаровского края поражение слизистых оболочек полости рта, генитального тракта чаще связано с развитием неспецифических воспалительных процессов с изменением качественного и количественного микробного состава биотопов. Использование микроскопических и микробиологических методов исследования при воспалении слизистых оболочек как клинико-диагностического способа, ограничено. Специалист нередко пользуется только визуальным и инструментальным осмотром.
Недостатком клинического исследования является его вынужденная необъективность по визуальному выявлению инфекционного агента. При хронических воспалительных процессах на слизистых оболочках развивается сходная клиническая картина с образованием налетов, изъязвлений, сухости, покраснения, некротических масс, увеличения объема, язык может иметь вид «географического». Тем не менее, визуально практически невозможно точно определить этиологию процесса. С целью качественной диагностики, правильных подходов к лечению и профилактике хронических воспалительных заболеваний необходимо использовать микроскопические, микробиологические и молекулярно-генетические методы исследования биоматериала из патологического очага: язв, налета, заднего свода шейки матки. Следует обратить внимание, что лечение дисбиотических проявлений, при которых выделяются энтеробактерии, или энтерококки, стафилококки и/или грибы кандида и др., имеют принципиальные отличия.
Кроме этого инфекционный процесс является результатом сложного, одновременного взаимодействия микробов между собой и с различными клетками и тканями организма хозяина. Среди типов взаимоотношений микро- и макроорганизма различают нейтрализм и симбиоз, включающий разные степени взаимодействия от мутуализма до паразитизма. Но при любом типе взаимоотношений микроорганизм может проявить свои патогенные свойства (Покровский В.И., 1998).
В связи с вышесказанным современный врач стоит перед разработкой персонифицированного подхода к пациенткам, беременным женщинам, с различными изменениями микробиома генитального тракта при различной патологии воспалительного и невоспалительного генеза органов репродуктивной системы женщин для дальнейшего создания эффективных и рациональных схем лечения. Это, в свою очередь, позволит оптимизировать результаты проводимой терапии.
На преаналитическом этапе диагностики следует учесть требование к безопасности процедуры забора биоматериала из заднего свода влагалища у беременных женщин, поскольку во 2 и 3 семестрах беременности с увеличением массы плода ограничиваются осмотры беременных женщин на кресле во время гинекологического приема с помощью гинекологических зеркал, во избежание провокации вызвать развитие тонуса матки и/или преждевременных родов.
Известен способ микробиологического исследования биологического материала, непосредственно взятого со слизистой генитального тракта. После введения зеркала и подъемника материал для исследования берут стерильным ватным тампоном из заднего свода или с патологически измененных участков слизистой. Материал для посева должен быть взят до проведения мануального исследования. Забор материала, посев и культивирование проводится согласно приказу Минздрава СССР №535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений» от 22.04.85 г. Чувствительность штаммов выявленных возбудителей хронических рецидивирующих оппортунистических инфекций генитального тракта беременных, вызванных энтеробактериями, стафилококками, энтерококками, кандидами, неферментирующими бактериями и другими условно-патогенными бактериями к антимикробным химиопрепаратам определяют согласно МУК 4.2.1980-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» от 04.03.2004 г.
Известен способ взятия проб материала для изучения микроорганизмов полости рта (журнал "Стоматология", №4. - М., 1971. – С.с. 57-60, авт. Кускова В.Ф., Ребреева Л.И.), при котором материал берут тонкими ватными турундами на корневых иглах или плотно скрученными из ваты шариками диаметром от 2 до 5 мм, предварительно простерилизованными в чашках Петри или бумажных пакетиках суховоздушным методом при 165-170°C в течение 1 ч. Турунду или ватный шарик непосредственно перед взятием пробы слегка увлажняют прикосновением к стерильному физраствору в пробирке. Немедленно после взятия пробы турунду, снятую пинцетом с корневой иглы, ватный шарик опускают в пробирку с питательной средой. При этом соблюдается обычная бактериостатическая техника посевов над пламенем горелки. Для вымывания микробов в слюну из тех участков, где они скапливаются в наибольшем количестве (межзубные промежутки, поверхность корня языка, десневые карманы и т.д.), могут быть применены два способа. Первый способ: обследуемому дают жевать кусочки стерильного воска или парафина /объемом около 5 см3/. Стерилизацию производят в автоклаве большими порциями в колбах. Перед употреблением парафин или воск расплавляют на водяной бане, разливают в стерильные чашки Петри и нарезают стерильным инструментом. Достаточно выбрать 5-6 мл слюны. Непосредственно перед стимуляцией обследуемый прополаскивает рот кипяченой водой.
Второй способ: обследуемый предварительно прополаскивает рот 50-100 мл стерильного физраствора для удаления остатков пищи и стимуляции слюноотделения. Спустя 10-15 минут обследуемому дают полоскать рот 8-10 мл стерильного физраствора и берут разведенную таким путем слюну полоскательную жидкость. Полоскание должно быть сильным и продолжительным /до 3-х мин./ и чтобы полоскательная жидкость омыла рот полностью. При обоих способах слюну берут в широкогорлые пробирки или колбочки, простерилизованные под двойными колпаками, чем обеспечивается стерильность краев стекла, которых обследуемый может коснуться губами. Такая же предосторожность нужна при стерилизации пробирок с физраствором для полоскания рта. Когда проба взята, бумажный колпачок заменяют ватной пробкой. Пробы слюны сохраняют в холодильнике /без замораживания/ не дольше 4-х ч.
Известен способ взятия проб материала для микробиологических исследований полости рта и устройство для его осуществления согласно патенту №2101692 Зуфарова С.А. и соавторов. Сущность изобретения: прополаскивают рот стерильным физраствором, отбирают пробы, культивируют их и идентифицируют микроорганизмы полости рта в стандартном наборе сред. Микрофлору берут с локальных участков слизистой оболочки и зубных протезов непосредственно в стерилизованные металлические гильзы с находящейся там питательной средой. Устройство для взятия проб материала для микробиологических исследований полости рта содержит простерилизованную емкость, которая выполнена в виде металлической гильзы, помещенной в гильзодержатель, соединенный с головкой, ручкой, при этом ручка соединена с хвостовиком головки резьбой с возможностью осевого поворота, гильзодержатель прикреплен к головке шарнирно. Головка выполнена упругой с возможностью регулировки трения в шарнире, а гильза имеет элемент локализации пробы в виде носика с острыми краями. Шарнирные соединения головки с гильзодержателем выполнены в виде полукольцевой упругой пластины, внутри которой на двух полуосях подвешен гильзодержатель, при этом одна из осей снабжена резьбой и регулировочным винтом. Способ позволяет получить более качественные пробы с локальной поверхности полости рта и протезов и повысить достоверность микробиологического анализа, удобен в эксплуатации.
Известны способы забора со спинки языка и бактериологическое исследование материала соскоба слизистых оболочек из очага поражения, описанные в учебнике «Микробиология, вирусология и иммунология полости рта» под редакцией профессора В. Н. Царева, издательской группы ГЭОТАР-Медиа, главе 10. Общие правила и нормативы микробиологического исследования различных биотопов полости рта.
Эти способы и применяемые для его реализации средства приняты в качестве наиболее близких аналогов-прототипов. Однако у всех вышеперечисленных способов есть существенный недостаток. Они не дают точной методики забора материала с корня и спинки языка, алгоритма его посева, выбора питательных сред, бактериологической диагностики и идентификации условно-патогенной флоры как индикатора дисбиотического состояния слизистых оболочек с помощью современных питательных сред. В доступной нам научной литературе не имеется указаний на взаимосвязь и взаимозависимость между биотопами корня (спинки) языка и генитоуринарного тракта у беременных женщин.
Задача изобретения: предложить опосредованный способ бактериологической диагностики дисбиотического состояния генитального тракта беременных женщин путем выявления условно-патогенных микроорганизмов, таких как энтеробактерии, стафилококки, энтерококки, пиогенные стрептококки, кандиды, неферментирующие бактерии и других, со слизистой оболочки корня и спинки языка.
Технический результат - щадящая диагностическая процедура для беременных женщин, особенно во 2 и 3 триместрах беременности, возможность опосредованной диагностики дисбиотического состояния генитоуринарного тракта у беременных женщин по выявлению условно-патогенных микроорганизмов, потенциальных патогенов, из числа индигенной микрофлоры тела человека, таких, как энтеробактерии, стафилококки, энтерококки, кандиды, пиогенные стрептококки, неферментирующие бактерии и другие, со слизистой оболочки корня и спинки языка, без применения прямого забора содержимого заднебокового свода влагалища и его бактериологического исследования. Повышение качества лечения с появлением возможности неоднократного бактериологического контроля за состоянием слизистых оболочек корня и спинки языка как опосредованного способа выявления состояния биотопа генитоуринарного тракта в результате проводимой терапии. Профилактика хронизации воспалительного процесса генитоуринарного тракта путем бактериологического контроля в процессе лечения и возможностью коррекции терапевтических процедур. Отсутствие препятствий к неоднократному забору биологического материала с поверхности языка на приеме у гинеколога, стоматолога или другого специалиста, позволяет широко использовать предлагаемый способ выявления условно-патогенной флоры в составе микробиома корня языка как прогностической модели дисбиотического состояния генитального тракта у беременных женщин. Профилактика риска возникновения тонуса матки и преждевременных родов. Безвредность. Доступность биотопа полости рта.
Технический результат достигается тем, что при наличии жалоб перед началом лечения беременным женщинам проводят микроскопическое и микробиологическое обследование нативного мазка слизистой оболочки корня и спинки языка на наличие условно-патогенных микроорганизмов, таких, как энтеробактерии, стафилококки, стрептококки, энтерококки, лептотрихии, кандиды, неферментирующие бактерии и другие, а именно со слизистой оболочки средней (спинки) и задней трети (корня) языка. Передняя треть языка (кончик) не исследуется, поскольку в этом локусе сосочки языка не защищают микроорганизмы от механического удаления и смывания слюной, ротовой жидкостью, более того, это самая подвижная часть языка, которая часто вступает в соприкосновение с другими тканями полости рта при разговоре, глотании и дыхании, не позволяя микроорганизмам полости рта длительное время вегетировать на ее поверхности. Целью исследования является выделение условно-патогенных микроорганизмов, которые появляются на поверхности языка только в случае развития дисбиотических процессов и, как правило, распространяются на все слизистые оболочки тела человека, поскольку имеет место угнетение в той или иной степени резистентности иммунной системы по различным причинам. У беременных женщин снижение иммунной резистентности имеет физиологические причины и возникает неизбежно. Наличие условно-патогенных микроорганизмов довольно постоянно, пусть и в небольшом количестве в различных стадиях дисбиоза, в этой связи не имеет значения время взятия биоматериала из полости рта. Обычно из полости рта рекомендуется забор материала натощак или через 2 часа после еды. Нередко перед забором запрещают гигиенические процедуры, чистку зубов и полоскание рта. Однако наши исследования показывают, что для восстановления вегетации условно-патогенных микроорганизмов из числа нормофлоры тела человека достаточно одного часа после гигиенических процедур в полости рта, приема пищи и/или напитков.
В качестве материала для микробиологического/ бактериологического исследования, не ранее чем через час после еды, приема напитков, воды или гигиенических процедур, делают широкий зигзагообразный мазок с поверхности слизистой оболочки средней и задней трети языка, стерильным вискозным тампоном, охватывая всю поверхность слизистой по ширине языка и длине спинки и корня языка, во время забора поворачивая тампон по часовой стрелке для полноценного наполнения тампона по всей поверхности, после этого материал на тампоне помещают в стерильную пробирку с транспортной средой Эймса без угля. Можно использовать тупферы разных производителей, выбирая среди модификаций пластиковый зонд и вискозный тампон с целью улучшения качественного забора биоматериала и наилучшего удаления с поверхности вискозы взятых микроорганизмов, учитывая, что в норме условно-патогенных бактерий и грибов на поверхности корня языка может быть незначительное количество, КОЕ от 102 до 103 в 1 г биоматериала, то есть от 1-2 колоний до 15-20 колоний при первичном посеве на питательные среды. Посев и культивирование, определение чувствительности к антибиотикам проводили согласно приказу Минздрава СССР №535 «Об унификации микробиологических методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений» от 22.04.85 г. и МУК 4.2.1980-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» от 04.03.2004 г. Посев с тампона на поверхность твердых питательных сред осуществляется стандартным полуколичественным методом. Дополнительно, кроме посева на 5% кровяной агар, тем же тампоном сразу делали первичный секторный посев, выполняемый отрывистыми штрихами, до 10-12 штрихов в пределах разметки сектора, тампон при этом поворачивают по часовой стрелке 4 раза, на чашки Петри диаметром 100 мм, на несколько селективных и дифференциально-диагностических сред: хромогенную питательную среду Уриселект 4 фирмы БиоРад, для предварительной идентификации энтеробактерий, энтерококков, стафилококков, кандид, а также на селективные среды маннитол-солевой агар для предварительной идентификации стафилококков, энтерококк-агар для предварительной идентификации энтерококков, среду Сабуро для культивирования дрожжеподобных грибов кандида и плесневых грибов с последующим пересевом части выросшей колонии методом бляшки диаметром 1 см на хромогенную среду Канди-селект фирмы ХайМедиа, Индия бактериальной петлей, а также на дифференциально-диагностическую среду Эндо фирмы БиоРад для энтеробактерий и неферментирующих бактерий. Культивировали в термостате «ЕсосеП» ВМТ с электронным табло и управлением в течение 20-24 часов при точно установленной температуре 35°С. Выбор температуры 35°С обусловлен физиологией условных патогенов и их способностью расти в широком диапазоне температур, в то время как прихотливые оральные стрептококки, анаэробы полости рта имеют оптимальную температуру культивирования 37°С. При отсутствии роста через сутки, посевы оставляли в термостате еще на одни сутки. Далее учитывали количество и характер выросших колоний, проводили идентификацию по стандартным микробиологическим методикам. Хромогенные питательные среды в значительной мере укорачивают первичную идентификацию энтеробактерий. Например, колонии кишечной палочки на Уриселекте 4 слизистые, имеют розовый цвет, Klebsiella pneumoniae выпуклые, слизистые, темно-голубые, Proteus mirabilis - золотисто-коричневые, колонии энтерококков мелкие, голубого цвета, колонии S. saprophyticus матовые бело-розовые, S. aureus - матовые бело-желтые, S. Epidermidis - белые. Благодаря хромогенным питательным средам можно получить предварительный результат в течение 2-3 суток исследования, а не через 4-5 суток, как при использовании стандартных сред.
Методом случайной выборки в течение 2012-2015 гг. обследовано 85 беременных женщин с вагинитами и вагинозами, у 60 женщин одновременно обследованы микробиологически полость рта и генитальный тракт.Выполнен статистический анализ. Микробиологическое исследование биологического материала со слизистой генитального тракта с определением чувствительности штаммов к антимикробным химиопрепаратам для выявления хронических рецидивирующих оппортунистических инфекций, вызванных энтеробактериями, стафилококками, пиогенными стрептококками, энтерококками и кандидами, ацинетобактерами и др., осуществляли из заднебокового свода влагалища по стандартной методике.
По данным нашего исследования, в консультации стоматолога нуждалась треть исследуемых беременных женщин. Из акушерского анамнеза: выкидыш - у 17,5%, медицинский аборт - 37,5%, замершая беременность - 7,5% случаев, внематочная беременность - 10,0% женщин. Первородящие без отягощенного гинекологического анамнеза составили 35%.
Зарегистрированы воспалительные заболевания репродуктивной системы: цервицит - у 45% исследуемых женщин, вагинальный кандидоз - у 42,5% женщин, вагинит - 30% женщин, эндометриоз /аденомиоз - у 6 (10%), эрозия шейки матки - 21 (35,0%).
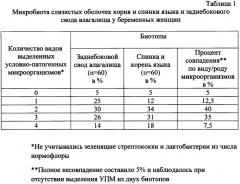
По результатам бактериологического исследования двух биотопов одновременно, у 45 из 60 беременных женщин зарегистрировано полное совпадение результатов бактериологического посева материала из ротовой полости с поверхности слизистой оболочки корня и спинки языка и заднебокового свода влагалища по видам выделенных микроорганизмов и их количеству/титру, что составило 75,0%.
Наблюдали также совпадение двух видов условно-патогенных микроорганизмов из трех выделенных видов у 7,5% женщин. Наблюдали совпадение одного вида микроорганизма из двух выделенных видов у 12,5% женщин. Полное несовпадение по видам выделенных микроорганизмов из двух биотопов зарегистрировано в 5,0%, в основном у здоровых беременных женщин, когда из заднего свода шейки матки выделяли монокультуру лактобактерий КОЕ до 1010-1012, а из полости рта преимущественно зеленящие оральные стрептококки. Из грамположительных условно-патогенных бактерий чаще всего, в 77,5% случаев, выделялись энтерококки: Enterococcus faecalis - в 45% и Enterococcus faecium - в 32,5%. Энтерококки наиболее чувствительны к ванкомицину, ципрофлоксацину, амоксиклаву, имипенему. Штаммов VRE не зарегистрировано. На втором месте из грам+флоры выявлялись стафилококки: Staphylococcus epidermidis (20%), Staphylococcus aureus (30%). Выделены дрожжеподобные грибы Candida albicans у 20 женщин, что составило 32,5%, С. kruzei и С. tropicalis - у 9, что составило 15,0%. Наибольшую чувствительность грибы проявляли к нистатину, клотримазолу, кетоконазолу, амфотерицину В. Реже выявляли ацинетобактеры, пиогенные стрептококки, кишечные палочки, клебсиеллы, цитробактеры, энтеробактеры.
Проводилось микроскопическое исследование корня языка при стоматитах, гингивитах и глосситах у беременных. Учитывая, что лептотрихии являются труднокультивируемыми формами, но имеют отличительные морфологические свойства, выявлено, что в 30% случаев наблюдали большое количество лептотрихий, более 20-60 в каждом поле зрения, измененные клетки эпителия, в 20% случаев отдельные овальные клетки кандид, так и ложные гифы, свидетельствующие об их инвазивности и патогенности. При дисбиозе в 60% случаев наблюдали большое количество микроорганизмов, как грамнегативных, так и грампозитивных. Выделены микроорганизмы различных видов. Наиболее часто встречались: Enterococcus faecalis 27%, Staphylococcus epidermidis 13%, Staphylococcus aureus 12%, Candida albicans 12%, Streptococcus viridians 6%. Энтеробактерии выявляли при среднетяжелых и тяжелых формах дисбиоза.
При бактериологическом выявлении энтерококков обязательно определение чувствительности их чистой культуры к антибиотикам, поскольку в настоящее время именно энтерококки приобретают все большую устойчивость к антимикробным химиопрепаратам, до 60% штаммов. В случае выделения грибов рода Candida в монокультуре или ассоциации требуется добавление к схеме лечения антимикотиков.
Учитывая, что при дисбиотических процессах в условиях снижения иммунной резистентности у беременных женщин выделяется от одного до четырех видов условно-патогенных микроорганизмов и из генитального тракта, и из полости рта, по данным нашего исследования зарегистрировано совпадение выделенных культур в той или иной степени из двух биотопов на 95%. Совпадение по титру и видам было полным в 75% случаев, частичным до 20% по одному или двум видам микроорганизмов и титру. Данные результатов бактериологического исследования представлены в таблице 1.
Эти результаты позволяют сделать вывод о том, что биотоп полости рта, а именно поверхность слизистой оболочки языка в области его спинки и корня, может быть использован как ориентировочная прогностическая модель для исследования при дисбиотических состояниях генитального тракта у беременных женщин и выявления как дисбиоза организма вообще, так и дисбиоза вагины в частности. В случае же выявления из биотопа полости рта с поверхности корня языка только грамположительных кокков - оральных зеленящих стрептококков экологической группы S. viridians, в которую, как правило, входят виды S, mitis, S. salivarius, S. sanquis и др. единичных колоний 0-5 стафилококков, энтерококков, результат расценивается как нормоценоз полости рта с прогнозом о нормоценозе генитального тракта.
Преимуществами предлагаемого способа являются:
- щадящая диагностическая процедура для беременных женщин, особенно во 2 и 3 триместрах беременности; простота использования;
- возможность опосредованной диагностики дисбиотического состояния генитоуринарного тракта у беременных женщин по выявлению условно-патогенных микроорганизмов, из числа индигенной микрофлоры тела человека, таких, как энтеробактерии, стафилококки, энтерококки, кандиды, пиогенные стрептококки, неферментирующие бактерии и другие, со слизистой оболочки корня языка, без применения прямого забора содержимого заднебокового свода влагалища и его бактериологического исследования;
- повышение качества лечения с появлением возможности неоднократного бактериологического контроля за состоянием слизистых оболочек корня языка как опосредованного/ориентировочного способа выявления состояния биотопа генитоуринарного тракта в результате проводимой терапии;
- профилактика рецидивирующего течения заболевания, профилактика хронизации воспалительного процесса генитоуринарного тракта путем бактериологического контроля в процессе лечения и возможностью коррекции терапевтических процедур;
- отсутствие препятствий к неоднократному забору биологического материала с поверхности корня языка на приеме у гинеколога, стоматолога или другого специалиста позволяет широко использовать предлагаемый способ выявления условно-патогенной флоры в составе микробиома корня языка как прогностической модели дисбиотического состояния генитального тракта у беременных женщин;
- после окончания курса терапии при отсутствии противопоказаний можно провести двойной бактериологический контроль состояния слизистых оболочек: поверхности корня и спинки языка и заднего свода влагалища;
- профилактика риска возникновения тонуса матки и/или преждевременных родов;
- доступность биотопа полости рта; отсутствуют психогенные реакции, стресс у беременных при применении заявляемого способа;
- отсутствуют противопоказания для применения способа; возможность использовать способа как в сочетании с другими методиками, так и без них;
- безвредность; экономичность.
Пример 1
Беременная М., 26 лет, 29-30 недель. Жалоб нет. На регулярном приеме у гинеколога, после получения письменного согласия, у женщины взят материал для бактериологического исследования и исследования методом ПЦР из полости рта с поверхности корня и спинки языка согласно предлагаемому способу, и из заднебокового свода влагалища, согласно Приказу МЗ СССР №535, после получения чистых культур и их идентификации установлено, что из генитального тракта выделены Lactobacillus spp., КОЕ 1010, с поверхности языка Streptococcus viridians, КОЕ 105 и Streptococcus mitis, КОЕ 103. Результаты исследования ПЦР на вирусы отрицательные. Заключение: микробиологическое выделение нормальных резидентов из полости рта и генитального тракта. Нормобиоценоз корня языка и генитального тракта. Роста условно-патогенной микрофлоры (УПМ) не выявлено. Продолжить наблюдение через 2 недели.
Пример 2
Беременная Д., 33 года, 33-34 недели. На очередном приеме у гинеколога предъявляла жалобы на дискомфорт, периодический зуд во влагалище и области наружных половых органов, особенно после вечернего приема горячего душа, выделения из половых путей хлопьевидного характера на протяжении недели, периодические тянущие боли внизу живота, после получения письменного согласия у женщины взят материал для бактериологического исследования и исследования методом ПЦР из полости рта с поверхности корня и спинки языка согласно предлагаемому способу и из заднебокового свода влагалища согласно Приказу МЗ СССР №535, после получения чистых культур и их идентификации установлено, что из генитального тракта выделены Lactobacillus spp., КОЕ 104, Candida albicans КОЕ 106, Ent. faecium КОЕ 104, с поверхности языка Candida albicans КОЕ 106, Ent. faecium КОЕ 103. Результаты исследования ПЦР на вирусы отрицательные. Заключение: на фоне снижения общего числа Lactobacillus spp. отмечается выраженный рост условно-патогенных микроорганизмов - Candida albicans с обоих исследуемых биотопов. В связи с развитием кандидоза полости рта и генитального такта рекомендовано следующие лечение: Пимафуцин свечи вагинальные во влагалище №7, затем Вагинорм-С вагинальные суппозитории №5, Дифлюкан 150 мг однократно перорально, Риофлора - баланс по 2 капс.-2 раза в сутки Повторная явка через 10 дней для контроля за проводимым лечением.
Пример 3
Беременная П., 21 год, 28-29 недель. Беременность желан