Новые агонисты npr-b
Иллюстрации
Показать всеИзобретение относится к новым пептидам, обладающие активностью агонистов NPR-B, которые могут быть использованы для лечения и профилактики нарушений, опосредованных натрийуретическими пептидами, например, таких как глаукома, гипертензия глаза и оптические нейропатии. 8 н. и 13 з.п. ф-лы, 3 ил., 5 табл., 5 пр.
Реферат
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
По настоящей заявке испрашивается на приоритет на основании предварительной заявки на выдачу патента США с регистрационным номером 61/245960, поданной 25 сентября 2009 г.
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение, главным образом, относится к новым соединениям, которые применимы для лечения и профилактики нарушений, опосредованных натрийуретическими пептидами или белками. Более конкретно, настоящее изобретение относится к новым пептидам, фармацевтическим композициям, содержащим один или несколько новых пептидов, описанных в настоящей публикации, и к их применению в способах лечения или профилактики глазных болезней, таких как глаукома, гипертензия глаза и оптические нейропатии, сердечнососудистое заболевание, болезнь почек, заболевание легких и другие нарушения, опосредованные натрийуретическими пептидами или белками.
2. ОПИСАНИЕ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
Натрийуретические пептиды (NP) образуют семейство циклических пептидных гормонов, которые впервые были описаны в связи с их участием в регуляции натрийуреза, диуреза и регуляции кровяного давления. К настоящему времени открыты четыре натрийуретических пептида у человека, т.е. атриальный натрийуретический пептид (ANP; SEQ ID NO: 1), натрийуретический пептид B-типа или натрийуретический пептид головного мозга (BNP; SEQ ID NO: 2), натрийуретический пептид C-типа (CNP; SEQ ID NO: 3) и уродилатин (SEQ ID NO: 4) (смотри фиг. 1; и Cho et al., 1999, Heart Dis. 1: 305-328). Все NP синтезируются в виде препрогормонов, которые активируются протеолитическим расщеплением перед их высвобождением в кровоток. NP связываются с рецепторами натрийуретических пептидов (NPR), группой из 3 разных связанных с мембранами рецепторов с гуанилилциклазной активностью (Pandey 2005, Peptides 26: 901-932).
ANP впервые открыт в качестве фактора, снижающего кровяное давление, в гомогенатах предсердий крыс в 1981 году (de Bold 1981, Life Sci. 28: 89-94). Пре-про-ANP человека (SEQ ID NO: 5) содержит 151 аминокислоту и сохраняется после отщепления N-конца в виде состоящего из 126 аминокислот про-ANP (SEQ ID NO: 6), преимущественно в предсердных гранулах. Растяжение сердца вследствие общей объемной перегрузки индуцирует быстрое высвобождение ANP из мест хранения. После секреции в кровяное русло C-концевая часть про-ANP отщепляется атриальной пептидазой с образованием биологически активной состоящей из 28 аминокислот форме ANP (SEQ ID NO: 1) (Yan 2000, Proc. Natl. Acad. Sci. 97: 8525-8529). Оставшаяся N-концевая часть может быть дополнительно расщеплена на 3 разных гормона, т.е. длительно действующий натрийуретический пептид (LANP, аминокислоты 1-30; SEQ ID NO: 7), сосудорасширяющий пептид (VSDL, аминокислоты 31-67; SEQ ID NO: 8) и калийуретический пептид (KP, аминокислоты 79-98; SEQ ID NO: 9) (Vesely 2004, Eur. J. Clin. Invest. 34: 674-682).
После открытия BNP в головном мозге свиней в качестве фактора, который проявляет активность, расслабляющую гладкую мускулатуру (Sudoh T., 1988, Nature 332: 78), намного более высокую тканевую экспрессию обнаружили в препаратах желудочков сердца (Mukoyama 1991, J. Clin. Invest. 87: 1402-1412), что привело к заключению о том, что BNP, подобно ANP, является пептидным гормоном сердца. Хотя BNP можно обнаружить в запасных гранулах в предсердиях, экспрессия в желудочках подвергается транскрипционной регуляции (Tamura 2000, Proc. Natl. Acad. Sci. 93: 4239-4244). Синтез пре-про-BNP индуцируется растяжением стенки сердца и приводит к образованию пептида длиной 134 аминокислоты (SEQ ID NO: 10), который затем расщепляется неизвестной протеазой, образуя про-BNP длиной 108 аминокислот (SEQ ID NO: 11). Дополнительное расщепление высвобождает активный 32-аминокислотный C-концевой фрагмент BNP (SEQ ID NO:2) и неактивный 76-аминокислотный N-концевой фрагмент, также называемый NT-pro-BNP (SEQ ID NO: 12). До настоящего времени не обнаружено известных вариантов сплайсинга BNP человека.
CNP был выделен из головного мозга свиньи почти через 10 лет после открытия ANP (Sudoh 1990, Biochem Biophys Res Comm. 168: 863-870). Он экспрессируется, главным образом, в центральной нервной системе и эндотелиальных клетках. В отличие от других NP CNP почти не присутствует в ткани сердца, что дополнительно свидетельствует о паракринной функции в отношении тонуса сосудов и роста мышечных клеток. Состоящая из 126-аминокислот молекула предшественника pro-CNP (SEQ ID NO: 13) процессируется внутриклеточной эндопептидазой до зрелого состоящего из 53 аминокислот пептида CNP-53 (SEQ ID NO: 14), который является наиболее распространенной формой в головном мозге (Totsune 1994, Peptides 15: 37-40), эндотелиальных клетках (Stingo, 1992, Am. J. Phys. 263: H1318-H1321) и сердце (Minamino 1991, Biochem. Biophys. Res. Comm. 179: 535-542). И в спинномозговой жидкости (Togashi 1992, Clin. Chem. 38: 2136-2139) и в плазме крови человека (Stingo 1992, Am. J. Phys. 263: H1318-H1321) наиболее распространенной формой является CNP-22 (SEQ ID NO: 3), который образуется из CNP-53 под действием неизвестной внеклеточной протеазы. В отличие от других NP в CNP-22 отсутствует C-концевое удлинение 17-аминокислотного цикла (смотри фиг. 1).
ANP (SEQ ID NO: 1), BNP (SEQ ID NO: 2) и CNP (SEQ ID NO: 3) имеют высоко консервативные аминокислотные последовательности у разных видов позвоночных (смотри фиг. 1; и Cho 1999, Heart Dis. 1: 305-328). NP инактивируются двумя разными механизмами, т.е. ферментативным расщеплением посредством нейтральных эндопептидаз и связыванием с рецептором, ответственными за клиренс NP (NPR-C; SEQ ID NO: 15), с последующей интернализацией и внутриклеточным распадом NP (Stoupakis 2003, Heart Dis. 5: 215-223).
После открытия натрийуретических пептидов ANP, BNP и CNP были описаны и клонированы их специфичные рецепторы, рецепторы натрийуретических пептидов -A, -B и -C (NPR-A, -B, -C) (Fuller 1988, J. Biol. Chem. 263: 9395-9401; Chang 1989 Nature 341: 68-72; Chinkers 1989, Nature 338: 78-83). NPR-A (SEQ ID NO: 16) предпочтительно связывает ANP и BNP, в то время как NPR-B (SEQ ID NO: 17) наиболее специфичен для CNP, и NPR-C (SEQ ID NO: 15) связывает все натрийуретические пептиды (Koller 1991, Science 252: 120-123).
Первичные структуры NPR-A и NPR-B содержат внеклеточный связывающий лиганд домен, трансмембранный домен, внутриклеточный домен, гомологичный киназе, содержащий сайты фосфорилирования, и C-концевой гуанилатциклазный домен (обзор в публикации Misono 2005, Peptides 26: 957-68). Последний домен позволяет классифицировать NPR-A и NPR-B в качестве гуанилатциклаз фракции частиц, также известных как GC-A и GC-B (E.C.4.6.1.2). Напротив, в NPR-C отсутствуют внутриклеточные домены гомологии, но появляется все больше доказательств роли NPR-C не только в качестве скавенджер-рецептора для натрийуретических пептидов, но для функционального связывания с ингибирующими G-белками и фосфоинозитидного обмена (Maack 1987, Science 238: 675-678; Murthy and Makhlouf 1999, J. Biol. Chem. 274: 17587-17592; Anand-Srivastava 2005, Peptides 26: 1044-1059). Отражая степень гомологии последовательностей натрийуретических пептидов, рецепторы натрийуретических пептидов проявляют высокую степень гомологии по своим внеклеточным связывающим лиганды доменам, при этом согласно расчетам сходство между NPR-A и NPR-B составляет 41% и сходство между NPR-A и NPR-C составляет 29% (van den Akker 2001, J. Mol. Biol. 311: 923-937).
Связывание лигандов с NPR требует наличия димера гликозилированных субъединиц рецептора (Fenrick et al. 1994, Mol. Cell. Biochem. 137: 173-182; Kuhn 2003, Circ. Res. 93: 700-709), и после связывания происходит конформационное изменение, приводящее к активации гуанилатциклазных доменов. Затем активность гуанилатциклаз фракции частиц регулируется фосфорилированием (смотри обзор в публикации Kuhn 2003, Circ. Res. 93: 700-709). Фосфорилирование NPR является максимальным в основном состоянии, тогда как после связывания лиганда следует дефосфорилирование и последующая десенсибилизация рецептора.
Натрийуретические рецепторы экспрессируются во многих тканях организма. NPR-A, NPR-B и NPR-C присутствуют в сердечнососудистой системе и почках, при этом NPR-C является наиболее распространенным подтипом рецепторов, на долю которого приходится 80% экспрессии NPR в некоторых тканях. NPR-B присутствует на особенно высоком уровне в эпифизе, семенниках и яичниках крыс. Лиганды NPR-A и NPR-B индуцируют независимое от эндотелия расширение сосудов, при этом ANP и BNP, главным образом, действуют на артериальные сосуды. Напротив, мишень CNP, главным образом, является венозная система, за исключением коронарных артерий, расслабление которых наступает в ответ на введение CNP (Marton et al. 2005, Vascul. Pharmacol. 43: 207-212). Важно, что индукция гипотензии посредством активации NPR-B требует в 10 раз более высоких концентраций лиганда по сравнению со снижением кровяного давления в ответ на активацию NPR-A (Wei et al. 1993, Am. J. Physiol. 264: H71-H73; Woods and Jones 1999, Am. J. Physiol. 276: R1443-R1452). Расслабление гладкой мускулатуры посредством активации NPR-B была обнаружена в различных тканях, включая кровеносные сосуды, семенные канальцы и матку. Также сокращение ткани трабекулярной сети глаза уменьшается при активации рецепторов натрийуретических пептидов, что подтверждает функциональное сходство трабекулярной сети и гладкомышечных клеток (Stumpff and Wiederholt 2000, Ophthalmologica 214: 33-53).
Другим основным органом-мишенью для натрийуретических пептидов является почка. Лиганды NPR-A индуцируют натрийурез и диурез посредством двойного механизма (обзор в Beltowski and Wojcicka 2002, Med. Sci. Monit. 8: RA39-RA52): (1) повышенной экскреции натрия благодаря сниженному обратному захвату ионов натрия в дистальных канальцах, впоследствии также приводящему к удерживанию большего количества воды в конечной моче; и (2) расширения подводящих и сопутствующего сужения отводящих клубочковых капилляров, увеличивающего скорость гломерулярной фильтрации за счет снижения перфузии почек (Endlich and Steinhausen 1997, Kidney Int. 52: 202-207). В отличие от NPR-A-специфичных лигандов NPR-B-специфичные лиганды не индуцируют значимого натрийуреза и диуреза и, кроме того, проявляют специфичность в отношении регуляции потока в клубочках: показано, что CNP расширяет как подводящие, так и отводящие капилляры в клубочках, таким образом увеличивая поток крови в почках, но не гломерулярную фильтрацию (Endlich and Steinhausen 1997, Kidney Int. 52: 202-207).
Кроме влияния активации NP-рецепторов (NPR) на кровяное давление и функцию почек, сильное влияние натрийуретических пептидов на процессы пролиферации в различных типах клеток документально подтверждено в литературе. Антипролиферативные свойства активации NPR документально доказаны для гладкомышечных клеток сосудов, фибробластов различного происхождения, мезангиальных клеток, злокачественных клеток и хондроцитов (обзор в публикации Schulz 2005, Peptides 26: 1024-1034). По меньшей мере, в случае VSMC доказательство участия фактора транскрипции GAX в регуляции пролиферации показало, какие внутриклеточные механизмы могут быть вовлечены в регуляцию роста посредством NPR (Yamashita et al. 1997, Hypertension 29: 381-387). Несмотря на то, что рост ткани, главным образом, регулируется пролиферативной активностью, для некоторых органов характерно варьирование размера клеток, влияющее на массу ткани. Это может быть физиологическим процессом, как во время эндохондриального окостенения, когда хондроциты созревают, подвергаясь гипертрофии, или патологическим явлением, как случае гипертрофии сердца, которое часто предшествует хронической сердечной недостаточности. Оба указанных выше явления гипертрофии регулируются NPR-B. Недостаточность NPR-B вызывает карликовость вследствие аномального эндохондриального окостенения, характеризуемого уменьшением размера зоны гипертрофии эпифизарной пластинки роста (Bartels et al. 2004, Am. J. Hum. Genet. 75: 27-34; Tamura et al. 2004, Proc. Natl. Acad. Sci. 101: 17300-17305).
Наоборот, частичный нокаут NPR-B у крыс стимулировал гипертрофию сердца, т.е. гипертрофию кардиомиоцитов (Langenickel et al. 2006, Proc. Natl. Acad. Sci. 103: 4735-4740).
Натрийуретические пептиды, обладающие активностью по отношению к натрийуретическим рецепторам, позднее также были обнаружены в различных тканях. Например, ANP открыт в начале 1980-х годов в качестве эндогенного диуретического и сосудорасширяющего пептида, основная циркулирующая форма которого состоит из 28 аминокислот (SEQ ID NO: l). Затем были открыты другие натрийуретические пептиды, такие как BNP (SEQ ID NO: 2) и CNP (SEQ ID NO: 3). Показано присутствие натрийуретических пептидов и их рецепторов в тканях глаза, особенно в тканях, вовлеченных в регуляцию внутриглазного давления (ВГД). Например, в глазах крыс и кроликов обнаружены мРНК ANP, BNP и CNP, а также NPR-A, NPR-B и NPR-C в цилиарных отростках, сетчатке и сосудистой оболочке (Mittag et al. 1987, Curr. Eye Res. 6: 1189-1196; Nathanson 1987, Invest. Ophthalmol. Vis. Sci. 28: 1357-1364; Fernandez-Durango et al. 1995, Exp. Eye Res. 61: 723-729). Сходные результаты получены в случае цилиарных отростков быка и культивируемых цилиарных эпителиальных клеток быка. (Millar et al. 1997, J. Ocul. Pharmacol. Ther. 13: 1-11; Shahidullah and Wilson 1999, Br. J. Pharmacol. 127: 1438-1446). Присутствие пептидов и их рецепторов в цилиарном эпителии свидетельствует о том, что они могут играть роль в образовании водянистой влаги.
Кроме цилиарных отростков рецепторы натрийуретических пептидов также были обнаружены в тканях, ассоциированных с вытеканием водянистой влаги. Сайты связывания ANP были локализованы в продольных волокнах цилиарной мышцы морской свинки. (Mantyh et al. 1986, Hypertension. 8: 712-721). В культивируемых TM и цилиарных мышечных клетках человека CNP является наиболее сильным и эффективным в отношении стимуляции продукции циклического ГМФ, что свидетельствует о присутствии функционального NPR-B. Активация такого рецептора снижает индуцируемый карбахолом приток кальция. (Pang et al. 1996, Invest. Ophthalmol. Vis. Sci. 37: 1724-1731). Такой результат предполагает, что активация NPR-B должна вызывать расслабление таких тканей. Действительно, CNP значимо снижает индуцируемое карбахолом сокращение цилиарных мышц обезьян и человека (Ding and Abdel-Latif, 1997, Invest. Ophthalmol. Vis. Sci. 38: 2629-2638). Изменение сократительной способности TM и цилиарной мышцы может влиять на возможность вытекания водянистой влаги.
Показано, что циклический ГМФ и соединения, которые повышают уровень циклического ГМФ в тканях глаза, такие как доноры окиси азота, снижают ВГД (Nathanson 1988, Eur. J. Pharmacol. 147: 155-156; Becker 1990, Invest. Ophthalmol. Vis. Sci. 31: 1647-1649; Nathanson 1992, J. Pharmacol. Exp. Ther. 260: 956-965; Stein and Clack 1994, Invest. Ophthalmol. Vis. Sci. 35: 2765-2768). Так как натрийуретические пептиды значительно увеличивают продукцию циклического ГМФ, было выдвинуто предположение, что они также снижают ВГД. За последние 20 лет было показано, что натрийуретические пептиды являются высоко эффективными в качестве средств, снижающих ВГД. Например, разные исследователи независимо показали, что интравитреальная инъекция ANP у кроликов последовательно и значимо снижает ВГД. Такой эффект длится в течение многих часов. (Sugrue and Viader, 1986, Eur J Pharmacol. 130: 349-350; Mittag et al. 1987, Сurr Eye Res. 6: 1189-1196; Nathanson 1987 Invest Ophthalmol Vis Sei. 28: 1357-1364; Korenfeld and Becker 1989, Invest Ophthalmol Vis Sei. 30: 2385-2392; Takashima et al. 1996, Invest Ophthalmol Vis Sei. 37: 2671-2677). Влияние ANP на ВГД коррелирует с увеличением продукции циклического ГМФ в радужной оболочке-цилиарном теле (Korenfeld and Becker 1989, Invest. Ophthalmol. Vis. Sci. 30: 2385-2392). Интравитреальная инъекция BNP (Takashima et al. 1996, Invest Ophthalmol Vis Sci. 37: 2671-2677) или CNP (Takashima et al. 1998, Exp. Eye Res. 66: 89-96) также высоко эффективна в снижении ВГД. Показано, что кроме интравитреальной инъекции субконъюнктивальная (Yang et al. 1997, Chin. J. Ophthalmol. 33: 149-151) или внутрикамерная (Sugrue and Viader 1986, Eur. J. Pharmacol. 130: 349-350; Fernandez-Durango et al. 1999, Eur. J. Pharmacol. 364: 107-113) инъекция натрийуретических пептидов также снижает глазное давление. Системное введение ANP кролику (Tsukahara et al. 1988, Ophthalmologica 197: 104-109) или человеку (Diestelhorst and Krieglstein 1989, Int. Ophthalmol. 13: 99-101) также снижает ВГД. К сожалению, невозможно было доставить такие пептиды местно из-за их неспособности проникать в роговицу. Таким образом, такие сильные и эффективные соединения, снижающие ВГД, не были разработаны для такого применения.
Существует потребность в новых агонистах NPR-B, обладающих улучшенной биодоступностью по сравнению с выделенными или синтезированными натрийуретическими пептидами, которые можно применять для лечения опосредованных натрийуретическими пептидами нарушений, таких как глазные нарушения, связанные с диабетом нарушения, сосудистые нарушения, сердечные и сердечнососудистые патологии, воспаление и другие нарушения, описанные в настоящей публикации. Новые агонисты NPR-B, композиции и способы согласно настоящему изобретению удовлетворяют такую потребность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым агонистам NPR-B, также называемым в настоящем описании миметиками или соединениями, подобными натрийуретическим пептидам, которые терапевтически применимы для снижения внутриглазного давления (ВГД) и лечения других нарушений, при которых активация рецептора натрийуретического пептида типа B может быть полезной. В частности, изобретение относится к новым агонистам NPR-B, которые активируют рецептор натрийуретического пептида типа B (NPR-B). Изобретение, кроме того, относится к композициям, содержащим такие новые агонисты NPR-B. Композиции, предлагаемые в изобретении, могут представлять собой офтальмологические композиции для применения в способах лечения или профилактики конкретных глазных болезней, таких как глаукома, предпочтительно благодаря снижению внутриглазного давления, с использованием таких новых агонистов NPR-B. Альтернативно композиции, предлагаемые в изобретении, можно применять в способах лечения или профилактики сердечнососудистых нарушений, заболевания почек, заболевания легких, нарушений скелета, бесплодия и других нарушений, опосредованных натрийуретическими пептидами или белками.
Изобретение отчасти основано на данных, полученных авторами изобретения, о том, что новые агонисты NPR-B, описанные в настоящей публикации, могут обеспечивать улучшенную биодоступность, повышенную химическую стабильность и повышенную метаболическую стабильность в жидкостях или тканях организма благодаря их значительно уменьшенному молекулярному размеру по сравнению с известными натрийуретическими пептидами. Некоторые варианты настоящей заявки, главным образом, относятся к новым пептидам, содержащим модифицированные аминокислоты, которые связываются и активируют NPR-B с высокой специфичностью, которые более подробно описаны в настоящей публикации.
В частности, предполагается, что любое ограничение, обсуждаемое в связи с одним вариантом осуществления изобретения, можно применить к любому другому варианту осуществления изобретения. Кроме того, любую композицию согласно изобретению можно применять в любом способе согласно изобретению, и любой способ согласно изобретению можно применять для получения или применения любой композиции согласно изобретению.
В используемом в настоящем описании смысле термин «агонист NPR-B» относится к новым молекулам, описанным в настоящей публикации, которые активируют NPR-B с высокой эффективностью.
Термин «или» в формуле изобретения используют для обозначения «и/или», если ясно не указано, что он относится только к альтернативным вариантам или альтернативный вариант взаимно исключен, хотя описание поддерживает определение, которое относится к отдельным альтернативам и «и/или».
На протяжении настоящего описания термин «примерно» используют для указания того, что значение включает стандартное отклонение ошибки для устройства и/или способа, используемого для определения значения.
В используемом в настоящем описании смысле форма единственного числа может означать один или несколько, если ясно не указано иное. В используемом в формуле изобретения смысле в случае сочетания со словом «содержащий» слова в единственном числе могут означать один или больше чем один. В используемом в настоящем описании смысле «другой» может означать, по меньшей мере, второй или больше.
Другие цели, отличительные признаки и преимущества настоящего изобретения будут понятны из следующего подробного описания. Однако следует понимать, что подробное описание и конкретные примеры, хотя и представляют предпочтительные варианты осуществления изобретения, приведены только в качестве иллюстрации, так как различные изменения и модификации, не отходящие от сути и не выходящие за рамки объема изобретения, будут очевидны для специалистов в данной области на основании подробного описания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Следующие фигуры образуют часть настоящего описания и включены для того, чтобы дополнительно продемонстрировать некоторые аспекты настоящего изобретения. Изобретение можно лучше понять при обращении к одному или нескольким таким чертежам в сочетании с подробным описанием конкретных вариантов, приведенном в настоящей публикации.
Фиг. 1. Иллюстрирует аминокислотную последовательность ANP (SEQ ID NO: 1), BNP (SEQ ID NO: 2) и CNP (SEQ ID NO: 3).
Фиг. 2. Иллюстрирует влияние CNP, ANP, BNP и мини-ANP (SEQ ID NO: 18) на продукцию циклического ГМФ в клетках GTM-3. Показано, что клетки GTM-3 экспрессируют NPR-B (Pang et al. 1996, Invest. Ophthalmol. Vis. Sci. 37: 1724-1731). Клетки обрабатывали CNP (треугольники), ANP (квадраты), BNP (ромбы) и мини-ANP (кружки). Символы представляют средние значения и стандартные отклонения. Самая высокая концентрация используемых соединений составляла 45 мкМ в случае ANP, BNP и мини-ANP и 5 мкМ в случае CNP. Значения EC50 определяли, используя логистическое уравнение с 4 параметрами. EC50 CNP=38,8 нМ, EC50 ANP=1,63 мкМ, EC50 BNP=1,18 мкМ, EC50 мини-ANP>45 мкМ. Emax (максимальную активацию) каждого соединения определяли относительно максимальной активации CNP, т.е. Emax CNP=100%, Emax ANP=15%, Emax BNP=20% и Emax мини-ANP=0%.
Фиг. 3. Иллюстрирует влияние CNP, ANP, BNP и мини-ANP на продукцию циклического ГМФ в трансфицированных NPR-A-клетках 293-T. Трансфицированные NPR-A клетки 293-T обрабатывали CNP (треугольники), ANP (квадраты), BNP (ромбы) и мини-ANP (кружки). Символы представляют средние значения и стандартные отклонения. EC50 определяли, используя логистическое уравнение с 4 параметрами. EC50 ANP=73,0 нМ, EC50 CNP=1,60 мкМ, EC50 BNP=1,85 мкМ, EC50 мини-ANP=1,54 мкМ.
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ
Настоящее изобретение отчасти основано на обнаружении того, что новые агонисты NPR-B, имеющие улучшенную биодоступность по сравнению с известными натрийуретическими пептидами, применимы для снижения повышенного внутриглазного давления и лечения глаукомы. Таким образом, настоящее изобретение, главным образом, относится к новым агонистам NPR-B и их применению в способах лечения или профилактики нарушений, опосредованных натрийуретическими пептидами или белками. В одном особенно предпочтительном варианте новые агонисты NPR-B, описанные в настоящей публикации, готовят в виде препарата для лечения глазных болезней, таких как глаукома, предпочтительно посредством снижения повышенного внутриглазного давления, часто ассоциированного с глаукомой, с использованием фармацевтической композиции, которая содержит один или несколько новых агонистов NPR-B, которые описаны в настоящей публикации. В других предпочтительных вариантах новые агонисты NPR-B, описанные в настоящей публикации, готовят в виде препарата для лечения других опосредуемых натрийуретическими пептидами или белками нарушений, таких как сердечнососудистые нарушения, нарушения почек, нарушения легких, нарушения скелета, нарушения репродуктивной функции и фиброз.
Отличительным признаком всех известных NP является состоящий из 17 аминокислот цикл, который образуется благодаря внутримолекулярному цистеиновому мостику (смотри фиг. 1). Полагают, что целостность циклической структуры NP необходима для функциональной активности, т.е. преобразованной рецептором NP продукции цГМФ. Авторы настоящего изобретения обнаружили, что некоторые линейные пептиды, такие как новые пептиды, описанные в настоящей публикации, обладающие повышенной химической и метаболической стабильностью и улучшенной биодоступностью по сравнению с известными NP, применимы для лечения опосредованных натрийуретическими пептидами или белками нарушений.
A. Новые пептиды
Настоящее изобретение относится к новым агонистам NPR-B, обладающим биологической активностью, которая улучшена в некоторых аспектах по сравнению с биологической активностью известных натрийуретических пептидов. Новые пептиды согласно изобретению включают обычные и необычные аминокислоты. Обычные аминокислоты обозначают согласно их стандартным трехбуквенным кодам, которые указаны в таблице 1 ниже.
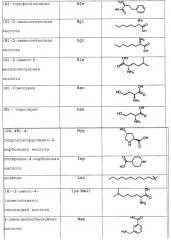
Необычные аминокислоты обозначают согласно трехбуквенному коду или используя другое сокращение, когда они присутствуют в новых агонистах NPR-B согласно изобретению. В таблице 2, ниже, приведено полное название, трехбуквенный код или сокращение и структура каждой необычной аминокислоты, встречающейся в последовательностях новых пептидов, описанных в настоящей публикации.
| Таблица 2Список сокращений необычных аминокислот и других химических структур | ||
| Название | Сокращение | Структура |
| (S)-2-((S)-3-амино-2,5-диоксопирролидин-1-ил)-5-гуанидинопентановая кислота | Dim-Arg | |
| рац-2-амино-4-морфолинобутановая кислота | AR-385-017 | |
| (S)-2-амино-3-(2H-тетразол-5-ил)пропановая кислота | AR-314-145 | |
| рац(1S,2S)-2-(октилкарбамоил)циклогексанкарбоновая кислота | AR-314-171 | |
| рац(1S,2S)-2-(гексилкарбамоил)циклогексанкарбоновая кислота | AR-314-170 | |
| рац(1R,2S)-2-октилкарбамоил)циклогексанкарбоновая кислота | AR-314-169 |
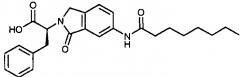
| (S)-2-(6-октанамидо-1-оксоизоиндолин-2-ил)-3-фенилпропановая кислота | AR-385-008 | |
| (S)-2-(4-октанамидо-1,3-диоксоизоиндолин-2-ил)-3-фенилпропановая кислота | AR-314-172 | |
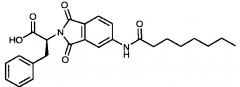
| (S)-2-(5-октанамидо-1,3-диоксоизоиндолин-2-ил)-3-фенилпропановая кислота | AR-385-042 | |
| (S,S)-2-(3-метил-3-октаноиламино-2-оксопирролидин-1-ил)-3-фенилпропионовая кислота | AR-314-102 | |
| 2-(7-октаноил-1-оксо-2,7-диазаспиро[4.5]дец-2-ил)-3-фенилпропионовая кислота | AR-314-087 | |
| 1-(3-метилбутил)пиперазин | AR-201-124 | |
| циклогептилпирролидин-2-илметиламин | ES-283-049 |
| (S)-аминотиофен-2-илуксусная кислота | BB727 | |
| (R)-аминотиофен-2-илуксусная кислота | BB726 | |
| 2-октилсульфанил-пропионовая кислота | AR-201-073 | |
| 5-пентилсульфанил-метилоксазол-2-карбоновая кислота | AR-201-072 | |
| 4-(4-бутилтиазол-2-иламино)бензойная кислота | AR-201-069 | |
| 4-(5-бутилтиазол-2-иламино)бензойная кислота | AR-201-068 | |
| 2-гексиламинооксазол-4-карбоновая кислота | AR-201-062 | |
| 2-гексаноил-аминооксазол-4-карбоновая кислота | AR-201-059 | |
| 3-гексилоксиизоксазол-5-карбоновая кислота | AR-201-058 | |
| 2-гексаноиламино-изоникотиновая кислота | AR-201-054 | |
| 1-карбоксиэтиловый эфир октановой кислоты | AR-201-049 | |
| 1-карбокси-2-фенилэтиловый эфир додекановой кислоты | AR-201-048 | |
| (R)-2-амино-4-(пиперидин-1-ил)бутановая кислота | abu(pip) | |
| 8-амино-3,6-диоксаоктановая кислота | Adx | |
| (2,3,4,5,6-пентагидрокси-гексилиденаминоокси)уксусная кислота | Gluc-Aoa | |
| 5-((4S)-2-оксогексагидро-1H-тиено[3,4-d]имидазол-4-ил)пентановая кислота | 74 | |
| адамантан-2-иламин | 504 | |
| циклогексиламин | 558 | |
| циклопентиламин | 559 | |
| 2-((1S,2R,4R)-бицикло[2.2.1]гептан-2-ил)уксусная кислота | 779 |
| 2-фенетилбензойная кислота | 785 | |
| додекановая кислота | 832 | |
| анилин | 873 | |
| октансульфонилхлорид | 933 | |
| гексилхлорформиат | 1270 | |
| 3-фенилпропионовая кислота | 1281 | |
| 4-фенилмасляная кислота | 1319 | |
| 5-фенилпентановая кислота | 1320 | |
| 4-циклогексилмасляная кислота | 1339 | |
| 3-циклогексил-пропионовая кислота | 1340 | |
| (S)-3,3-диметилбутан-2-амин | 1381 | |
| 2-(гексиламино)уксусная кислота | 1625-Ac | |
| 1-бензиловый эфир пиперидин-1,2-дикарбоновой кислоты | 1695 |
| 4-метилциклогексиламин | 1859 | |
| (1R,2R)-2-метилциклогексанамин | 1860 | |
| [2-(2-метоксиэтокси)этокси]уксусная кислота | 1888 | |
| (1R,2R,4R)-бицикло[2.2.1]гептан-2-амин | 1906 | |
| (2-метоксиэтокси)ацетилхлорид | 1913 | |
| (1R,2R)-2-(бензилокси)циклогексанамин | 1934 | |
| (S)-1,2,3,4-тетрагидронафталин-1-амин | 2118 | |
| (S)-3-метилпиперидин | 2137 | |
| 4-(4-метоксифенил)масляная кислота | 2553 | |
| (1R,2R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-амин | 2797 | |
| 2-((2S,3R,4R,5R)-2,3,4,5,6-пентагидрокси-гексиламино)уксусная кислота | 2857-Ac |
| циклобутиламин | 2906 | |
| (S)-2-циклопентил-гексановая кислота | 3218 | |
| 3-амино-4-гидроксибензойная кислота | 3421 | |
| 1-этилпропиламин | 3791 | |
| (R)-2-метилбутан-1–ами |