Антибактериальные средства на основе производных ципрофлоксацина
Иллюстрации
Показать всеИзобретение относится к новым производным ципрофлоксацина общей формулы (I), проявляющим антибактериальные свойства.
Технический результат: получены новые производные ципрофлоксацина общей формулы (I), которые могут быть использованы в качестве антибактериальных средств. 1 з.п. ф-лы, 3 табл., 14 пр.
Реферат
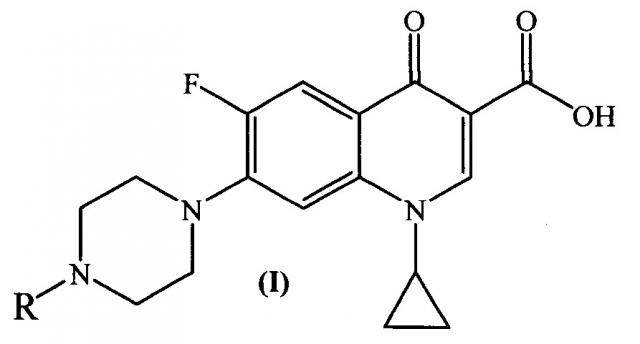
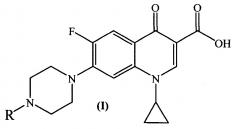
Изобретение относится к химии органических гетероциклических соединений, а именно к новым производным ципрофлоксацина общей формулы (I), проявляющим антибактериальные свойства. Соединения могут найти применение в медицине и ветеринарии.
где R =
Поиск и направленный синтез высокоэффективных и безопасных антибактериальных средств является одной из первостепенных задач современной фармакологии и медицинской химии. В последние годы наблюдается заметный рост и распространенности инфекционных заболеваний, обусловленных появлением высокопатогенных штаммов микроорганизмов и повышением их резистентности к существующим антибиотикам.
Несмотря на наличие эпизодически возникающих острых бактериальных инфекций, например, вызванных мутировавшими штаммами кишечной палочки (O104:H4), одной из основных причин смертности в развитых странах остаются хорошо известные бактерии - стафилококк золотистый, кишечная и синегнойная палочки.
В частности, по данным ВОЗ, золотистый стафилококк возглавляет список бактерий, которыми наиболее часто заражаются в медицинских учреждениях. Особую опасность для человека представляют метициллин-устойчивые штаммы золотистого стафилококка, которые вызывают сепсис и тяжелые формы инфекций кожи и мягких тканей (фурункулезы, флегмона, синдром ошпаренной кожи), являясь причиной гибели до 31% зараженных ими пациентов.
Одним из наиболее эффективных антибактериальных препаратов, используемым в современной практике для подавления метициллин-устойчивых штаммов золотистого стафилококка, является препараты фторхинолонового ряда, в частности ципрофлоксацин. По химической структуре ципрофлоксацин относится к производным фторхинолонового ряда.
Механизм его действия заключается в подавлении бактериальной ДНК-гиразы (топоизомеразы II и IV, ответственные за процесс суперспирализации хромосомной ДНК вокруг ядерной РНК, что необходимо для считывания генетической информации), нарушении синтеза ДНК, роста и деления бактерий, что вызывает выраженные морфологические изменения (в том числе клеточной стенки и мембран) и быструю гибель бактериальной клетки.
Ципрофлоксацин оказывает антибактериальное действие с наибольшей активностью в отношении ряда аэробных грамотрицательных и грамположительных бактерий, а именно: Pseudomonas aeruginosa, Haemophilus influenzae, Escherichia coli, Shigella spp., Salmonella spp., Neisseria meningitidis, N. Gonorrhoeae, Staphylococcus spp. (продуцирующих и не продуцирующих пенициллиназу), некоторых штаммов Enterococcus spp., а также Campylobacter spp., Legionella spp., Mycoplasma spp., Chlamidia spp., Mycobacterium spp. [Яковлев В.П. Антибактериальные препараты группы фторхинолонов // Рус. мед. журн. - 1997, Вып. 5 - С. 1405-1413].
Ципрофлоксацин применяют при инфекционно-воспалительных заболеваниях, вызванных чувствительными к ципрофлоксацину микроорганизмами, в т.ч. при заболеваниях дыхательных путей, брюшной полости и органов малого таза, костей, суставов, кожи, септицемии, тяжелых инфекциях ЛОР-органов и др [ Quinolones: a class of antimicrobial agents // Vet. Med. - 2001 - V. 46 - P. 257-274].
Существенным недостатком ципрофлоксацина является ограничение приема по возрасту - противопоказано назначение этого препарата детям и подросткам, так как он вызывает нарушение роста [Белобородова К.В., Падейская Е.Н., Бирюков А.В. Фторхинолоны в педиатрии - за и против // Педиатрия - 1996. Вып. 2. - С. 76-84].
Также к недостаткам ципрофлоксацина относят и довольно часто встречающиеся побочные проявления действия препарата - боль в животе, тошнота, дисбактериоз, бессонница, головокружение, проявление аллергических реакций (отек Квинке, крапивница, зуд). В последние годы отмечается значительный рост резистентности микроорганизмов ко всему классу фторхинолонов [Norrby S.R. Side-effects of quinolones: comparisons between quinolones and other antibiotics // Eur. J. Clin. Microbiol. Infect. Dis. - 1991 - V. 10 - P. 378-383].
На дату подачи заявленного технического решения известно, что резистентными к ципрофлоксацину являются большинство стафилококков, устойчивых к метициллину [Lowy F.D. Antimicrobial resistance: the example of Staphylococcus aureus // J. Clin. Invest. - 2003 - V. 111. - P. 1265-1273].
Исследование взаимоотношений структура-биологической активности в ряду производных ципрофлоксацина выявило, что наибольшее влияние на их биологическое действие оказывает природа заместителя при атоме C-7 [Emamia S., Shafiee A., Foroumadi A. Quinolones: Recent Structural and Clinical Developments // Iran. J. Pharm. Res. - 2005. - V. - P. 123-136].
Наиболее часто в качестве таких заместителей оказываются пяти- и шестичленные азотсодержащие гетероциклы, такие как пиперазин, пиримидин, 1,2,3-триазол, пирролидин и их замещенные производные.
В источнике [N. German, P. Wei, G.W. Kaatz и R.J. Kerns. Synthesis and evaluation of fluoroquinolone derivatives as substrate-based inhibitors of bacterial efflux pumps // Eur. J. Med. Chem. - 2008 - V. 43. - P. 2453-2463] описаны производные ципрофлоксацина, модифицированные по атому C-7 пиперазинового кольца фрагментами различных пептидов и замещенных диарилмочевин. Данные соединения проявили несколько меньшую антибактериальную активность по сравнению с ципрофлоксацином.
Модификация ципрофлоксацина по атому C-7 пиперазинового кольца аминогликозидным антибиотиком неомицином через мостик, содержащий 1,2,3-триазольный фрагмент, приводило к получению гибридных структур, проявляющих высокую антибактериальную активность в отношении штаммов грамотрицательных и грамположительных бактерий [V. Pokrovskaya, V. Belakhov, M. Hainrichson, S. Yaron and Т. Baasov Design, Synthesis, and Evaluation of Novel Fluoroquinolone-Aminoglycoside Hybrid Antibiotics // J. Med. Chem. - 2009 - V. 5. - P, 2243-2254].
В международной заявке [WO 2011034971 A1. Modified fluoroquinolone compounds and methods of using the samee / Designmedix, Inc - Опубл. - 24.03.2011] описаны производные ципрофлоксацина по атому С-7 пиперазинового кольца, существенно превосходящие его по антибактериальной активности в отношении штаммов грамположительных и грамотрицательных бактерий.
Следует обратить внимание на то, что существенным недостатком всех приведенных выше соединений является их высокая токсичность, которая не позволяет рассматривать их в качестве кандидатов в антибактериальные лекарственные средства.
Задачей заявленного технического решения является создание новых нетоксичных (безопасных) антибактериальных препаратов фторхинолонового ряда на основе ципрофлоксацина, обладающих высокой антибактериальной активностью, с целью расширения арсенала известных средств указанного назначения.
Техническим результатом заявленного технического решения является получение новых соединений общей формулы (I), содержащих в своем составе как фрагмент природного соединения (пиридоксина, входящего в группу витамина B6), так и фрагмент антибактериального препарата ципрофлоксацина.
Задача решается, и указанный технический результат достигается получением заявляемых новых производных ципрофлоксацина формулы (I):
согласно нижеприведенным схемам 1-7, где заявляемые соединения обозначены номерами I-1-I-12.
Схема 1. (a) N,N-Диметилформамид (далее ДМФА), ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч.
* в [] указаны не выделяемые промежуточные продукты
Схема 2. (a) H2O, 55°C, 3 ч; (b) H2O, ДМФА, ципрофлоксацин гидрохлорид, KI, NaHCO3, 55°C, 6 ч; (с) H2O, HCl.
Схема 3. (a) CH3OH, SHCH2CH2OH, CH3ONa, 50°C, 5 ч; (b) CHCl3, NBS, PPh3, 20°C, 1 ч; (с) ДМФА, ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч; (d) H2O, HCl, 25°C, 24 ч.
Схема 4. (a) СН3С(O)Н, HCl, 3-5°C, 3 ч или C6H6, R1C(O)H, p-TsOH, кипячение, 8 ч; (b) CHCl3, NBS, PPh3, 20°C, 1 ч; (с) ДМФА, ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч.
* в [] указан не выделяемый промежуточный продукт
Схема 5. (a) ДМФА, ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч. (b) H2O, HCl.
Схема 6. (a) ципрофлоксацин, KI, NaHCO3, 20°C, 4 ч. (b) H2O, HCl, 25°C, 24 ч.
* в [] указан не выделяемый промежуточный продукт
Схема 7. (а) C6H6, параформ, p-TsOH, кипячение, 6 ч; (b) CHCl3, SOCl2, 20°C, 3 ч; (с) ДМФА, ципрофлоксацин, KI, NaHCO3, 80°C, 4 ч. (d) H2O, HCl.
Характеристики новых соединений, полученных в соответствии со схемами 1-7, приведены далее в примерах конкретного выполнения.
Структуры полученных соединений подтверждены методами масс-спектрометрии, 1H и 13C ЯМР-спектроскопии.
Спектры ЯМР регистрируют на приборе Bruker AVANCE-400. Химический сдвиг определяют относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13C).
Температуры плавления определяют с помощью прибора Stanford Research Systems MPA-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводят методом TCX на пластинах Sorbfil Plates.
Масс-спектры MALDI регистрируют на приборе Ultraflex III компании Bruker, оборудованном твердотельным лазером и время-пролетным анализатором масс. Ускоряющее напряжение 25 кВ. Образцы наносят на мишень Anchor Chip. Запись спектров производят в режиме положительных ионов. Результирующий спектр представляет собой сумму 300 спектров, полученных в разных точках образца. В качестве матриц применяют 2,5-дигидроксибензойную кислоту (DHB) (Acros, 99%) и n-нитроанилин (PNA). Для приготовления матриц использовуют хлороформ. Нанесение образцов на мишень проводят методом «высушенных капель».
Примеры конкретного выполнения заявленного технического решения
Пример 1. Получение 1-циклопропил-6-фтор-7-(4-((2,2,8-триметил-4H-[1,3]диоксино-[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-1)
К раствору 1.44 г (5.5 ммоль) соединения (1) [Tomita I., Brooks H.G., Metzler D.E. Synthesis of vitamin B6 derivatives. II. 3-Hydroxy-4-hydroxymethyl-2-methyl-5-pyridine acetic acid and related substances // J. Heterocycl. Chem. - 1966 - V. 3., N. 2. - P. 178-183] в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 1.50 г (4.5 ммоль) ципрофлоксацина, 0.84 г (10.0 ммоль) гидрокарбоната натрия и 0.23 г (1.4 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 1.12 г (47%), светло-желтые кристаллы, т. пл. 243°C (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.14-1.18 м (2Н, циклопропил CH2), 1.32-1.37 м (2Н, циклопропил CH2), 1.53 с (6Н, 2CH3), 2.36 с (3H, CH3), 2.61 м (4Н, 2CH2), 3.29 м (4Н, пиперазино 2CH2), 3.44 с (2Н, CH2N), 3.50-3.56 м (1H, циклопропил CH), 4.98 с (2Н, CH2O), 7.28 д (1H, 4JH-F=7.1 Гц, СНар), 7.78 д (1H, 3JH-F=13.1 Гц, CHap), 7.87 с (1H, CHap), 8.60 с (1Н, СНпир), 14.95 уш с (1H, OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.18 с (циклопропил 2CH2), 18.43 с (CH3), 24.74 с (2CH3), 35.36 с (циклопропил CH), 49.79 д (4JC-F=4-7 Гц, пиперазино 2CH2), 52.55 с (пиперазино 2 CH2), 57.46 с (CH2), 58.77 с (CH2), 99.62 с (С(CH3)2), 104.86 с (Cap), 107.78 с (Сар), 112.00 д (2JC-F=23.5 Гц, Сар), 119.42 д (3JC-F=7.8 Гц, Сар), 126.32 (Спир), 126.48 с (Спир), 139.02 с (C), 140.42 с (С), 145.77 д (2JC-F=10.2 Гц, Cap-N), 146.13 с (С), 147.26 с (С), 147.52 с (С), 153.57 д (1JC-F=251.6 Гц, Cap-F), 166.86 с (C(О)OH), 176.83 д (4JC-F=2.2 Гц, C=O).
MALDI-MS: [М+Н]+ 523.
Пример 2. Получение гидрохлорида 1-циклопропил-6-фтор-7-(4-((5-гидрокси-4-гидроксиметил-6-метилпиридин-3-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-2)
Раствор 2.50 г (10.3 ммоль) 3-гидрокси-4,5-хлорметил-2-метилпиридиний гидрохлорида (2) [R. Serwa, T.G. Nam, L. Valgimigli, S. Culbertson, C.L Rector, B.S. Jeong, D.A. Pratt, N.A. Porter. Preparation and Investigation of Vitamin B6-Derived Aminopyridinol Antioxidants // Chem. Eur. J. - 2010 - V. 16., N. 46. - P. 14106-14114] в 25 мл дистиллированной воды перемешивают 3 ч при 55°C. К полученному раствору добавляют 75 мл диметилформамида, 3.60 г (9.8 ммоль) ципрофлоксацина гидрохлорида и 3.38 г (40.2 ммоль) гидрокарбоната натрия. По окончании активного выделения газа (~2 минуты) добавляют 0.25 г (1.50 ммоль) йодистого калия. Полученный раствор перемешивают в течение 6 ч при 55°C. По окончании перемешивания растворитель удаляют в вакууме. К сухому остатку добавляют 100 мл дистиллированной воды и кипятят 30 минут. Нерастворившийся осадок отфильтровывают в вакууме.
Осадок переносят в кругл о донную колбу на 100 мл, добавляют 50 мл дистиллированной воды и подкисляют концентрированной соляной кислотой до pH=2.56. Растворитель удаляют в вакууме.
Сухой остаток переносят в круглодонную колбу на 100 мл, заливают 60 мл воды и при перемешивании нейтрализовывают добавлением NaHCO3 до pH=6.00. Выпавший осадок отфильтровывают, переносят в кругло донную колбу на 100 мл, добавляют 50 мл дистиллированной воды и подкисляют концентрированной соляной кислотой до pH=2.56. Раствор высушивают в вакууме. Выход 2.75 г (54%), т. пл. не ниже 190°C (разл.).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ м.д.: 1.19-1.20 м (2Н, циклопропил CH2), 1.30-1.32 м (2Н, циклопропил CH2), 2.64 с (3H, CH3), 3.52 уш с (4Н, пиперазино 2CH2), 3.69-3.71 уш с (4Н, пиперазино 2CH2), 3.86 с (1H, циклопропил СН), 4.70 с (2Н, CH2), 4.96 с (2Н, CH2), 7.60 д (1Н, 4JH-F=7.3 Гц, CHap), 7.95 д (1H, 3JH-F=13.0 Гц, СНар), 8.67 с (1H, СН), 8.72 с (1H, CH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 7.66 с (циклопропил 2CH2), 15.63 с (CH3), 36.03 с (циклопропил СН), 46.32 с (пиперазино 2CH2), 50.71 с (пиперазино 2CH2), 52.76 с (CH2), 55.52 с (CH2), 106.86 с (Сар), 107.00 с (Сар), 111.25 д (2JC-F=23.2 Гц, Сар), 119.39 д (3JC-F=8.1 Гц, Сар), 126.42 с (Спир), 135.37 с (Спир), 139.11 с (С), 143.70 д (2JC-F=10.4 Гц, Cap-N), 144.01 с (С), 144.18 с (С), 148.30 с (С), 152.20 с (С), 152.88 д (1JC-F=248.9 Гц, Cap-F), 165.90 с (C(О)OH), 176.42 с (С=O).
MALDI-MS: [M-Cl]+ 483.
Пример 3. Получение тетрагидрохлорида 1-циклопропил-6-фтор-7-(4-((5-гидрокси-4-гидроксиметил-6-метилпиридин-3-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-3)
Раствор 2.50 г (10.3 ммоль) 3-гидрокси-4,5-хлорметил-2-метилпиридиний гидрохлорида (2) [R. Serwa, T.G. Nam, L. Valgimigli, S. Culbertson, C.L. Rector, B.S. Jeong, D.A. Pratt, N.A. Porter. Preparation and Investigation of Vitamin B6-Derived Aminopyridinol Antioxidants // Chem. Eur. J. - 2010 - V. 16., N. 46. - P. 14106-14114] в 25 мл дистиллированной воды перемешивают 3 ч при 55°C. К полученному раствору добавляют 75 мл диметилформамида, 3.60 г (9.8 ммоль) ципрофлоксацина гидрохлорида и 3.38 г (40.2 ммоль) гидрокарбоната натрия. По окончании активного выделения газа (~2 минуты) добавляют 0.25 г (1.50 ммоль) йодистого калия. Полученный раствор перемешивают в течение 6 ч при 55°C. По окончании перемешивания растворитель удаляют в вакууме. К сухому остатку добавляют 100 мл дистиллированной воды и кипятят 30 минут. Нерастворившийся осадок отфильтровывают в вакууме.
Осадок переносят в кругл о донную колбу на 100 мл, добавляют 50 мл дистиллированной воды и 5 мл концентрированной соляной кислоты. Растворитель удаляют в вакууме. Выход 4.23 г (65%), т. пл. не ниже 220°C (разл.).
Доказательство структуры тетрагидрохлорида проводят с использованием метода аргентометрического титрования. Исследование проводят на автоматическом титраторе Metrohm Basic Titrino 794 (дозирование с точностью до 1 мкл). Реактивы: вода дист., нитрат серебра AgNO3, ≈1% раствор хромата калия K2CrO4.
Приготовление раствора титранта: Vк.=100 мл, m(AgNO3)=1.70750 г, Mr(AgNO3)=169.87 г/моль, c(AgNO3)=0.1005 M. После приготовления титрант заполняют дозирующее устройство титратора.
Приготовление раствора образца: Vк.=100 мл, m(образца)=0.49140 г, Mr(I-3)=482.51 г/моль, Mr(HCl)=36.46 г/моль, ω(H2O)=8.16%, m(образца без воды)=0.45130 г.
Процедура титрования: титрование проводят по методу Мора (прямое аргентометрическое титрование в присутствии хромата калия). Аликвоту исследуемого раствора (Vал.=20 мл) переносят в стаканчик, куда помещают перемешивающий стержень. pH исходного раствора около 2.2 доводят до значения 9.5 концентрированным раствором КОН (при pH около 4 выпадает осадок, который растворяется при pH около 9). Затем добавляют 4-5 капель хромата калия (раствор окрашивается в желтый цвет), погружается носик дозатора и выполняют медленное титрование. Сначала в растворе появляется осадок хлорида серебра и раствор приобретает лимонно-желтую окраску. Затем при добавлении титранта появляется красный осадок хромата серебра, который при перемешивании дает оранжевое окрашивание, исчезающее со временем (сначала быстро, но по мере приближения к точке эквивалентности медленнее). Конец титрования определяют по оранжевой окраске, неисчезающей в течение 2-3 минут.
Результаты титрования: объем титранта (Vтитранта) по результатам четырех измерений составляет: 5.898 мл, 5.828 мл, 5.752 мл и 5.807 мл.
Vсредн.=5.821±0.060 мл
с(HCl)=c(AgNO3)*Vсредн./Vал.=0.02925±0.00030 M
ν(HCl)=c(HCl)*Vк.=0.002925±0.000030 моль
m(HCl)=(HCl)*Mr(HCl)=0.1066±0.0011 г
m(I-3)=m(образца без воды)-m(HCl)=0.3447±0.0011 г
ν(I-3)=m(I-3)/Mr(I-3)=0.0007144±0.0000023 моль
n(HCl)=ν(HCl)/ν(I-3)=4.094±0.042
Таким образом, в состав соединения I-3 входят 4 молекулы хлороводорода.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ м.д.: 0.99-1.03 м (2Н, циклопропил CH2), 1.23-1.28 м (2Н, циклопропил CH2), 2.56 с (3H, CH3), 3.52 уш м (9Н, пиперазино 4CH2 + циклопропил CH), 4.61 с (2Н, CH2), 4.98 с (2Н, CH2), 7.26 д (1Н, 3JH-F=12.9 Гц, CHap), 7.30 д (1H, 4JH-F=7.2 Гц, CHap), 8.30 с (1Н, СН), 8.41 с (1H, CH).
Спектр ЯМР 13C (100 МГц, ДМСО-d6+D2O) δ, м.д.: 9.12 c (циклопропил 2CH2), 16.83 с (CH3), 37.75 с (циклопропил CH), 48.05 д (4JC-F=4.8 Гц, пиперазино 2CH2), 53.25 с (пиперазино 2 CH2), 56.42 с (CH2), 58.20 с (CH2), 107.23 с (Сар), 108.26 с (Сар), 112.30 д (2JC-F=22.9 Гц, Cap), 120.34 д (3JC-F=8.4 Гц, Сар), 127.49 с (Спир), 136.11 с (Спир), 140.46 с (C), 145.56 д (2JC-F=10.2 Гц, Cap-N), 146.61 с (С), 147.40 с (С), 149.79 с (С), 154.17 с (С), 154.82 д (1JC-F=251.6 Гц, Cap-F), 170.25 с (C(О)OH), 177.40 с (С=O).
MALDI-MS: [M-4Cl]+ 483.
Пример 4. Получение 1-циклопропил-6-фтор-7-(4-(2-(((2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)сульфанил)этил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-4)
Стадия 1. Получение 5-(((2-гидроксиэтил)сульфанил)метил)-2,2,8-триметил-4H-[1,3]-диоксино[4,5-с]пиридина (3)
К раствору 0.52 г (22.4 ммоль) натрия в 10 мл абсолютного метанола добавляют 2.69 г (10.2 ммоль) соединения (1) [Tomita I., Brooks H.G., Metzler D.E. Synthesis of vitamin B6 derivatives. II. 3-Hydroxy-4-hydroxymethyl-2-methyl-5-pyridine acetic acid and related substances // J. Heterocycl. Chem. - 1966 - V. 3., N. 2. - P. 178-183], после чего добавляют при охлаждении 1.14 г (14.6 ммоль) меркаптоэтанола. Реакционную смесь перемешивают в течение 5 часов при 50°C. Выпавший осадок отфильтровают, растворитель удаляют в вакууме. Сухой остаток растворяют в минимальном количестве хлороформа и очищают с помощью колоночной хроматографии (элюент - хлороформ, затем этилацетат). Выход 1.74 г (64%), белые кристаллы, т. пл. 103-104°C. Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.53 с (6Н, 2CH3), 2.37 с (3H, CH3), 2.61 т (2Н, 3JHH=6.1 Гц, ), 3.00 с (1H, OH), 3.58 с (2Н, CH2S), 3.71 т (2Н, 3JHH=6.1 Гц, , 4.94 с (2Н, CH2O), 7.83 c (1H, СН).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 18.42 с (CH3), 24.82 с (2CH3), 30.07 с ), 34.44 с (CH2S), 58.52 с (CH2O), 60.09 с (CH2O), 99.91 c , 125.63 с (Спир), 126.63 с (Спир), 139.93 с (Спир), 146.46 с (Спир), 147.46 с (Спир).
Стадия 2. Получение 5-(((2-бромэтил)сульфанил)метил)-2,2,8-триметил-4H-[1,3]диоксино[4,5-с]пиридина (4)
К раствору 1.74 г (6.5 ммоль) соединения (3) в 20 мл абсолютного хлороформа при 20°C добавляют 1.70 г (6.5 ммоль) трифенилфосфина и 1.16 г (6.5 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 1.42 г (66%), светло-коричневое масло.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.54 с (6Н, 2CH3), 2.39 с (3H, CH3), 2.86 т (2Н, 3JHH=7.6 Гц, ), 3.40 т (2Н, 3JHH=7.6 Гц, ), 3.60 с (2Н, CH2S), 4.93 с (2Н, CH2O), 7.85 с (1H, CH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 18.60 c (CH3), 24.85 с (2CH3), 30.18 с , 30.57 с , 33.69 с (CH2S), 58.52 с (CH2O), 99.96 с , 125.41 с (Спир), 126.15 с (Спир), 139.89 с (Спир), 146.48 с (Спир), 147.92 с (Спир).
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-(2-(((2,2,8-триметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)сульфанил)этил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-4)
К раствору 0.49 г (1.5 ммоль) соединения (4) в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 0.46 г (1.4 ммоль) ципрофлоксацина, 0.12 г (1.4 ммоль) гидрокарбоната натрия и 0.05 г (0.4 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.41 г (51%), светло-желтые кристаллы, т. пл. 206-208°C (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.16-1.20 м (2Н, циклопропил CH2), 1.35-1.40 м (2Н, циклопропил CH2), 1.54 с (6Н, 2CH3), 2.38 с (3H, CH3), 2.60-2.62 м (4Н, пиперазино 2CH2), 2.64-2.67 м (4Н, ), 3.31-3.33 м (4Н, пиперазино 2CH2), 3.51-3.56 м (1H, циклопропил СН), 3.59 с (2Н, CH2N), 4.96 с (2Н, CH2O), 7.32 д (1H, 4JH-F=7.1 Гц, CHap), 7.85 с (1H, CHap), 7.93 д (1H, 3JH-F=13.1 Гц, CHap), 8.70 с (1Н, СНпир), 14.97 уш с (1H, OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.33 с (циклопропил 2CH2), 18.60 с (CH3), 24.85 с (2CH3), 28.75 с (CH2), 30.57 с (CH2), 35.40 с (циклопропил CH), 49.82 д (4JC-F=4.8 Гц, пиперазино 2CH2), 52.74 с (пиперазино 2CH2), 57.81 с (CH2), 58.53 с (CH2), 99.87 с , 104.91 д (4JC-F=3.0 Гц, Сар), 108.16 с (Сар), 112.41 д (2JC-F=23.5 Гц, Cap), 119.84 д (3JC-F=7-7 ГЦ. Сар), 125.42 с (Спир), 126.62 с (Спир), 139.17 с (С), 140.04 с (С), 145.95 д (2JC-F=10.5 Гц, Cap-N), 146.42 с (С), 147.46 с (С), 147.54 с (С), 153.77 д (1JC-F=251.6 Гц, Cap-F), 167.08 с (C(О)ОН), 177.16 с (С=O).
MALDI-MS: [М+Н]+ 583.
Пример 5. Получение 1-циклопропил-6-фтор-7-(4-(2-(((5-гидрокси-4-гидроксиметил-6-метилпиридин-3-ил)метил)сульфанил)этил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-5)
0.24 г (0.4 ммоль) производного ципрофлоксацина (I-4) и 1 мл конц. HCl в 20 мл воды перемешивают 24 ч при 25°C. Далее раствор нейтрализовывают с помощью гидрокарбоната натрия до рН=6. Выпавший осадок отфильтровывают и промывают последовательно ацетоном, хлороформом и водой. Выход 0.12 г (52%), светло-коричневые кристаллы, т. пл. 135-140°C (разл).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.18 уш с (2Н, циклопропил CH2), 1.32 уш с (2Н, циклопропил CH2), 2.32 с (3H, CH3), 2.58-2.64 м (8Н, пиперазино 2CH2, SCH2CH2N), 3.32-3.36 м (4Н, пиперазино 2CH2), 3.61-3.67 м (1H, циклопропил СН), 3.80 (2Н, CH2N), 4.82 с (2Н, CH2O), 5.88 уш с (1Н, ОН), 7.56 уш с (1H, CHap), 7.82 с (1H, CHap), 7.88 д (1Н, 3JH-F=13.2 Гц, CHap), 8.65 с (1Н, СНпир), 9.32 уш с (1Н, ОН).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 7.57 с (циклопропил 2CH2), 19.31 с (CH3), 28.01 с (CH2), 29.80 с (CH2), 35.88 с (циклопропил СН), 49.32 с (пиперазино 2CH2), 52.06 с (пиперазино 2CH2), 56.48 с (CH2), 57.26 с (CH2), 106.38 д (4JC-F=2.7 Гцо, Cap), 108.18 с (Сар), 110.91 д (2JC-F=23.1 Гц, Сар), 118.56 д (3JC-F=7.8 Гц, Сар), 129.95 с (Спир), 131.42 с (Спир), 139.16 с (С), 140.33 с (С), 145.13 д (2JC-F=10.1 Гц, Cap-N), 146.01 с (С), 147.96 с (С), 150.07 с (С), 153.01 д (1JC-F=249.6 Гц, Cap-F), 165.94 с (C(О)OН), 176.34 с (С=O).
MALDI-MS: [М+Н]+ 543.
Пример 6. Получение 1-циклопропил-6-фтор-7-(4-((2,8-диметил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-6)
Стадия 1. Получение 5-гидроксиметил-2,8-диметил-4H-[1,3]диоксино[4,5-с]пиридина (6)
Через суспензию 12.00 г (59.0 ммоль) гидрохлорида пиридоксина (5) в 150 мл ацетальдегида, при охлаждении до 3-5°C и перемешивании пропускают 39.00 г (1070.0 ммоль) хлороводорода. Полученную реакционную смесь перемешивают в течение 20 ч. Осадок отфильтровывают, промывают эфиром и нейтрализуют водным раствором поташа. Продукт отфильтровывают и перекристаллизовывают из этилового спирта. Выход 5.65 г (50%), бесцветные кристаллы, т. пл. 125°C [RU 02466728. Фосфониевые соли на основе производных пиридоксина / Штырлин Ю.Г., Штырлин Н.В., Пугачев М.В. - Опубл. - 20.11.2012].
Стадия 2. Получение 5-бромметил-2,8-диметил-4H-[1,3]диоксино[4,5-c]пиридина (9)
К раствору 0.99 г (5.1 ммоль) соединения (6) в 20 мл абсолютного хлороформа при 20°C добавляют 1.34 г (5.1 ммоль) трифенилфосфина и 0.91 г (5.1 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 0.45 г (34%), светло-желтое маслообразное вещество.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.57 д (3H, 3JHH=5.1 Гц, ), 2.40 с (3H, CH3), 4.27, 4.32 (AB-система, 2Н, 2JHH=-10.8 Гц, CH2O), 4.94, 4.97 (AB-система, 2Н, 2JHH=-15.8 Гц, CH2 Br), 5.15 к (1H, 3JHH=5.1 Гц, ), 8.00 с (1H, CH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 18.59 с (CH3), 20.62 с (CH3), 26.74 с (CH2Br), 63.47 с (CH2O), 97.32 с , 126.79 с (Спир), 126.94 с (Спир), 140.91 с (Спир), 147.93 с (Спир), 148.63 с (Спир).
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-((2,8-диметил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (1-6). К раствору 0.38 г (1.5 ммоль) соединения (9) в 30 мл абсолютного ДМФА при 20°C последовательно добавляют 0.41 г (1.2 ммоль) ципрофлоксацина, 0.10 г (1.2 ммоль) гидрокарбонат натрия и 0.06 г (0.4 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.31 г (49%), светло-желтые кристаллы, т. пл. 233°C (разл).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.17-1.20 м (2Н, циклопропил CH2), 1.33-1.38 м (2Н, циклопропил CH2), 1.58 д (3H, 3JH-H=5.1 Гц, CH3), 2.41 с (3H, CH3), 2.61-2.63 м (4Н, пиперазино 2CH2), 3.28-3.31 м (4Н, пиперазино 2CH2), 3.43, 3.46 (AB-система, 2Н, 2JH-H=-13.4 Гц, CH2N), 3.49-3.53 м (1Н, циклопропил CH), 5.02, 5.08 (AB-система, 2Н, 2JH-H=-16.2 Гц, CH2O), 5.18 к (1H, 3JH-H=5.1 Гц, СН), 7.30 д (1H, 4JH-F=7.0 Гц, CHap), 7.89 д (1Н, 3JH-F=13.1 Гц, CHap), 7.92 с (1H, CHap), 8.67 с (1H, СНпир), 14.95 уш с (1Н, OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.30 с (циклопропил 2CH2), 18.43 с (CH3), 20.76 с (2CH3), 35.39 с (циклопропил СН), 49.91 д (4JC-F=4.7 Гц, пиперазино 2CH2), 52.62 с (пиперазино 2CH2), 57.59 с (CH2), 64.49 с (CH2), 97.21 с , 104.92 с (Cap), 108.09 с (Сар), 112.34 д (2JC-F=23.5 Гц, Cap), 119.78 д (3JC-F=7.8 Гц, Cap), 126.82 с (Спир), 128.08 с (Спир), 139.13 с (С), 141.02 с (С), 145.88 д (2JC-F=10.4 Гц, Cap-N), 147.26 с (С), 147.43 с (С), 148.02 с (С), 153.73 д (1JC-F=251.6 Гц, Cap-F), 167.00 с (C(О)ОН), 177.08 с (С=O). MALDI-MS: [М+Н]+ 509.
Пример 7. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-пропил-4Н-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-7)
Стадия 1. Получение 5-гидроксиметил-8-метил-2-пропил-4H-[1,3]диоксино[4,5-c]-пиридина (7)
В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 7.00 г (34.4 ммоль) гидрохлорида пиридоксина (5), 13.70 г (72.1 моль) моногидрата n-толуолсульфокислоты и 6.50 мл (72.2 ммоль) масляного альдегида в бензола. Реакционную массу кипятят 8 ч, затем растворитель отгоняют в вакууме, нейтрализовывают до pH=7 водным раствором гидрокарбоната натрия. Выпавший осадок отфильтровают и промывают бензолом. Выход 5.58 г (73%), белые т. пл. 101°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.99 т (3H, 3JHH=7.4 Гц, ), 1.52-1.58 м (2Н, ), 1.80-1.87 м (2Н, ), 2.34 с (3H, CH3), 4.25 уш с (1H, ОН), 4.48 с (2Н, CH2O), 4.96 с (2Н, CH2O), 4.97 т (1H, 3JHH=4.8 Гц, СН), 7.83 с (1Н, CH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.01 с (C3H7), 17.08 с (C3H7), 18.17 с (CH3), 36.41 с (C3H7), 60.04 с (CH2O), 64.27 с (CH2O), 99.97 с , 127.76 с (Спир), 130.11 с (Спир), 139.17 с (Спир), 147.31 с (Спир), 147.99 с (Спир).
Стадия 2. Получение 5-бромметил-8-метил-2-пропил-4H-[1,3]диоксино[4,5-c]пиридина (10)
К раствору 2.97 г (13.3 ммоль) соединения (7) в 20 мл абсолютного хлороформа при 20°C добавляют 3.49 г (13.3 ммоль) трифенилфосфина и 2.37 г (13.3 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 1.56 г (41%), белое маслообразное вещество.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.00 т (3H, 3JHH=7.4 Гц, ), 1.52-1.62 м (2Н, ), 1.82-1.91 (2Н, ), 2.43 с (3H, CH3), 4.30, 4.34 (AB-система, 2Н, 2JHH=-10.8 Гц, CH2O), 4.99 с (2Н, CH2Br), 5.03 т (1H, 3JHH=5.2 Гц, ), 8.03 с (1Н, СН).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.02 с (C3H7), 17.07 с (C3H7), 18.49 с (CH3), 26.73 с (C3H7), 36.35 с (CH2Br), 63.63 с (CH2O), 100.13 с , 127.00 с (Спир), 127.50 с (Спир), 140.36 с (Спир), 148.15 с (Спир), 148.61 с (Спир).
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-пропил-4Н-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-7)
К раствору 1.51 г (5.3 ммоль) соединения (10) в 30 мл абсолютного ДМФА при 20°C последовательно добавляют 1.44 г (4.4 ммоль) ципрофлоксацина, 0.37 г (4.4 ммоль) гидрокарбоната натрия и 0.15 г (1.3 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.6 г (26%), светло-желтые кристаллы, т. пл. 237-239°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.99 т (3H, 3JHH=7.4 Гц, C3H7), 1.13-1.19 м (2Н, циклопропил CH2), 1.34-1.37 м (2Н, циклопропил CH2), 1.49-1.60 м (2Н, C3H7), 1.77-1.89 (2Н, C3H7), 2.39 с (3H, CH3), 2.60-2.62 м (4Н, пиперазино 2CH2), 3.27-3.29 м (4Н, пиперазино 2CH2), 3.41, 3.45 (AB-система, 2Н, 2JH-H=-13.2 Гц, CH2N), 3.52 м (1H, циклопропил СН), 5.00, 5.08 (AB-система, 2Н, 2JH-H=-16-2 Гц, CH2O), 5.02 к (1H, 3JH-H=5.2 Гц, СН), 7.29 д (1H, 4JH-F=7.0 Гц, CHap), 7.84 д (1H, 3JH-F=13.1 Гц, CHap), 7.90 с (1H, CHap), 8.63 с (1H, СНпир), 14.94 уш с (1Н, ОН).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.26 с (циклопропил 2CH2), 13.99 с (C3H7), 17.07 с (C3H7), 18.29 с (CH3), 35.39 с (C3H7), 36.43 с (циклопропил СН), 49.85 д (4JC-F=4.7 Гц, пиперазино 2CH2), 52.59 с (пиперазино 2CH2), 57.56 с (CH2), 64.54 с (CH2), 99.92 с , 104.90 д (4JC-F=2.9 Гц, Cap), 107.96 с (Cap), 112.20 д (2JC-F=23.4 Гц, Cap), 119.63 д (3JC-F=7.8 Гц, Cap), 126.89 с (Спир), 128.37 с (Спир), 139.09 с (С), 140.80 с (С), 145.84 д (27C-F=10.3 Гц, Cap-F), 147.19 с (С), 147.37 с (С), 148.07 с (С), 153.68 д (1JC-F=251.7 Гц, C-F), 166.95 с (C(О)OH), 176.99 с (С=O).
MALDI-MS: [M-H]+ 535.
Пример 8. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-октил-4H-[1,3]диоксино[4,5-c]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-8)
Стадия 1. Получение 5-гидроксиметил-2-октил-8-метил-4H-[1,3]диоксино[4,5-c]пиридина (8)
В круглодонной колбе, снабженной насадкой Дина-Старка, приготовляют суспензию 7.00 г (34.4 ммоль) гидрохлорида пиридоксина (5), 13.70 г (72.1 моль) моногидрата н-толуолсульфокислоты и 5.90 мл (34.4 ммоль) нонилового альдегида в 120 мл бензола. Реакционную массу кипятят 8 ч, затем растворитель отгоняют в вакууме. Остаток нейтрализовают до pH=7 водным раствором гидрокарбоната натрия. Выпавший осадок отфильтровают и промывают петролейным эфиром. Выход 8.26 г (82%), белые кристаллы, т. пл. 175°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.88 т (3H, 3JHH=6.6 Гц, CH3), 1.28-1.38 (10H, C8H17), 1.49-1.57 м (2Н, C8H17), 1.80-1.94 м (2Н, C8H17), 2.39 с (3H, CH3), 3.30 уш с (1H, ОН), 4.53 с (2Н, CH2O), 4.99 с (2Н, CH2O), 5.00 к (1H, 3JHH=5.2 Гц, СН), 7.83 с (1Н, CH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.25 с (C8H17), 18.33 с (CH3), 22.80 с (C8H17), 23.71 с (С8Н17), 29.35 с (C8H17), 29.51 с (C8H17), 29.60 с (C8H17), 31.99 с (C8H17), 34.42 с (C8H17), 60.38 с (CH2O), 64.32 с (CH2O), 100.21 с , 127.79 с (Спир), 129.81 с (Спир), 139.31 с (Спир), 147.59 с (Спир), 148.05 с (Спир).
Стадия 2. Получение 5-бромметил-2-октил-8-метил-4H-[1,3]диоксино[4,5-c]пиридина (11)
К раствору 2.99 г (10.2 ммоль) соединения (8) в 20 мл абсолютного хлороформа при 20°C добавляют 2.67 г (10.2 ммоль) трифенилфосфина и 1.82 г (10.2 ммоль) бромсукцинимида. Через 1 ч раствор концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир : петролейный эфир = 2:1). Выход 1.89 г (52%), белые кристаллы, т. пл. 175°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.87 т (3H, 3JHH=7.2 Гц, C8H17), 1.26-1.34 (10H, C8H17), 1.48-1.55 м (2Н, C8H17), 1.79-1.93 м (2Н, C8H17), 2.41 с (3H, CH3), 4.28, 4.33 (AB-система, 2Н, 2JHH=-10.8 Гц, CH2O), 4.96 с (2Н, CH2Br), 4.99 т (1H, 3JHH=5.2 Гц, ), 8.00 с (1H, СН).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.18 с (C8H17), 18.55 с (CH3), 22.74 с (C8H17), 23.62 с (C8H17), 26.74 с (C8H17), 29.28 с (C8H17), 29.43 с (C8H17), 29.54 с (CH2Br), 31.93 с (C8H17), 34.30 с (C8H17), 63.58 с (CH2O), 100.26 с , 126.84 с (Спир), 127.21 с (Спир), 140.79 с (Спир), 148.05 с (Спир), 148.67 с (Спир).
Стадия 3. Получение 1-циклопропил-6-фтор-7-(4-((8-метил-2-октил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)пиперазинил)-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (I-8)
К раствору 1.20 г (3.4 ммоль) соединения (11) в 20 мл абсолютного ДМФА при 20°C последовательно добавляют 0.93 г (2.8 ммоль) ципрофлоксацина, 0.24 г (2.8 ммоль) гидрокарбоната натрия и 0.10 г (0.8 ммоль) иодида калия. Через 4 ч растворитель удаляют в вакууме. Сухой остаток экстрагируют этилацетатом, нерастворимую часть отфильтровывают, фильтрат высушивают досуха и перекристаллизовывают из смеси растворителей ацетон : вода = 2:1. Выход 0.91 г (54%), желтые кристаллы, т. пл. 89-93°C.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (3H, 3JHH=6.8 Гц, С8Н17), 1.15-1.18 м (2Н, циклопропил CH2), 1.23-1.38 м (12Н, C8H17), 1.48-1.54 м (2Н, циклопропил CH2), 1.82-1.90 м (2Н, C8H17), 2.41 с (3H, CH3), 2.61-2.63 м (4Н, пиперазино 2CH2), 3.29-3.33 м (4Н, пиперазино 2CH2), 3.41, 3.45 (AB-система, 2Н, 2JH-H=-13.2 Гц, CH2N), 3.52 м (1H, циклопропил CH), 5.01, 5.09 (AB-система, 2Н, 2JH-H=-16.2 CH2O), 5.12 к (1Н, 3JH-H=5.2 Гц, СН), 7.30 д (1H, 4JH-F=7.0 Гц, CHap), 7.88 д (1Н, 3JH-F=13.1 Гц, CHap), 7.91 с (1Н, CHap), 8.66 с (1H, СНпир), 14.95 уш с (1Н, OH).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.29 с (циклопропил 2CH2), 14.18 с (C8H17), 18.39 с (CH3), 22.73 с (C8H17), 23.70 с (C8H17), 29.28 с (C8H17), 29.46 с (C8H17), 29.55 с (C8H17), 31.93 с (C8H17), 34.44 с (C8H17), 35.39 с (циклопропил CH), 49.90 д (4JC-F=4.6 Гц, пиперазино 2CH2), 52.62 с (пиперазино 2CH2), 57.60 с (CH2), 64.58 с (CH2), 100.13 с , 104.89 д (4JC-F=2.9 Гц, Cap), 108.06 с (Cap), 112.32 д (2JC-F