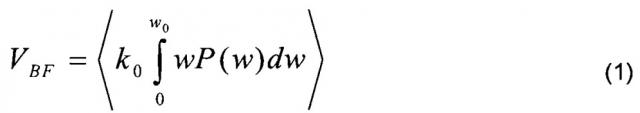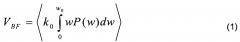Устройство для неинвазивного измерения потока микроциркуляции крови
Иллюстрации
Показать всеИзобретение относится к медицинской технике. Устройство для неинвазивного измерения потока микроциркуляции крови в ткани содержит источник излучения (2) для освещения исследуемой биологической ткани (12), фотоприемник (3) для регистрации обратно рассеянного от ткани излучения, электронный блок фильтрации зарегистрированного сигнала (4), блок вычитания фоновой засветки (7), блок определения и индикации показателя перфузии исследуемой ткани (10) и блок управления и синхронизации (11). Электронный блок фильтрации содержит аналого-цифровой преобразователь (5) и блок усреднения оцифрованного сигнала (6) для усреднения полезного сигнала с сигналом фоновой засветки и усреднения сигнала фоновой засветки по измеренным значениям сигналов соответственно. Блок вычитания фоновой засветки содержит оперативно-запоминающее устройство (8) для хранения вычисленных средних значений соответственно сигнала фоновой засветки и общего сигнала и разностный блок (9) для вычитания усредненного сигнала фоновой засветки из усредненного общего сигнала. Блок определения и индикации показателя перфузии выполнен с возможностью вычисления показателя перфузии на основе нормированного постоянной компонентой полезного сигнала первого момента спектральной плотности мощности полезного сигнала и отображения указанного значения. Блок управления и синхронизации выполнен с возможностью формирования прямоугольных импульсов управления со скважностью 50%. Источник излучения выполнен в виде по меньшей мере трех ИК-диодов, излучающих в диапазоне длин волн 800-820 нм, расположенных на равном расстоянии друг от друга радиально вокруг фотоприемника и установленных заподлицо с рабочей поверхностью фотоприемника. Достигается повышение точности используемого устройства за счет вычитания фоновой засветки, а также повышение его помехозащищенности и безопасности за счет использования светодиодных источников излучения вместо лазеров без использования оптических волокон. 3 з.п. ф-лы, 5 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к медицине и медицинской технике, а именно - к оптическим неинвазивным устройствам для измерения потока крови в микроциркуляторном сосудистом русле.
УРОВЕНЬ ТЕХНИКИ
Динамические параметры циркуляции крови в мелких кровеносных сосудах органов (артериолах, венулах, капиллярах и т.д.), именуемые в специализированной литературе как параметры микроциркуляции крови, в частности - поток микроциркуляции крови или перфузия тканей кровью, являются важными физиологическими параметрами в оценке функционального состояния тканей и органов человека, важны для выявления различных дисфункций, заболеваний, патологических нарушений в тканях и органах и так далее. Их оценка в медицине важна как в обычном (нормальном) состоянии испытуемого, так и при использовании различных функциональных нагрузочных тестов на систему микроциркуляции крови - тестов с локальным нагреванием, охлаждением, с физическими упражнениями, т.е. в движении испытуемого и т.д. (Крупаткин А.И., Сидоров В.В. Функциональная диагностика микроциркуляторно-тканевых систем: Руководство для врачей. - М.: Либроком, 2013. с. 252-304). Поэтому наиболее перспективными сегодня методами инструментальной оценки динамических параметров микроциркуляции крови являются неинвазивные методы, позволяющие проводить длительный мониторинг параметров микроциркуляции крови и оценивать их изменения во время нагрузочных тестов (оценивать реакцию системы микроциркуляции на применяемую нагрузку), то есть проводить полноценную функциональную диагностику системы микроциркуляции крови.
Из уровня техники известны оптические неинвазивные методы оценки параметров микроциркуляции крови.
Известен метод и устройство для видео-капилляроскопии (Gurfinkel Yu. I. Computer capillaroscopy as a channel of local visualization, noninvasive diagnostics, and screening of substances in circulating blood // Optical Technologies in Biophysics and Medicine- II, V.V. Tuchin - Editor. Proc. SPIE. 2000. V. 4241. P. 467-472), содержащее видеокамеру с микрообъективом, позволяющим получать увеличенное изображение капилляров ногтевого ложа, и систему неподвижной фиксации пальца руки под микрообъективом. Это прямой, поэтому весьма точный метод оценки параметров микроциркуляции крови. С помощью устройства для видео-капилляроскопии получают видеоизображение движения форменных элементов крови по капиллярным петлям ногтевого ложа, передают его в компьютер и рассчитывают поток и скорость тока крови через капилляры. Однако данный метод и устройство имеют много недостатков: в методе оценивается поток крови только в капиллярах без учета других звеньев микроциркуляторного русла (артериол, венул и пр.); оценивается поток только в ногтевом ложе, при этом другие органы и ткани малодоступны данному методу; палец испытуемого во время исследований крепится неподвижно под микрообъективом, что исключает возможность проведения функциональных нагрузочных тестов в движении.
Известны методы и устройства оптической инфракрасной (ИК) термометрии (Ring Е F J and Ammer K Infrared thermal imaging in medicine // Physiol. Meas. 33 (2012) R33-R46.). Эти методы и устройства используют оптическое ИК излучение и физическое явление испускания ИК излучения нагретыми телами для оценки температуры поверхности исследуемого органа, которая в очень большой степени (хотя и не полностью) коррелирует с параметрами кровоснабжения поверхностных тканей исследуемого органа. Устройства для ИК-термометрии состоят из ИК-видеокамеры, калиброванной по интенсивности принимаемого излучения в температуре (С°) обследуемой поверхности биоткани в предположении равенства спектральной излучательной способности (степени черноты) исследуемой поверхности и спектральной излучательной способности абсолютно черного тела. Однако эти метод и устройство имеют существенные недостатки: метод не является прямым методом измерений динамических параметров микроциркуляции, а лишь косвенно, через температуру поверхности, позволяет оценивать параметры микрогемодинамики, поэтому обладает низкой точностью. Температура исследуемой поверхности может зависеть от температуры внешней среды, испарения влаги с поверхности ткани, а не только от микрогемодинамики. Функциональные нагрузочные тесты в движении также труднореализуемы в данном случае: объект должен быть неподвижен в поле зрения ИК-видеокамеры, локальное поверхностное нагревание не применимо и так далее. Описанный выше метод для врача не позволяет оценивать динамические параметры микроциркуляции, так как. в нем не пересчитываются значения измеренной температуры в показатель потока крови (в показатель перфузии тканей кровью). Результатом измерений является температура поверхности.
Также известны метод и устройство для фотоплетизмографии (ФПГ) и фотоплетизмографической объективизации пульсовых волн в системе микроциркуляции крови (Мошкевич B.C. Фотоплетизмография: Аппаратура и методы исследования. - М.: Медицина, 1970. с. 14-40). В данном методе с помощью внешнего источника низкоинтенсивного оптического излучения непрерывно освещается исследуемая область живой биоткани, фотоприемник, расположенный на поверхности регистрирует выходящее из биоткани обратно рассеянное или прошедшее насквозь вторичное излучение, ослабленное, в том числе за счет поглощения света кровью, электрический сигнал с фотоприемника усиливается, фильтруется в диапазоне частот пульсовых волн (от долей до единиц Гц), и отфильтрованный сигнал выдается на экран монитора в виде графика. Этот сигнал за счет поглощения света кровью представляет собой пульсограмму, на которой проявляются пульсовые волны в системе микроциркуляции крови. Метод можно считать прямым и достаточно точным в оценке параметров пульсовых волн (амплитуда волн, частота пульса и т.п.). Однако для полноценной функциональной диагностики системы микроциркуляции крови метод имеет существенный недостаток в том, что оценивает только пульсовые колебания в системе микроциркуляции и не позволяет оценивать параметр перфузии (поток крови) в ткани.
Наиболее полную информацию о параметрах микроциркуляции крови позволяют получать сегодня методы и приборы лазерной доплеровской флоуметрии (ЛДФ). Физический принцип метода ЛДФ основан на использовании эффекта Доплера - сдвига частоты излучения при освещении светом движущихся форменных элементов крови. Метод реализуется путем освещения (зондирования) лазерным излучением исследуемой биологической ткани и регистрации обратно рассеянного от биоткани излучения, которое в данном случае будет содержать как минимум две компоненты: обратно рассеянное излучение на исходной частоте зондирующего лазерного излучения, формирующееся от неподвижных неоднородностей внутри клеточной биоткани без доплеровского смещения частоты, и обратно рассеянное излучение от движущихся форменных элементов крови, главным образом эритроцитов, с доплеровским сдвигом частоты. Как было показано Боннером и Носселем (Bonner R.F., Nossal R. Model for laser Doppler measurements of blood flow in tissue // Appl. Opt. 1981. V. 20. P. 2097-2107), суммируясь на фотоприемнике, эти два сигнала образуют низкочастотные биения с частотами w, регистрация и обработка спектра которых с вычислением первого момента от нормированной на постоянный сигнал спектральной плотности мощности фототока фотоприемника P(w), образующихся от этих биений, по формуле:
позволяет получать сигнал VBF, пропорциональный с коэффициентом пропорциональности k0 произведению количества эритроцитов на среднюю скорость их движения по сосудам, то есть, параметру потока крови (перфузии тканей кровью). Одним словом, в ЛДФ оценивается не сам доплеровский сдвиг частоты или скорость кровотока, а некий интегральный параметр - индекс или показатель микроциркуляции (в российской терминологии), называемый часто, особенно в англоязычной литературе, индексом перфузии тканей кровью, просто перфузией или потоком крови. Это синонимичные названия одного и того же параметра. Мы будем использовать далее для него термин показатель перфузии. Этот интегральный параметр - показатель перфузии VBF - является сегодня наиболее информативным в медицине для функциональной диагностики системы микроциркуляции крови и содержит в себе как составную часть различные частотные составляющие физиологических колебаний потока крови - пульсовые волны, дыхательные и так далее (Лазерная доплеровская флоуметрия микроциркуляции крови: Руководство для врачей / Под ред. А.И. Крупаткина, В.В. Сидорова. - М.: Медицина, 2005. с. 90-92). В уровне техники известны устройства для оценки и мониторирования потока крови и определения показателя перфузии с использованием эффекта Доплера (US 4596254 А, опубл. 24.06.1986, US 4476875 А, опубл. 16.10.1984). Принцип работы данных устройств весьма схож. Все они содержат монохроматический источник излучения - лазер для освещения исследуемой биологической ткани, оптоволоконную систему доставки излучения к исследуемой биологической ткани и обратно, фотоприемник, регистрирующий обратно рассеянное от биологической ткани излучение и биение компонент этого излучения (гетеродинный принцип детектирования), а также электрическую схему усиления сигнала с фотоприемника, его фильтрации и блок аналогового или цифрового вычисления по зарегистрированному фототоку с фотоприемника показателя перфузии VBF на основе соотношения (1). Однако эти все устройства обладают рядом недостатков. Поскольку они используют эффект Доплера, ко всем этим устройствам предъявляется жесткое требование использования лазерного источника, имеющего стабильное по мощности монохроматическое излучение. Устройства используют оптические волокна (жгуты оптических волокон) для транспортировки лазерного излучения до биологической ткани и обратно рассеянного от биологической ткани излучения к фотоприемнику. Однако оптическое волокно является очень чувствительным к малейшим движениям, изгибам, поэтому в существующих приборах ЛДФ с оптическими волокнами остро стоит проблема влияния артефактов движения на регистрируемый сигнал (TP Newson, A Obied, RS Wolton, et al. Laser Doppler velocimetry: the problem of fibre movement artifacts // J. Biomed. Eng. 9, 1987: 169-172). Эти движения вносят значительный вклад в низкочастотную область спектра биений, искажая результаты.
Как правило, коммерческие ЛДФ системы используют фильтр высоких частот (с частотой среза 20 Гц), чтобы отфильтровать низкочастотную часть спектра, отвечающую за артефакты движения. Но это помогает лишь частично, поскольку шумы такого рода имеют спектр вплоть до 3-5 кГц, накладываясь на спектр полезного сигнала (Gush RJ, King ТА. Investigation and improved performance of optical fibre probes in laser Doppler blood flow measurement // Med. Biol. Eng. Comput. (1987) 678: 29-36). Для уменьшения артефактов движения предложен модифицированный волоконно-оптический зонд. Предложено использовать зонд с малой апертурой и держать его близко к коже во время измерений, но это совсем исключает движения испытуемого и, следовательно, функциональную диагностику системы микроциркуляции крови. Еще одним техническим решением, позволяющим частично избавиться от артефактов движения, было использование интегрированного датчика, в котором доставка света до ткани и его регистрация осуществляются в одном зонде (deMul F.F.M et al. Mini laser-Doppler (blood) flow monitor with diode laser source and detection integrated in the probe // Applied Optics (1984) 23: 2970-2973). Тем не менее во всех описанных выше работах проблема артефактов движения не решена полностью.
Кроме того, фотоприемник устройства ЛДФ должен быть достаточно чувствительным для регистрации слабого по интенсивности обратно рассеянного излучения с доплеровским сдвигом частоты, собранного тонким оптическим волокном с маленькой апертурой, поэтому часто внешний свет влияет на показания прибора и снижает точность диагностики.
Для устранения этого эффекта было предложено устройство ЛДФ с дифференциальной схемой измерений, раскрытое в US 4476875 А, опубл. 16.10.1984.. Особенностью этого устройства и его схемы является то, что для регистрации обратно рассеянного от биологической ткани излучения используются два фотоприемника и два идентичных электронных блока обработки сигнала с фотоприемника. Соответственно, используются два оптических волокна для доставки излучения к фотоприемникам, которые собирают излучение от отдельных, прилегающих друг к другу объемов освещаемой биоткани. Полезный выходной сигнал определяется в устройстве по разнице сигналов этих двух каналов. Поскольку помехи, вызванные внешним освещением, в обоих каналах синфазны, то они эффективно подавляются в дифференциальном усилителе при вычитании сигналов. Но связанные с кровотоком переменные составляющие выходных сигналов с обоих каналов, наоборот, усиливаются, поскольку считается, что они возникают от различных эритроцитов в потоке крови и являются взаимно статистически независимыми реализациями одного и того же стохастического процесса. Поэтому они усиливаются в схеме.
Однако рассматриваемая дифференциальная схема приводит к образованию ложных компонент в спектре полезного сигнала. Это существенно снижает точность диагностики. Данная базовая схема может быть несколько улучшена (схема улучшенного устройства раскрыта в RU 2599371 С1, опубл. 10.10.2016), однако, проблемы влияния оптических волокон на результаты измерений, необходимость иметь достаточно дорогой и высокостабильный источник лазерного излучения - остаются.
Наиболее близким аналогом заявляемого изобретения является устройство ЛДФ для измерения микроциркуляции крови (US 6173197, опубл. 09.01.2001, WO 9820794 А1, опубл. 22.05.1998), содержащее оптическую головку, содержащую монохроматический источник излучения в виде низкоинтенсивного лазерного источника излучения с длиной волны в красном или ближнем инфракрасном диапазоне длин волн, выход которого соединен с отдельным оптическим волокном, доставляющим излучение лазера к обследуемой биоткани, и фотоприемника, вход которого также соединен со своим отдельным оптическим волокном, доставляющим обратно рассеянное от биологической ткани излучение к фотоприемнику. Освещающее и приемное волокна образуют оптический жгут волокон, который при работе устройства своим дистальным концом устанавливается на поверхности тестируемой биологической ткани для освещения участка поверхности биоткани и сбора обратно рассеянного от нее излучения в апертуру приемного оптического волокна. Также указанное устройство включает электронный блок фильтрации сигнала, состоящий из полосового фильтра с нижней оси ω1 и верхней ω2 частотами среза, примерно равными ω1=20 Гц и ω2=30 кГц, который осуществляет выделение переменной (АС) компоненты регистрируемого сигнала, и фильтра низких частот, который осуществляет выделение постоянной (DC) компоненты сигнала, мультиплексора с аналого-цифровым преобразователем и блока вычисления показателя перфузии на основе DSP-процессора, который осуществляет вычисление показателя перфузии (потока крови) на основе Фурье-анализа частотного спектра переменной (АС) компоненты сигнала, ее нормировки на постоянную (DC) компоненту и определения взвешенного среднего от спектральной плотности мощности сигнала по формуле (1), то есть определяет искомый показатель перфузии VBF. При этом выход фотоприемника соединен одновременно со входами полосового фильтра и фильтра низких частот, выходы этих двух фильтров соединены со входом мультиплексора, а выход мультиплексора соединен со входом блока вычисления показателя перфузии.
В наиболее близком аналоге известно в качестве варианта осуществления 16-канальное устройство, которое вместо одного фотодетектора и одного полосового фильтра с последующим Фурье-анализом частотного спектра сигнала использует 16 фотодетекторов и 16 полосовых фильтров, каждый на свой диапазон частот внутри общего диапазона 20 Гц - 30 кГц, что исключает необходимость использования Фурье-анализа частотного спектра сигнала, но требует наличия дополнительного блока быстрой оперативной памяти для запоминания промежуточных результатов.
К основным и существенным недостаткам наиболее близкого аналога изобретения применительно к рассматриваемой проблеме определения показателя перфузии относятся:
1. Наличие в устройстве оптических волокон, являющихся большими источниками погрешностей и не позволяющих проводить функциональную диагностику системы микроциркуляции крови в движении пациента.
Для устранения случайных артефактов от движений оптических волокон в указанном устройстве применяются методы обработки сигнала, однако, данная методика не позволяет проводить полноценную функциональную диагностику системы микроциркуляции крови в движении пациента.
2. Отсутствие в устройстве методов и средств, исключающих или хотя бы снижающих влияние на результаты измерений внешнего света (внешней фоновой засветки, например, от комнатного освещения). Внешний свет будет попадать в приемное волокно и будет восприниматься фотодетектором, а также последующими электронными узлами и блоками устройства как обратно рассеянное от биоткани излучение, что будет давать ложный сигнал и будет снижать точность диагностики.
Среди дополнительных недостатков устройства можно назвать необходимость использования лазерного источника излучения, что удорожает конструкцию устройства и заставляет классифицировать данное устройство как устройство повышенной опасности, содержащее источник лазерной опасности - лазерный источник излучения - согласно международному стандарту МЭК 60825-1:2007.
Таким образом, существует актуальная потребность в медицине в устройстве для неинвазивного измерения потока микроциркуляции крови, лишенном указанных недостатков.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Техническая проблема, решаемая заявляемым изобретением, состоит в невозможности проводить функциональную диагностику системы микроциркуляции крови в движении пациента, уменьшения влияния внешней засветки на результаты измерений и устранения колебаний оптического волокна.
Техническим результатом настоящего изобретения является повышение точности, помехозащищенности и безопасности оптического неинвазивного устройства для неинвазивного измерения потока микроциркуляции крови, используемое для функциональной диагностики системы микроциркуляции крови в движении пациента в том числе.
Технический результат достигается за счет того, что устройство для неинвазивного измерения потока микроциркуляции крови в ткани включает источник излучения для освещения исследуемой биологической ткани, фотоприемник для регистрации обратно рассеянного от исследуемой биологической ткани излучения, электронный блок фильтрации зарегистрированного фотоприемником сигнала, содержащий аналого-цифровой преобразователь и блок усреднения оцифрованного сигнала для усреднения полезного сигнала с сигналом фоновой засветки и усреднения сигнала фоновой засветки по измеренным значениям сигналов соответственно, блок вычитания фоновой засветки, содержащий оперативно-запоминающее устройство для хранения вычисленных средних значений соответственно сигнала фоновой засветки и общего сигнала и разностный блок для вычитания усредненного сигнала фоновой засветки из усредненного общего сигнала, блок определения и индикации показателя перфузии исследуемой биологической ткани, выполненный с возможностью вычисления показателя перфузии исследуемой биологической ткани на основе нормированного постоянной компонентой полезного сигнала первого момента спектральной плотности мощности полезного сигнала и отображения указанного значения, блок управления и синхронизации, выполненный с возможностью формирования прямоугольных импульсов управления со скважностью 50%, выходы которого соединены с источником излучения и с синхронизирующими входами соответственно аналого-цифрового преобразователя, блока усреднения оцифрованного сигнала и оперативно-запоминающего устройства, при этом источник излучения выполнен в виде по меньшей мере трех ИК-диодов, излучающих в диапазоне длин волн 800-820 нм, расположенных на равном расстоянии друг от друга радиально вокруг фотоприемника и установленных заподлицо с рабочей поверхностью фотоприемника, при этом выход фотоприемника соединен с основным информационным входом аналого-цифрового преобразователя электронного блока фильтрации, выход аналого-цифрового преобразователя соединен с основным информационным входом блока усреднения оцифрованного сигнала, выход блока усреднения оцифрованного сигнала соединен с основным информационным входом оперативного запоминающего устройства, выход которого соединен со входом разностного блока, а выход разностного блока соединен со входом блока определения и индикации показателя перфузии.
Кроме того, блок управления и синхронизации выполнен с возможностью формирования прямоугольных импульсов управления с рабочей частотой не менее 320 Гц.
Кроме того, устройство может дополнительно содержать усилитель постоянного тока, расположенный между фотоприемником и аналого-цифровым преобразователем.
Кроме того, источник излучения и фотоприемник установлены в оптической головке, выполненной в виде микрочипа с возможностью крепления на теле пациента.
Использование в изобретении для регистрации и анализа иные компоненты обратно рассеянного от биологической ткани излучения, отличные от доплеровской компоненты, позволяет не использовать лазеры, так как для формирования этих компонент достаточно узкополосных светодиодных источников излучения, что позволяет уменьшить опасность в применении заявляемого устройства.
Использование блока вычитания фоновой засветки с разностным блоком, выполненным с возможностью вычитания усредненного сигнала фоновой засветки из усредненного общего сигнала и блока управления, выполненного с возможностью управления и синхронизации работы элементов устройства, позволяет свести к минимуму влияние внешней засветки на результаты измерений показателя перфузии.
Конструктивное выполнение источника излучения в виде по меньшей мере трех ИК-диодов, излучающих в диапазоне длин волн 800-820 нм, расположенных на равном расстоянии друг от друга радиально вокруг фотоприемника и установленных заподлицо с рабочей поверхностью фотоприемника позволяет исключить из устройства средство доставки излучения к исследуемой поверхности пациента в виде оптического волокна, которое вносит в результаты измерений большие погрешности и не позволяет проводить функциональную диагностику системы микроциркуляции крови в движении пациента. В данном исполнении заявляемое устройство компактно и может быть применимо при использовании функциональных нагрузочных тестов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Прилагаемые чертежи, которые включены в состав настоящего описания и являются его частью, иллюстрируют варианты осуществления изобретения и совместно с вышеприведенным общим описанием изобретения и нижеприведенным подробным описанием вариантов осуществления служат для пояснения принципов настоящего изобретения. На чертежах одинаковые позиции применяются для обозначения одинаковых частей.
На фиг. 1 изображен график спектральной плотности мощности фототока: амплитудно-модулированная компонента спектра Pam(ω) (1), составляющая биений амплитудно-модулированной и доплеровской компонент спектра Pam,d(ω) (2), доплеровская компонента спектра Pd(ω) (3), суммарный спектр плотности мощности фототока Р(ω) (4).
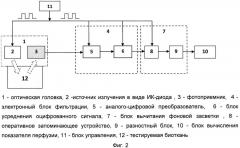
На фиг. 2 схематично представлена конструкция предлагаемого устройства.
На фиг. 3 изображено расположение излучателей и фотоприемника в оптической головке.
На фиг. 4 схематично показано расположение оптической головки заявляемого устройства на теле человека.
На фиг. 5 представлена временная диаграмма хода управляющих импульсов и моментов оцифровки сигнала в блоке аналого-цифрового преобразователя.
ОБОЗНАЧЕНИЯ
1 - оптическая головка, 2 - источник излучения в виде ИК-диода, 3 - фотоприемник, 4 - электронный блок фильтрации, 5 - аналого-цифровой преобразователь, 6 - блок усреднения оцифрованного сигнала, 7 - блок вычитания фоновой засветки, 8 - оперативное запоминающее устройство, 9 - разностный блок, 10 - блок вычисления показателя перфузии, 11 - блок управления, 12 - тестируемая биоткань.
ТЕРМИНЫ (ОПРЕДЕЛЕНИЯ)
Под динамическими параметрами циркуляции крови в мелких кровеносных сосудах органов (артериолах, венулах, капиллярах и т.д.) в указанной заявке понимают поток крови в мелких сосудах, амплитуду и частоту пульсовых волн кровотока, коэффициент вариаций кровотока и другие параметры, связанные с движением крови.
Под «показателем перфузии» в указанной заявке понимают величину, пропорциональную с коэффициентом пропорциональности произведению количества эритроцитов на среднюю скорость их движения по сосудам, то есть, параметру потока крови (перфузии тканей кровью).
Термины «перфузия», «показатель перфузии», «индекс микроциркуляции», «поток крови» в данном документе - синонимы.
Используемый в документе термин «клеточные биоткани» относится к тканям, окружающим и выстилающим кровеносные сосуды - эпителий, мышцы, эпидермис и дерма кожи, и т.п.
Термины «биоткань» и «биологическая ткань» являются синонимами.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Известно, что переменное кровенаполнение клеточных биотканей (кожи, слизистых оболочек органов), возникающее вследствие разных физиологических процессов в организме, таких как ритмическая работа сердца, вазодилятация и вазоконстрикция сосудов и прочее, вызывает амплитудную модуляцию обратно рассеянного оптического излучения внутри биоткани, создавая таким образом шум во входном сигнале ЛДФ-прибора ([1-4]). Однако данная амплитудно-модулированная компонента обратно рассеянного излучения также несет в себе и аналогичную информацию о микроциркуляции крови в отношении показателя перфузии, если вычисления показателя перфузии VBF проводить по формуле (1), подставляя в нее вместо нормированной спектральной плотности мощности фототока от биений доплеровской компоненты и компоненты, не имеющей доплеровского сдвига частоты спектральную плотность мощности переменной компоненты (АС) фототока от регистрации амплитудно-модулированной компоненты обратно рассеянного излучения, которая также должна быть нормирована на постоянную компоненту (DC) суммарно регистрируемого фототока.
Суммарная спектральная плотность мощности фототока P(w) (кривая 4 на фиг. 1), как показали исследования [1-4], представляет собой в общем случае сложную сумму компонент, которые образуются от регистрации разных компонент обратно рассеянного излучения - обратно рассеянного излучения на исходной частоте зондирующего (освещающего) излучения, которое формируется от неподвижных неоднородностей внутри клеточной биоткани без доплеровского смещения частоты и без амплитудной модуляции, обратно рассеянного излучения от движущихся форменных элементов крови с доплеровским сдвигом частоты (совместно образующие биения и формирование доплеровской компоненты Pd(w) представлены на фиг. 1, кривая 3), обратно рассеянного излучения с амплитудной модуляцией на разных частотах (амплитудно-модулированная компонента спектра Pam(ω) представлена на фиг. 1, кривая 1), а также вклады от различных биений разных компонент с амплитудной модуляцией и компонент с доплеровским сдвигом частоты (составляющая биений амплитудно-модулированной и доплеровской компонент спектра Pam,d(ω) представлена на фиг. 1, кривая 2).
Таким образом, если освещать биологическую ткань узкополосным оптическим излучением, не лазерным, например, излучением светодиодов, и регистрировать фотоприемником обратно рассеянное оптическое излучение в частотном интервале амплитудной модуляции, биений и других флуктуаций сигнала от 0 до (примерно) 160 Гц, то спектральная плотность мощности суммарно возникающего фототока может быть использована для вычисления показателя перфузии по формуле (1), как и в случае ЛДФ метода. Результаты будут аналогичны.
Предлагаемое устройство, реализующее указанный выше метод измерения потока микроциркуляции крови, схематично представлено на Фиг. 2.
Устройство состоит из источника излучения (2) для освещения исследуемой биологической ткани и фотоприемника (3) для регистрации обратно рассеянного от исследуемой биологической ткани излучения, например, кремниевого фотодиода. При этом источник излучения выполнен в виде по меньшей мере трех светодиодов, излучающих узкополосное излучение в ближнем инфракрасном диапазоне спектра в интервале длин волн 800-820 нм (район изобестической точки гемоглобина), например, по меньшей мере трех инфракрасных диодов (ИК-диодов) (2). Источник излучения и фотоприемник расположены в оптической головке (1). Устройство также включает электронный блок фильтрации (4), содержащий аналого-цифровой преобразователь (5) и блок усреднения оцифрованного сигнала (6), блок вычитания фоновой засветки (7), содержащий оперативное запоминающее устройство (8) и разностный блок (9), блок определения и индикации показателя перфузии (10) и блок управления и синхронизации (11).
При этом аналого-цифровой преобразователь (5), блок усреднения оцифрованного сигнала (6) и оперативное запоминающее устройство (8) выполнены с возможностью синхронизации работы по импульсам блока управления и синхронизации (11), для чего помимо основного информационного входа имеют дополнительный вход синхронизации (управления). Блок управления и синхронизации (11) выполнен с возможностью формировать прямоугольные импульсы управления с рабочей частотой не менее Fраб=320 Гц и скважностью 50%, при этом выход блока управления и синхронизации (11) соединен со входом каждого ИК-диода (2) и со входами синхронизации аналого-цифрового преобразователя (5), блока усреднения оцифрованного сигнала (6) и оперативного запоминающего устройства (8), выход фотоприемника (3) соединен с основным информационным входом аналого-цифрового преобразователя (5), выход аналого-цифрового преобразователя (5) соединен с основным информационным входом блока усреднения оцифрованного сигнала (6), выход блока усреднения оцифрованного сигнала (6) соединен с основным информационным входом оперативного запоминающего устройства (8), выход которого, в свою очередь, соединен со входом разностного блока (9), а выход разностного блока (9) соединен со входом блока вычисления показателя перфузии (10).
В оптической головке (1) (Фиг. 3) ИК-диоды (2) расположены на равном расстоянии друг от друга радиально вокруг фотоприемника (3) для обеспечения равномерной засветки объема биоткани вокруг фотоприемник и установлены заподлицо с рабочей поверхностью фотоприемника (3). При этом сама оптическая головка (1), в которой расположены как источник излучения, так и фотоприемник, выполнена в виде микрочипа с возможностью крепления на теле человека с помощью ремешка или лейкопластыря (способ крепления не является предметом изобретения) так, что рабочая поверхность фотоприемника (3) и источников излучения в виде ИК-диодов (2) будут касаться обследуемой поверхности тела (биоткани) (12), как показано на Фиг. 4.
Предлагаемое устройство работает следующим образом.
Блок управления и синхронизации (11) формирует прямоугольные импульсы управления с рабочей частотой Fраб, например 320 Гц и скважностью 50%. Источники излучения в виде ИК-диодов (2) в момент прихода импульса от блока управления и синхронизации (11) включаются на время действия этого импульса и освещают тестируемую биологическую ткань (12) - кожу или слизистые оболочки органов - своим оптическим излучением, которое рассеивается и поглощается в ткани, а его обратно рассеянные компоненты выходят из ткани назад на поверхность и регистрируются фотоприемником (3). С выхода фотоприемника (3) сигнал поступает на основной информационный вход аналого-цифрового преобразователя (5), работа которого синхронизируется с приходящими на его синхронизирующий вход импульсами от блока управления и синхронизации (11) так, что за время импульса, а также в его отсутствие аналого-цифровой преобразователь (5) успевает несколько (N) раз, но не менее N=5 раз, оцифровать сигнал с выхода фотоприемника (Фиг. 5). Оцифрованные N значений сигнала за время действия управляющего импульса будут соответствовать суммарному полезному сигналу с примесью сигнала фоновой засветки U∑i, а оцифрованные N значений сигнала за время отсутствия управляющего импульса, когда излучатели выключены, будут соответствовать сигналу фоновой засветки UFi, где i=1, 2, 3, … N.
Далее в блоке усреднения оцифрованного сигнала (6) синхронно с импульсами управления происходит усреднение измеренных значений U∑i и UFi по N измеренным значениям (каждый в своем цикле - в момент действия импульсов и в момент их отсутствия) с нахождением, соответственно, средних значений U∑cp и UFср по формулам
Найденные средние значения U∑cp и UFср запоминаются далее каждый в своем цикле (в момент действия импульсов и в момент их отсутствия) по импульсам управления в оперативном запоминающем устройстве (8), а в разностном блоке (9) происходит компенсация засветки и выделение полезного сигнала Uп путем вычитания UFср из U∑cp в момент прихода следующего импульса по формуле:
Таким образом, с выхода разностного блока (9) на вход блока определения и индикации показателя перфузии (10) поступает уже полезный сигнал Uп, очищенный от фоновой засветки. При этом применяемая процедура многократной оцифровки и последующего усреднения равносильна процедуре фильтрации сигнала на частотах выше Fраб (выше 320 Гц в данном конкретном случае). Добротность фильтрации будет определяться числом оцифровок N. В результате полезный сигнал Uп будет содержать постоянную (DC) и переменную (АС) компоненты сигнала в диапазоне частот 0-320 Гц, что по известной теореме Найквиста позволяет анализировать частотный спектр сигнала в диапазоне от 0 до Fраб/2 Гц, то есть в данном конкретном случае в диапазоне частот от 0 до 160 Гц.
В блоке определения и индикации показателя перфузии (10) полезный сигнал Uп проходит последнюю цифровую обработку: на основе цифрового частотного Фурье-анализа выделяется постоянная (DC) компонента сигнала (нулевой член разложения в ряд Фурье), затем все переменные компоненты сигнала (АС) в спектральной плотности мощности сигнала P(w) нормируются на DC, и нормированная таким образом спектральная плотность мощности фототока P(w) подставляется в формулу (1) с ω1=0 Гц и ω2=160 Гц для определения взвешенного среднего, т.е. для определения искомого показателя перфузии VBF.
Если мощности сигнала с фотоприемника (3) недостаточно для качественной оцифровки сигнала, между фотоприемником и аналого-цифровым преобразователем (5) может располагаться усилитель постоянного тока (УПТ).
Предлагаемое устройство, таким образом, не содержит оптических волокон и лазерных источников излучения, в нем компенсировано влияние на регистрируемый сигнал внешней фоновой засветки, устройство может быть миниатюрным в части оптической головки, которая может крепиться неподвижно на теле человека, перемещаться синхронно с телом, не создавая взаимных смещений тела относительно головки, не мешает движению и так далее, то есть пригодно для полноценной функциональной диагностики в движении испытуемого. В перспективе головка может быть выполнена с беспроводной связью с остальным устройством, например, может быть связана с ним по Bluetooth (такие решения в целом известны сегодня), что еще больше даст свободы движения испытуемому и откроет путь к носимым индивидуальным системам суточного мониторинга показателя перфузии. Поэтому можно констатировать, что в данном предлагаемом устройстве достигаются все заявленные цели изобретения.
Приведенное описание примерного варианта осуществления дает общее представление о принципах конструирования, функционирования, изготовления и применения устройства, предлагаемого настоящим изобретением. По меньшей мере, один пример из данных вариантов осуществления проиллюстрирован п