Способ синтеза сульфат-фосфатов металлов
Иллюстрации
Показать всеИзобретение может быть использовано при производстве термомеханически стабильных материалов и изделий на их основе, требующих высокого сопротивления термоудару и устойчивых к резким изменениям температур. Способ синтеза сульфат-фосфатов металлов включает определение максимально допустимого температурного интервала, внутри которого синтез идет без потери серы. Выбирают исходные реагенты, способствующие протеканию реакции с образованием промежуточных простых сульфатов, температура разложения которых находится в пределах максимально допустимого температурного интервала синтеза. Готовят растворы солей металлов из исходных реагентов. Смешивают растворы солей металлов с растворами кислот Н3РО4 и H2SO4. Проводят поэтапную сушку реакционной смеси при температурах 90°С и 130°С. Дальнейшую термообработку реакционной смеси в максимально допустимом температурном интервале проводят в течение 6-48 часов с диспергированием и контролем химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждой термообработки. Выбирают металлы с близкими ионными радиусами и используют сочетания следующих катионов металлов: М+ - Na и K, М2+ - Mg, Ва, Pb, М3+ - Cr, Fe, М4+ - Zr. В качестве исходных реагентов используют нитраты, хлориды металлов, ацетат хрома. Изобретение позволяет предотвратить потерю серы из-за ее связывания в промежуточный серосодержащий прекурсор с высокой температурой разложения. 5 з.п. ф-лы, 2 ил., 8 табл., 4 пр.
Реферат
Предлагаемое изобретение относится к области химии, касается способа синтеза сульфат-фосфатов металлов, которые могут быть использованы при производстве термомеханически стабильных материалов и изделий на их основе, требующих высокого сопротивления термоудару и устойчивых к резким изменениям температур: инструментальной керамики, арматуры для высокоточной пайки, подложек микросхем, носителей катализаторов, локализующих матриц для надежного захоронения токсичных, в том числе радиоактивных отходов.
В настоящее время наблюдается повышенный интерес к сульфат-фосфатам, который объясняется расширяющейся перспективой их использования в качестве высокотехнологичных материалов, многие из которых обладают высокими температурами плавления и разложения, низким тепловым расширением.
В составе некоторых фосфатов анионы РО43- присутствуют вместе с другими тетраэдрическими анионами. Перспективность использования смешанных фосфатов, структурных аналогов минерала коснарита KZr2(PO4)3, изоструктурного с большим классом твердых ионных проводников NASICON и NaZr2(PO4)3, содержащих дополнительные тетраэдрические анионы ТО4 (Т=Mo, As, V, Si, В), связана с важными для технических приложений свойствами - новыми или улучшенными по сравнению с моноанионными фосфатами.
Наиболее изучены силикофосфаты M+1+xM4+2(SiO4)x(PO4)3-x благодаря высокой катионной проводимости базовых твердых растворов NASICON - Na1+xZr2SixP3-xO12 (0≤х≤3) (А.К. Иванов-Шиц, И.В. Мурин. Ионика твердого тела. Т. 1. Изд-во СПбГУ, Санкт-Петербург, 2001).
Фосфаты со структурой коснарита, имеющие каркасное строение, с крупными катионами Cs, Sr, Ва в полостях структуры - CsZr2(PO4)3, CsHf2(PO4)3, Sr0.5Zr2(PO4)3, K0.5Sr0.25Zr2(PO4)3, Ca0.38Ba0.12Zr2(PO4)3 обладают близкими к нулю значениями коэффициентов теплового линейного расширения (КТЛР) и анизотропии расширения (V.I. Pet'kov, A.I. Orlova, G.N. Kasantsev, S.G. Samoilov, M.L. Spiridonova. Thermal expansion in the Zr and 1-, 2-valent complex phosphates of NaZr2(PO4)3 (NZP) structure. J. Therm. Anal. Cal. 2001. V. 66. №2. P. 623-632; S.Y. Limaye, D.K. Agrawal, H.A. McKinstry. Synthesis and thermal expansion of MZr4P6O24 (M=Mg, Ca, Sr, Ba). J. Am. Ceram. Soc. 1987. V. 70. №10. P. C-232-C-236; H. Miyazaki, I. Ushiroda, D. Itomura, T. Hirashita, N. Adachi, T. Ota. Thermal expansion of NaZr2(PO4)3 family ceramics in a low-temperature range. Jpn. J. Appl. Phys. 2008. V. 47. №9. P. 7262-7265; B. Zhang, J. Guo. Thermal shock resistance of KZr2P3O12-SrZr4P6O24 ceramics // J. Eur. Ceram. Soc. 1995. V. 15. №9. P. 929-933; P. Oikonomou, Ch. Dedeloudis, C.J. Stournaras, Ch. Ftikos. [NZP]: A new family of ceramics with low thermal expansion and tunable properties. J. Eur. Ceram. Soc. 2007. V. 27. №2-3. P. 1253-1258). На их основе могут быть созданы термомеханически стабильные материалы, способные многократно выдерживать резкие изменения тепловых нагрузок (В.И. Петьков. Сложные фосфаты, образованные катионами металлов в степенях окисления I и IV. Успехи химии. 2012. Т. 81. №7. С. 606-637).
Известен синтез фосфатов со структурой типа NaZr2(PO4)3 (автореферат диссертации на соискание ученой степени кандидата химических наук В.Ю. Волгутова «Разработка новых материалов со структурой NaZr2(PO4)3 (NZP), устойчивых в условиях высоких температур, тепловых стрессов и радиации», Нижний Новгород, 2013 г.) коллоидно-химическим (золь-гель) методом. Метод предполагает "конструирование" новых составов соединений со структурой NaZr2(PO4)3 путем введения катионов (Са, Sr, Ва; Nd, Eu, Er; Zr; Th) с ионными радиусами во внекаркасные позиции, уменьшение заселенности этих позиций, их характеризацию методами РФА, ИК-спектроскопии, электронного и атомно-силового микрозондового анализа. Синтез включает смешение 1 моль/л растворов металлов с лимонной кислотой и этиленгликолем, либо с 1 моль/л раствора NH4H2PO4, нагрев смеси до 160°С в течение 8 часов для испарения воды, затем нагрев в течение 3 часов при температуре 130-350°С для разложения органических комплексов, диспергирование в течение 15 минут, нагрев до 600°С, 800°С, 900°С в течение 8 часов на каждой стадии с межстадийным диспергированием в течение 15 минут. Синтез обеспечивает получение новых составов соединений со структурой NaZr2(PO4)3 с малыми и регулируемыми характеристиками теплового расширения, способствует уменьшению размера зерен и повышению их однородности.
Из литературных данных известно, что температуры синтеза фосфатов весьма высоки (>800°С), в то время как многие сульфаты являются термически неустойчивыми (>750°С) (таблица 1). Таким образом, значительная разность в температурах получения фосфатов и термической устойчивости сульфатов приводят к сложностям синтеза смешанных сульфат-фосфатов, поэтому их известно очень мало. Главная проблема заключается в частичной потере серы в процессе синтеза (в виде SO3), что приводит к нарушению стехиометрии образца и, в конечном счете, не позволяет получить желаемый сульфат-фосфат.
Известен синтез сульфат-фосфатов α- и β-Zr2(PO4)2SO4 кипячением фосфатного геля в концентрированной серной кислоте при температурах 180-200°С в течение 5 суток (J. Alamo, R. Roy. Zirconium phospho-sulfates with NaZr2(PO4)3-type structure. J. Solid State Chem. 1984. V. 51. №2. P. 270-273). Цирконий-фосфатный гель получали добавлением фосфорной кислоты к смеси азотной кислоты и ZrO(NO3)2⋅2H2O с последующим осаждением при отношении P:Zr=2.5.
Недостатком метода является трудоемкость и значительные затраты времени.
Известен синтез сульфат-фосфатов общей формулы M4(PO4)2SO4, где М=Sr, Ва, Pb, твердофазным методом (Н.F. Folkerts, J. Zuidema, G. Blasse. Different types of s2 ion luminescence in compounds with eulytite structure. Chemical Physics Letters. 1996. V. 249. №1-2. P. 59-63). Исходными реагентами были SrCO3, ВаСО3, PbCO3, PbSO4, (NH4)2HPO4, (NH4)2SO4. Стехиометрические количества реагентов прокаливали 8 часов при 500°С, затем от 25-70 часов при 700-1100°С.
Метод длительный, использование исходных реагентов в синтезе не обосновано, что приводит к образованию промежуточных серосодержащих соединений с низкими температурами разложения, а высокие температуры синтеза могли привести к частичному испарению серы. Состав конечных продуктов не подтвержден.
Известен синтез сульфат-фосфатов M2MgTi(PO4)2SO4, где М=Na, K, Rb, Cs с использованием золь-гель методики и этилового спирта в качестве высаливателя (А.Е. Канунов, Е.А. Асабина, А.И. Орлова. Получение и рентгеноструктурное исследование фосфатосульфатов M2MgTi(SO4)(PO4)2. Журнал общей химии. 2016. Т. 86. Вып. 1. С. 20-27). Изотермический нагрев проводили при 90°С, 200°С, 500°С, 700°С, 900°С в течение 24 часов на каждой стадии. Сульфат-фосфат Na2MgTi(PO4)2SO4 начинал кристаллизоваться при 600-700°С, K2MgTi(PO4)2SO4 - при 500-600°С. Повышение температуры более 800°С приводило к распаду обеих фаз. Вместо ожидаемых сульфат-фосфатов Rb2MgTi(PO4)2SO4, Cs2MgTi(PO4)2SO4 были получены смеси фаз. Образование ожидаемых сульфат-фосфатов M2MgTi(PO4)2SO4 сопряжено с определенными трудностями, прежде всего вследствие неаргументированного выбора исходных реагентов, взаимодействие которых приводит к образованию промежуточных серосодержащих соединений с низкими температурами разложения. Еще одним недостатком указанного способа является необоснованная продолжительность термообработки на каждой стадии. Эти причины затрудняют управление состоянием продуктов синтеза, а сам синтез сульфат-фосфатов связан со значительными затратами средств и времени.
В задачу изобретения положен способ синтеза новых сульфате фосфатов металлов, основанный на реакциях, протекающих в водных растворах.
Техническим результатом от использования изобретения является предотвращение потери серы на стадии синтеза из-за связывания серы в промежуточный серосодержащий прекурсор с высокой температурой разложения, получение однофазных сульфат-фосфатов, в которых вся сера встроена в кристаллическую структуру.
Поставленная задача достигается тем, что способ синтеза сульфат-фосфатов металлов включает определение максимально допустимого температурного интервала, внутри которого синтез идет без потери серы, выбор исходных реагентов, способствующих протеканию реакции с образованием промежуточных простых сульфатов, температура разложения которых находится в пределах максимально допустимого температурного интервала синтеза, приготовление растворов солей металлов из исходных реагентов, смешение растворов солей металлов с растворами кислот Н3РО4 и H2SO4, поэтапную сушку реакционной смеси при температурах 90°С и 130°С для полного обезвоживания продукта, дальнейшую термообработку реакционной смеси в максимально допустимом температурном интервале в течение 6-48 часов, с диспергированием и контролем химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждой термообработки, при этом выбирают металлы с близкими ионными радиусами и используют сочетания следующих катионов металлов: М+ - Na и K, М2+ - Mg, Ва, Pb, М3+ - Cr, Fe, М4+ - Zr, а в качестве исходных реагентов используют нитраты, хлориды металлов, ацетат хрома.
В таблице 1 представлены значения температуры синтеза фосфатов и значения термической устойчивости сульфатов, °С.
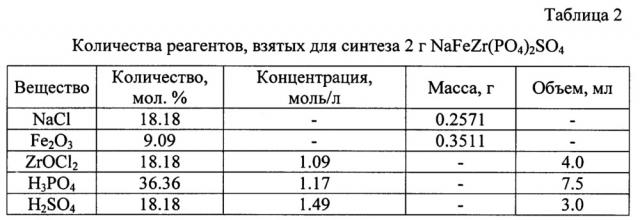
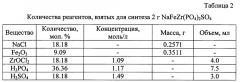
В таблице 2 представлены значения количества реагентов, взятых для синтеза 2 г NaFeZr(PO4)2SO4.
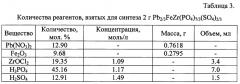
В таблице 3 представлены значения количества реагентов, взятых для синтеза 2 г Pb2/3FeZr(PO4)7/3(SO4)2/3.
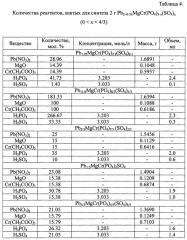
В таблице 4 представлены значения количества реагентов, взятых для синтеза 2 г Pb2-0.5xMgCr(PO4)3-x(SO4)x, 0<х<4/3.
В таблице 5 представлены значения температур плавления промежуточных продуктов синтеза сульфат-фосфатов М2+1.5Mg2(PO4)(SO4)2, где М2+=Pb, Ва, и K3Mg2(PO4)(SO4)2.
В таблице 6 представлены значения количества реагентов, взятых для синтеза 2 г M2+1.5Mg2(PO4)(SO4)2, где М2+=Pb, Ва и K3Mg2(PO4)(SO4)2.
В таблице 7 представлены данные прогнозирования оптимального температурного интервала синтеза сульфат-фосфатов.
В таблице 8 представлены данные электронно-зондового микроанализа сульфат-фосфатов.
На фиг. 1 представлена рентгенограмма сульфат-фосфата NaFeZr(PO4)2SO4.
На фиг. 2 представлен экспериментальный рентгендифракционный спектр синтезированного образца (сплошная линия) и рассчитанный рентгендифракционный спектр Pb2/3FeZr(PO4)7/3(SO4)2/3. Вертикальные штрихи - местоположение рефлексов теоретической рентгенограммы, кривая в нижней части рисунка - разностная кривая интенсивностей экспериментального и теоретического спектров.
Предлагаемый способ синтеза сульфат-фосфатов металлов осуществляют следующим образом.
Предварительно проводят структурно-химический дизайн новых сульфат-фосфатов на основе кристаллохимических принципов. С учетом ионных радиусов и степеней окисления элементов прогнозируют вероятность нахождения атомов в сходных позициях кристаллической структуры (см. книгу В.С. Урусов. Теоретическая кристаллохимия, М.: Изд-во МГУ, 1987. - 275 с.). Близость ионных радиусов и степеней окисления фосфора и серы позволяет рассчитывать на широкий изоморфизм в сульфат-фосфатах, то есть смешивать в составе одного соединения элементы (металлы) близких ионных радиусов и степеней окисления в эквивалентных позициях кристаллической структуры. Так, использование в составе одного соединения Zr4+ и Fe3+, а также Mg2+ и Cr3+, с близкими степенями окисления и ионными радиусами, отличающимися на 10-15%, является благоприятным для получения однофазных образцов заданного состава.
После выбора элементного состава сульфат-фосфата прогнозируют максимально допустимый температурный интервал, внутри которого синтез будет происходить без потерь серы, и подбор исходных реагентов, способствующих протеканию последующей твердофазной реакции при более мягких условиях (с образованием продукта при более низкой температуре и меньшей продолжительности процесса синтеза).
Прогнозирование максимально допустимого температурного интервала основано на обзоре литературных данных по температурной устойчивости простых сульфатов. Определяют температуры, при которых начинают разлагаться промежуточные простые сульфаты металлов, образующиеся в процессе синтеза сульфат-фосфатов (см. А.И. Волков, И.М. Жарский. Большой химический справочник. Мн.: Современная школа, 2005. С. 229; В.А. Рабинович, З.Я. Хавин. Краткий химический справочник. Л.: Химия, 1977. 63 с.; Справочник химика под ред. Б.П. Никольского. Т. 2. М.: Химия, 1966. С. 33, 197; Р.А. Лидин, В.А. Молочко, Л.Л. Андреева. Химические свойства неорганических веществ. 3-е изд. М.: Химия, 2000. С. 35, 58, 379). Из-за медленного протекания твердофазной реакции при температурах выше температуры разложения простых сульфатов сера начнет быстрее испаряться из образца в виде ее летучих оксидных соединений, чем входить в структуру более сложного соединения (сульфат-фосфата).
Недостаток серосодержащих реагентов вызовет нарушение стехиометрии образца, что приведет к получению смеси веществ и не позволит получить желаемый сульфат-фосфат. Поэтому изначально устанавливают теоретический лимит по максимальной температуре синтеза сульфат-фосфата с учетом температур разложения простых сульфатов. В случае использования в сульфат-фосфатах элементов, образующих нестойкие простые сульфаты, необходимо зафиксировать серу с одним или несколькими катионами металлов, способными образовывать термостойкие простые сульфаты. К примеру, если в составе соединения присутствует катионы циркония, образующие нестойкие простые сульфаты и катионы свинца, способные к образованию с SO42--анионами устойчивые сульфаты, то серу можно удержать, если мольное соотношение устойчивого катиона к сульфатному аниону будет равным В:1 с В≥1. Таким образом, максимальную температуру синтеза устанавливают по самой низкой температуре разложения одного из промежуточных термостойких простых сульфатов, связывающих серу.
В качестве катионов используют М+ - Na и K, М2+ - Mg, Ва, Pb, М3+ - Cr, Fe, М4+ - Zr.
В синтезе сульфат-фосфатов можно использовать более широкий спектр металлов в тех же степенях окисления, например: М+ - Li, Rb, Cs, Ag, Tl; M2+ - Ca, Sr, Be, Mn, Fe, Co, Ni, Cu, Zn, Cd, Hg; M3+ - Al, Ga, In, Y, лантаниды и актиниды, Bi; M4+ - Ti, Hf, Ge, Sn.
После теоретического этапа проводят эмпирический этап, включающий проведение различных анализов, позволяющих оценить эффективность связывания серы в образце опытным путем и установить более точную температурную границу синтеза. Для этого используют совмещенный дифференциально-термический и термогравиметрический анализ (ДТА-ТГ), позволяющий в динамике оценить степень потери серы в зависимости от температуры термообработки. Помимо динамического определения максимально возможной температуры синтеза используют метод статического нагревания. Суть метода заключается в поэтапном нагреве образца, после которого отбирается проба и проводится электронно-зондовый микроанализ. На каждом последующем этапе температуру повышают на 30-50°С. Таким образом, после каждого нагрева данные электронно-зондового микроанализа позволяют количественно определить содержание серы в образце.
В результате проведения данной комплексной методики определяют интервал температур, внутри которого синтез пройдет без потери серы.
На эмпирическом этапе, также, определяют реагенты, использование которых позволит провести последующую твердофазную реакцию с образованием промежуточных простых сульфатов, температура разложения которых находится в пределах максимально допустимого температурного интервала синтеза при более мягких условиях. Наиболее благоприятными реагентами являются те, температура разложения которых минимальна (не относится к сульфатам, так как серу необходимо фиксировать в соединении). К данной группе относятся вещества, при нагревании которых не входящие в состав сульфат-фосфатов компоненты (азот, хлор, углекислый газ и т.д.) улетучиваются, а нужные катионы металлов остаются. Преимущественно, в качестве таких веществ используют нитраты, карбонаты, хлориды металлов, соли органических кислот, например ацетат хрома. Их разложение при нагреве приводит к перестройке их кристаллической структуры, вызывая большое количество дефектов кристаллической решетки, благоприятно влияющих на скорость протекания последующей твердофазной реакции. Использование термически устойчивых веществ (оксидов) требует более высоких температур для их активации и начала протекания реакции.
В дальнейшем осуществляют приготовление растворов солей металлов М из исходных реагентов, смешение растворов солей металлов с растворами кислот Н3РО4 и H2SO4, поэтапную сушку реакционной смеси до полного обезвоживания продукта сначала при температуре 90°С, затем при температуре 130°С, дальнейшую термообработку реакционной смеси в подобранном максимально допустимом температурном интервале, с диспергированием и контролем химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждого нагрева.
Термообработку реакционной смеси в максимально допустимом температурном интервале осуществляют в течение 6-48 часов. При нагреве менее 6 часов сульфат-фосфат не успевает полностью закристаллизоваться и может быть неоднофазным. Термообработка более 48 часов не вызывает заметных изменений в сформированном однофазном кристаллическом образце и может привести к частичной потере серы.
Диспергирование смеси осуществляют после каждой термообработки, например, в течение 30 минут.
Перед последним нагревом осуществляют прессование полученного порошка под давлением.
В случае появления на рентгенограмме аморфного гало, наличия нечетких дифракционных максимумов и асимметрии профилей дифракционных линий на рентгенограмме, свидетельствующих о наличии аморфной фазы и несовершенств кристаллической структуры в образце, осуществляют дополнительную термообработку образца при температуре последнего нагрева.
Предложенный подход, основанный на реакциях, протекающих в водных растворах, позволяет предотвратить потерю серы в процессе синтеза из-за ее связывания в промежуточный серосодержащий прекурсор с высокой температурой разложения и получить заданные однофазные сульфат-фосфаты, в которых вся сера встроена в кристаллическую структуру.
Направленное сочетание в составе полученных соединений разных тетраэдрических анионов, из которых один фосфор, а другой более мелкий - сера, позволяет корректировать КТЛР сульфат-фосфатов в сторону меньших значений.
Ниже приведены примеры конкретного осуществления предлагаемого изобретения.
Пример 1.
Сульфат-фосфат NaFeZr(PO4)2SO4 с ожидаемой NZP-структурой был спрогнозирован на основе кристаллохимических данных. Семейство NZP (базовая структура NaZr2(PO4)3) включает соединения и твердые растворы, описываемые кристаллохимической формулой (М1)0→1(М2)0→3{[L2(TO4)3]p-}3∞, где {[L2(TO4)3]p-}3∞ - каркас структуры (р - заряд каркаса), а (М1)0→1, (М2)0→3 - разные типы внекаркасных катионных позиций с обозначением заполнения позиций в каждом типе. Каркас структуры образован объединением по вершинам LO6-октаэдров и ТО4-тетраэдров; пустоты M1 и М2 разного размера удобны для размещения широкого набора катионов, компенсирующих заряд каркаса. Структурообразующие октаэдрические катионы L с преимущественно ковалентным характером связи металл-кислород обычно имеют степени окисления от +5 до +3. В случае спрогнозированного соединения каркас образуют октаэдры ZrO6 и FeO6 (степени окисления и ионные радиусы Zr4+ и Fe3+ близки), тетраэдры РО4 и SO4. Внекаркасные позиции занимают катионы меньшей степени окисления и большего радиуса. В нашем случае это катионы Na+. Изоморфное замещение Zr4++Р5+→Fe3++S6+ (обеспечивающее условие электронейтральности соединения в целом) в базовом NaZr2(PO4)3 приводит к сульфат-фосфату NaFeZr(PO4)2SO4.
Синтез сульфат-фосфата проходит через образование промежуточных простых сульфатов металлов Na2SO4, Fe2(SO4)3, Zr(SO4)2. Их температуры плавления составляют 884°С, 600°С и 410°С соответственно. Сульфаты Na и Fe способны удержать все количество серы в образце, по крайней мере, до 600°С. Поэтому рекомендуемая максимальная температура синтеза составляет 600°С.
Для синтеза сульфат-фосфата в качестве исходных реагентов были выбраны NaCl, Fe2O3 (его предварительно растворяли в растворе соляной кислоты; образовавшийся водный FeCl3 плавится при 309°С), ZrOCl2⋅8H2O, H3PO4, H2SO4. Их использование обеспечило удаление ненужных реагентов (хлороводорода), удержание серы в образце и позволило провести процесс при наиболее низкой температуре.
Процессы, предшествующие образованию целевой фазы NaFeZr(PO4)2SO4, изучали методами совмещенного анализа ТГ-ДТА и рентгенографии (см. ниже).
Для получения сульфат-фосфата NaFeZr(PO4)2SO4 использовали следующие реагенты: NaCl, Fe2O3, ZrOCl2⋅8H2O, H3PO4 и H2SO4. Для получения 2 г продукта на первом этапе к навеске Fe2O3 добавляли концентрированную соляную кислоту до полного растворения оксида. К образовавшемуся раствору добавляли NaCl и приливали раствор оксихлорида циркония при постоянном перемешивании. Затем по каплям добавляли растворы фосфорной и серной кислот (см. таблицу 2).
Реакционную смесь первоначально высушивали при температуре 90°С для удаления воды и далее при 130°С для полного обезвоживания продукта. В дальнейшем реакционную смесь подвергли термообработке при 600°С в течение 24 часов, после которой образец диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образец снова обжигали в печи при тех же температурных и временных параметрах. Каждую стадию нагревания чередовали с диспергированием.
Максимальная температура синтеза составляла 600°С (таблица 7).
При синтезе в интервале температур от 100°С до 600°С наблюдалась потеря массы, характеризующаяся размытыми эндоэффектами на кривой ДТА с минимумами при температурах 120°С и 430°С, максимальная потеря массы происходила до 200°С. Изученная температурная область отвечает разложению гидрофосфата циркония, образующегося в процессе реакции, выделению хлороводорода, воды и формированию конечного продукта - смешанного сульфат-фосфата натрия-железа-циркония согласно уравнению реакции:
NaCl+0.5Fe2O3+ZrOCl2+2H3PO4+H2SO4=NaFeZr(PO4)2SO4+3HCl+2.5H2O.
NaFeZr(PO4)2SO4, по данным рентгенофазового анализа (РФА) (фиг. 1), кристаллизуется в структуре NZP, параметры его элементарной ячейки: а=8.750(4), с=22.626(9) , V=1500(1) 3. Данные электронно-зондового микроанализа показали однородность состава зерен, их состав отвечал формуле Na0.98(3)Fe1.02(5)Zr0.99(3)P2.06(4)S0.95(4)O12 (таблица 8).
Результаты РФА свидетельствуют, что при нагревании сульфат-фосфата NaFeZr(PO4)2SO4 выше 600°С параметры ячейки образца растут. Это связано с уменьшением содержания в образце аниона SO4 (более мелкого по размеру по сравнению с РО4) из-за частичной потери серы в виде SO3.
Для изучения термораспада образец NaFeZr(PO4)2SO4 подвергли изотермическому обжигу при 650°С и 700°С. Время выдержки при каждой температуре составляло 24 ч. После выдержки однофазного образца при 650°С потери серы, по данным электронно-зондового микроанализа, составили 60 мас. %; после выдержки при 700°С образец содержал менее 20 мас. % от первоначального количества серы и представлял собой смесь фаз: Na1.4Fe0.6Zr1.4(PO4)2.8(SO4)0.2 и Fe2O3.
Пример 2.
Сульфат-фосфат Pb2/3FeZr(PO4)7/3(SO4)2/3 с ожидаемой NZP-структурой был спрогнозирован на основе кристаллохимических данных. В случае спрогнозированного соединения (аналогично примеру 1) каркас образуют октаэдры ZrO6 и FeO6, тетраэдры PO4 и SO4. Внекаркасные позиции занимает катион меньшей степени окисления и большего радиуса - это Pb2+. Замещение Pb2++2Р5+→2S6+ (или (1/3)Pb2++(2/3)Р5+→(2/3)S6+) в известном PbFeZr(PO4)3 с NZP-структурой приводит к сульфат-фосфату Pb2/3FeZr(PO4)7/3(SO4)2/3.
Соотношение катионов Pb2+ к анионам SO42- (1:1) в соединении Pb2/3FeZr(PO4)7/3(SO4)2/3 было выбрано для связывания всего количества серы в исходной реакционной смеси в промежуточный тугоплавкий интермедиат PbSO4 (с температурой плавления выше 1000°С) и предотвращения ее потери в ходе синтеза. ДТА реакционной смеси со стехиометрией Pb2/3FeZrS2/3P7/3O12 в совокупности с данными РФА позволили заключить, что эндотермические эффекты на кривой ДТА связаны с разложением исходных реагентов, образующих гетерогенную систему (380°С), кристаллизацией целевого фосфата (750°С) и его разложением (1195°С). Разложение сульфат-фосфата приводит к образованию в качестве основного продукта фосфата PbFeZr(PO4)3.
Для получения сульфат-фосфата использовали следующие реагенты: Pb(NO3)2, Fe2O3 (его предварительно растворяли в растворе соляной кислоты; образовавшийся водный FeCl3 плавится при 309°С), ZrOCl2⋅8H2O, Н3РО4, H2SO4. Их использование обеспечило удаление ненужных реагентов (хлороводорода и оксидов азота), удержание серы в образце и позволило провести процесс при наиболее низкой температуре.
Для получения 2 г продукта на первом этапе растворяли Pb(NO3)2 в соответствующем объеме серной кислоты для получения PbSO4. Далее к навеске Fe2O3 добавляли концентрированную соляную кислоту до полного растворения оксида. Образовавшийся раствор FeCl3 и водный раствор ZrOCl2 добавляли к раствору сульфата свинца при постоянном перемешивании. Затем по каплям добавляли раствор фосфорной кислоты (см. таблицу 3).
Реакционную смесь первоначально высушивали при температуре 90°С для удаления воды и далее при 130°С для полного обезвоживания продукта. В дальнейшем реакционную смесь подвергли термообработке при 600°С в течение 24 часов, после которой образец диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образец снова обжигали в печи при температуре 750°С. Для завершения синтеза образец прессовали в диск и спекали при той же температуре в течение суток.
Максимальная температура синтеза 700-750°С. Предотвратить потерю серы в случае синтеза Pb2/3FeZr(SO4)2/3(PO4)7/3 помогал обоснованный выбор исходных реагентов и стехиометрии образца.
Образец представлял собой поликристаллический порошок красно-коричневого цвета. Pb2/3FeZr(SO4)2/3(PO4)7/3 по данным рентгенографии (фиг. 2), кристаллизуется в структуре NZP, параметры его элементарной ячейки: а=8.6339(4), с=23.2991(9) , V=1504.1(1) 3. Данные электронно-зондового микроанализа показали однородность состава зерен, их состав отвечал формуле Pb0.66(2)Fe1.04(6)Zr0.97(4)P2.37(5)S0.64(3)O12 (таблица 8).
Пример 3.
Сульфат-фосфаты Pb2-0.5xMgCr(PO4)3-x(SO4)x (0<х<4/3) с ожидаемой NZP-структурой были спрогнозированы на основе кристаллохимических данных. В данном случае каркас структуры образуют октаэдры MgO6 и CrO6 (степени окисления и ионные радиусы Mg2+ и Cr3+ близки), тетраэдры РО4 и SO4. Внекаркасные позиции занимает катион меньшей степени окисления и большего радиуса - это Pb2+.
В ряду Pb2-0.5xMgCr(PO4)3-x(SO4)x (0<х<4/3) соотношение катионов Pb2+ к анионам SO42- всегда оказывается , что удовлетворяет условиям для связывания серы в промежуточный тугоплавкий интермедиат PbSO4. Более того наличие катионов Cr3+ и Mg2+ стабилизирует реакционную смесь, так как в случае частичного связывания серы с данными катионами произойдет образование простых сульфатов Cr2(SO4)3 и MgSO4, термически устойчивых до 730°С и 1137°С соответственно.
Для получения данного ряда сульфат-фосфатов использовали следующие реагенты: Pb(NO3)2, MgO (к навеске MgO добавляли концентрированную азотную кислоту до полного растворения оксида; образующийся нитрат Mg(NO3)2 разлагается выше 300°С), Cr(СН3СОО)3, ZrOCl2⋅8H2O, H3PO4 и H2SO4. Их использование обеспечило удаление ненужных реагентов (хлороводорода, оксидов азота, паров уксусной кислоты), удержание серы в образце и позволило провести процесс при наиболее низкой температуре.
Для получения 2 г продукта на первом этапе растворяли Pb(NO3)2 в соответствующем объеме серной кислоты для получения PbSO4, к навеске MgO добавляли концентрированную азотную кислоту до полного растворения оксида. Далее к навеске Cr(СН3СОО)3 добавляли дистиллированную воду до полного растворения ацетата. Полученные растворы солей сливали при перемешивании. Далее по каплям добавляли раствор фосфорной кислоты (см. таблицу 4).
Реакционную смесь первоначально высушивали при температуре 90°С для удаления воды и далее при 130°С для полного обезвоживания продукта. В дальнейшем реакционную смесь подвергли термообработке при 600°С в течение 24 часов, после которой образец диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образец снова обжигали в печи при температуре 720°С. Для завершения синтеза образца его прессовали в диск и спекали при той же температуре в течение суток.
По данным рентгенографии все образцы состава Pb2-0.5xMgCr(PO4)3-x(SO4)x с 0<х<4/3 кристаллизуется в структуре NZP. Данные электронно-зондового микроанализа показали однородность состава их зерен и соответствие ожидаемых (спрогнозированных) и фактических составов с учетом погрешности метода (таблица 8).
Пример 4.
Сульфат-фосфаты M2+1.5Mg2(PO4)(SO4)2, где М2+=Pb, Ва, и K3Mg2(PO4)(SO4)2 с ожидаемой структурой были спрогнозированы на основе кристаллохимических данных. В данном случае каркас структуры образуют октаэдры MgO6, тетраэдры РО4 и SO4. Внекаркасные позиции занимают катионы или большего радиуса (Pb2+ или Ва2+), или меньшей степени окисления и большего радиуса - это K+.
Элементный состав сульфат-фосфатов М2+1.5Mg2(PO4)(SO4)2, где М2+=Pb, Ва, и K3Mg2(PO4)(SO4)2 позволяет использовать при синтезе высокие температуры в силу того, что промежуточные соединения серы (PbSO4, BaSO4, MgSO4, K2SO4) являются тугоплавкими (таблица 5).
Для получения данных сульфат-фосфатов использовали следующие реагенты: Pb(NO3)2, Ba(NO3)2, KNO3, MgO (к навеске MgO добавляли концентрированную азотную кислоту до полного растворения оксида; образующийся нитрат Mg(NO3)2 разлагается выше 300°С), H3PO4 и H2SO4. Их использование обеспечило удаление ненужных реагентов (оксидов азота), удержание серы в образце и позволило провести процесс при наиболее низкой температуре.
Для получения 2 г продукта на первом этапе к навеске MgO добавляли концентрированную азотную кислоту до полного растворения оксида. К образовавшемуся раствору добавляли соответственно Pb(NO3)2, Ba(NO3)2 или KNO3 при постоянном перемешивании. Затем по каплям добавляли растворы фосфорной и серной кислот (см. таблицу 6).
Реакционные смеси первоначально высушивали при температуре 90°С для удаления воды и далее при 130°С для полного обезвоживания продукта. В дальнейшем реакционные смеси подвергли термообработке при 600°С в течение 24 часов, после которой образцы диспергировали в агатовой ступке в течение 30 минут с применением изопропилового или этилового спирта для обеспечения гомогенизации смеси. Затем образцы обжигали в печи при температуре 950°С в течение 36-48 часов.
В представленных примерах в синтезе сульфат-фосфатов использованы катионы металлов: Na+, K+, Mg2+, Ва2+, Pb2+, Cr3+, Fe3+, Zr4+. Однако в синтезе сульфат-фосфатов может быть использован более широкий спектр металлов в тех же степенях окисления, например, M+ - Li, Rb, Cs, Ag, Tl; M2+ - Ca, Sr, Be, Mn, Fe, Co, Ni, Cu, Zn, Cd, Hg; M3+ - Al, Ga, In, Y, лантаниды и актиниды, Bi; M4+ - Ti, Hf, Ge, Sn. Поэтому представленные примеры иллюстрируют предлагаемое изобретение, но не ограничивают его.
1. Способ синтеза сульфат-фосфатов металлов включает определение максимально допустимого температурного интервала, внутри которого синтез идет без потери серы, выбор исходных реагентов, способствующих протеканию реакции с образованием промежуточных простых сульфатов, температура разложения которых находится в пределах максимально допустимого температурного интервала синтеза, приготовление растворов солей металлов из исходных реагентов, смешение растворов солей металлов с растворами кислот Н3РО4 и H2SO4, поэтапную сушку реакционной смеси при температурах 90°С и 130°С для полного обезвоживания продукта, дальнейшую термообработку реакционной смеси в максимально допустимом температурном интервале в течение 6-48 часов с диспергированием и контролем химического и фазового состава методами электронно-зондового микроанализа и рентгенографии после каждой термообработки, при этом выбирают металлы с близкими ионными радиусами и используют сочетания следующих катионов металлов: М+ - Na и K, М2+ - Mg, Ва, Pb, М3+ - Cr, Fe, М4+ - Zr, а в качестве исходных реагентов используют нитраты, хлориды металлов, ацетат хрома.
2. Способ по п. 1, отличающийся тем, что максимально допустимый температурный интервал определяют эмпирическим путем с помощью совмещенного дифференциально-термического и термогравиметрического анализа или с помощью метода статического нагревания.
3. Способ по п. 1, отличающийся тем, что максимальную температуру синтеза устанавливают по самой низкой температуре разложения одного из промежуточных термостойких простых сульфатов, связывающих серу, и данным электронно-зондового микроанализа.
4. Способ по п. 1, отличающийся тем, что диспергирование осуществляют после каждой термообработки в течение 30 минут.
5. Способ по п. 1, отличающийся тем, что перед последним нагревом осуществляют прессование полученного порошка под давлением.
6. Способ по п. 1, отличающийся тем, что осуществляют дополнительную термообработку образца при температуре последнего нагрева в случае появления на рентгенограмме аморфного гало, наличия нечетких дифракционных максимумов и асимметрии профилей дифракционных линий на рентгенограмме, свидетельствующих о наличии аморфной фазы и несовершенств кристаллической структуры в обра