Способ определения особенностей течения эпилепсии на основе физиологических показателей методом логит-регрессионного анализа
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к неврологии. Определяют показатели: частоты альфа-колебаний и кросскорреляционной функции электроэнцефалограммы, межпиковой амплитуды N75P100 зрительного вызванного потенциала, межпиковой амплитуды N2P3 когнитивного вызванного потенциала Р300, а также показатели времени простой зрительно-моторной реакции и среднего квадратичного отклонения вариабельности сердечного ритма, зарегистрированных у пациентов с эпилепсией при стандартных условиях. При помощи уравнения регрессии, имеющего вид у=-5,57+0,86* и логит-преобразования Р=еу/(1-еу) определяют вероятность попадания пациента с эпилепсией в одну из групп, характеризующих пациентов с благоприятным или неблагоприятным течением эпилепсии. Способ позволяет увеличить достоверность диагностики течения эпилепсии, что достигается за счет использования указанных выше физиологических показателей и их математического преобразования. 2 табл.
Реферат
Изобретение относится к области медицины, а именно к клинической медицине (неврологии).
Классификация эпилепсии является одним из сложных и непрерывно совершенствуемых вопросов эпилептологии [8]. Основой классификации в настоящее время является анатомо-физиологическая концепция, определение этиологии, выделение электроклинических синдромов [13, 14, 15]. Вместе с тем, комплексное описание состояния больных эпилепсией должно характеризовать тип приступов, их динамику на фоне получаемой пациентами антиконвульсантной терапии, а также особенности психологической сферы, качество жизни, в том числе социальную адаптацию пациентов с эпилепсией [8, 10]. Основанная на данных характеристиках адекватная фармакотерапия позволяет оптимизировать лечебный процесс, снизить прямые экономические затраты при лечении больных [2, 3].
Современный подход к описанию состояния пациентов с эпилепсией предполагает интеграцию множества методологических и методических приемов с характеристикой деятельности неспецифических моделирующих структур головного мозга и корковых нейрональных популяций методом электроэнцефалографии (ЭЭГ), описанием деятельности афферентных систем, специфически изменяющих свою активность при некоторых формах эпилепсии [4]. Кроме того, использование метода когнитивных вызванных потенциалов Р300, являющихся электрофизиологическим коррелятом перцептивных и мнестических процессов, позволяет улучшить диагностику нарушений высших психических функций при данном заболевании [5]. Участие компонентов моторных систем в реализации эпилептиформной активности в виде эпиприступа предполагает описание моторных функций у больных эпилепсией [8]; а изменение вегетативной регуляции как в иктальный, так и в интериктальный период - исследование вегетативного обеспечения деятельности [1]. Общепринятым является то, что ЭЭГ является основным методом функциональной диагностики, используемым в эпилептологии для характеристики состояния больных, как в приступный, так и в межприступный период. При этом анализу подвергается не только эпилептиформная активность, но и специфика основных спектральных составляющих ЭЭГ и их реакция на функциональные нагрузки [6]; а исследование вегетативного обеспечения деятельности, в свою очередь, является одним из основных методов дифференциации эпилептических и неэпилептических приступов [8]. Таким образом, вышеизложенное свидетельствует о том, что для достоверной диагностики особенностей течения эпилепсии необходим интегральный подход, характеризующий состояние пациента, страдающего данным заболеванием.
Наиболее близким по назначения способом к заявленному изобретению по совокупности признаков является способ прогнозирования развития симптоматической эпилепсии при нейроинфекциях у детей (прототип) [11], в котором на основе выявления этиологического агента-возбудителя заболевания, данных нейровизуализации, особенностей клинического состояния, характеристик ЭЭГ пациентов при помощи линейно-классификационных функций определяют благоприятный или неблагоприятный исход заболевания (без развития или с развитием симптоматической эпилепсии соответственно).
К причинам, препятствующим достижению результата при использовании известного способа, принятого за прототип, относится решение задачи прогнозирования развития симптоматической эпилепсии без описания особенностей ее течения, использование комплекса нейровизуализационных, нейрофизиологических и лабораторных исследований, определяющих высокие экономические затраты на реализацию способа, использование линейно-классификационных функций, определяющих прогноз на основе преобладания количественных выходных значений одной из них.
Целью изобретения является определение особенностей течения эпилепсии на основе комплекса физиологических показателей при помощи логит-регрессионной модели.
Цель достигается тем, что на основе показателей частоты альфа-колебаний ЭЭГ в отведении O1 (частота альфа O1) в Гц, частоты кросскорреляционной функции ЭЭГ в паре отведений O1-O2 (частота ККФ O1O2) в Гц, межпиковой амплитуды N75P100 зрительного вызванного потенциала в отведении Oz (амплитуда ЗВП N75P100) в микровольтах, межпиковой амплитуды N2P3 когнитивного вызванного потенциала Р300 в Cz (амплитуда N2P3 P300 в Cz) в микровольтах, времени простой зрительно-моторной реакции для правой руки (время ПЗМР) в миллисекундах и среднего квадратичного отклонения вариабельности сердечного ритма (СКО ВСР) в миллисекундах, зарегистрированных у пациента при стандартных условиях, при помощи уравнения регрессии, имеющего вид у=-5,57+0,86*частота альфа 01-0,25*частота ККФ О1-О2+0,16*амплитуда ЗВП N75P100 в Oz+0,07*амплитуда N2P3 P300 в Cz-0,01*время ПЗМР+0,02*СКО ВСР, и логит-преобразования Р=еу/(1-еу) определяется вероятность распределения пациентов с эпилепсией в группы, имеющие известные характеристики и обозначенные как группы с благоприятным и неблагоприятным течением заболевания.
Способ определения особенностей течения эпилепсии на основе комплекса физиологических показателей методом логит-регрессионного анализа осуществляется следующим образом. Определяются физиологические показатели в определенных условиях, обозначенных как стандартные и приведенные ниже. Регистрируется электроэнцефалограмма в течение 5 минут в исходном состоянии, для анализа выделяется фрагмент ЭЭГ, не содержащий артефактов и участков эпилептиформной активности, методом спектрального анализа и анализа кросскорреляционной функции ЭЭГ при величине эпохи анализа 20,48 секунд определяется средняя частота альфа-колебаний в O1 в Гц и частота кросскорреляционной функции ЭЭГ в паре O1-O2 в Гц. Регистрируются зрительных вызванные потенциалы (ЗВП) на шахматный паттерн при условии стимуляции, описанных ниже в экспериментальном обосновании, на кривой зрительных вызванных потенциалов определяется пик N75 и P100, определяется амплитуда N75P100 в мкВ. Регистрация когнитивного вызванного потенциала P300 осуществляется в стандартных условиях, описанных ниже в экспериментальном обосновании, идентифицируются пики N2 и P3, определяется межпиковая амплитуда N2P3 в мкВ. ПЗМР регистрируется на вспышку красного цвета, определяется среднее время реакции при серии из 30 стимулов для правой руки. Для анализа ВСР используется электрокардиограмма длительностью 5 минут, зарегистрированная одновременно с ЭЭГ в положении сидя; на основе методов статистического анализа динамического ряда R-R интервалов определяется СКО ряда R-R интервалов. Данные показатели вводятся как значения независимых факторов в вышеописанное уравнение с известными коэффициентами регрессии, в результате при использовании логит-преобразования определяется вероятность распределения пациента в группу 1 (неблагоприятное течение заболевания) или 2 (благоприятное течение заболевания).
Экспериментальное обоснование проведено на выборке больных эпилепсией, включающей 163 человека; средний возраст составил 36,1 лет, из них 52 мужчины и 58 женщин. Проводилось определение формы эпилепсии по рекомендациям Международной антиэпилептической лиги [15, 16]. Симптоматическая (структурно-метаболическая) форма эпилепсии установлена у 91 пациента, криптогенная (вероятно-симптоматическая) форма эпилепсии у 62 больных, у 10 пациентов установлен диагноз генерализованной идиопатической юношеской миоклонической эпилепсией. Среди локализационно-обусловленных форм эпилепсии височная эпилепсия диагностирована у 77 пациентов, лобная эпилепсия у 76 пациентов. Средний возраст начала заболевания составил 22,8 лет, стандартная ошибка средней 1,26 лет.
Проводилась балльная оценка эмоциональных, когнитивных нарушений, уровня социальной адаптации [7]. Для исследования эмоциональной сферы заполнялась «Госпитальная шкала тревоги и депрессии». Когнитивные нарушения оценивались при помощи краткой шкалы оценки психического статуса (MMSE) и батареи тестов для оценки лобной дисфункции (Frontal Assesment Battery - FAB) [17], характеризующей лобные регуляторные нарушения. Монреальская шкала оценки когнитивных функций (MOCATEST) [18] применялась как параллельный тест. Показатели качества жизни исследовались как критерий уровня социальной адаптации пациентов. Использовались опросники SF-36 и QOLIE-31 [13, 19]. Критерии, используемые для оценки, представлены ниже: 0 баллов по сфере «Эмоциональные нарушения» соответствует уровень тревоги или депрессии по шкале HADS 0-3 балла; 1 баллу - тревога или депрессия по шкале HADS 4-6 баллов; 2 баллам - тревога по HADS более 6 баллов или депрессия по шкале HADS более 7 баллов, а также наличие жалоб на тревогу, депрессию у пациентов или психотических эпизодов, связанных с эпилепсией в анамнезе. При оценке когнитивных нарушений 0 баллов соответствует уровень MMSE от 30 до 27 баллов или FAB 17-18 баллов; 1 баллу - MMSE 24-26 баллов или FAB 15-16 баллов; 2 баллам уровень MMSE менее 24 или FAB менее 15 баллов. Оценка социальной адаптации предполагает выделение 0 баллов при оценке шкалы «Ролевые ограничения, связанные с физическим состоянием» (RF) опросника SF-36 от 100 до 75 баллов или субсферы социальное функционирование (SF) опросника QOLIE-31 от 100 до 80 баллов; 1 балла при оценке шкалы RF опросника SF-36 от 74 до 40 баллов или субсферы SF QOLIE-31 от 79 до 55 баллов, 2 баллов при оценке шкалы RF SF-36 от 36 менее 40 баллов или субсферы SF QOLIE-31 менее 55 баллов. Оценивалось среднее число приступов по данным анамнеза за 1 год, предшествующий визиту, и по данным последующего катамнестического 4-6 месячного наблюдения после проводимой по необходимости коррекции фармакотерапии. Учитывались сложные парциальные приступы (СИП), первично- и вторично-генерализованные приступы (ГП). Оценивалось число принимаемых пациентами антиконвульсантов после проводимой по необходимости коррекции фармакотерапии.
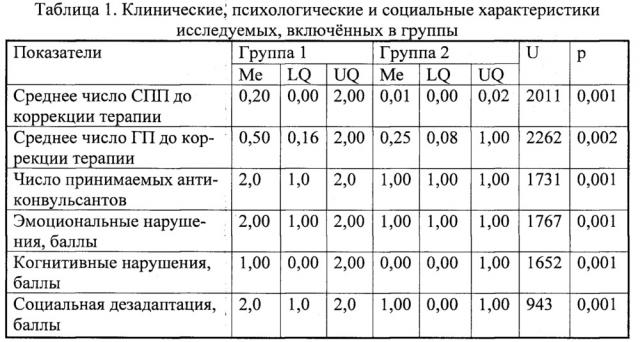
Методом кластерного анализа (k-средних) при помощи пакета программ Statistica 6.0 выделены 2 группы пациентов; различия между группами оценивались методом непараметрической статистики на основании критерия Манна-Уитни (U), при уровне значимости ошибки р<0,05; описывалась медиана (Me), нижний квартиль (LQ) и верхний квартиль (UQ) [12]. В таблице 1 представлены клинических, психологические и социальные характеристики пациентов, включенных в группы.
В группу 1 вошло вошло 96 человек, в группу 2 вошло 67 человек; различия между группами достоверны как по числу приступов (с преобладанием в группе 1), так и по числу принимаемых антиконвульсантов, уровню эмоциональных, когнитивных нарушений и социальной адаптации; в связи с этим кластер 1 пациентов обозначен как группа с неблагоприятным течением заболевания, а кластер 2 как группа, характеризующаяся благоприятным течением.
Регистрация и анализ ЭЭГ проводилась с целью оценки состояния неспецифических модулирующих систем ствола мозга, корковых нейронных популяций в динамике целенаправленной деятельности, а также для оценки характера и степени выраженности (индекса) эпилептиформной активности [6]. Регистрация ЭЭГ осуществлялась при помощи 19 канального цифрового электроэнцефалографа «Нейро-спектр-3» и соответствующего программного обеспечения «Нейрон-спектр» («Нейрософт», Россия).
Монтаж электродов проводился по схеме «10-20%» (Fp1, Fp2, F7, F3, F4, F8, T3, C3, C4, T4, T5, P3, P4, T6, O1, O2, Fz, Cz, Pz) с референтными электродами на ушах А1 и А2. Частота квантования АЦП составляла 200 Гц, фильтр высоких частот (постоянная времени) - 0,5 Гц (0,32 с), фильтр нижних частот - 75 Гц. Средняя эпоха анализа составила 20,48 секунд (4096 отсчетов). Перед проведением математического анализа ЭЭГ проводилось выделение и исключение из анализа артефактов, а также выделение эпилептиформной активности как визуально, так и путем программной детекции спайков и острых волн. Для анализа использовались фрагменты записи без эпилептиформной активности. Анализ ЭЭГ проводился методами спектрального анализа на основании быстрого преобразования Фурье с выделением следующих частотных диапазонов: дельта (0,5-3,9 Гц), тета (4,0-7,9 Гц), альфа (8-13 Гц), бета-1 (14-19,9 Гц), бета-2 (20-35 Гц), гамма-ритм (36-100 Гц).
При спектральном анализе исследовались следующие показатели: полная мощность, средняя мощность, средняя амплитуда и средняя частота альфа-колебаний; бета1-колебаний и бета2-колебаний, тета- и дельта-колебаний. Проводился кросскорреляционный анализ с расчетом межполушарных и внутриполушарных показателей коэффициента кросскорреляции, а также средней частоты кросскорреляционной функции.
Регистрация ЗВП на шахматный паттерн осуществлялась при помощи программно-аппаратного комплекса «Нейро-МВП» ООО «Нейрософт» (г. Иваново) при расположении активных электродов в отведениях O1, O2, Oz, референтный электрод Fz, с заземляющим электродом на ушах, максимальный подэлектродный импеданс составлял 5 кОм. Стимуляция проводилась реверсивным шахматным паттерном, для которого более характерна четкая выраженность специфической афферентации, при помощи 17 дюймового монитора Samsung TFT, угловая величина стимула составила 40 угловых минут, расстояние до экрана 1,5 м. Стимуляция осуществлялась на оба полуполя зрения одновременно (полным полем) с фиксацией взгляда в центре экрана. Частота реверсии шахматных паттернов составила 1 Гц. Чувствительность усиления составила 10 мкВ/дел, окончательная чувствительность после усреднения - 2-5 мкВ/дел. - Частотная полоса пропускания 0,5-100 Гц, эпоха анализа 400 мс. Число усреднений 120. Идентификация компонентов на основании выделения пиков ВП осуществлялась путем наложения кривых. При анализе оценивались следующие показатели: латентность компонентов Р50, N75 (потенциалы ближнего поля, 17 поля по Бродману), Р100 (результат генерации биопотенциалов в корковых полях 17-18), N145 (генез потенциала связан с ассоциативной областью зрительного анализатора, в основном полями 18 и 19), Р200, а также межпиковая амплитуда P50N75, N75P100, P100N145, N145P200.
Проводилась регистрация потенциала Р300 в рамках вероятностной парадигмы появления значимого стимула. Осуществлялась звуковая стимуляция с частотой и вероятностью незначимого стимула 1000 Гц и 80%, значимого - 2000 Гц и 20%, длительность стимула 50 мс, интенсивность 60 Дб SPL, межстимульный интервал составил 2 с. Регистрация и усреднение ответа проводились по отведениям Pz, Cz, Fz с референтными электродами на ушах (A1, A2), полоса частот составила от 0,5 Гц до 30 Гц, эпоха анализа 750 мс. Испытуемый находился в положении сидя с открытыми глазами, предварительно давалась инструкция о нажатии на кнопку ответа пациента при появлении значимого стимула. В структуре когнитивного вызванного потенциала осуществлялась идентификация поздней волны N2-P3-N3, то есть когнитивной составляющей ответа на значимый стимул. При этом пик N2 в комплексе P300 ассоциировался с правильностью опознания стимула, а пик P3 с принятием решения в его отношении. Анализировались следующие параметры: латентность N2; межпиковая амплитуда P2N2; латентность P3; межпиковая амплитуда N2P3, также оценивалось среднее время реакции на значимый стимул, число верных и неверных нажатий.
Регистрация ПЗМР проводилась при помощи комплекса для психофизиологического тестирования «НС-Психотест» (фирма «Нейрософт», г. Иваново [9]). В рамках методики ПЗМР проводилось последовательное предъявление сигналов красного цвета, при этом при появлении сигнала обследуемый должен как можно быстрее нажать на соответствующую кнопку, стараясь при этом не допускать ошибок (ошибками считаются преждевременное нажатие кнопки и пропуск сигнала). Световой сигнал подавался в случайные моменты времени, но с определенной регулярностью, чтобы каждый очередной сигнал был ожидаем. Интервал между сигналами составил от 0,5 до 2,5 с, при этом первые 5-7 сигналов являлись пробными, предназначенными для адаптации обследуемого и не регистрировались. Сигналы предъявлялись бинокулярно; число сигналов - 30. Оценивались среднее значение времени реакции, стандартное отклонение как мера стабильности сенсомоторного реагирования, число преждевременных нажатий и пропусков.
Иследование ВСР применялось для оценки вегетативного обеспечения целенаправленной деятельности. Использовался метод кратковременных записей (5 минут). Регистрация электрокардиограмм проводилась при помощи прибора Варикард 2.5 (фирма «Рамена», г. Рязань) и программы «ИСКИМ» (версия 6.0, разработка той же фирмы). Запись электрокардиограмм осуществлялась в I стандартном отведении (при вертикальной электрической оси сердца во II отведении) при положении испытуемого сидя. Настройки фильтра верхних частот 0,1 Гц, нижних частот - 100 Гц, режекторный фильтр 50 Гц, частота дискретизации 300 Гц. После регистрации проводилась дополнительная фильтрация записи для устранения артефакта колебания электродов и распознавание зубцов R-R. Минимальное значение кардиоинтервала, которое оценивалось как нормальное (не аритмическое) 0,24 секунды, максимальное - 2 секунды. Использовались статистические методы анализа ВСР с определением в том числе среднего квадратичного отклонения (СКО) и методы спектрального анализа.
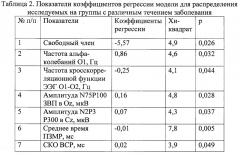
Создание модели логит-регрессии осуществлялось при помощи пакета программ Statistica 6.0 [12]. Уравнение регрессионного анализа представлено в виде Y=b0+b1X1+b2X2…+bnXn; где b0 - константа (свободный член), b1, b2 … bn - коэффициенты регрессии для независимых факторов, X1, X2 … Xn - независимые факторы; вероятность распределения пациентов в подгруппы оценена по формуле Р=eу/(1+eу); для минимизации функции потерь использован метод максимума правдоподобия, алгоритм Хука-Дживиса; для оценивания пригодности модели был использован статистический критерий сходимости хи-квадрат (при р<0,05). После выполнения шагов итерации были определены следующие характеристики модели логит-регрессии (таблица 2).
Показатель сходимости модели по критерию хи-квадрат для данной модели составил 30,5, p=0,00003; как следует из таблицы, коэффициенты регрессии для параметров статистически значимы. Оценивалась вероятность распределения пациентов в группы на основе предсказанных значений Р(у) меньше или равных 0,5 для группы 1 и больше 0,5 для группы 2; распределение осуществлено корректно в 79% в группе 1 и 76% в группе 2.
Отношение шансов (odds ratio - OR) для свободного члена составило 0,77, для независимого фактора 1 (частота альфа-колебаний O1) 2,00; для независимого фактора 2 (частота кросскорреляционной функции ЭЭГ O1-O2) 0. 77; для независимого фактора 3 (амплитуда N75P100 ЗВП в Oz) 1,17; для независимого фактора 4 (амплитуда N2P3 P300 в Cz) 1,07; для независимого фактора 5 (среднего времени ПЗМР) 0,99; для независимого фактора 6 (СКО ВСР) 1,02; то есть наиболее значимыми для распределения пациентов на группы являются характеристики частоты альфа-колебаний в O1, показатели экзогенных и когнитивных вызванных потенциалов.
Предложенный способ позволяет определить особенности течения эпилепсии по ограниченному набору физиологических показателей, что способствует более рациональному определению тактики лечения данных больных.
СПИСОК ЛИТЕРАТУРЫ
1. Баевский P.M. Анализ вариабельности сердечного ритма в космической медицине / P.M. Баевский // Физиология человека. - 2002. - Т. 28, №2. - С. 70-82.
2. Белоусов Д.Ю. Фармакоэкономический анализ применения перампанела при резистентной парциальной эпилепсии / Д.Ю. Белоусов, Е.В. Афанасьев, Е.А. Ефремова // Качественная клиническая практика. - 2014. - №1. - С. 24-39.
3. Власов П.Н. Анализ «затраты-эффективность» при лечении «новыми» противоэпилептическими препаратами / П.Н. Власов, Н.В. Орехова // Журнал неврологии и психиатрии им. С.С. Корсакова. - 2011. - Т. 111, №10. - С. 39-43.
4. Гнездицкий В.В. Атлас по вызванным потенциалам мозга (практическое руководство, основанное на анализе конкретных клинических наблюдений) / В.В. Гнездицкий, О.С. Корепина. - Иваново: ПресСто, 2011. - 532 с.
5. Гордеев С.А. Применение метода эндогенных связанных с событиями потенциалов мозга P300 для исследования когнитивных функций в норме и клинической практике // Физиология человека. - 2007. - Т. 33, №2. - С. 121-133.
6. Зенков Л.Р. Клиническая электроэнцефалография (с элементами эпилептологии) / Л.Р. Зенков. - М.: МЕДПресс, 2004. - 187 с.
7. Зорин Р.А. Анализ гетерогенности группы больных эпилепсией методом кластерного анализа / Р.А. Зорин, В.А. Жаднов, М.М. Лапкин // Актуальные проблемы клинической и экспериментальной патологии: межрегиональный тематический сборник научных трудов, посвященный 70-летию основания Рязанского государственного медицинского университета им. академика И.П. Павлова и 100-летию создания инфильтрационной теории атеросклероза академика Н.Н. Аничкова / под ред. д.м.н., проф. Ю.Ю. Бяловского, д.м.н., проф. В.В. Давыдова. - Рязань: РИО РязГМУ, 2013. - С. 97-102.
8. Карлов В.А. Эпилепсия у детей и взрослых женщин и мужчин / В.А. Карлов. - М.: ОАО «Издательство «Медицина», 2010. - 720 с.
9. Мантрова Н.Н. Методическое руководство по психофизиологической и психологической диагностике / Н.Н. Мантрова. - Иваново: ООО "Нейрософт", 2007. - 216 с.
10. Новиков А.Е. Эволюция в клинической эпилептологии / А.Е. Новиков. - Иваново: ИвГМА, 2006. - 387 с.
11. Прототип. Способ прогнозирования развития симптоматической эпилепсии при нейроинфекциях у детей: заявка №2012116757; заявл. 24.05.2012; опубл. 27.10.2013.
12. Руководство по обеспечению решения медико-биологических задач с применением программы Statistica 10.0 / В.М. Боев [и др.] - Оренбург: Южный Урал, 2004. - 208 с.
13. Cramer J.A. et al. Development and cross-cultural translations of a 31-item quality of life in epilepsy inventory / J. A. Cramer [et al.] / Epilepsia. - 1998. - Vol. 39, №1. - p. 81-88.
14. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Comission on Theurapeutic Strategies / P. Kwan et al. / Epilepsia. - 2010. - Vol. 51, №6. - p. 1069-1077.
15. International League Against Epilepsy (ILAE). Guidelines for epidemiologic studies on epilepsy / ILAE // Epilepsia. - 1993. - Vol. 34. - Р. 592-596.
16. Revised terminology and concepts for organization of seizures and epilepsies: Report of the ILAE Comission on Classification and Terminolog 2005-2009 / A.T. Berg [et al.] // Epilepsia. - 2010. - Vol. 51 - p. 676-685.
17. The FAB: A Frontal Assesment Battery at bedside / B. Dubois [et al.] // Neurology. - 2000. - Vol. 55, №11. - Р. 1621-1626.
18. The Monreal Cognitive Assesment, MoCA: a brief screening tool for mild cognitive impairment / Z.S. Nasreddine [et al.] // Journal of the American Geriatrics Sociey. - 2005. - Vol. 53, №4. - Р. 695-699.
19. Ware J.E, Snow K.K., Kosinski M., Gandek B. Sf-36 Health Survey. Manual and Interpretation Guide / J.E. Ware [et al.]. - Lincoln, RI: QualityMetric Incorporated, 2000. - 150 p.
Способ определения особенностей течения эпилепсии на основе физиологических показателей методом логит-регрессионного анализа, отличающийся тем, что на основе показателей частоты альфа-колебаний электроэнцефалограммы в отведении 01, частоты кросскорреляционной функции электроэнцефалограммы в паре отведений 01-02, межпиковой амплитуды N75P100 зрительного вызванного потенциала в отведении Oz, межпиковой амплитуды N2P3 когнитивного вызванного потенциала Р300 в Cz, времени простой зрительно-моторной реакции для правой руки, среднего квадратичного отклонения вариабельности сердечного ритма, зарегистрированных у пациентов с эпилепсией при стандартных условиях при помощи уравнения регрессии, имеющего вид у=-5,57+0,86* частота альфа-колебаний электроэнцефалограммы в отведении 01-0,25* частота кросскорреляционной функции электроэнцефалограммы в паре отведений 01-02+0,16* межпиковая амплитуда N75P100 зрительного вызванного потенциала в отведении Oz+0,07* межпиковая амплитуда N2P3 когнитивного вызванного потенциала Р300 в Cz-0,01* среднее время простой зрительно-моторной реакции + 0,02* среднее квадратичное отклонение вариабельности сердечного ритма и логит-преобразования Р=еу/(1-еу) определяют вероятность попадания пациента с эпилепсией в одну из групп, характеризующих пациентов с благоприятным или неблагоприятным течением эпилепсии.