Флуоресцентно-меченые дезоксиуридинтрифосфаты
Иллюстрации
Показать всеИзобретение относится к флуоресцентно-меченым дезоксиуридин трифосфатам, которые могут найти применение в качестве меток для маркирования ДНК в ходе ПЦР. Предложенные соединения включают в себя 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1-(4-сульфонатобутил)-1'-этилиндодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-ди-(4-сульфонатобутил))индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1'-(4-сульфонатобутил)-1-этилиндодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-5'-сульфо-1,1'-диэтил-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-9-(3,3',3'-триметил-1,1'-диэтил-5-сульфо-индодикарбоцианин-3-ил)-нон-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-7-(1-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1'-этилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-7-(1'-(4-сульфонатобутил)-3,3,3',3'-тетраметил-1-этилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил)]-2'-дезоксиуридин-5'-трифосфат, 5-[4-аза-5-оксо-7-(3,3,3',3'-тетраметил-5'-сульфо-1,1'-диэтилиндодикарбоцианин-5-ил)-гепт-1-ен-1-ил]-2'-дезоксиуридин-5'-трифосфат или их соли. Предложены новые флуоресцентно-меченые нуклеотиды, эффективные в качестве флуоресцентных меток для маркирования ДНК в ходе ПЦР, в том числе с использованием известных тест-систем для определения мутаций, ассоциированных с лекарственной устойчивостью к М. Tuberculosis и с генетической предрасположенностью к тромбозам. 3 н.п. ф-лы, 13 ил., 4 табл., 45 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области химии нуклеиновых кислот, а именно к новым модифицированным нуклеотидам - флуоресцентно-меченым дезоксиуридинтрифосфатам. Изобретение включает в себя синтез нуклеотидов, модифицированных по С5-положению пиримидинового цикла, а также их использование для анализа нуклеиновых кислот (ДНК).
Уровень техники
Анализ нуклеиновых кислот используется как для проведения широкого круга исследований в разных областях науки, так и для клинической диагностики, фармакологии, медицины, биотехнологии и др. Введение маркеров, визуализирующих синтезируемую ДНК, позволяет изучать процессы взаимодействия исследуемой ДНК с различными мишенями: ДНК, РНК, белками, низкомолекулярными соединениями. Флуоресцентное маркирование нуклеиновых кислот является одним из способов выявления результатов гибридизационного анализа, в частности, в технологии биологических микрочипов, в микроскопической цитометрии, в проточном цитометрическом сортинге и т.д. Во всех этих методах анализируемую ДНК первоначально выявляют с помощью комплементарной ей нуклеиновой кислоты. Затем количество образовавшихся дуплексов измеряют по интенсивности флуоресценции метки, связанной с одним из компонентов дуплекса.
Введение флуоресцентно-меченых нуклеотидов при помощи ДНК-полимераз нашло широкое применение для маркирования генов и ДНК. Пробы с высокой плотностью меток позволяют повысить чувствительность анализа. Полимеразная цепная реакция является удобным методом для маркирования и амплификации ДНК с высокой плотностью флуорофоров с образованием флуоресцентно-меченых нуклеотидов, являющихся субстратами для ДНК-полимераз в ходе ПЦР. Однако использование флуоресцентно-меченых нуклеотидов имеет некоторые ограничения, поскольку большинство ферментов плохо распознают модифицированные нуклеотиды. Эффективность маркирования также сильно зависит от типа красителя в модифицированных нуклеотидах.
Известно, что С5-положение пиримидинового цикла лучше всего подходит для модификации нуклеотидов, поскольку ориентировано в широкую бороздку двунитевых ДНК и не ингибирует взаимодействие А-Т оснований. Функциональные маркеры, такие как флуорофоры, ферменты, лиганды, например биотин, присоединяют к С5-положению пиримидинового основания через линкер с аминогруппой (Tester J.К. et al., Synthesis and characterization of DNA oligomers and duplexes containing covalently attached molecular labels: comparison of biotin, fluorescein, and pyrene labels by thermodynamic and optical spectroscopic measurements, J. Am. Chem. Soc, 1989, vol. 111, pp. 6966-6976). Зачастую модифицированные ДНК получают, используя ДНК-синтезаторы (Ketomaki К. et al., Hybridization properties of support-bound oligonucleotides: the effect of the site of immobilization on the stability and selectivity of duplex formation, Bioconjugate Chem., 2003, vol. 14, pp. 811-816).
Однако если ДНК-полимеразы могут воспринять модифицированные нуклеотиды в качестве субстратов, то модифицированные ДНК получают энзиматически. Энзиматическое получение модифицированных ДНК, а именно меченых флуорофорами, представляет особый интерес. Сочетание полимеразной цепной реакции (ПЦР), позволяющей получить множество копий с исследуемой ДНК, с одновременным флуоресцентным маркированием представляется чрезвычайно важным.
Для проведения ПЦР используют смесь дезоксинуклеозидтрифосфатов, которая содержит dATP, dGTP, dCTP и dTTP, причем вместо dTTP может использоваться dUTP или смесь dTTP/dUTP в любой молярной пропорции. Любой из указанных дезоксинуклеозидтрифосфатов может нести флуоресцентную метку (патент США №6589737, Compositions and methods for labeling of nucleic acid molecules, 08.07.2003). Наиболее предпочтительно использование флуоресцентно-меченого дезоксиуридинтрифосфата, что, с одной стороны, обусловливает эффективное включение данного субстрата во вновь синтезированную цепь ДНК в процессе ПЦР, с другой - обеспечивает возможность предотвращать получение ложных результатов за счет перекрестной кросс-контаминации ампликонами путем использования на первой стадии фермента урацил-ДНК-гликозилазы.
Эффективность включения в ДНК производных, несущих заместители в С5-положении пиримидинового цикла, зависит от нуклеотида, природы заместителя и вида ДНК-полимеразы (Kuwahara М. et al., Systematic characterization of 2'-deoxynucleoside-5'-triphosphate analogs as substrates for DNA polymerases by polymerase chain reaction and kinetic studies on enzymatic production of modified DNA, Nucleic Acids Res., 2006, vol. 34, №19, pp. 5383-5394).
Производные 2'-дезоксиуридина с пропинильной группой в С5-положении хорошие субстраты для Vent- и Taq-ДНК полимераз (Giller G. et al., Incorporation of reporter molecule-labeled nucleotides by DNA polymerases. I. Chemical synthesis of various reporter group-labeled 2'-deoxyribonucleoside-5'-triphosphates, Nucleic Acids Res. 2003, vol. 31, №10, pp. 2630-2635). Производные с пропенильной группой хорошие субстраты для Taq-ДНК полимеразы, но плохие для Vent- и Pfu-ДНК полимераз, а с пропильной группой очень плохие субстраты для Taq-ДНК полимеразы (Godovikova T.S. et al., 5-[3-(E)-(4-azido-2,3,5,6-tetrafluorobenzamido)propenyl-1]-2'-deoxyuridine-5'-triphosphate substitutes for thymidine-5'-triphosphate in the polymerase chain reaction, Bioconjugate Chem., 1999, vol. 10, pp. 529-537; Gourlain T. et al, Enhancing the catalytic repertoire of nucleic acids. II. Simultaneous incorporation of amino and imidazolyl functionalities by two modified triphosphates during PCR, Nucleic Acids Res., 2001, vol. 29, №9, pp. 1898-1905). Иными словами, для 2'-дезоксиуридина хорошими субстратами являются производные с жесткими линкерами, линкерами на основе этина (ацетилена) и Е-этена (этилена, трансизомеры), а плохими с гибкими линкерами, линкерами на основе этана и Z-этена (цис-изомеры). Для 2'-дезоксицитидина пропинильные С5-производные хорошие субстраты для Vent- и Taq-ДНК полимеразы.
Даже незначительная химическая модификация аминогруппы 5-аминоаллил-2'-дезоксиуридин-5'-трифосфата приводит к существенному различию включения ДНК-полимеразами в ПЦР продукт. Однако эффективность энзиматического включения зависит не только от заместителя, находящегося в непосредственной близости от Соположения пиримидинового цикла, но и от более отдаленного окружения. В публикации (Giller G. et al., Incorporation of reporter molecule-labeled nucleotides by DNA polymerases. I. Chemical synthesis of various reporter group-labeled 2'-deoxyribonucleoside-5'-triphosphates, Nucleic Acids Res. 2003, vol. 31, №10, pp. 2630-2635) показано, что эффективность включения флуоресцентно-меченых производных 5-аминоаллил-2'-дезоксиуридина-5'-трифосфата Vent(exo)-HHK полимеразой существенно зависит от природы флуорофора, присоединенного к аминогруппе линкера.
В качестве флуоресцентной метки может быть использован любой флуоресцентный краситель, который можно химически ввести в молекулу дезоксинуклеозидтрифосфата таким образом, чтобы не препятствовать в существенной степени прохождению полимеразной цепной реакции. В случае флуоресцентно-меченого дезоксиуридинтрифосфата, например, флуоресцентный краситель может быть присоединен к 5'-концу аминопропаргильного производного dUTP (Ranasinghe R.T. et al, Fluorescence based strategies for genetic analysis, Chem. Commun, 2005, pp. 5487-5502). Используют красители флуоресцеинового (TAMRA®, ROX®, JOE®), родаминового (Texas Red®), индоцианинового (Cy3®, Cy5®, Cy5.5®, Cy7®) рядов. Наиболее предпочтительными являются красители, спектр возбуждения которых лежит в длинноволновой (красной) области спектра с меньшей фоновой флуоресценцией, области «диагностического окна биологической ткани», что позволяет увеличить чувствительность анализа.
Индоцианиновые красители широко используются для получения флуоресцентно-меченых ДНК. Природа заместителей и места их связывания с флуорофорным ядром красителя влияют на яркость флуоресценции, растворимость, образование молекулярных агрегатов, как самого красителя, так и маркированных им нуклеиновых кислот. Ориентация флуорофорного ядра красителя относительно маркированного нуклеотида, длина и химическая природа линкера, отдаляющего флуорофор от маркированной ДНК, существенно сказываются на эффективности образования совершенных дуплексов с комплементарной ДНК, и в итоге сказываются на чувствительности биоанализа в целом. Индоцианины, содержащие различные заместители - алкильные-, сульфо-, сульфоалкильные, конденсированные арильные, известны давно. Каждый новый ряд индоцианиновых красителей служит основой для получения нового ряда флуоресцентно-меченных биологически-активных соединений и полупродуктов для их получения.
В публикации (Европейский патент №1152008, Fluorescent nucleotides containing а cyanine, merocyanine or styryl dye for the detection of nucleic acid, 07.11.2001) предложены флуоресцентно-меченые 5-аминоаллилдезоксиуридинтрифосфаты, содержащие в качестве маркеров индокарбо- и индодикарбоцианиновые красители с различными заместителями (сульфамид, хлор, гидроксил).
В публикации (Yu Н. et al., Cyanine dye dUTP analogs for enzymatic labeling of DNA probes, Nucleic Acids Res., 1994, vol. 22, №15, pp. 3226-3232) представлен синтез Cy5-dUTP и Cy3-dUTP, которые использовали для получения флуоресцентно-меченых фрагментов нуклеиновых кислот, используя методы ник-трансляции, «рандом-прайм» маркирование и ПЦР.
В публикации (Lacenere C.J. et al, Effects of a modified dye-labeled nucleotide spacer arm on incorporation by thermophilic DNA polymerases, Nucleosides, Nucleotides and Nucleic Acids, 2006, vol. 25, pp. 9-15) выявлено влияние длины линкера, соединяющего флуорофор и AAdUTP, на эффективность роста цепи синтетических праймеров в зависимости от используемых ДНК-полимераз. Показано, что длинный линкер приводит к более эффективной элонгации, и образуются продукты длиннее исходного праймера на 30-52 пар оснований, тогда как короткий линкер способствует образованию продуктов длиннее на 5-10 пар оснований.
В публикации (Европейский патент №1211294, Improved process and method for the preparation of asymmetric monofunctionalised indocyanine labelling reagents and obtained compounds, 05.06.2002) представлен синтез флуоресцентно-меченых сульфобензиндоцианиновыми красителями трифосфатов дезоксиуридина. В публикации (Европейский патент №1801165, Modified carbocyanine dyes and their conjugates, 27.06.2007) фирмой Molecular Probes предложены флуоресцентно-меченые 5-аминоаллил-и 5-аминопропаргилдезоксиуридинтрифосфаты, содержащие в качестве маркеров полисульфированные индоцианиновые красители с карбоксипентильным заместителем в положении 3 индоленинового фрагмента. Синтезированные соединения рекомендованы для ник-трансляции и метода in-vitro транскрипции.
В публикации (Европейский патент №1491591, New fluorescence cyanine labels containing a sulfamido linker arm, 29.12.2004) предложена общая методика получения флуоресцентно-меченых 5-аминопропаргилдезоксиуридин- и дезоксицитидинтрифосфатов на основе гидроксисукцинимидных эфиров цианиновых красителей с карбоксильной группой, присоединенной через сульфамидоалкильную цепь в положении 5, с различным числом метиленовых звеньев от 1 до 6. Авторы утверждают, что такого рода красители имеют явное преимущество перед их аналогами - с карбоксиалкильной группой в положениях 1 и 5. Присоединение карбоксильной функции через сульфамидную связь привело к увеличению жесткости молекулы, а вследствие этого и к улучшению флуоресцентных характеристик красителя.
В публикации (патент США №2004186278, Cyanine dye labelling reagents with meso-substitution, 23.09.2004) для получения флуоресцентно-меченого дезоксиуридинтрифосфата использовали цианиновый краситель с нитрильным заместителем в мезо-положении полиметиновой цепи.
Подход оценки эффективности энзиматического включения флуоресцентно-меченых производных нуклеотидов с помощью олигонуклеотидных биочипов в литературе не описан и представляется очень эффективным. Возможность одновременного наблюдения нескольких десятков сигналов в условиях кинетического и термодинамического контроля позволяет получать одновременно большой объем количественной информации, с большей достоверностью. Наличие большого числа примеров флуоресцентно-меченых производных 2'-дезоксиуридин-5'-трифосфата и количественная оценка на отработанных моделях биочипов позволят четко определить влияние различных структурных факторов на эффективность включения в ПЦР продукт.
Раскрытие изобретения
Целью изобретения явился синтез производных нуклеотидов, содержащих цианиновый краситель в положении С5, а также их применение для маркирования ДНК в ходе ПЦР. Получаемая при этом модифицированная ДНК приобретает новые свойства, обусловленные введенными модификациями, но должна специфично взаимодействовать с ДНК и белками. Наш подход основывается на синтезе индоцианиновых красителей, содержащих две гетероциклические кольцевые системы, связанные полиметиновой линкерной связью и содержащие карбоксильную группу в положении 3 или 5 индоленинового гетероцикла, присоединенную через полиметиленовую цепочку. Такими соединениями, предлагаемыми в данном изобретении, являются соединения общей формулы (I).
где R1 представляет собой -CH3; -(CH2)4СООН;
R2 представляет собой -(СН2)2СООН; -Н; -SO3-;
R3 представляет собой -С2Н5; -(CH2)4SO3-;
R4 представляет собой -Н; -SO 3-;
R5 представляет собой -С2Н5; -(CH2)4SO3-.
В частности, соединения, условно отнесенные к соединениям группы ТА, соответствующие общей формуле (ТА)
где R1 представляет собой -Н; -SO3-;
R2 представляет собой -C2H5;-(CH2)4SO3-;
R3 представляет собой -Н; -SO3-;
R4 представляет собой -С2Н5; -(CH2)4SO3-.
а также соединения, условно отнесенные к соединениям группы ТВ, соответствующие общей формуле (ТВ)
где R1 представляет собой -С2Н5; -(CH2)4SO3-;
R2 представляет собой -Н; -SO3-;
R3 представляет собой -С2Н5; -(CH2)4SO3-.
Предлагаемые флуоресцентно-меченые трифосфаты общей формулы (ТА) характеризуются тем, что реактивная карбоксильная группа индоцианиновых красителей общей формулы (А), входящих в их состав, присоединена в 3 положении индоленинового фрагмента через тетраметиленовую цепочку атомов (где R1, R2, R3, R4 - алкильные-, сульфо- и сульфоалкильные заместители).
Предлагаемые флуоресцентно-меченые трифосфаты общей формулы (ТВ) характеризуются тем, что реактивная карбоксильная группа индоцианиновых красителей общей формулы (В), входящих в их состав, присоединена в 5 положении индоленинового фрагмента через диметиленовую цепочку атомов (где R1, R2, R3 - алкильные-, сульфо- и сульфоалкильные заместители).
Указанные структурные отличия индоцианиновых красителей общих формул (А) и (В), входящих в состав нуклеозидтрифосфатов (ТА) и (ТВ), приводят к ряду отличительных свойств, а именно к повышенной светостойкости, повышенной химической устойчивости и термостойкости при использовании в качестве флуоресцентных меток.
Показано, что при непрерывном облучении на флуоресцентном микроскопе на длине волны 655 нм время полураспада красителей формул (А) и (В) различается: для красителя (А2) время полураспада составляет 7 ч, для красителей (Al), (В1) - 5,3 ч, для красителя (A3), (В2) - 6 ч, для красителя (А4) - 6,9 ч, в то время как для красителя, входящего в состав трифосфата общей формулы (I) (R1=-CH3; R2=R4=-H; R3=-(СН2)5СООН, R5=-C2H5) составляет 5,5 ч (Фиг. 1 линия №4), для красителя формулы (I) (R1=-CH3; R2=R5=-H, R3=-(СН2)5СООН, R4=-(CH2)4SO3-) составляет 1,5 ч (Фиг. 1 линия №6), для красителя формулы (I) (R1=-CH3; R2=-SO3-, R3=-(СН2)5СООН, R4=-(CH2)4SO3-) составляет 2,5 ч (Фиг. 1 линия №7).
Значения молярного коэффициента экстинкции красителей (А1) и (А2) превышают 240000, (В1) - около 200000 (таблица 1, Фиг. 2). Квантовый выход флуоресценции красителей (А1)-(А4) в метаноле превышает 25% (таблица 1, Фиг. 3).
Была определена относительная эффективность флуоресценции красителей общей формулы (А) и (В), при этом наибольшее значение эффективности получено для красителя (А2) при возбуждении и регистрации в максимумах поглощения и флуоресценции и принято за единицу (таблица 1, Фиг. 4). Были получены следующие данные:
- при возбуждении и регистрации в максимумах поглощения и флуоресценции значение относительной эффективности флуоресценции превышает 0.6 для красителей (А1)-(А4) в метаноле и для красителя (А2) в PBS;
- при возбуждении на длине волны 655 нм и регистрации на 690 нм значение относительной эффективности флуоресценции превышает 0.2 для красителя (А2) в метаноле и больше 0.1 в PBS.
Предлагаемые красители структур (А) и (В) в зависимости от заместителей в гетероциклическом фрагменте различаются спектральным диапазонам возбуждения и флуоресценции, суммарным электрическим зарядом и растворимостью в воде (таблица 1). Благодаря спектральным характеристикам в ближнем ИК-диапазоне, индодикарбоцианиновые красители формул (А) и (В) являются оптимальными для маркирования биомолекул, так как биоматериал в диапазоне длин волн между 600-800 нм имеет низкую собственную флуоресценцию. Введение меток в ДНК в виде флуоресцентно-меченых нуклеозидтрифосфатов общей формулы I на стадии наработки кДНК методом ПЦР позволяет добиться более высокой чувствительности, так как маркер вводится не в единственном числе, а в большем количестве вместе с нуклеотидами (Yu H. et al., Cyanine dye dUTP analogs for enzymatic labeling of DNA probes, Nucleic Acids Res., 1994, vol. 22, №15, pp. 3226-3232).
Далее представлены результаты использования красителей для получения флуоресцентно-меченых нуклеозидтрифосфатов с последующим их применением для маркирования ДНК в ходе ПЦР. Все красители общих формул (A1)-(А5) и (В1)-(B3) в виде их N-гидроксисукцинимидных эфиров (для (A) R1=-(CH2)4COOSu; для (В) R2=-(CH2)2COOSu) и пара-нитрофениловых эфиров (для (A) R1=-(CH2)4COOpNP; для (В) R2=-(CH2)2COOpNP) с хорошим выходом маркируют нуклеотиды, содержащие в С5-положении аминоаллильный заместитель.
Спектральные свойства флуоресцентно-меченых нуклеотидов общей формулы I представлены в таблице 2. Модифицированные нуклеотиды характеризуются интенсивными полосами поглощения и флуоресценции (Фиг. 5) и значениями квантового выхода флуоресценции 15-20% в фосфатно-солевом буферном растворе (Фиг. 6). По сравнению с красителями (А) и (В) наблюдается батохромный сдвиг максимумов поглощения и флуоресценции на несколько нм, а также увеличение квантового на 1-7% в зависимости от структуры соединения. Максимумы поглощения и флуоресценции модифицированных нуклеотидов I располагаются в области 645 нм и 663 нм соответственно. Мы наблюдали батохромный сдвиг максимума поглощения уридин-5'-трифосфата с 262 нм до ~300 нм при его модификации посредством присоединения аминоалкильного заместителя, несущего флуоресцентную метку.
Установлено, что результаты полимеразной цепной реакции с использованием флуоресцентно-меченых нуклеозидтрифосфатов общей формулы I (ТА1)-(ТА5) и (ТВ1)-(TB3) зависят от структуры модифицированных нуклеотидов, используемых в качестве субстратов в ПЦР. Для сравнительной оценки степени встраивания модифицированных нуклеотидов вычисляют средний флуоресцентный сигнал совершенных дуплексов в ячейках биочипа и затем нормируют его на значение, полученное для коммерчески-доступного продукта производства фирмы Amersham (CY5-DUTP, Amersham РА55022). Установлено, что образование полноразмерного ПЦР продукта зависит не только от химической структуры заместителей, но также от расположения заместителя в молекуле флуорофора. Флуоресцентный сигнал выше для нуклеотидов (ТА1), (TA3)-(ТА5) и (ТВ1)-(TB3), содержащих цианиновый краситель с одной сульфогруппой (Фиг. 7, Фиг. 11). Флуоресцентные сигналы, полученные для нуклеотида (ТА2) и коммерчески-доступного Cy5-dUTP, оказались ниже и приблизительно равными. Было обнаружено, что расположение сульфогруппы в молекуле красителя влияет на эффективность встраивания модифицированных нуклеотидов в продукт ПЦР.
Установлено, что все красители формул (A1)-(А5) и (В1)-(B3) в составе конъюгатов с нуклеотидами не ингибируют полимеразную цепную реакцию (Фиг. 9, Фиг. 10, Фиг. 12). Модифицированные нуклеотиды общей формулы (I) не влияют на стабильность всех остальных компонентов анализа. Установлено, что все соединения формулы (I) (ТА1)-(ТА5) и (ТВ1)-(TB3) обладают стабильностью, достаточной для проведения полного цикла анализа без заметного разложения красителя. По совокупности всех свойств соединения формулы (I) (ТА1)-(ТА5) и (ТВ1)-(TB3) могут быть использованы в качестве флуоресцентных меток при разработке диагностических тест-систем, основанных на проведении ПЦР.
Краткое описание чертежей
Фиг. 1. Зависимость интенсивности флуоресценции от времени при облучении красителей на биочипе полупроводниковым лазерным источником света (655 нм/690 нм, 40 мВт): 1 - краситель (А2); 2 - краситель (А4); 3 - красители (A3, В2); 4 - краситель формулы (I) (R1=-CH3; R2=R4=-H; R3=-(СН2)5СООН, R5=-C2H5); 5 - красители (A1, B1); 6 - краситель формулы (I) (R1=-CH3; R2=R5=-H, R3=-(СН2)5СООН, R4=-(CH2)4SO3-); 7 - краситель формулы (I) (R1=-CH3; R2=-SO3-, R3=-(СН2)5СООН, R4=-(CH2)4SO3-).
Фиг. 2. Коэффициенты молярной экстинкции красителей в метаноле и PBS.
Фиг. 3. Квантовый выход флуоресценции красителей в метаноле и PBS.
Фиг. 4. Относительная эффективность флуоресценции красителей: возбуждение - в максимуме поглощения и на длине волны 655 нм, регистрация - в максимуме флуоресценции и на длине волны 690 нм соответственно.
Фиг. 5. Нормированные спектры поглощения и флуоресценции флуоресцентно-меченного дезоксиуридинтрифосфата.
Фиг. 6. Квантовый выход флуоресценции модифицированных дезоксиуридинтрифосфатов в PBS.
Фиг. 7. Гибридизация ДНК образца дикого типа на ТБ-биочипе.
Фиг. 8. Электрофоретический анализ в 2% агарозном геле результатов мультиплексной амплификации генов rpoB, katG, inhA, ahpC и инсерционного элемента IS6110 с различными флуоресцентно-мечеными трифосфатами дезоксиуридина в реакционной смеси в концентрации 8 мкМ: (а) проявление этидийбромидом, (b) проявление в свете флуоресценции цианинового красителя. Полоса 1 - маркер молекулярного веса pUC19/MspI (67-501 bp); полоса 2 - положительный контроль, не содержит меченого нуклеозидтрифосфата; полоса 3 - нуклеотид ТА2; полоса 4 - нуклеотид ТА1; полоса 5 - нуклеотид TA3; полоса 6 - нуклеотид ТА4; полоса 7 - нуклеотид ТА5; полоса 8 - нуклеотид TBI; полоса 9 - нуклеотид ТВ2; полоса 10 - нуклеотид TB3; полоса 11 - отрицательный контроль амплификации.
Фиг. 9. Зависимость нормированного сигнала флуоресценции от концентрации флуоресцентно-меченного нуклеозидтрифосфата ТА2 и ТА4.
Фиг. 10. Нормированный сигнал флуоресценции для различных модифицированных нуклеотидов при использовании диагностической тест-системы «ТБ-биочип».
Фиг. 11. Гибридизация, нормированный сигнал и генотип маркированных фрагментов ДНК образцов на Тромбо-биочипе на примере флуоресцентно-меченного нуклеотида ТА1 (wt - дикий тип, mut - мутация).
Фиг. 12. Электрофоретический анализ в 2% агарозном геле результатов мультиплексной амплификации генов системы фибринолиза: (а) проявление этидийбромидом, (b) проявление в свете флуоресценции цианинового красителя. А - FGB ген, В - F7 ген, С -MTHFR ген, D - PAI-1 ген, Е - GPIIIa ген. Полоса 1 - нуклеотид ТА2; полоса 2 - нуклеотид ТА1; полоса 3 - нуклеотид TA3; полоса 4 - нуклеотид ТА4; полоса 5 - нуклеотид ТА5; полоса 6 - нуклеотид TBI; полоса 7 - нуклеотид ТВ2; полоса 8 - нуклеотид TB3; полоса 9 - положительный контроль, не содержит меченого нуклеозидтрифосфата; полоса 10 - отрицательный контроль амплификации; полоса 11 - маркер молекулярного веса pUC19/MspI (67-501 bp).
Фиг. 13. Нормированный сигнал флуоресценции для различных модифицированных нуклеотидов при использовании диагностической тест-системы «ПФ-биочип Тромбо».
Осуществление изобретения
Соединения по изобретению общих формул ТА и ТВ синтезировали согласно схеме 1.
Схема 1
Синтез несимметричных индодикарбоцианиновых красителей формул (А, В), входящих в состав нуклеозидтрифосфатов ТА и ТВ, основан на реакции конденсации солей индолениния, содержащих активную метиленовую группу, и гидрохлорида дианила малонового диальдегида (схема 2, таблица 3, 4) (В.Е. Кузнецова и др. Изв. АН, Сер. хим., 2007, №11, с. 2186-2190; В.Е. Кузнецова и др. Изв. АН, Сер. хим., 2007, №12, с. 2355-2359; V.E. Kuznetsova et al., Mend. Comm, 2008, №3, pp. 138-140). Синтез промежуточных соединений, необходимых для получения красителей формул (А, В), представлен на схемах 3-9 (В.Е. Кузнецова и др. Изв. АН, Сер. хим. - 2008. - №3. - С. 595-598; В.Е. Кузнецова и др. Изв. АН, Сер. хим., 2007, №11, с. 2186-2190).
Схема 2
Схема 3
Схема 4
Схема 5
Схема 6
Схема 7
Схема 8
Схема 9
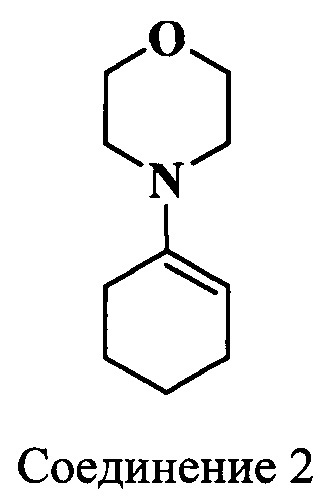
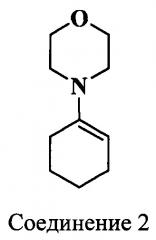
Исходным соединением для синтеза индоленинов (7) (схема 4) и (9) (схема 5), содержащих функциональную группу в положении 3, является 6-метил-7-оксооктановая кислота (6), синтез которой представлен на схеме 3. Ацетилирование циклогексанона проводили двумя способами: комплексом BF3⋅2AcOH и действием ацетилхлорида в хлороформе на морфолиновое производное циклогексена (2) в присутствии Et3N. 2-Ацетил-2-метилциклогексанон (4) получали действием метил иодида на раствор 2-ацетилциклогексанона (3) в метиловом спирте. Затем при помощи метилата лития синтезировали метиловый эфир кетокислоты (5). Гидролиз которого проводили разбавленной соляной кислотой, получая при этом кетокислоту (6). Конденсацией фенилгидразинов и 6-метил-7-оксо-октановой кислоты (6) (схема 3) получали соответствующие индолениновые основания (7, 9) (схема 4, 5).
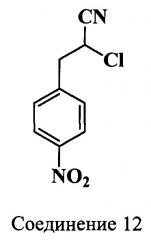
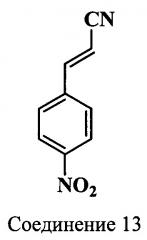
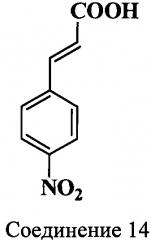
Исходным соединением для синтеза индоленина (17), содержащего функциональную группу в положении 5, является гидрохлорид 4-(2-карбоксиэтил)фенилгидразина (16) (схема 6). Нитрил (12) получали из 4-нитроанилина действием раствора акрилонитрила в ацетоне на образующуюся в ходе реакции диазониевую соль. 3-(4-Нитрофенил)-акрилонитрил (13) получали кипячением водно-этанольного раствора 2-хлор-3-(4-нитрофенил)-пропионитрила (12) в присутствии ацетата натрия. 3-(4-Нитрофенил)-2-пропеновую кислоту (14) получали кислотным гидролизом нитрила (13). Дальнейшее восстановление кислоты (14) приводило к получению 3-(4-аминофенил)-пропионовой кислоты (15). Гидрохлорид 4-(2-карбоксиэтил)фенилгидразина (16) получали восстановлением в кислой среде диазониевой соли, которая образовывалась в ходе реакции. Карбоксиэтильное производное индоленина (17) синтезировали из гидразина (16) и метилизопропилкетона в ледяной уксусной кислоте в присутствии ацетата калия без выделения образующегося в ходе реакции гидразона.
Конденсацией фенилгидразина (1) с метилизопропилкетоном получали соответствующий индоленин (20) (схема 7).
N-Сульфоалкилирование всех индолениновых оснований проводили в 1,2-дихлорбензоле или бутиронитириле при действии 1,4-бутансультона (соединение (11) схема 5, соединение (19) схема 6, соединение (22) схема 8). N-Алкильные производные получали действием этилиодида или этилового эфира n-толуолсульфокислоты на раствор индоленина в ацетонириле или бутиронитриле (соединение (8) схема 4, соединение (10) схема 5, соединение (18) схема 6, соединение (21) схема 7, соединение (23) схема 8).
Полиметиновый мостик получали следующим образом (схема 9). Реакцией этилвинилового эфира и триэтилортоформиата в присутствии эфирата трехфтористого бора получали тетраэтилацеталь малонового альдегида (24). Далее при действии анилин гидрохлорида получен гидрохлорид дианила малонового диальдегида (25).
Несимметричные индодикарбоцианиновые красители формул (А, В) синтезируют конденсацией солей индолениния и гидрохлорида дианила малонового диальдегида (схема 2, таблицы 3, 4). В ходе реакции кроме целевого соединения образуются еще два побочных симметричных продукта. На первой стадии в реакцию конденсации вводили один индоленин. Ход реакции контролировали спектрофотометрически, при этом происходило исчезновение пиков λmax 237 и 280 нм, характерных для индоленинов, и появление нового сигнала λmax 440 нм, характерного для промежуточного соединения. Для полного протекания реакции достаточно нагревания при 118°C в течение 1-3 ч. Вторую стадию получения индодикарбоцианинового красителя осуществляют при использовании диизопропилэтиламина или безводного ацетата калия в качестве конденсирующих агентов. Все синтезированные индодикарбоцианиновые красители выделяли обращенно-фазовой хроматографией в системе ацетонитрил-0.01М триэтиламмонийацетатный буферный раствор градиентным элюированием от 0 до 50% ацетонитрила. Далее получали их натриевые соли.
p-Нитрофениловые эфиры красителей получали действием бис p-нитрофенил карбоната в ДМФ. Активные эфиры выделяли обращенно-фазовой хроматографией. Реакцией аминогруппы AAdUTP с 1.25 эквивалентом р-нитрофенилового эфира красителя общей формулы (А) или (В) в 0.1 М NaHCO3/Na2CO3 (рН 8.5) в ДМФ получали флуоресцентно-меченые нуклеозид трифосфаты общей формулы (I) с выходом примерно 40% в зависимости от структуры используемого красителя (схема 1). Флуоресцентно-меченые нуклеотиды очищали в 2 этапа - анионная ионообменная хроматография на сорбенте DEAE-целлюлоза и обращенно-фазовая (C18-RP) хроматография.
Еще одним объектом изобретения является применение соединений по изобретению общей формулы (I) для маркирования ДНК. Ферментативное введение соединений формул (ТА) и (ТВ) представлено на примере диагностической тест-системы «ТБ-биочип» для определения мутаций, ассоциированных с лекарственной устойчивостью М. Tuberculosis.
Процедура молекулярной идентификации мутаций состоит из трех последовательных стадий: (1) мультиплексная ПЦР с амплификацией 5 ДНК фрагментов; (2) асимметричная мультиплексная ПЦР с образованием 5 флуоресцентно-меченых одно нитевых фрагментов ДНК; (3) гибридизация маркированных фрагментов с олигонуклеотидным микрочипом (биочип). Флуоресцентно-меченые нуклеозид трифосфаты общей формулы (I) добавляли в смесь природных dNTP, используемых в ПЦР. При проведении ПЦР получали ампликон, который содержал флуоресцентную метку. Флуоресцентно-меченный ампликон гибридизовали на биочипе.
Микрочип (Фиг. 7) представляет собой расположенные на подложке ячейки из гидрогеля с иммобилизованными внутри ячеек олигонуклеотидными зондами. Диаметр ячеек приблизительно 100 микрон. В разных ячейках находятся олигонуклеотидные зонды различного строения. В ячейках, в которых строение зонда соответствует строению ампликона, происходит связывание ампликона в прочный комплекс, дуплекс. В тех ячейках в которых строение зонда не соответствует строению ампликона не происходит связывания ампликона. Результаты анализа оценивают по интенсивности флуоресцентных сигналов в ячейках биочипа. В ячейках, в которых произошло связывание флуоресцентно-меченого ампликона с зондом, наблюдается интенсивный сигнал флуоресценции. Для регистрации сигналов используют флуоресцентный микроскоп, снабженный компьютером со специальным программным обеспечением.
Образование полноразмерных ПЦР продуктов подтверждено при помощи горизонтального электрофореза в агарозном геле в присутствии бромистого этидия и при помощи флуоресцентного анализатора (Фиг. 8). Электрофоретические полосы ПЦР продуктов (3-10), полученные обоими методами - идентичны. Все модифицированные нуклеотиды общей формулы (I) не ингибируют ПЦР для участка гена rpoB Mycobacterium tuberculosis и встраиваются в амплифицированные продукты.
Гибридизация дикого типа М. tuberculosis с биочипом представлена на Фиг. 7. Интенсивности гибридизационных сигналов на биологическом микрочипе для продуктов ПЦР, полученных с разными флуоресцентно-мечеными трифосфатами дезоксиуридина, различаются. На величину сигналов влияют различные факторы: эффективность встраивания ДНК-полимеразой модифицированных нуклеотидов в амплифицированный продукт, специфическое связывание с образованием совершенных дуплексов с олигонуклеотидными зондами, находящимися в ячейках биочипа, неспецифическое связывание с компонентами ячейки биочипа, яркость флуоресценции флуоресцентной метки, связанной с амплифицированнм продуктом.
Определена оптимальная концентрация флуоресцентно-меченых трифосфатов дезоксиуридина для проведения ПЦР при использовании Taq ДНК-полимеразы (Фиг. 9), которая соответствует 8 мкМ. На Фиг. 10 представлены уровни флуоресцентных сигналов на чипе с различными флуоресцентно-мечеными трифосфатами дезоксиуридина в концентрации 8 мкМ. Был вычислен средний флуоресцентный сигнал совершенных дуплексов в ячейках биочипа и затем нормирован на значение, полученное для коммерчески-доступного Cy5-dUTP.
Образование полноразмерного ПЦР продукта зависит не только от химической структуры заместителей, но также от расположения заместителя в молекуле флуорофора. В ряду соединений общей формулы (ТА) наиболее эффективен препарат с сульфогруппой жестко связанной с индолениновым фрагментом красителя и наиболее удаленной от пиримидинового основания нуклеозида (ТА4) - 6.75, тогда как эффективность соединения (TA3) с сульфонатобутильным заместителем равна 5.25. При приближении сульфогруппы к пиримидиновому основанию трифосфата эффективность конъюгата общей формулы (ТА) снижается: (ТА1) - 4.25, (ТА5) - 3.9. Также было показано, что количество сульфогрупп в структуре красителя сильно влияет на эффективность конъюгата - вне зависимости от расположения карбоксильной группы. Флуоресцентные сигналы, полученные для нуклеотида (ТА2) и коммерчески-доступного Cy5-dUTP, оказались ниже и приблизительно равными. В ряду соединений общей формулы ТВ наиболее эффективны препараты с сульфонатобутильным заместителем: (TB1) - 7.42, (ТВ2) - 7.11, тогда как соединение (TB3) с сульфогруппой, жестко связанной с индолениновым фрагментом красителя и наиболее удаленной от пиримидинового основания нуклеозида, оказался менее эффективным - 5.17.
Также эффективность встраивания модифицированных нуклеотидов (ТА) и (ТВ) в условиях ПЦР представлена при использовании тест-системы «ПФ-биочип Тромбо» для определения генетической предрасположенности к тромбозам. С использованием флуоресцентно-меченых нуклеотидов (ТА) и (ТВ) проведен анализ полиморфизма генов системы фибринолиза (FGB, F7, GPIIIa, PAI-1, MTHFR) (Фиг. 11). Процедура включает амплификацию последовательности выбранных генов с последующей гибридизацией маркированных фрагментов с олигонуклеотидами, иммобилизованными в гелиевые ячейки биочипа.
Степень ингибирования ферментативной активности определена проведением симметричной ПЦР при использовании стандартного протокола, в котором используемые праймеры применялись в равном количестве. Для определения образования и размера ПЦР продуктов генов FGB, F7, GPIIIa, PAI-1, MTHFR использован агарозный гель электрофорез. Как видно из Фиг. 12, продукты ПЦР FGB гена расположены между полосами 242 bp и 100 bp маркера pUC19/MspI. Амплификация при использовании только нативных нуклеотидов (полоса 9) и в присутствии модифицированных субстратов (полосы 1-8) привела к образованию полноразмерного продукта. Электрофореграммы ПЦР продуктов, проявленные при помощи этидий бромида и при регистрации сигнала флуоресценции красителя были одинаковыми для генов F7, GPIIIa, PAI-1 and MTHFR.
Гибридизация на биологическом микрочипе проведена после двух-раундной мультиплексной ПЦР с образованием одноцепочечных флуоресцентно-меченых фрагментов ДНК. Результаты гибридизации продемонстрированы на Фиг. 11.2 верхних ячейки (перфект матч) и две нижних (мисматч) продублированы. Флуоресцентный сигнал продублированных ячеек был усреднен и нормализован.
Эффективность встраивания модифицированных нуклеотидов в ПЦР определена измерением флуоресценции перфектных дуплексов для каждой анализируемой олигонуклеотидной пробы. Полученные данные скорректированы относительно сигнала фона и нормированы на значение Cy5-dUTP (Фиг. 13). Обнаружено, что эффективность встраивания модифицированных нуклеотидов в ПЦР аналогична в обеих тест-системах («ТБ-биочип» и «ПФ-биочип Тромбо»). Флуоресцентный с