Способ получения n-алкил-о-арилкарбаматов
Иллюстрации
Показать всеИзобретение относится к способу получения N-алкил-О-арилкарбаматов общей формулы I, где R означает арильные группы, a R1 - алкильные группы нормального или разветвленного строения с числом атомов углерода от 1 до 4. Способ заключается в том, что осуществляют взаимодействие фенолов с диалкилмочевиной общей формулы II при температуре 130-180°C при барботировании через реакционную массу хлористого водорода, являющегося одновременно катализатором процесса и акцептором выделяющегося алкиламина. Предлагаемый способ является экологически безопасным и при этом позволяет сохранить удовлетворительный выход и чистоту получаемого продукта. 3 пр.
Реферат
Изобретение относится к химии эфиров N-замещенных карбаминовых кислот, а именно к N-алкил-О-арилкарбаматам общей формулы I:
где R означают арильные группы, a R1 - алкильные группы нормального или разветвленного строения с числом атомов углерода от 1 до 4.
Изобретение относится к способам получения соединений общей формулы I.
Эфиры N-алкилкарбаминовых кислот обладают широким спектром биологической активности, используются в качестве средств защиты растений [Мельников Н.Н. Химия, технология и применение пестицидов. – М.: Химия, 1987. - С. 752] и в составе различных лекарственных препаратов [Машковский М.Д. Лекарственные средства в 2-х томах – М.: Медицина, 1993; Бертрам Г. Катцунг. Базисная и клиническая фармакология в 2-х томах - М.: Бином, 1998].
Представитель соединений заявленной формулы I α-нафтил-N-метилкарбамат (севин) является эффективным инсектицидом, применяемым как для борьбы с вредителями сельскохозяйственных культур, так и для уничтожения насекомых-паразитов.
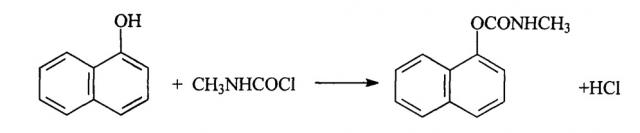
Известен способ получения α-нафтил-N-метилкарбамата путем фосгенирования альфа-нафтола в среде какого-либо нейтрального органического растворителя, например толуола или дихлорэтана, в присутствии водного раствора едкого натра [Пат. 1117598 (ФРГ). Verfahren zur gegebenenfalls kontinuerlichen Herstellung von Chlorameisensaure-arylestern. // C. A. - 1961. - v.57. - p.11106; Пат. 36946 (ГДР). РЖХ. 1967. 14Н534]. Этот способ был доработан путем использования гидроксида натрия или третичных аминов для связывания хлористого водорода, выделяющегося в процессе фосгенирования [Авт. Свид. 17387 (СССР). РЖХ. 1966. 18Н490].
Известен также способ получения севина исходя из карбамоилхлорида по следующей схеме:
Реакция может проводиться в широком интервале температур, в различных растворителях с выходом 82-90% [Пат. 1344934. (Франция). Preparation d'esters carbamiques. Опубл. 13.11.62]. Использование различных катализаторов: тетрахлорида олова, сульфата магния, ацетата натрия позволяет увеличить выход продукта до 95-98% [А.С. 186438 (СССР). Опубл. 1966; Пат. US 4095034 Manufacture of alpha-naphthyl-N-methyl-carbamate, Опубл. 13.06.1978].
Недостатком данного способа является существенное снижение качества целевого продукта и сложность технологического процесса.
Известен способ получения α-нафтил-N-метилкарбамата путем амминолиза динафтилкарбоната [ЕР 0029460 B1, Procede de preparation d'urethannes aromatiques. Опубл. 1982, МПК С07С 239/00].
В некоторых патентах имеются сведения о синтезе α-нафтил-N-метилкарбамата по реакции метилового эфира N-метилкарбаминовой кислоты с α-нафтолом [Заявка 2276294 (Франция). Опубл. 1976]. Реакцию проводят при температуре 160°С и давлении 160 мм рт.ст. в присутствии кислот Льюиса.
Основным недостатком данного способа является низкий выход реакции, составляющий всего 28%.
Наиболее близким по достигаемому результату способом синтеза заявленных О-арилкарбаматов является основной способ синтеза О-арилкарбаматов, реализуемый в промышленности, заключающийся в обработке фенола алкиллизоцианатом [Пат. US 3426064 PREPARATION OF ALPHA-NAPHTHYL ALKYL-CARBAMATES, Опубл. 4.02.1969]. Главным преимуществом данного способа является высокое качество получаемого продукта наряду с количественным выходом.
К недостаткам способа относится проблема хранения и транспортировки алкилизоцианата, большое количество побочных продуктов при производстве алкиллизоцианата, необходимость использования фосгена для его получения. Поэтому представляют интерес другие варианты получения О-арил-N-алкилкарбаматов общей формулы I.
Задачей данного изобретения является разработка удобного экологически безопасного (бесфосгенного) способа синтеза О-арилкарбаматов при сохранении удовлетворительного выхода и чистоты получаемого продукта.
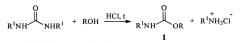
Поставленная задача решается способом получения соединений общей формулы I, где R означают арильные группы, a R1 алкильные группы нормального или разветвленного строения с числом атомов углерода от 1 до 4, заключающемся в том, что осуществляют взаимодействие фенолов с диалкилмочевинами общей формулы II при температуре 130-180°С при барботировании через реакционную массу хлористого водорода, являющегося одновременно катализатором процесса и акцептором выделяющегося алкиламина.
Отличие данного способа от известного заключается в алкоголизе фенолом вместо алкилизоцианатов более доступных и безопасных диалкилмочевин при одновременном барботировании через реакционную массу хлористого водорода, играющего роль катализатора процесса и акцептора выделяющегося в ходе реакции алкиламина.
Новый способ синтеза N-алкил-О-арилкарбаматов заключается в проведении процесса взаимодействия симметричных диалкилмочевин с фенолами при мольном соотношении реагентов (1÷3): 1, соответственно, в среде ароматических углеводородов или галогензамещенных ароматических углеводородов при температуре 130-180°С и барботировании через реакционную массу хлористого водорода:
В приведенной схеме R обозначает арильные группы, R1 - алкильные группы нормального и разветвленного строения с количеством атомов углерода от 1 до 4. Целевой продукт отделяется от фенола промывкой реакционной массы раствором щелочи. Выход N-алкил-О-арилкарбаматов общей формулы I по данному способу составляет 20-40%. В результате удается получить чистый карбамат, не содержащий примеси исходных реагентов и побочных продуктов.
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. О-α-Нафтил-N-метилкарбамат
В трехгорлую колбу, снабженную обратным холодильником, термометром и барботером загружают 0,44 г (0,005 моль) N-N'-диметилмочевины, 0,72 г (0,005 моль) α-нафтола и 25 мл о-дихлорбензола. Смесь нагревают при интенсивном перемешивании и барботировании хлористого водорода до температуры 180°С. В ходе процесса реакционная масса изменяет окраску с красного на желтый и выпадает осадок гидрохлорида метиламина. Продолжительность реакции 1,5 часа. По окончании процесса реакционную массу охлаждают и промывают в делительной воронке последовательно 50 мл 2% раствора гидроксида натрия и 20 мл воды. Органическую фазу отделяют и сушат над сульфатом магния, при этом выпадает оставшийся фенолят натрия. Реакционную массу отфильтровывают от осадка и отгоняют растворитель при пониженном давлении. В колбу с осадком и частью не отогнанного о-дихлорбензола приливают 20 мл гексана. Осадок отфильтровывают и высушивают. Выход α-нафтил-N-метилкарбамата 0,375 г (38%). Температура плавления 139-140°С.
Пример 2. О-м-Толлил-N-метилкарбамат
В трехгорлую колбу, снабженную обратным холодильником, термометром и барботером загружают 1,32 г (0,015 моль) N-N'-диметилмочевины, 0,54 г (0,005 моль) м-метилфенола и 25 мл о-дихлорбензола. Смесь нагревают при интенсивном перемешивании и барботировании хлористого водорода до температуры 175°С. Продолжительность реакции 1,5 часа. По окончании реакции реакционную массу охлаждают и промывают в делительной воронке последовательно 50 мл 2% раствора гидроксида натрия и 20 мл воды. Органическую фазу отделяют и сушат над сульфатом магния. Реакционную массу отфильтровывают от осадка и отгоняют растворитель при пониженном давлении. О-Дихлорбензол отгоняется при температуре 63-65°С (40 мм рт.ст.). В колбу с осадком и частью не отогнанного о-дихлорбензола приливают 20 мл гексана. Осадок отфильтровывают и высушивают. Выход О-м-толлил-N-метилкарбамат 0,33 г (40%). Температура плавления 76-77°С. ЯМР 1Н спектр (δ, м.д.; J, Гц) (400 МГц в CDCl3): 2.34 (3Н; s; CH3-(Ph)); 2.89 (3Н; s; СН3-N); 4.94 (1Н; s; -NH-; 6.92 (1H; d; Н6arom); 6.94 (1H; d; H2arom); 7.00 (1H, d, H4arom); 7.22 (1H, t, H5-arom).
Пример 3. О-Фенил-N-бутилкарбамат
В трехгорлую колбу, снабженную обратным холодильником, термометром и барботером, загружают 2,58 г (0,015 моль) N-N'-дибутилмочевины, 0,47 г (0,005 моль) фенола и 25 мл п-ксилола. Смесь нагревают при интенсивном перемешивании и барботировании хлористого водорода до температуры 130°С. Процесс продолжают в течение 3 часов. По окончании реакции реакционную массу охлаждают и промывают в делительной воронке последовательно 50 мл 2% раствора гидроксида натрия и 20 мл воды. Органическую фазу отделяют и сушат над сульфатом магния. Реакционную массу отфильтровывают от осадка и отгоняют растворитель при пониженном давлении. В колбу с осадком и частью не отогнанного п-ксилола приливают 20 мл гексана. Осадок отфильтровывают и высушивают. Выход Фенил-N-бутилкарбамата 0,33 г (23%). Температура плавления 39-40°С. ЯМР 1Н спектр (δ, м.д.; J, Гц) (400 МГц в CDCl3): 0.96 (3Н, t, 7 Гц, СН2СН2СН3), 1.35 (2Н, sextet, 7 Гц, СН2СН2СН3), 1.56 (2Н, quintet, 7 Гц, СН2СН2СН3), 3.27 (2Н, q, 7 Гц, NHCH2), 4.99 (1Н, br s, NH), 7.12-7.37 (4Н, m, aromatic Н).
Таким образом, разработан экологически чистый (бесфосгенный) способ синтеза N-алкил-О-арилкарбаматов общей формулы I алкоголизом симметричных диалкилмочевин в присутствии хлористого водорода с выходом 20-40%.
Способ получения N-алкил-О-арилкарбаматов общей формулы I:
,
где R означает арильные группы, a R1 - алкильные группы нормального или разветвленного строения с числом атомов углерода от 1 до 4, заключающийся в том, что осуществляют взаимодействие фенолов с диалкилмочевиной общей формулы II при температуре 130-180°C при барботировании через реакционную массу хлористого водорода, являющегося одновременно катализатором процесса и акцептором выделяющегося алкиламина.