Светочувствительный химерный белок gpcr
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению светочувствительного химерного белка, способного включать световой сигнал в сигнальный каскад метаботропного глутаматного рецептора 6 (mGluR6), который является природным компонентом клеточной мембраны ON-биполярных клеток во внутреннем слое сетчатки, что может быть использовано в медицине. Получают химерный белок GPCR, содержащий домены по меньшей мере двух членов белкового суперсемейства рецепторов, сопряженных с G-белками (GPCR), нуклеиновую кислоту, кодирующую указанный белок, вектор экспрессии, включающий указанную нуклеиновую кислоту, а также трансгенную клеточную линию, содержащую генетическую информацию, кодирующую химерный белок GPCR. Изобретение позволяет осуществлять эффективную медикаментозную терапию и получать эффективное лекарственное средство для улучшения зрения, в частности для лечения потери зрения в результате дегенерации фоторецепторов сетчатки. 10 н. и 22 з.п. ф-лы, 6 ил., 1 табл., 1 пр.
Реферат
Область техники
Изобретение относится к области медицинских препаратов и медикаментозной терапии для лечения пациентов, которыми являются люди и животные, страдающие от потери зрения, и относится к способам лечения и получения лекарственных средств для улучшения зрения, в частности для лечения потери зрения в результате дегенерации фоторецепторов сетчатки с применением светочувствительного химерного белка GPCR (G-protein-coupled receptor, рецептор, сопряженный с G-белком).
Предшествующий уровень техники
Основные причины дегенерации фоторецепторов сетчатки включают пигментный ретинит (RP, retinitis pigmentosa), возрастную макулярную дегенерацию (ВМД), диабетическую ретинопатию и другие заболевания. Около одного из трех тысяч или трех миллионов человек по всему миру страдают пигментным ретинитом, генетическим заболеванием, которое приводит к дегенерации фоторецепторов и в конечном итоге, к слепоте. Скорость и степень тяжести дегенерации фоторецепторов варьирует и сильно зависит от конкретной мутации. Может быть затронуто более пятидесяти генов (Hartong et al. Lancet 368:1795-1809; 2006). На сегодняшний день доступно немного вариантов лечения пациентов с пигментным ретинитом. Продолжающиеся исследования, сфокусированные на нейропротекторах (например, ЦНТФ, цилиарный нейротрофный фактор), или дополнительная генная терапия (введение «немутантного» гена), которые направлены на то, чтобы исправить приобретенные или наследуемые мутантные генотипы до состояния нормально функционирующих генов, до сих пор демонстрировали только незначительный успех. Учитывая, что сетчатка взрослого организма не способна генерировать новые фоторецепторы после потери фоторецепторов, дополнительная генная терапия является полезной только до тех пор, пока потеря фоторецепторов невелика, и главным образом замедляет или стабилизирует прежнее состояние.
Альтернативным подходом, применяемым в последних экспериментальных исследованиях, является обеспечение светочувствительности оставшихся фоторецепторов или выживших внутренних нейронов сетчатки путем трансгенной экспрессии светочувствительного белка.
В US 2009/0088399 и US 2010/0015095 предлагается вводить светочувствительный ионный канал водоросли ченнелродопсин-2 (ChR2, channelrhodopsin-2) во внутренний слой сетчатки пациентам, страдающим дегенерацией фоторецепторных клеток. Это поддерживает естественные светочувствительные клетки внутреннего слоя сетчатки, такие как биполярные или амакриновые клетки, светочувствительными и способными детектировать зрительную информацию, которая затем передается в мозг, без получения поступающей информации от фоторецепторов.
Аналогичным образом, в US 2005/0208022 и US 2009/0208462 предлагается вводить фоторецепторный белок, такой как опсин (в том числе меланопсин) или цитохромы, в нейроны внутреннего слоя сетчатки, включая амакриновые, горизонтальные и биполярные клетки пациентов, страдающих дегенерацией фоторецепторов.
Способ трансгенной экспрессии ChR2 в нейронах внутреннего слоя сетчатки открывает широкие перспективы и в настоящее время испытан на приматах (Fradot M et al. Human Gene Therapy 22(5), 587-593; 2011) и выделенных сетчатках человека (Ivanova E et al. Opthalmol Vis Sci 51(10), 5288-5296, 2010), что дает надежду на клинические испытания в ближайшем будущем.
В последние годы генно-заместительная терапия сетчатки с применением рекомбинантного аденоассоциированного вируса (rAAV, recombinant Adeno-associated virus) оказалась успешной и достигла финальной фазы клинических испытаний. В частности, Бэйнбридж (Bainbridge) с коллегами применяли рекомбинантный аденоассоциированный вирус для того, чтобы заместить ген, кодирующий дефектный пигментный эпителий-специфический белок сетчатки с молекулярной массой 65 кДа (RPE65, retinal pigment epithelium-specific 65-kDa). Дефицит белка RPE65 приводит к тому, что фоторецепторы становятся неспособными реагировать на свет, так как данный белок необходим для рециркуляции хромофора, т.е. превращение полностью-транс-ретиналя в 11-цис-ретиналь (Bainbridge JWB et al., N Engl J Med 358(21), 2231-2239:2008). Генная терапия, таким образом, является перспективным терапевтическим подходом коррекции зрительных нарушений путем введения соответствующих генов в нейроны сетчатки.
Доступные в настоящее время фотоактивируемые белки, которые возможно применять в генной терапии для компенсации потери фоторецепторных клеток, однако, все еще имеют ряд существенных недостатков: 1) Искусственная экспрессия чужеродных белков беспозвоночных или водорослей, например ChR2, может вызвать непредсказуемые иммунные реакции у пациентов. 2) ChR2 имеет относительно высокую проницаемость для кальция, который может быть токсичным в течение длительного периода. 3) Ответ на ChR2 является изначально слабым при естественной интенсивности света, так как каждый захваченный фотон может активировать только один белок. 4) Хотя меланопсин способен усиливать световые сигналы путем управления активностью высокоэнергетических ферментативных реакций, данные ферментативные партнеры не доступны в достаточной степени в нейронах сетчатки. Таким образом, экспрессия меланопсина в ганглионарных клетках и ON-биполярных клетках не вызывает усиления светового сигнала, достаточного для восстановления функционального зрения при естественной интенсивности освещения. 5) Кроме того, регуляторные механизмы, которые естественным образом контролируют активность белков путем изменений в обмене и модуляции белка, отсутствуют при экспрессии чужеродных белков.
Целью настоящего изобретения является получение светочувствительного химерного белка, который при экспрессии в нейронах внутреннего слоя сетчатки преодолевает данные недостатки. То есть, целью настоящего изобретения является обеспечение усовершенствованного светочувствительного белка для улучшения и восстановления зрения, в частности у пациентов с дегенерацией фоторецепторов сетчатки. Данный химерный белок будет улучшать или восстанавливать светочувствительность в большей степени по сравнению со светочувствительностью, которую возможно получить с применением белков, предлагаемых в предшествующем уровне техники. Дополнительные цели изобретения включают генетическую информацию, кодирующую химерный светочувствительный белок, и способы экспрессии данного химерного белка в живых клетках и организмах. Также дополнительные цели настоящего изобретения включают экспрессию генетической информации, кодирующей химерный светочувствительный белок в клетках внутреннего слоя сетчатки in vivo, для терапевтического лечения, и биомедицинские продукты, включающие светочувствительный белок или генетическую информацию, кодирующую химерный белок.
Краткое описание изобретения
Данная техническая задача решается с помощью светочувствительного химерного белка, содержащего домены, по меньшей мере, двух членов белкового суперсемейства рецепторов, сопряженных с G-белками (GPCR), которые слиты для получения светочувствительного химерного GPCR, способного включать световой сигнал в сигнальный каскад метаботропного глутаматного рецептора 6 (mGluR6).
Члены белкового суперсемейства рецепторов, сопряженных с G-белками (GPCR), представляют собой трансмембранные белковые рецепторы, передающие сигналы от поверхности клетки к внутриклеточным эффекторам. Они имеют структуру, как правило, включающую семь трансмембранных доменов (по ТМ1 по ТМ7), три внеклеточные петли (с EL1 по EL3), три внутриклеточные петли (с IL1 по IL3), внеклеточный N-концевой домен (NT) и внутриклеточный C-концевой домен (СТ). Суперсемейство белков GPCR включает светочувствительные рецепторные белки, имеющие название фотопигменты, такие как опсины, например, родопсин и меланопсин. Суперсемейство GPCR также включает метаботропные рецепторы, управляемые лигандами, например mGluR6. Метаботропные рецепторы, ассоциированные с G-белками, опосредованно связаны с ионными каналами в мембране через каскад сигнальной трансдукции, опосредованный специфическими G-белками, осуществляющими усиление сигнала. То есть, активированные G-белки регулируют активность ферментов, например, аденилатциклазы, которые быстро производят большие количества продукта, например цАМФ, который в свою очередь может активировать большое количество ионных каналов в клеточной мембране. В отличие от данных метаботропных GPCR, ионотропные рецепторы напрямую связаны с ионными каналами в мембране. Таким образом, ионотропные рецепторы, такие как ченнелродопсин, не способны усиливать сигнал подобно метаботропным рецепторам.
Один из аспектов изобретения относится к химерному белку GPCR, содержащему домены, которые получены из, по меньшей мере, двух членов семейства GPCR.
Первый из, по меньшей мере, двух членов семейства GPCR является для химерного светочувствительного белка GPCR источником доменов, опосредующих светочувствительность. Данный первый член относится к семейству светочувствительных GPCR, также имеющих название фотопигменты, и в некоторых воплощениях данным светочувствительным белком GPCR является меланопсин, в частности, меланопсин человека.
Второй из, по меньшей мере, двух членов семейства GPCR, а именно mGluR6, является источником доменов, осуществляющих включение светового сигнала во внутриклеточный сигнальный каскад mGluR6.
mGluR6 является естественным компонентом клеточной мембраны on-биполярных клеток внутреннего слоя сетчатки. Для терапевтических аспектов настоящего изобретения данные ON-биполярные клетки являются клетками-мишенями, в которых будет экспрессирован светочувствительный химерный белок GPCR. Физиологически, нативный mGluR6 ON-биполярных клеток активирует свой внутриклеточный сигнальный каскад после внеклеточного связывания глутамата. Таким образом, ON-биполярные клетки в естественном состоянии содержат специфические внутриклеточные компоненты, опосредующие сигнальный каскад mGluR6.
При физиологическом пути трансдукции светового сигнала фотоактивируемые здоровые фоторецепторные клетки палочки и колбочки реагируют на снижение интенсивности света увеличением уровня глутамата, который высвобождается из их синаптических окончаний, который затем связывается с mGluR6 на ON-биполярных клетках, которые, в свою очередь, вызывают усиление светового сигнала через специфический внутриклеточный сигнальный каскад, ассоциированный с G-белком. По аналогии с данным естественным путем, химерный светочувствительный белок GPCR, который экспрессирован в ON-биполярных клетках слепых сетчаток, передает световой сигнал на все еще существующий (Krizaj D et al., Vision Res. 50:2460-65, 2010) внутриклеточный сигнальный каскад рецептора mGluR6, при фотоактивации.
Примечательно, что ON-биполярные клетки с дополнительным химерным светочувствительным белком GPCR непосредственно воспринимают световой сигнал данным химерным светочувствительным белком GPCR, обходя опосредованный сигнал глутамата, который следует после световой стимуляции фоторецепторов. Таким образом, химерный светочувствительный белок GPCR способен непосредственно включать фотоактивацию в сигнальный каскад mGluR6. Другими словами, фотоактивация не зависит ни от одного типа фоторецепторных клеток: палочек или колбочек. Кроме того, физиологическое усиление сигнала, вызываемого одним фотоном, сохраняется через сигнальный каскад mGluR6.
Термин "домен" в контексте данной патентной заявки относится к внутриклеточным и внеклеточным петлям, N- и С-концам, а также трансмембранным районам члена семейства белков GPCR. Термин "домен, полученный из", например, домен, полученный из mGluR6, или домен, полученный из опсина, включает какой-либо домен, у которого соответствующая физиологически значимая часть имеет идентичную аминокислотную последовательность или подобную аминокислотную последовательность с аминокислотной последовательностью данного домена у физиологического аналога, являющегося членом семейства GPCR. В целом подобные аминокислотные последовательности или подобные домены демонстрируют гомологию, по меньшей мере, 60%, предпочтительно, гомологию, по меньшей мере, 80%, и наиболее предпочтительно, гомологию по меньшей мере 90%. Подобные домены также в частности включают домены, содержащие значимые консервативные аминокислоты, не зависимо от отклонения или отсутствия оставшейся части последовательности в нативном аналоге, а также от наличия дополнительных последовательностей, которые не присутствуют в нативном члене семейства GPCR, в химерном белке.
В некоторых воплощениях химерный белок включает внеклеточный фотоактивируемый домен, полученный из бистабильного фотопигмента, такого как, например, меланопсин, но не родопсин. Преимуществом бистабильных пигментов является то, что они регенерируют после обесцвечивания путем восстановления светом, а не внешними клеточными ферментами. Скорость восстановления очень высока и будет поддерживать высокую светочувствительность даже при высокой интенсивности освещении. Для бистабильных фотопигментов обесцвечивание под воздействием света и восстановление обесцвечивания в равной степени усиливаются при высокой интенсивности освещения, в то время как родопсин, который не является бистабильным, теряет свою светочувствительность во время облучения светом, так как все больше и больше родопсина обесцвечивается. Под воздействием света обесцвечивание фотопигментов, не являющихся бистабильными, таких как родопсин, может привести в худшем случае к краткосрочной потере зрения. Скорость восстановления может быть даже медленнее, если фотопигмент, не являющийся бистабильным, такой как родопсин, экспрессирован в чужеродном типе клеток, так как восстанавливающие ферменты не обязательно являются доступными в непосредственной близости. В здоровой сетчатке данные ферменты находятся в пигментном эпителии сетчатки.
Соответственно выбор доменов первого члена химерного GPCR, сделанный в пользу доменов, полученных из бистабильного фотопигмента, обеспечивает восстановление химерного GPCR после обесцвечивания под воздействием света вне зависимости от наличия ферментов, восстанавливающих обесцвечивание. В некоторых воплощениях фотоактивируемый домен бистабильного рецепторного белка выбран из семейства опсинов, наиболее предпочтительным является меланопсин, и в случае испытания на людях, применяют меланопсин человека во избежание иммунной реакции.
В некоторых воплощениях химерного белка GPCR первый член GPCR является, по меньшей мере, источником домена, содержащего аминокислотные остатки, образующие основание Шиффа (ковалентно связывающее хромофор с GPCR), которые в случае меланопсина представляют собой тирозин149 (Y149) в ТМ3 и лизин321 (K321) в ТМ7, или всех доменов, полученных из доменов, которые образуют хромофор-связывающий карман в физиологическом аналоге. Хромофор-связывающий карман относится к сайту связывания светочувствительного пигмента, который поглощает фотон, такой как, например, 11-цис-ретиналь в меланопсине (Hermann et al., Neuroscience letters, Vol.376 p76-80, 2004).
В некоторых воплощениях химерный белок GPCR включает все внеклеточные домены первого члена GPCR, представляющие собой N-конец и три внеклеточные петли (EL1, EL2, EL3) и дополнительно все семь трансмембранных доменов (ТМ1 - ТМ7) из первого члена GPCR.
В любом из данных воплощений, по меньшей мере, один из внутриклеточных доменов химерного белка GPCR, т.е., по меньшей мере, одна из внутриклеточных петель IL1, IL2, IL3 и/или С-конец получены из второго GPCR, которым является mGluR6. В некоторых воплощениях изобретения, по меньшей мере, один внутриклеточный домен, полученный из mGluR6, представляет собой IL3, или IL3 и дополнительно, по меньшей мере, один другой внутриклеточный домен, например, IL3 и IL2, или IL3 и IL2 и С-конец, или другие комбинации.
Функциональные химерные белки GPCR по изобретению являются светочувствительными и способными включать фотоактивацию в сигнальный каскад mGluR6. В зависимости от того, какой фотопигмент выбран в качестве первого члена GPCR для химерного белка, используют либо некоторые, либо все внеклеточные домены данного белка. Доменами, которые требуются для формирования хромофорного кармана, необходимого для того, чтобы сделать химерный белок фотоактивируемым, являются, например, с ТМ3 по ТМ7 в меланопсине и с ТМ2 по ТМ7 в ченнелродопсине.
Домены, необходимые для включения фотоактивации в сигнальный каскад mGluR6, должны иметь способность связывать G-белок, специфичный для сигнального пути mGluR6, Galpha(o). IL3 представляется особенно важным для специфического связывания с G-белком сигнального каскада GPCR. Как правило, другие внутриклеточные петли и С-конец повышают специфичность связывания с G-белком в воплощениях изобретения, где все или некоторые из IL1 и IL2 и C-концевого домена не получены из mGluR6.
В некоторых воплощения изобретения химерный белок GPCR включает домены, которые получены из другого бистабильного белка GPCR (или химеры опсина, основанные на бистабильном GPCR), который не является ни первым, ни вторым членом.
Для минимизации потенциальных иммуногенных реакций и для оптимизации физиологического связывания с mGluR6, в некоторых воплощениях изобретения, предназначенных для применения в медикаментозной терапии у людей, светочувствительные домены получают из GPCR человека, таких как меланопсин человека, родопсин человека, конопсин человека, но также и химерных опсинов человека.
Светочувствительный химерный белок GPCR сконструирован путем слияния генетической информации, кодирующей домены членов семейства GPCR с необходимыми функциональными свойствами: светочувствительностью и включение фотоактивации в сигнальный каскад mGluR6, в соответствии со способами, известными в данной области техники. Идентификация необходимых доменов и определение подходящих сайтов разрезания и лигирования на N- и С-терминальных концах каждого конкретного домена основывались в первую очередь на: 1) выравнивании последовательностей генов/консервативных остатков и 2) компьютерном моделировании вторичной и третичной структуры светочувствительного члена семейства GPCR и mGluR6, с применением стандартного программного обеспечения, доступного в данной области техники. Данный подход имеет свойственную вариабельность в точном определении длины конкретных доменов, и данная вариабельность включена в объем настоящего изобретения, когда речь идет о доменах. Кроме того, в конкретных сайтах слияния между доменами, как правило, существует несколько возможностей сплайсинга доменов с получением функционального белка. И, очевидно, удаление частей аминокислотной последовательности, не влияющих на функцию, консервативные замены аминокислот, например, замены гидрофобных аминокислот на гидрофобные или гидрофильных на гидрофильные, а также нуклеотидные замены, также входят в объем настоящего изобретения. Соответственно, значительное число вариантов последовательностей, в частности, в районах сайтов слияния смежных доменов химерных белков GPCR, входят в объем настоящего изобретения, при условии, что они обеспечивают функциональные химерные белки GPCR. В тех вариантах осуществления изобретения, в которых все трансмембранные и внеклеточные домены получены из первого члена GPCR, и, по меньшей мере, один или все внутриклеточные домены замещены соответствующими доменами, полученными из mGluR6, все возможные сайты разрезания и лигирования для замены IL1, IL2, IL3 и С-конца входят в объем настоящего изобретения.
Дополнительный аспект изобретения относится к генетической информации фотоактивируемого химерного белка GPCR, способного включать фотоактивацию в сигнальный каскад mGluR6, векторам, в том числе вирусным векторам, таким как rAAVs, включающим данную генетическую информацию, трансгенным животным, таким как мыши и данио-рерио, включающим данную генетическую информацию, а также клеточным культурам клеток, содержащих данную генетическую информацию или экспрессирующим фотоактивируемый химерных белок GPCR, способный включать фотоактивацию в сигнальный каскад mGluR6, включая, в частности, нейрональные клеточные линии, нейрональные клеточные линии внутреннего слоя сетчатки и биполярные клеточные линии, в частности, линии ON-биполярных клеток.
Дополнительный аспект изобретения относится к способам введения генетической информации для экспрессии фотоактивируемого химерного белка GPCR, способного включать фотоактивацию в сигнальный каскад mGluR6, в глаз, предпочтительно в ON-биполярные клетки. Еще один аспект изобретения относится к способам введения генетической информации для экспрессии фотоактивируемого химерного белка GPCR, способного включать фотоактивацию в сигнальный каскад mGluR6, в клетки клеточных линий, в частности нейрональных клеточных линий, включая клеточные линии сетчатки, клеточные линии внутреннего слоя сетчатки и клеточные линии биполярных клеток.
Дополнительный аспект изобретения относится к способам введения генетической информации для экспрессии фотоактивируемого химерного белка GPCR, способного включать фотоактивацию в сигнальный каскад mGluR6, в глаз, в частности, в витреальную полость или субретинальное пространство для направленного действия на клетки сетчатки, в том числе ON-биполярные клетки, а также на клетки фоторецепторов - палочки и колбочки, для улучшения зрения при медикаментозной терапии. Данные методы генной терапии включают электропорацию, вирусную трансдукцию и химическую трансфекцию, но не ограничиваются ими. Данная медикаментозная терапия включает, в частности, лечение частичной или полной потери зрения, например, пигментный ретинит, макулярную дегенерацию (ВМД) и другие формы дегенерации фоторецепторов.
Еще один аспект изобретения относится к фотоактивируемому химерному белку GPCR, способному включать фотоактивацию в сигнальный каскад mGluR6 или генетической информации, кодирующей указанный химерный белок, а также к композициям, содержащим указанный химерный белок или указанную генетическую информацию как таковые, или внутри векторов или клеток для целей медикаментозной терапии, в частности для улучшения зрения, для лечения частичной или полной потери зрения, например, пигментного ретинита, макулярной дегенерации (ВМД) и других форм дегенерации фоторецепторов.
С точки зрения физиологии, метаботропный глутаматный рецептор ON-биполярных клеток во внутреннем слое сетчатки активируется нейромедиатором глутаматом в ответ на активность фоторецепторных клеток сетчатки. При стимуляции фоторецепторов светом, концентрация глутамата, высвобождаемого на ON-биполярные клетки, меняется. Светочувствительный химерный белок GPCR является вариантом нативного белка mGluR6, который активируется светом напрямую, в то время как нативный mGluR6 опосредованно активируется глутаматом после стимуляции фоторецепторных клеток изменением освещенности. Таким образом, к пациентам, страдающим дегенерацией фоторецепторов возможно применять лечение путем экспрессии химерного фотоактивируемого белка, включающего внутриклеточные домены mGluR6, способного включать фотоактивацию в сигнальный каскад mGluR6 в ON-биполярных клетках.
В некоторых воплощениях светочувствительного химерного белка GPCR, по меньшей мере, один или все внутриклеточные компоненты меланопсина или другого бистабильного фотопигмента заменены на внутриклеточные компоненты mGluR6, что обеспечивает химерный белок, содержащий фоторецепторные домены меланопсина, который способен запускать существующие внутриклеточные сигнальные каскады mGluR6 в нейронах внутреннего слоя сетчатки, в частности в ON-биполярных клетках.
За счет искусственной экспрессии химерного фотоактивируемого белка mGluR6-меланопсина в ON-биполярных клетках, слабые световые сигналы усиливаются путем регуляции физиологических уже существующих быстрых ферментативных реакций, которые регулируются mGluR6. Кроме того, данные химерные белки позволяют избежать иммунных реакций, при применении внеклеточных доменов нативных фоторецепторных белков, таких как меланопсин человека, так как единственная часть, доступная для иммунной системы, будет идентична таковой у нативного меланопсина человека.
Преимуществом применения mGluR6 в качестве первого члена GPCR является то, что mGluR6 экспрессируется только в ON-биполярных клетках в сетчатке. Таким образом, трансгенно экспрессированный химерный mGluR6-меланопсин будет эффективно включаться в сигнальный каскад mGluR6 только в ON-биполярных клетках. Кроме того, деградация и регуляция активности химерного белка (например, связывание с аррестином) будет происходить через уже существующие пути mGluR6, обеспечивая полный самоконтроль активности белка.
Существует еще один конкретный эффект экспрессии химерного светочувствительного белка mGluR6-меланопсина в ON-биполярных клетках для восстановления зрения, который отличается от других способов восстановления зрения: зрительный контраст фактически будет инвертирован, темное будет ярким, а яркое будет темным. То есть, нейронные цепи, которые в естественных условиях активируются увеличением интенсивности света, будут активироваться уменьшением интенсивности света и наоборот. Это фактически может иметь ключевое преимущество над известным уровнем техники, как описано ниже:
Фоторецепторы высвобождают относительно высокие уровни своего нейромедиатора (глутамата) в темноте и меньшие количества нейромедиатора при увеличении яркости. ON-биполярные клетки получают входной сигнал через рецепторы mGluR6, которые гиперполяризуют биполярные клетки при активации (в темноте), и наоборот. Если отсутствуют фоторецепторы, отсутствует глутамат, ON-биполярные клетки деполяризованы и выжившие клетки внутреннего слоя сетчатки эффективны в адаптивном режиме "очень яркий свет". Фактически, очень медленная дегенерация ON-биполярных клеток может быть связана с данной длительной деполяризацей. Пациенты с пигментным ретинитом не осознают световой адаптации их сетчатки, так как выходной сигнал сетчатки указывает только на пространственные и временные изменения интенсивности света. То есть, если не обнаружены изменения интенсивности света, сетчатка не будет эффективно посылать сигнал в мозг, несмотря на то, что сетчатка находится в полностью адаптированном к свету состоянии.
Для улучшения зрения у пациентов с частичной или полной потерей фоторецепторных клеток, важно принять во внимание, что сетчатка находится в полностью адаптированном к свету состоянии. Это означает, что ON-биполярные клетки постоянно относительно деполяризованы. Ченнелродопсин-2, экспрессированный в ON-биполярных клетках, будет только дополнительно деполяризовывать данные клетки, и, таким образом, разница сигнала между состояниями "свет" и "темнота" будет относительно мала. Напротив, ON-биполярные клетки, экспрессирующие химерный светочувствительный белок mGluR6-GPCR согласно изобретению, гиперполяризуются под воздействием света. Очевидно, что это увеличивает разницу сигнала и, следовательно, усиливает выходной сигнал, и, соответственно, светочувствительность.
Краткое описание графических материалов
На Фиг.1 приведено схематическое изображение, показывающее домены и ориентацию в мембране клетки воплощения светочувствительного химерного белка GPCR с N-концом (NT), трансмембранными доменами (ТМ1 - ТМ7) и внеклеточными петлями 1-3 (EL1 - EL3) из меланопсина и внутриклеточными петлями 1 - 3 (IL1 - IL3) и С-концом (СТ) из mGluR6.
Фиг.2 относится к Примеру 1: Токовые ответы целых клеток линии HEK293(GIRK), трансфицированных т01иР6-меланопсином мыши (IL2(DRIY), IL3(I) иСТ из mGluR6, иллюстративное воплощение D с SEQ ID No. 7/8 - в настоящее время предпочтительная последовательность с максимальными токами, которые измеряли в клетках HEK293 (GIRK).
Фиг.3 относится к Примеру 1: Выходные токи К+
Фиг.4 относится к Примеру 2: Успешная и специфическая трансдукция mGluR6-меланопсином ON-биполярных клеток мыши с применением вектора rAAV2 с мутантным капсидом.
На Фиг.5 приведены световые ответы, зарегистрированные в ганглионарных клетках восьминедельной сетчатки rd1 (сетчатки без фоторецепторных клеток), один месяц после введения mGluR6-меланопсина в ON-биполярные клетки с применением вектора rAAV2.
На Фиг.6 приведено иммуномечение кроличьими антителами anti-Rab1A, которое показывает, что адаптированная к темноте сетчатка слепой мыши rd1 находится в адаптированном к свету деполяризованном состоянии.
Подробное описание некоторых воплощений
Идентификация необходимых доменов и определение подходящих сайтов разрезания и лигирования на N- и C-терминальных концах каждого конкретного домена основывались, в первую очередь, на: 1) выравнивании последовательностей генов/консервативных остатков и 2) компьютерном моделировании вторичной и третичной структуры светочувствительного члена семейства GPCR и mGluR6, с применением, например, такого программного обеспечения как CLC Protein Workbench, I-TASSER, MODELLER, QUARK или SWISS-Model (Kiefer F et al., Nucleic Acids Res 37, D387-D392, 2009).
В некоторых воплощениях светочувствительного химерного белка GPCR первым членом GPCR является меланопсин, в частности меланопсин человека, а вторым членом GPCR является mGluR6 человека или мыши. Для краткости данные воплощения химерного светочувствительного белка GPCR названы mGluR6-меланопсин.
Несколько вариантов конструирования светочувствительного mGluR6-меланопсина описаны ниже более подробно. Объем изобретения не ограничивается данными конкретными воплощениями. В некоторых воплощениях изобретения IL2, IL3 и СТ получают из mGluR6, в то время как остальную часть химерного белка получают из меланопсина. В некоторых других воплощениях изобретения все три внутриклеточные петли с IL1 по IL3 и СТ получают из mGluR6, а все трансмембранные и внеклеточные домены получают из меланопсина.
На Фиг.1 схематически показаны домены и ориентация в мембране клетки воплощения с N-концом (NT), трансмембранными доменами (ТМ1 - ТМ7) и внеклеточными петлями 1-3 (EL1 - EL3) из меланопсина и внутриклеточными петлями 1-3 (IL1 - IL3) и С-концом (СТ) из mGluR6. Семь сайтов сплайсинга отмечены буквами а - ж. В принципе, все возможные сайты разрезания и лигирования для замены внутриклеточных петель меланопсина на внутриклеточные петли mGluR6 находятся в пределах объема настоящего изобретения.
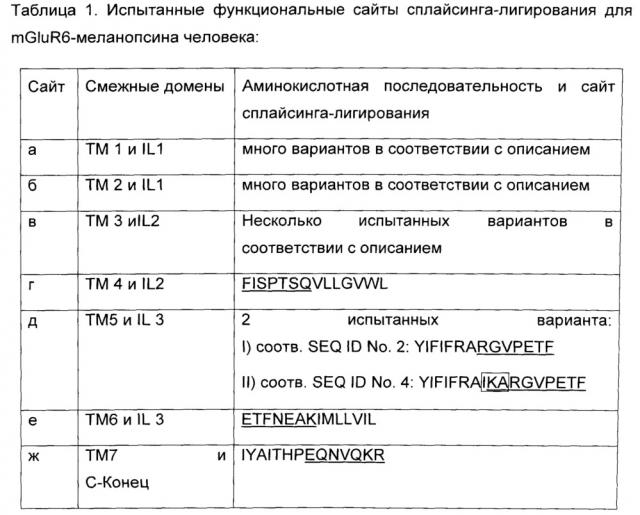
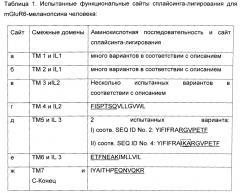
В Таблице 1 раскрыт ряд особо успешных сайтов сплайсинга для конструирования построения воплощений mGluR6-меланопсина, которые выбирали на основе выравнивания последовательностей и 3D-моделирования, для которых обнаружили наличие функциональной активности. Существуют различные комбинации альтернативных вариантов сплайсинга для конструирования функциональных химер mGluR6-меланопсина, и они находятся в пределах объема настоящего изобретения.
Для воплощений химерного mGluR6-меланопсина, где IL2, IL и C-концевой домены меланопсина заменены на соответствующие домены mGluR6, необходимы сплайсинг генов и лигирование между трансмембранными доменами и внутриклеточными петлями в сайтах, обозначенных от а до ж согласно Фиг.1. Сайты сплайсинга г, д, е, ж, обозначенные на Фиг.1, обеспечивают замены петель, которые являются функциональными по результатам испытания согласно способу Примера 1. Для сайта сплайсинга д два варианта сплайсинга являются функциональными по результатам испытания, они приведены в Таблице 1 как вариант I и II. В то время как сайты сплайсинга г, д, е, ж, согласно Таблице 1, являются в частности, рекомендуемыми, любой вариант сплайсинга, обеспечивающий светочувствительный mGluR6-меланопсин, способный включать фотоактивацию в сигнальный каскад mGluR6 находится в пределах объема настоящего изобретения.
Для сплайсинга и лигирования в сайте между ТМ 3 и IL 2 по результатам сравнения аминокислотных последовательностей меланопсина и mGluR6 существует несколько доступных вариантов. Любой вариант сплайсинга с обоснованной гомологией аминокислотной последовательности и 3D структурой находится в пределах объема настоящего изобретения. Представляется важным сохранение сайта DRY между ТМ3 и IL2, который является наиболее консервативной аминокислотной последовательностью в белках GPCR. Примечательно, что дополнительные функциональные варианты сайта DRY включают DRIY, NRIY или NRY. Все данные варианты обеспечивали функциональные химеры mGluR6-меланопсина в испытаниях согласно Примеру 1.
Для воплощений химерного mGluR6-меланопсина, где дополнительно IL1 меланопсина заменен на IL1 mGluR6, дополнительный сплайсинг гена и лигирование также требуются между трансмембранными доменами ТМ1 и ТМ2 и внутриклеточной петлей IL1 в сайтах, обозначенных а и б на Фиг.1. Гомология между последовательностями меланопсина и mGluR6 в отношении процента консервативных аминокислот, и, главным образом, в отношении предсказания 3D структуры, ниже в сайтах сплайсинга и лигирования а и б по сравнению с сайтами от в до ж, что расширяет выбор оптимальных сайтов сплайсинга и лигирования. Предварительные испытания с воплощениями, содержащими IL1, полученный из mGluR6, обеспечили функциональные химерные белки, и ожидается, что оптимальная замена IL1 будет усиливать специфическое связывания G-белка с химерным белком. Все данные варианты сайтов разрезания и лигирования для замены IL1 из меланопсина на IL1 из mGluR6 с учетом их консервативных аминокислотных последовательностей находятся в пределах объема настоящего изобретения.
Для нижеследующих иллюстративных воплощений химерного белка mGluR6-меланопсина А - Д полная последовательность ДНК гена и аминокислотные последовательности перечислены с указанием кодирующих последовательностей, соответствующих различным доменам, таким как внутриклеточные (IL) и внеклеточные (EL) петли, N-концевой и C-концевой домен (NT, СТ) и трансмембранный домен (ТМ).
А: воплощение mGluR6-меланопсина человека с IL2(DRIY), IL3 вариантом сплайсинга I и СТ, полученным из mGluR6
SEQ ID No. 1: последовательность ДНК
Последовательность ДНК, кодирующая химерный белок (с применением генов человека). Подчеркнутые области кодируют внутриклеточные домены mGluR6 (IL2, IL3 (вариант сплайсинга I) и СТ)
SEQ ID No. 2: аминокислотная последовательность
Химерная пептидная последовательность (с применением генов человека). Подчеркнутые области кодируют внутриклеточные домены mGluR6 (IL2 , IL3 (вариант сплайсинга I) и СТ). Аминокислоты, выделенные жирным шрифтом, формируют EL, а взятые в рамки остатки Y и К вовлечены в связывание хромофора.
Б: воплощение mGluR6-меланопсина человека с IL2(DRIY), IL3 вариантом сплайсинга II и СТ, полученным из mGluR6
SEQ ID No. 3: последовательность ДНК
Последовательность ДНК, кодирующая химерный белок (с применением генов человека). Подчеркнутые области кодируют внутриклеточные домены mGluR6 (IL2, IL3 (вариант сплайсинга II) и СТ)
SEQ ID No. 4: аминокислотная последовательность
Химерная пептидная последовательность (с применением генов человека). Подчеркнутые области кодируют внутриклеточные домены mGluR6 (IL2 , IL3 (вариант сплайсинга II) и СТ). Аминокислоты, выделенные жирным шрифтом, формируют EL, а взятые в рамки остатки Y и К вовлечены в связывание хромофора.
В: воплощение mGluR6-меланопсина человека с IL1, IL2(DRIY), IL3 вариантом сплайсинга I и СТ, полученным из mGluR6
SEQ ID No. 5: последовательность ДНК
Последовательность ДНК, кодирующая химерный белок (с применением генов человека). Подчеркнутые области кодируют внутриклеточные домены mGluR6 (IL1, IL2, IL3 (вариант сплайсинга I) и СТ)
SEQ ID No. 6: аминокислотная последовательность
Химерная пептидная последовательность (с применением генов человека). Подчеркнутые области кодируют внутриклеточные домены mGluR6 (IL1, IL2 , IL3 (вариант сплайсинга I) и СТ). Аминокислоты, выделенные жирным шрифтом, формируют EL, а взятые в рамки остатки Y и K вовлечены в связывание хромофора.
Г: mGluR6-меланопсин мыши (согласно воплощению А) с IL2(DRIY), IL3 вариантом сплайсинга I и СТ, полученным из mGluR6
SEQ ID No. 7: последовательность ДНК
Последовательность ДНК, кодирующая химерный белок (с применением генов мыши). Подчеркнутые области кодируют внутриклеточные домены m