Способ прогнозирования степени вероятности возможности выполнения оптимальной циторедуктивной операции у больных с диссеминированными формами рака яичников
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано для прогнозирования степени вероятности выполнения циторедуктивной операции в оптимальном объеме у больных диссеминированным раком яичников. Для этого определяют клинические параметры: стадию заболевания, объем асцитической жидкости, уровень сывороточных маркеров СА 125 и НЕ4, уровень инсулиноподобного фактора II типа (IGF-II) и металлопротеиназы РАРР-А в асцитической жидкости до лечения. Рассчитывают дискриминантные функции Y1, Y2. При значениях Y1>Y2 прогнозируют высокую, а при Y1<Y2 - низкую степень вероятности выполнения циторедуктивной операции в оптимальном объеме. Изобретение позволяет определить этапность хирургического и химиотерапевтического лечения у больных с диссеминированным раком яичников. 1 табл., 2 пр.
Реферат
Изобретение относится к области медицины, онкологии и может быть использовано для прогнозирования степени вероятности возможности выполнения оптимальной циторедуктивной операции у больных с диссеминированными формами рака яичников.
Злокачественные опухоли эпителиального происхождения составляют до 90% всех злокачественных новообразований яичника. Приблизительно 80-85% карцином яичника являются серозными (Kurman R.J., Carcanqiu M.L., et al., 2014). Ввиду крайне агрессивного течения РЯ III-IV стадия заболевания устанавливается у превалирующего большинства пациенток. Летальность на первом году с момента установления диагноза составляет 23,7% (Каприн А.Д., Старинский В.В., 2015). Даже при локализованных формах РЯ, после проведенного комбинированного лечения, 25-40% больных умирают в дальнейшем от рецидивов заболевания (Максимов С.Я., 2014).
Персонализированный подход в терапии рака яичника (РЯ) в настоящее время находится в стадии медленного накопления научных знаний, при этом РЯ рассматривается как гетерогенное заболевание. Обусловлено это отсутствием четких представлений о патогенезе заболевания.
Исследования последних лет позволили выделить несколько отличных друг от друга молекулярных подтипов серозных карцином яичников, отличающихся факторами риска, молекулярными нарушениями, клиническим течением и ответом на химиотерапию [Tothill RW, Tinker AV, et al 2008, Vang R., Shih L, et al., 2009]. По современным представлениям патогенез РЯ представляет собой сложный процесс, поскольку в нем задействовано большинство известных в настоящее время сигнальных путей, и это приводит к затруднению при выборе мишеней для воздействия.
В то же время, система прогнозирования при диссеминированном РЯ окончательно не разработана, также до сих пор дискутируется вопрос о последовательности химиотерапии и циторедуктивной операции. Клинические факторы не имеют большого прогностического значения при диссеминированном РЯ. Практически, лишь диаметр резидуальной опухоли, отражает выживаемость такой категории больных. С 1986 года оптимальной считается циторедуктивная операция с резидуальными очагами ≤1 см в наибольшем измерении, что увеличивает безрецидивную выживаемость с 17 до 39 месяцев (Hoskins W.J. et al., 1994). При отсутствии макроскопически определяемой опухоли после хирургического вмешательства говорят о полной циторедукции. Полная циторедукция - это наилучший вариант оптимальной циторедукции. Таким образом, поиск способов определения возможности выполнения циторедуктивной операции в оптимальном объеме является актуальным и, пока что, единственным, способствующим, исход из данных статистики, улучшить показатели эффективности лечения РЯ. В настоящее время, задача определения вероятности выполнения циторедуктивной операции в оптимальном объеме решается на основании клинических данных и данных компьютерной томографии, а зачастую, может быть окончательно решена лишь при интраоперационной ревизии.
Известно, что сывороточный маркер СА-125 используется для диагностики и мониторинга эффективности проводимого противоопухолевого лечения и дальнейшего динамического наблюдения, однако в полной мере его уровень не отражает операбельность процесса. Определенные перспективы в плане прогнозирования течения РЯ связаны с исследованием нового маркера НЕ4 (Richard G. Moore, D. et al. 2009, Drapkin R., von Horsten H.H. et al., 2005). Считается, что их совместное использование обладает большим прогностическим значением в отношении как безрецидивной, так и общей выживаемости, особенно в случае платинорезистентного течения РЯ (Steffensen K., et al., 2012).
Разработан ряд способов прогнозирования продолжительности жизни рецидива РЯ, эффективности неоадъювантной химиотерапии, однако способов прогнозирования выполнения оптимальной циторедуктивной операции нами не найдено.
Новичковым Е.В. предложен способ определения продолжительности жизни больных муцинозным РЯ (патент РФ №2354303, опубл. 10.05.2009). Автор предложил прогнозировать продолжительность жизни больных муцинозной карциномой яичника, оценивая ряд морфологических параметров опухоли. Продолжительность жизни в месяцах определял по формуле ПЖ(мес)=58,15-0,187*Х1-0,108*Х2+0,707*Х3-5,104*Х4, где Х1 - средняя площадь опухолевой клетки (мкм2) измерялась окуляром-микрометром или анализатором телевизионного изображения; X2 - средняя площадь сосудов опухолевой стромы (мкм2) подсчитывалась окуляром-микрометром или анализатором телевизионного изображения; Х3 - количество свободных клеток опухолевой стромы (n) подсчитывались на 10000 мкм2 площади стромы с использованием анализатора телевизионного изображения; Х4 - объемная доля некроза в опухолевом узле (%) измерялась при помощи морфометрических сеток или анализатором телевизионного изображения. Данный способ определения продолжительности жизни больных применим лишь при муцинозном варианте карциномы яичника, предполагает определение небольшого количества вычисляемых переменных, однако данные параметры не относятся к числу определяемых при проведении стандартного патоморфологического исследования.
Он же с соавторами в 2006 г. предлагал способ диагностики рецидива серозного РЯ после проведенного радикального лечения до его клинической манифестации (Патент РФ №2290078, опубл. 27.12.2006). Вероятность развития рецидива при данном способе определялась дихотомической переменной, вычисляемой по формуле, определяемой логистической регрессией, и включающей, помимо уже указанных выше параметров (морфологические параметры опухоли, а именно площадь опухолевой клетки, средняя плоидность ядер опухолевых клеток), уровнем экспрессии р53, уровнем экспрессии рецепторов эстрогена, уровнем экспрессии PCNA. Способ может быть использован в повседневной практике патологоанатомических отделений больниц при условии доступности иммуногистохимических методик определения экспрессии р53, рецепторов эстрогенов и PCNA.
В изобретении, предложенном группой исследователей НИИ онкологии им. проф. Н.Н. Петрова (Новик В.И., Геворкян В.А., Максимов С.Я., 2006) проводится цитологическое исследование асцитической жидкости до лечения, мазки окрашиваются по Фельгену и определяется плоидность опухоли (Прогностическая значимость плоидности опухолевых клеток у больных распространенным раком яичников. // Вопросы онкологии, т. 52, №1, 2006 г. С. 54-58). Показатели гинекологического статуса больной (репродуктивный период - 1, постменопаузальный - 2), наличия (1) или отсутствия (0) гидроторакса, размера остаточной опухоли до 2 см (1) или более 2 см (2) и плоидности опухоли (анеуплоидной - 1 или диплоидной - 2) используются для вычисления канонической линейной дискриминантной функции (КЛДФ) по формуле: КЛДФ=-4,35465 + код статуса ⋅ 1,28017 + код гидроторакса ⋅ 0,64462 + код остаточной опухоли ⋅ 1,55890 + код плоидности ⋅ 0,65926. В случае, если расчетный показатель меньше дискриминационного значения (Д3=-0,94584), предполагают благоприятный прогноз заболевания, если показатель больше ДЗ, предполагают неблагоприятный прогноз заболевания. Способ прост в исполнении и позволяет осуществить прогноз с высокой точностью, однако, не позволяет влиять на химиотерапевтическую стратегию.
Изобретение Моисеенко Т.И. с соавт. (2000 г.) может быть использовано для прогнозирования течения РЯ III-IV-стадий (патент №2146056 РФ, опубл. 27.02.2000 г.). В крови больного, находящегося в стадии длительной клинической ремиссии, авторы рекомендуют определять количество Е-розеткообразующих клеток в присутствии леакадина. При показателе стимулированных клеток 77,0-59,0% прогнозируют начало генерализации заболевания и возобновляют противоопухолевое лечение. При показателе стимулированных клеток 58,0-40,0% прогнозируют ремиссию заболевания и химиогормонотерапию проводят в более поздние сроки. Способ позволяет определить признаки рецидива заболевания на доклинической стадии, однако на настоящий момент пересмотрены взгляды на так называемый «маркерный» рецидив, поскольку, проведение противорецидивной химиотерапии до появления клинических признаков рецидива не влияет на показатели общей выживаемости, ухудшает качество жизни больных и увеличивает финансовые затраты (ASCO, 2010 г.).
Другое изобретение имеет большее прикладное значение. Сущность способа, предложенного группой авторов Ростовского научно-исследовательского онкологического института (Франциянц Е.М., Долматова O.K., Архангельская А.В., 1994 г.) заключается в том, что асцитическую жидкость больного инкубируют с различными химиопрепаратами и их комбинациями в течение 1 ч при 37°C, затем определяется изменение активности щелочной фосфатазы после инкубации, и, при снижении активности на 75% и более от исходного уровня данные химиопрепараты выбирают для проведения химиотерапии. Всего было обследовано 105 больных РЯ III-IV стадии, которым с эффективностью 97% были подобраны химиопрепараты и их комбинации для терапии (патент РФ №1718650, опубл. 16.06.1992 г.). Способ осуществлялся в течение 3-х часов и не требовал дорогостоящей аппаратуры, однако, не может быть применен к безасцитным формам РЯ, а для постановки метода на ткани опухоли требуются дополнительные методическая подготовка и апробация на клиническом материале.
Аналогичный способ определения чувствительности к химиопрепаратам по результатам инкубации с ними асцитической жидкости был предложен другими коллегами Ростовского научно-исследовательского онкологического института (Сидоренко Ю.С., Голотина Л.Ю. с соавт., 2001 г.). Однако параметрами, по которым оценивалась чувствительность опухолевых клеток к химиопрепаратам, были количество живых и мертвых клеток (патент РФ№2161801, опубл. 10.01.2001 г.). Обращают на себя внимание субъективность методов оценки чувствительности опухоли к химиопрепаратам.
Кроме того, Сидоренко Ю.С. с соавторами предлагают для оценки эффекта неоадъювантной химиотерапии, определять плазминоген и плазмин в опухолевой ткани (патент РФ №2383396 опубл. 10.03.2010 г.). Далее, по соотношению первого ко второму, оценивать клинический эффект: при повышении этого показателя прогнозировать наступление клинического эффекта от проводимого лечения, а в случае снижения показателя, либо его неизмененности, прогнозировать отсутствие клинического эффекта. Способ позволяет выявить пациенток с эффектом от лечения и хорошим прогнозом и больных без эффекта, с плохим прогнозом, которым необходимо агрессивное адъювантное лечение, позволяет определить индивидуальную чувствительность или резистентность злокачественной опухоли больных к конкретным схемам химиотерапии. Однако, показатели изучаются в динамике (на этапах до и после НАХТ), таким образом, обоснование схем химиотерапии определяется не всегда своевременно, а после апробации эмпирически выбранного лечения (2010 г.).
Неродо Г.А. с соавторами разработали способ прогнозирования рецидива РЯ по данным ДНК-цитометрического анализа опухолевой ткани (Патент РФ №2530556, опубл. 10.10.2014 г.). Технический результат достигается тем, что в опухолевой ткани яичников определяют долю клеток в S-фазе клеточного цикла, при значении этого показателя менее 15,9% прогнозируют благоприятный исход, а при значении этого показателя более 15,9%, прогнозируют неблагоприятный исход. Недостатком метода является отсутствие предиктивности в отношении химиотерапии в результатах анализа.
Наиболее близким к предлагаемому является способ определению операбельности процесса при раке яичников на основании данных ревизии и по результату определения модифицированного индекса перитонеального канцероматоза [Шпенкова А.А., 2010]. Из возможных имеющихся на данный момент способов оценки операбельности РЯ, помимо данных компьютерной томографии, метод подсчета индекса перитонеального канцероматоза может быть пока единственным и наиболее оптимальным, однако, предполагает проведение интраоперационной ревизии. Определение вероятности выполнения циторедуктивной операции в оптимальном объеме у больных РЯ на этапе планирования лечения пока не решена.
Таким образом, представленные способы обладают рядом существенных недостатков, их прогностические данные нуждаются в дополнительном подтверждении высокотехнологичными методами, так как не в полной мере отвечают на поставленные вопросы, на основании чего можно считать проблему прогнозирования при РЯ пока нерешенной.
Новый технический результат - повышение точности и информативности способа оценки операбельности процесса за счет использования новых клинических и молекулярно-генетических параметров, характеризующих биологические особенности опухоли и получаемых с помощью доступных методик.
Для достижения нового технического результата в способе прогнозирования степени вероятности возможности выполнения оптимальной циторедуктивной операции у больных с диссеминированными формами рака яичников, путем исследования пациента, в качестве маркеров используют клинические параметры: стадию заболевания, объем асцитической жидкости, уровень сывороточных маркеров СА 125 и НЕ4, уровень инсулиноподобного фактора II типа (IGF-II) и металлопротеиназы РАРР-А в асцитической жидкости до лечения. Рассчитывают дискриминантные функции Y1, Y2 по уравнениям:
Y1=5,34⋅X1-10,7556⋅X2+0,0067⋅X3-0,0006⋅X4+0,0748⋅X5+25,2216⋅X6-13,2965;
Y2=14,6053⋅X1+5,51⋅Х2-0,0085⋅Х3+0,0010⋅Х4-0,0416⋅Х5-37,0782⋅Х6-20,4686,
где X1 - стадия заболевания по FIGO (2 - 3A, B; 3 - 3C-IVA);
Х2 - наличие и количество асцита до лечения (0 - отсутствует или следовые количества (до 200 мл); 1 - в большом количестве (более 1000 мл); 2 - в умеренном количестве (от 200 до 1000 мл);
X3 - уровень СА 125 в сыворотке крови до лечения, в ЕД/мл;
Х4 - уровень НЕ4 в сыворотке крови до лечения, в рМ;
Х5 - уровень IGF-II в асците до лечения, в нг/мг белка;
Х6 - уровень РАРР-А в асците до лечения, в нг/мг белка,
и при Y1>Y2 прогнозируют высокую степень, а при Y1<Y2 - низкую степень вероятности выполнения циторедуктивной операции в оптимальном объеме.
Таким образом, если Y1>Y2, объект относят к первому классу, когда циторедукция возможна с уровнем значимости р<0,05, что означает, что вероятность выполнения оптимальной циторедукции у данной больной составляет 95%.
Если Y1<Y2, то объект относят ко второму классу когда оптимальная циторедукция невозможна с уровнем значимости р<0,05, что означает, что вероятность того, что циторедукция будет неоптимальной, составляет 95%.
Способ осуществляют следующим образом.
Стадию заболевания устанавливают согласно критериям классификации FIGO. Наличие и количество асцита определяют клинически и по данным ультразвукового исследования. Уровень сывороточных опухолевых маркеров определяют с использованием наборов для радиоиммунного (СА 125) и иммуноферментного анализа (НЕ4). Забор ткани для определения исследуемых параметров проводят при выполнении лапароскопии, стадирования. Уровень белков системы IGF-II и РАРР-А в асцитической жидкости и ткани опухоли определяют следующим методом: для получения бесклеточной фракции аликвоту (около 10 мл) асцитической жидкости центрифугируют при 4°C и 3000 об/мин в течение 10 минут. Жидкую фракцию отбирают и в ней определяют тотальный (внутриклеточный и внеклеточный) пул свободного IGF-II, а также РАРР-А с использованием наборов ELISA (R&D Systems, DSL) на ИФА-анализаторе «Anthos 2020» (Австрия). Содержание белка в асцитической жидкости определяют по методу Лоури. Результаты выражают в нг/мг белка. Рассчитывают дискриминантные функции Y1, Y2 по уравнениям:
Y1=5,34⋅X1-10,7556⋅X2+0,0067⋅X3-0,0006⋅X4+0,0748⋅X5+25,2216⋅X6-13,2965;
Y2=14,6053⋅X1+5,51⋅Х2-0,0085⋅Х3+0,0010⋅Х4-0,0416⋅Х5-37,0782⋅Х6-20,4686,
где X1 - стадия заболевания по FIGO (2 - 3A, B; 3 - 3C-IVA);
Х2 - наличие и количество асцита до лечения (0 - отсутствует или следовые количества (до 200 мл); 1 - в большом количестве (более 1000 мл); 2 - в умеренном количестве (от 200 до 1000 мл);
Х3 - уровень СА 125 в сыворотке крови до лечения, в ЕД/мл;
Х4 - уровень НЕ4 в сыворотке крови до лечения, в рМ;
Х5 - уровень IGF-II в асците до лечения, в нг/мг белка;
Х6 - уровень РАРР-А в асците до лечения, в нг/мг белка и при Y1>Y2 прогнозируют высокую, а при Y1<Y2 - выполнение циторедуктивной операции в оптимальном объеме.
Для оценки прогноза выполнения оптимальной циторедукции у больных диссеминированным РЯ был проведен дискриминантный анализ, поскольку он является одним из методов решения так называемой задачи классификации - задачи отнесения изучаемого объекта (больного) к одной из нескольких групп на основе измерения у него некоторого числа признаков и традиционно используется для решения задач диагностики и прогнозирования [О.Ю. Реброва, 2006, В.И. Юнкеров, 2002].
Результатом дискриминантного анализа явилась статистическая модель, представленная набором линейных дискриминантных функций, определяющих границы принятия решения в пользу той или иной группы (класса). Количество линейных дискриминантных функций равно количеству групп. В исследование были включены больные с серозными и эндометриоидными карциномами низкой степени дифференцировки III-IV стадии по FIGO (Тип II по классификации Kurman R.S., 2013), BRCA-негативные (у всех больных приводилось определение мутаций BRCA I 5382ins С, BRCA I 185delAG, BRCA I T300G, BRCA 14153 delA, BRCA 2 6174delT).
Оценку вероятного прогноза возможности выполнения оптимальной циторедукции проводили на основании комплексной оценки основных клинико-морфологических параметров (возраст, менопаузальный статус, стадия заболевания по FIGO (2013), гистотип, классификация опухоли по Kurman (Kurman R.S, 2013), наличию асцита и его количества до лечения), уровня опухолевых маркеров до лечения (СА125 и НЕ4), показателей системы инсулиноподобных факторов роста в асците до лечения, включая уровень рецептора IGF-IR в ткани опухоли до лечения; экспрессии белков, ассоциированных с клеточной подвижностью в ткани опухоли до лечения (TGFbeta-RI, p45Ser β-катенин, Arp3, гельзолин, кофилин, тимозин 4β). Всего было проанализировано более 60 показателей. Параметры системы инсулиноподобных факторов роста (ИФР-I, ИФР-II, IGFBP-3,4, IGF-IR и РАРР-А) и показатели, отражающие локомоторную активность опухолевых клеток (экспрессия кофилина-1, гельзолина, тимозина 4β, β-катенина и Arp3) определяли в ткани опухоли, забранной во время выполнения оперативного вмешательства, либо диагностической лапароскопии. Параметры системы инсулиноподобных факторов роста исследовали также во внеклеточной части асцитической жидкости. Забор асцитической жидкости проводили до начала лечения. Образцы осветленных гомогенатов опухолей и образцы внеклеточной части асцитической жидкости использовали для определения ИФР-I, ИФР-II, IGFBP-3, IGFBP-4, РАРР-А с использованием наборов для твердофазного иммуноферментного анализа. IGF-IR определялся методом проточной цитофлюориметрии. Показатели клеточной подвижности (экспрессия кофилина-1, гельзолина, тимозина 4β, β-катенина и Arp3) определяли методом проточной цитофлуориметрии в клеточной суспензии, а также методом Вестерн блоттинг.
Традиционно дискриминантный анализ включал следующие этапы: первичный отбор признаков для построения модели; набор обучающей выборки (группы пациентов у которых регистрируются отобранные признаки); отбор информативных признаков и формирование на их основе группы дифференциальных функций (критерий Фишера); проверка качества полученной дискриминантной модели. Анализ проводили в программах Statistica 10.0 и SPSS 11.0.
Результат классификации оценивали следующим образом: возможно выполнение оптимальной циторедукции или оптимальная циторедукция невозможна. Таким образом, все больные РЯ были распределены на 2 группы (2 класса). Далее были рассчитаны линейные дискриминантные функции - линейные комбинации переменных (показателей), включенных в модель вида Y=a⋅x+b, где Y - значение линейной дискриминантной функции; X - определяющая переменная; a - коэффициент при определяющей переменной; b - независимая константа.
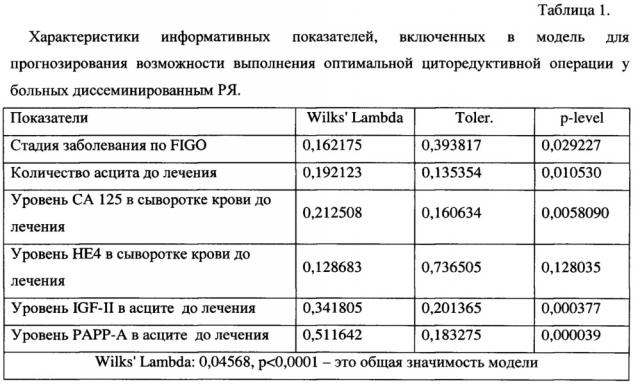
В результате для группы больных РЯ были получены информативные показатели, представленные в Таблице 1. Приложения – Характеристики информативных показателей, включенных в модель для прогнозирования возможности выполнения оптимальной циторедуктивной операции у больных диссеминированным РЯ.
* Примечание: Wilks Lambda - величина, отвечающая за выполнение условий о правомерности включения показателя в модель и значимости различий значений дискриминантной функции в группах, что является необходимым условием при создании модели; Toler. (толерантность) - величина, отражающая информативность переменной, которая является необходимым условием для включения переменной в модель; p-level - уровень значимости.
Процедуру отнесения объекта к классу проводили в 2 этапа:
- Расчет значений y1 и y2 с использованием значений признаков у исследуемого объекта.
- Относили объект (больную РЯ к одному из классов (если y1>y2, то объект относили к первому классу (оптимальная циторедукция возможна); если y1<y2, то объект относили ко второму классу (оптимальную циторедукцию выполнить невозможно).
В результате были получены следующие линейные дискриминантные функции:
Y1=5,34⋅X1-10,7556⋅X2+0,0067⋅X3-0,0006⋅X4+0,0748⋅X5+25,2216⋅X6-13,2965;
Y2=14,6053⋅X1+5,51⋅Х2-0,0085⋅Х3+0,0010⋅Х4-0,0416⋅Х5-37,0782⋅Х6-20,4686, где
X1 - стадия заболевания по FIGO (II - IIIA, B; 3 - IIIC-IVA);
X2 - наличие и количество асцита до лечения (0 - отсутствует или следовые количества (до 200 мл); 1 - в большом количестве (более 1000 мл); 2 - умеренное количество (от 200 до 1000 мл);
X3 - уровень СА 125 в сыворотке крови до лечения, в ЕД/мл;
X4 - уровень НЕ4 в сыворотке крови до лечения, в рМ;
X5 - уровень IGF-II в асците до лечения, в нг/мг белка;
X6 - уровень РАРР-А в асците до лечения, в нг/мг белка.
При расчете дискриминантных функций объект (больную РЯ) относили к одному из классов. Если Y1>Y2, то объект относили к первому классу (циторедукция возможна) с уровнем значимости p<0,05, что означает, что вероятность выполнения оптимальной циторедукции у данной больной составляет 95%. Если Y1<Y2, то объект относится ко второму классу (оптимальная циторедукция невозможна) с уровнем значимости р<0,05, что означает, что вероятность того, что циторедукция будет неоптимальной, составляет 95%.
Данные существенные признаки не выявлены в научно-медицинской литературе. Способ апробирован на базе ФГБНУ «Томского НИИ онкологии». Данное техническое решение соответствует критериям «новизна», «изобретательский уровень», «промышленно применимо».
Способ осуществляют следующим образом. Стадия заболевания устанавливают согласно критериям классификации FIGO. Наличие и количество асцита определяется клинически и по данным ультразвукового исследования. Уровень сывороточных опухолевых маркеров определяется с использованием наборов для радиоиммунного (СА 125) и иммуноферментного анализа (НЕ4). Забор ткани для определения исследуемых параметров проводился при выполнении лапароскопии, стадирования. Уровень белков системы IGF-II и РАРР-А в асцитической жидкости и ткани опухоли определяется следующим методом: для получения бесклеточной фракции аликвоту (около 10 мл) асцитической жидкости центрифугируется при 4°C и 3000 об/мин в течение 10 минут. Жидкую фракцию отбирают и в ней определяют тотальный (внутриклеточный и внеклеточный) пул свободного IGF-II, а также РАРР-А с использованием наборов ELISA (R&D Systems, DSL) на ИФА-анализаторе «Anthos 2020» (Австрия). Содержание белка в асцитической жидкости определяют по методу Лоури. Результаты выражают в нг/мг белка.
Такой подход к прогнозированию выполнения оптимально объема операции при раке яичников обусловлен рядом предпосылок:
Использование таких параметров, как Ca125 и НЕ4 сыворотки крови обосновано доступностью методик и существованием данных об определенной прогностической значимости их совместного использования при РЯ. Определение количества асцитической жидкости может быть осуществлено при проведении регламентированного стандартами объема обследования. Информативность отобранных критериев: IGF-II и РАРР-А в асците до начала специфического лечения обоснована, во-первых, доступностью для исследования асцитической жидкости, а, во-вторых, высоким уровнем экспрессии отдельных маркеров, как в клеточной, так и во внеклеточной части асцитической жидкости (Davidson, 2009). Несмотря на то, что нет однозначных результатов относительно вовлеченности белков системы IGFs в процессы канцерогенеза при РЯ, ранее было показано, что высокий уровень ИФР-II в злокачественных опухолях яичника эпителиального происхождения коррелировал с запущенной стадией, серозным гистотипом, низкой степенью дифференцировки и размером остаточной опухоли более 2 см. (Lu L., 2006). По некоторым данным, экспрессия гена ИФР-II в злокачественных эпителиальных опухолях яичника более чем в 300 раз превышает экспрессию гена в нормальном эпителии яичника и ассоциирована с III-IV стадией заболевания, низкой степенью дифференцировки и субоптимальным объемом резекции (Huang G. et al., 2010, Sayer R.A., 2005), а высокий уровень ИФР-II после химиотерапии в асцитической жидкости у больных РЯ коррелирует с низкой общей выживаемостью (Slipcevic A. et al., 2009).
Кроме того, выявлена взаимосвязь между уровнем IGFII и чувствительностью к XT. Так, на клеточной линии РЯ, резистентной к таксанам, отмечался высокий уровень ИФР-II, а снижение уровня ИФР-II восстанавливало чувствительность клеток к таксанам (Huang G. et al., 2010). Одной из основных функций РАРР-А является расщепление ИФР, что приводит к увеличению биодоступности инсулиноподобного фактора роста, активность системы которого ассоциирована с такими процессами как пролиферативная активность и метастазирование.
В таблице 1 представлены показатели, включенные в модель оценки вероятности выполнения циторедуктивной операции в оптимальном объеме. Примечание: Wilks Lambda - величина, отвечающая за выполнение условий о правомерности включения показателя в модель и значимости различий значений дискриминантной функции в группах, что является необходимым условием при создании модели; Toler. (толерантность) - величина, отражающая информативность переменной, которая является необходимым условием для включения переменной в модель; p-level - уровень значимости.
Показатели специфичности и прогностической значимости положительного результата (риска выполнения оптимальной циторедукции) свидетельствуют о высокой информативности заявляемого способа, который предполагает более широкого использования данного способа. Выделение группы больных РЯ с высокой вероятностью оптимальной операции будет способствовать увеличению показателей эффективности лечения путем увеличения частоты оптимальных циторедуктивных вмешательств первым этапом, а также избежать необоснованного назначения неоадъювантной химиотерапии. Соответственно, выделение группы больных с низкой вероятностью выполнения оптимальной циторедуктивной операции позволит снизить частоту эксплоративных лапаротомий, способствуя своевременному и обоснованному назначению неоадъювантной химиотерапии с возможностью выполнения оптимальной операции на этапе интервальной циторедукции.
Оценку качества полученных функций проводили на 20 пациентах, не включенных в основную выборку. Чувствительность и специфичность полученной модели составили 85% и 90%, соответственно.
Клинические примеры
Пример 1
Больная У., 55 лет, обратилась в НИИ онкологии «Томского НИМЦ», где по результатам комплексного обследования у нее был диагностирован рак яичников, стадия T3cNxM0.
Канцероматоз брюшины. Асцит.
Было проведено обследование согласно предлагаемому способу. Для этого проводилась оценка клинических параметров (стадия заболевания, объем асцитической жидкости), исследовались уровни сывороточных маркеров СА-125 и НЕ4, в образце асцитической жидкости определяли уровень инсулиноподобного фактора II типа (IGF-II) и металлопротеиназы РАРР-А. Объем асцитической жидкости составил 200-250 мл (категория 2 - от 200 до 1000 мл). Уровень маркера СА 125 составлял 2580 Ед/мл, НЕ4 600 рМ. Уровень IGF-II в асцитической жидкости составил 36,81 нг/мг белка, а РАРР-А 0,51 нг/мг белка. Вычисление дискриминантных функций с использованием исследуемых параметров показало, что значение Y1=13,29; что больше чем Y2=-7,40. Данный клинический случай был классифицирован как случай с высокой вероятностью выполнения оптимальной циторедукции, что в дальнейшем подтвердилось при выполнении хирургического этапа лечения. Период динамического наблюдения за больной составил 32 месяца.
Пример 2
Больная З., 56 лет, обратилась в ФГБНУ «Томский НИИ онкологии», где по результатам комплексного обследования у нее был диагностирован рак яичников, стадия T3вN1M0. Канцероматоз брюшины. Асцит. Было проведено обследование согласно предлагаемому способу. Для этого оценивали клинические параметры (стадия заболевания, объем асцитической жидкости), исследовались уровни сывороточных маркеров СА 125 и НЕ4, в образце асцитической жидкости определяли уровень инсулиноподобного фактора II типа (IGF-II) и металлопротеиназы РАРР-А. Объем асцитической жидкости составил 5000 мл (категория 1 - более 1000 мл). Уровень маркера СА 125 составил 1390 Ед/мл, НЕ4 246 рМ. Уровень IGF-II в асцитической жидкости был равен 19,66 нг/мг белка, уровень РАРР-А был равен нулю. Вычисление дискриминантных функций с использованием исследуемых параметров показало, что Y1=2,60; что меньше чем Y2=16,45. Данный клинический случай был классифицирован как случай с низкой вероятностью выполнения оптимальной циторедукции. Использование препаратов 1-линии XT в неоадъювантном режиме сопровождалось увеличением размеров опухоли менее чем на 25%, появлением метастаза в области пупка. В последующем пациентке была выполнена циторедуктивная операция в неоптимальном объеме, с размером остаточных опухолевых масс до 1,5 см. В дальнейшем, при динамическом наблюдении был выявлен рецидив заболевания, продолжительность безрецидивного периода составила 5 мес.
Таким образом, предлагаемый способ позволяет с высокой точностью и информативностью прогнозировать степень вероятности выполнения оптимальной циторедукции при раке яичников и делает возможным на диагностическом этапе прогнозировать вероятность выполнения циторедуктивной операции в оптимальном объеме у больных диссеминированным раком яичников, определить этапность хирургического и химиотерапевтического методов лечения. В целом, применение данного способа будет способствовать увеличению показателей эффективности лечения диссеминированных форм РЯ.
Источники информации
1. Kurman R.J., Carcanqiu M.L., Herrington C.S., Young R.H. WHO Classifications of Female Reproductiv organsFourth Edition. IARC, 2014, p.307.
2. Каприн А.Д., Старинский B.B., Петрова Г.В. Состояние онкологической помощи населению России в 2014 году. - М.: ФГБУ «МНИОИ им. П. А. Герцена» Минздрава России, 2015.- 235 с.
3. Максимов С.Я., Хаджимба А.С., Ильин А.А., Соболев И.В. Роль повторных лапаротомий в лечении больных злокачественными опухолями яичников // Практическая онкология, 2014., т. 2., т. 4., с. 176-185.
4. Tothill RW, Tinker AV, George J., Brown R. et al. Novel molecular subtypes of serous and endometrioid ovarian cancer linked to clinical outcome // Clin. Cancer. Res. 2008 Aug 15; 14(16):5198-208. doi: 10.1158/1078-0432.CCR-08-0196.
5. Vang R., Shin I., Kurman R.J. Ovarian Low-grade and High-grade serous carcinoma: pathogenesis, clinicopathologic and molecular biologic features, and diagnostic problems // Adv. Anat. Pathol. 2009 Sep; 16(5): 267-282. doi: 10.1097/PAP.0b013e3181b4fffa.
6. Hoskins W.J., McGuire W.P., Brady M.F., et al. The effect of diameter of largest residual disease on survival after primary cytoreductive surgery in patients with suboptimal residual epithelial ovarian carcinoma. Am. J. Obstet. Gynecol. 1994; 170: 974-979.
7. Moore R.G., McMeekin S. Brown A.K., DiSilvestro P., Miller M.C., Allard W.J., Gajewski W…, Kurman R. Bast R.C., Skates S.J. A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass // Published in final edited form as: Gynecol. Oncol. 2009 January; 112(1): 40-46. doi: 10.1016/j.ygyno.2008.08.031.
8. Drapkin R., von Horsten H.H., Lin Y, Mok SC, Crum CP, Welch WR, Hecht JL. Human epididymis protein 4 (HE4) is a secreted glycoprotein that is overexpressed by serous andendometrioid ovarian carcinomas. Cancer Res. 2005; 65:2162-2169.
9. Steffensen K.D., M., Brandslund I., Petzold M., Jakobsen A. The prognostic and predictive value of combined HE4 and CA-125 in ovarian cancer patients // Int. J. Gynecol. Cancer. 2012 Nov; 22(9): 1474-82. doi: 10.1097/IGC.0b013e3182681cfd.
10. Davidson В., Espina V., Steinberg S.M., Florenes V.A., Liotta L.A., Kristensen G.B., et al. Proteomic analysis of malignant ovarian cancer effusions as a tool for biologic and prognostic profiling. Clin Cancer. Res. 2006; 12(3 Pt 1): 791-910. Doi: 1158/1078-0432.CCR-05-2516.
11. Lu L., Katsaros D., Wiley A., Rigault de la Longrais I.A., Puopolo M., Schwartz P., Promoter-specific transcription of insulin-like growth factor-II in epithelial ovarian cancer. Ginecol. Oncol. 2006; 1-3 (3): 990-5.
12. Huang G.S., Brouwer-Visser J., Ramirez M.J., Kim C.H., Hebert T.M., Lin J., et al. Insulin-like growth factor 2 expression modulates Taxol resistance and is a candidate biomarker for reduced disease-free survival in ovarian cancer. Clin Cancer Res. 2010;16:2999-3010.
13. Sayer R.A., Lancaster J.M., Pittman J., Gray J., Whitaker R., Marks J.R., Berchuck A. High insulin-like growth factor-2 (IGF-2) gene expression is an independent predictor of poor survival for patients with advanced stage serous epithelial ovarian cancer. Gynecol Oncol. 2005; 96(2):355-61.
14. Slipicevic A., Oy G.F., Askidt I.C. et al. diagnostic and prognostic role of the insulin growth factor pathway members insulin-like growth factor-II and insulin-like growth factor binding protein-3 in serous effusions // Hum. Pathol. - 2009. - Vol. 40(4). - P. 527-537.
15. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA // М.: МедиаСфера, 2002 (I изд.), 2003 (II изд.), 2006 (III и IV изд.). 312 с.
16. Шпенкова А.А. Рак яичников: эффективность лечения в зависимости от градаций канцероматоза или нерешенные вопросы стадирования // Вестник Новгородского Государственного Университета, 2010, №59. - Р. 116-120.
17. Юнкеров В.И., Григорьев С.Г. Математико-статистическая обработка данных медицинских исследований // ВМедА, 2002, 266 с.
Приложение
Способ прогнозирования степени вероятности выполнения циторедуктивной операции в оптимальном объеме у больных диссеминированным раком яичников путем исследования пациента, отличающийся тем, что определяют клинические параметры: стадию заболевания, объем асцитической жидкости, уровни сывороточных маркеров СА 125 и НЕ4, инсулиноподобного фактора II типа (IGF-II) и металлопротеиназы РАРР-А в асцитической жидкости до лечения, далее рассчитывают значения дискриминантных функций Y1, Y2 по уравнениям:
Y1=5,34⋅X1-10,7556⋅X2+0,0067⋅X3-0,0006⋅X4+0,0748⋅X5+25,2216⋅X6-13,2965;
Y2=14,6053⋅X1+5,51⋅X2-0,0085⋅X3+0,0010⋅X4-0,0416⋅X5-37,0782⋅X6-20,4686,
где X1 - стадия заболевания по FIGO (2 - 3А, В; 3 - 3C-IVA);
X2 - наличие и количество асцита до лечения (0 - отсутствует или следовые количества (до 200 мл); 1 - в большом количестве (более 1000 мл));
2 - в умеренном количестве (от 200 до 1000 мл);
X3 - уровень СА 125 в сыворотке крови до лечения, в ЕД/мл;
X4 - уровень НЕ4 в сыворотке крови до лечения, в рМ;
X5 - уровень IGF-II в асците до лечения, в нг/мг белка;
X6 - уровень РАРР-А в асците до лечения, в нг/мг белка,
и при Y1>Y2 прогнозируют высокую, а при Y1<Y2 - низкую степень вероятности выполнения оптимальной циторедукции.