Способ иммунотерапии хронического вирусного гепатита с
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для иммунотерапии хронического вирусного гепатита С. Осуществляют введение больному аутологичных дендритных клеток, которые генерируют из клеток периферической крови с помощью индукторов дифференцировки, нагруженных антигенами, кодирующими вирусные белки, и индуцированных к дальнейшему созреванию. Назначают интерлейкин-2 в качестве адьюванта. В качестве антигена применяют комбинацию фрагментов рекомбинантных вирусных белков Core (1-120 ак) и NS3 (1192-1457 ак), созревание ДК индуцируют с помощью азоксимер бромида, дендритные клетки применяют 2 курсами посредством подкожных вакцинаций, сочетая введение ДК с подкожными интермиттирующими инъекциями рекомбинантного интерлейкина-2 в качестве адъювантной неспецифической терапии больным хроническим вирусным гепатитом С. В качестве индукторов дифференцировки дендритных клеток используют гранулоцитарно-макрофагальный колониестимулирующий фактор и интерферон-альфа. Способ позволяет повысить эффективность лечения. 1 з.п. ф-лы, 2 табл., 3 пр.
Реферат
Изобретение относится к медицине, а именно к способам иммунотерапии хронического вирусного гепатита С на основе вирусных антигенов и дендритных клеток. Способ может быть использован для лечения и профилактики инфекций человека, вызванных вирусом гепатита С (HCV).
Хронический вирусный гепатит С (ХГС) относится к социально значимым инфекциям, представляющим глобальную проблему для здравоохранения во всем мире. Количество инфицированных вирусом гепатита С составляет в настоящее время более 200 млн человек во всем мире, и большинство из них имеют хроническую инфекцию (Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium // J Viral Hepat. 1999; 6: 35-47).
Используемые в современном лечении ХГС препараты интерферона - альфа (в виде монотерапии или в сочетании с рибавирином) имеют ограниченную эффективность (ответ регистрируется у 40-50% пациентов с 1-м генотипом и часто вызывает развитие тяжелых побочных эффектов, вынуждающих прекратить лечение (Manns MP, Wedemeyer Н, Cornberg М. Treating viral hepatitis С: efficacy, side effects, and complications. Gut. 2006; 55: 1350-9). Таргетная терапия ингибиторами протеаз, обещающая стать прорывом в лечении ХГС, также имеет ряд серьезных побочных эффектов, показана только для пациентов с генотипом 1 и на сегодняшний день ограничена высокой стоимостью (Wilby KJ1, Partovi N, Ford JA, Greanya E, Yoshida EM. Review of boceprevir and telaprevir for the treatment of chronic hepatitis C. Can J Gastroenterol. 2012 Apr; 26 (4): 205-10).
Таким образом недостатками современных методов прямой противовирусной терапии является их токсичность, недостаточная эффективность, зависимость эффективности терапии от генотипа вируса, риск возобновления репликации вируса после прекращения терапии, развитие резистентности к противовирусным препаратам и высокая стоимость.
Согласно современным представлениям, ведущую роль в уничтожении вируса играют CD8+ Т-клетки, цитотоксический эффект которых в отношении вирусинфицированных гепатоцитов реализуется через продукцию IFN-γ (Thimme R, Bukh J, Spangenberg HC, et al. Viral and immunological determinants of hepatitis С virus clearance, persistence, and disease. Proc Natl Acad Sci USA 2002; 99: 15661-8) или прямой цитолитический эффект (Cerny A, McHutchison JG, Pasquinelli С, et al. Cytotoxic T lymphocyte response to hepatitis С virus-derived peptides containing the HLA A2.1 binding motif. J Clin Investig 1995; 95: 521-30). Поскольку генерация этих клеток требует ко-стимуляторных сигналов со стороны CD4+Т-хелперных клеток, элиминация вируса и исход в выздоровлении обеспечивается запуском сильного мультиэпитопного (с широкой кросс-реактивностью) ответа CD8+ и CD4+ Т-клеток, продуцирующих цитокины первого типа (Lauer GM, Barnes Е, Lucas М, et al. High resolution analysis of cellular immune responses in resolved and persistent hepatitis С virus infection. Gastroenterology. 2004; 127: 924-36; Lechner, F., D.K. Wong, P.R. Dunbar, et al. 2000. Analysis of successful immune responses in persons infected with hepatitis С virus. J. Exp. Med. 191: 1499-1512; Schulze zur Wiesch J, Lauer GM, Day CL, et al. Broad repertoire of the CD4+ Th cell response in spontaneously controlled hepatitis С virus infection includes dominant and highly promiscuous epitopes. J Immunol. 2005; 175: 3603-13). Соответственно недостаточность Т-клеточного ответа ассоциирована с исходом в хронизацию и персистенцией вирусной инфекции. Это подтверждается тем, что высокая активность цитотоксических CD8+ Т-лимфоцитов сопряжена с низким уровнем виремии, а отсутствием клональной экспансии цитотоксических Т-клеток, в том числе вследствие недостаточности Тh1-ответа - с персистенцией вируса (Hiroishi К, Kita Н, Kojima М, et al. (1997). Cytotoxic Т lymphocyte response and viral load in hepatitis С virus infection. Hepatol 25: 705-12.; Rehermann В and Chisari F V (2000). Cell mediated immune response to hepatitis С virus. Curr Top Microbiol Immunol 242: 299-325.). Поэтому индукция сильного иммунного ответа с помощью вакцин на основе вирусных антигенов рассматривается в качестве перспективной стратегии лечения ХГС (Roohvand F, Kossari N. Advances in hepatitis С virus vaccines, part two: advances in hepatitis С virus vaccine formulations and modalities. Expert Opin Ther Pat. 2012; 22 (4): 391-415).
Ряд вакцин на основе структурных и неструктурных белков вируса гепатита С или входящих в их состав пептидов дошли до клинических испытаний. Результаты этих исследований, суммированные в обзоре Li D. (Li D., Huang Z., Zhong J. Hepatitis С virus vaccine development: old challenges and new opportunities Natl Sci Rev, September 2015, 2 (3): 285-295. doi: 10.1093/nsr/nwv040), показали безопасность и иммуногенность, однако продемонстрировали лишь незначительный клинический эффект.
Известно, что ведущую роль в активации цитотоксических CD8+ Т-клеток и CD4 Т-хелперных клеток, их клональной экспансии и дифференцировке CD8+ Т-лимфоцитов в цитотоксические Т-клетки и Т-клетки памяти, играют дендритные клетки (ДК) (Eickhoff S1, Brewitz A1, Gerner MY2, et al. Robust Anti-viral Immunity Requires Multiple Distinct T Cell-Dendritic Cell Interactions. Cell. 2015 Sep 10;162(6):1322-37.; Sachdeva M., Chawla Y.R., Arora S.R. Dendritic cells: The warriors upfront-turned defunct in chronic hepatitis С infection World J Hepatol 2015 September 8; 7(19): 2202-2208). ДК представляют наиболее профессиональные антигенпрезентирующие клетки, которые благодаря ряду свойств (высокой экспрессии молекул гистосовместимости I и II класса и ко-стимуляторных молекул, медленной внутриклеточной деградации антигена и длительной презентации антигенных пептидов на клеточной мембране), превышают активность макрофагов и других антиген-презентирующих клеток и способны презентировать антигены наивным Т-клеткам (Massard G., Tongia М-М., Wihin J-M., Morand G. The dendritic cell lineage: a ubiquitous antigen-presenting organization // Ann. Thorac. Surg. -1996. - Vol. 61.- P. 252-258).
Исход в хронизацию при ХГС связан со способностью вируса избегать иммунного ответа вследствие высокой генетической изменчивости вируса и его иммуносупрессивных свойств. При этом одной из стратегий, используемых вирусом для избегания иммунного ответа, является способность вирусных антигенов подавлять функции ДК (Sachdeva М., Chawla Y.R., Arora S.R. Dendritic cells: The warriors upfront-turned defunct in chronic hepatitis С infection World J Hepatol 2015 September 8; 7 (19): 2202-2208). Так, при ХГС отмечаются различные дефекты ДК, в частности, задержка созревания ДК и снижение их стимуляторной активности. Это позволило предположить, что восстановление функций ДК путем воздействия на них in vivo или использования генерированных ex vivo ДК (в качестве вакцин) может стать новой стратегией восстановления специфического иммунного ответа при ХГС.
Созданию и апробации таких подходов во многом способствовала разработка метода получения большого количества ДК в культуре in vitro и выяснение механизмов подавления функций ДК при ХГС. Согласно стандартным протоколам ДК получают из моноцитов путем культивирования прилипающей фракции мононуклеарных клеток (источник моноцитов) с гранулоцитарно-макрофагальным колониестимулирующим фактором (ГМ-КСФ/GM-CSF) и интерлейкином-4 (ИЛ-4/IL-4). Способность таких ИЛ4-ДК индуцировать специфический ответ CD4+ и CD8+ Т-лимфоцитов против капсидного и неструктурных белков HCV была недавно продемонстрирована в культурах in vitro у доноров (Li W., Krishnadas D.K., Li J., Tyrrell D.L., Agrawal B. Induction of primary human T cell responses against hepatitis С virus-derived antigens NS3 or core by autologous dendritic cells expressing hepatitis С virus antigens: potential for vaccine and immunotherapy. J Immunol. 2006; 176 (10): 6065-75). Использование в качестве кандидатных вирусных антигенов как структурных, так и неструктурных белков (Core, NS3-NS5) или входящих в их состав пептидов, обусловлено тем, что эти антигены являются высоко иммуногенными и индуцируют Т-клеточный иммунный ответ, включая активацию Т-хелперов I-типа и генерацию цитотоксических Т-лимфоцитов (Roohvand F, Kossari N. Advances in hepatitis С virus vaccines, part two: advances in hepatitis С virus vaccine formulations and modalities. Expert Opin Ther Pat. 2012; 22 (4): 391-415). Среди них особый интерес представляет вирусный белок NS3, обладающий протеазной и геликазной активностью и играющий важную роль в размножении вируса (Dubuisson J. Hepatitis С virus proteins World J Gastroenterol 2007 May 7; 13 (17): 2406-2415). У пациентов с эффективным контролем за вирусом наблюдается наиболее сильный и устойчивый Т-клеточный иммунный ответ к эпитопам вирусного белка NS3 (Bronowicki JP, Vetter D, Uh G, Hudziak H, Uhrlacher A, et al. 1997; Lymphocyte reactivity to hepatitis С virus (HCV) antigens shows evidence for exposure to HCV in HCV-seronegative spouses of HCV-infected patients. J Infect Dis 176, 2: 518-522; Diepolder HM, Gerlach JT, Zachoval R, et al. 1997.Immunodominant CD4. T-cell epitope within nonstructural protein 3 in acute hepatitis С virus infection. J Virol 71: 6011-6019). Кроме того показано, что высокая цитотоксическая активность NS3-cпeцифичecкиx Т-клеток ассоциирована с ответом на терапию интерфероном-α (Vertuani S, Bazzaro М, Gualandi G, et al. 2002; Effect of interferon-alpha therapy on epitope-specific cytotoxic T lymphocyte responses in hepatitis С virus-infected individuals. Eur J Immunol 32: 144-154).
Для улучшения стимуляторной активности ДК (как in vitro так и in vivo) обсуждается использование цитокинов и синтетических агонистов TLR, индуцирующих созревание ДК и экспрессию ими ко-стимуляторных молекул, а также блокирование ингибиторных молекул на ДК (Kornbluth RS1, Stone GW. Immunostimulatory combinations: designing the next generation of vaccine adjuvants. J Leukoc Biol. 2006 Nov; 80 (5): 1084-102. Epub 2006 Aug 24.).
Известна лекарственная композиция для лечения хронического вирусного гепатита С, характеризующаяся тем, что она содержит, по меньшей мере, один из группы активных ингредиентов - IL-15, стимуляторы созревания миеловидных дендритных клеток (например, CpG-олигонуклеотид, CpG-дезоксинуклеотид, GM-CSF, IL-4, CD40L, polyl, TNF-α, IFN-β), лектин-связывающее вещество (например, карбогидрат маннозы, карбогидрат фукозы, анти-лектиновые антитела), а также способ лечения хронического гепатита С с использованием такого активного ингредиента (ов). В приведенной выше фармацевтической композиции можно использовать интерферон-α (ИФН/IFN-α) вместе с этими активными ингредиентами (US 2007110714, А61К 31/7004, 2007).
Недостатком этого способа является то, что вся доказательная база построена на исследованиях in vitro, в которых демонстрируется способность входящих в состав композиции ингредиентов усиливать экспрессию молекул MICA/B на ДК (являющиеся лигандами NKG2D-сигнального пути активации НК клеток) и активировать цитолитичесую активность НК-клеток доноров и больных ХГС, а также подавлять чувствительность ДК к инфицированию рекомбинантным вирусом везикулярного стоматита. Однако в патенте отсутствуют данные об анализе иммунокорригирующего эффекта и клинической эффективности композиции при лечении больных ХГС. Кроме того, данный метод иммунотерапии, будучи направленным на улучшение функции ДК, является неспецифическим.
Известна вакцина против вируса гепатита С, созданная на основе нереплицируемого аденовируса, содержащего различные варианты рекомбинации неструктурных генов серии NS, включая NS3/NS4 и NS4/NS5, а также способы получения и применения этой вакцины (US 2010310605, А61K 39/29, А61Р 31/14, 2010). Трансфецированные указанными конструкциями ДК доноров и больных ХГС были способны индуцировать в культуре in vitro антигенспецифический иммунный ответ, который подтверждался в ELISPOT-тесте возрастанием количества Т-клеток, продуцирующих IFN-γ и гранзим В. Также продемонстрирована безопасность аденовирусных вакцин, несущих HCVNS3/NS4 или HCVNS4/NS5 гены, и их способность индуцировать сильный клеточный иммунный ответ при внутримышечном введении экспериментальным животным.
Недостатком этого метода можно считать отсутствие доказательств развития устойчивого иммунного ответа и его эффективности при использовании данной вакцины в лечении больных ХГС.
Известен способ профилактики и лечения ХГС, основанный на использовании для иммунизации против вируса гепатита С композиций, включающих вирусные антигены и антигенные пептиды, соответствующие или полученные из белков или их фрагментов вируса гепатита С, соединенные с тяжелой и/или легкой цепью антител (или их фрагментов), специфических для дендритных клеток (WO 2012135132, А61K 39/12, С07K 14/005, 2012). Композиция также может включать как минимум один из агонистов Toll-like рецепторов (TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8) и один или более фармацевтически приемлемых носителей или адъювантов. В описании патента авторы демонстрируют, что ДК, полученные от больных ХГС (предварительно пролеченных интерферонами и рибавирином), нагруженные с помощью коньюгатов антител против CD40 и/или DCIR и HCV NS3 и NS5 антигенов вызывают in vitro экспансию CD4+ Т-клеток, распознающих широкий спектр антигенных пептидов и продуцирующих IFN-γ и TNF-α.
Однако метод является технологически сложным и дорогостоящим. Кроме того, как и в предыдущем патенте, отсутствуют доказательства его эффективности при использовании in vivo, т.е. при лечении пациентов ХГС.
Иммунный ответ против вируса гепатита С может быть индуцирован с помощью ДК, трансфецированных аденовирусом, содержащим нуклеотидные последовательности, кодирующие вирусные антигены. Показано, что ДК здоровых доноров после трансфекции рекомбинантным аденовирусным вектором, содержащим Core (1-191) и NS3 (1027-1657) гены, экспрессируют HCV Core и NS3 белки и способны вызывать пролиферацию антигенспецифических Т-клеток и продукцию ими цитокинов (Li W., Krishnadas D.K., Li J., Tyrrell D.L., Agrawal B. Induction of primary human T cell responses against hepatitis С virus-derived antigens NS3 or core by autologous dendritic cells expressing hepatitis С virus antigens: potential for vaccine and immunotherapy. J Immunol. 2006; 176 (10): 6065-75.).
Позднее было показано, что ДК, трансфецированные аденовирусом, содержащим ген NS3 (AdNS3) и адапторную молекулу CFm/h40L, вызывающую созревание ДК, активировали in vitro специфические интерферон-γ-продуцирующие Т-клетки у здоровых доноров и больных ХГС и вызывали сильный ответ CD4 и CD8 Т клеток против HCV NS3 при иммунизации. ДК, трансфецированные аденовирусом, содержащим ген NS3 (AdNS3) и адапторную молекулу CFm/h40L, вызывающую созревание ДК, активировали in vitro специфические интерферон-γ-продуцирующие Т-клетки у здоровых доноров и больных ХГС и вызывали сильный ответ CD4+ и CD8+ Т клеток против HCV NS3 при иммунизации. Причем в отличие от ДК доноров (способных индуцировать специфический иммунный ответ при трансфекции только одного AdNS3), ДК больных индуцировали NS3-специфический ответ только при совместной трансфекции AdNS3 и адапторной молекулы CFh40L (Echeverria I1, Pereboev А, Silva L, Zabaleta A, Riezu-Boj JI, Bes M, Cubero M, Borras-Cuesta F, Lasarte JJ, Esteban JI, Prieto J, Sarobe P. Enhanced T cell responses against hepatitis С virus by ex vivo targeting of adenoviral particles to dendritic cells. Hepatology. 2011 Jul; 54 (1): 28-37. doi: 10.1002/hep.24325. Epub 2011 May 14.). На основании этих данных был разработан способ иммунотерапии, основанный на вакцинации пациентов ХГС ДК, трансфецированными AdNS3 и адапторной молекулой CFh40L Согласно этому способу ДК получали из моноцитов, которые выделяли с помощью магнитной сепарации с использованием системы CliniMACS CD14 System. Выделенные моноциты культивировали с ГМ-КСФ и ИЛ-4 и трансдуцировали аденовирусом, кодирующим ген NS3 и адапторный белок CFh40L. Клиническая апробация метода на 5 пациентах с ХГС показала, что 3-кратная подкожная вакцинация аутологичными ДК, трансфецированными AdNS3 не вызывала побочных эффектов но и не улучшала биохимические показатели, а также не снижала вирусную нагрузку.
Авторы объяснили это неспособностью ДК-вакцины индуцировать у больных сильный и устойчивый иммунный ответ. Так, кратковременная активация интерферон-γ-продуцирующих Т-клеток в ответ на стимуляцию периферических мононуклеарных клеток больных рекомбинантным NS3 белком наблюдалась только у 1 из 5 пациентов. Низкую иммуностимулирующую активность вакцины у больных ХГС авторы объяснили усилением продукции интерлейкина-10 (ИЛ-10) дендритными клетками больных и генерацией регуляторных Т-клеток с супрессорной активностью после трансдукции адапторной молекулы (Zabaleta А, D'Avola D, Echeverria I, Llopiz D, Silva L, Villanueva L, Riezu-Boj JI, Larrea E, Pereboev A, Lasarte JJ, Rodriguez-Lago I, Icarrairaegui M, Sangro B, Prieto J, Sarobe P.Clinical testing of a dendritic cell targeted therapeutic vaccine in patients with chronic hepatitis С virus infection. Mol Ther Methods Clin Dev. 2015 Mar 11; 2: 15006. doi: 10.1038/mtm.2015.6. eCollection 2015).
Известны способы и составы для иммунизации против вируса гепатита С (патент Канады СА 2831294, А61K 39/29, 2012). Описанные композиции состоят из вирусных антигенов и антигенных пептидов, соответствующих или полученных из белков вируса гепатита С или их фрагментов, соединенных с тяжелой или легкой цепью антител или их фрагментов, специфичных к дендритным клеткам. Описанные компоненты могут быть использованы в качестве иммуностимулирующих композиций (HCV вакцины, HCV антиген-презентирующие дендритные и др.); в качестве методов усиления эффективности презентации вирусных антигенов антиген-презентирующими клетками, методов профилактики и лечения гепатита С у человека и методов иммуностимуляции посредством активации дендритных клеток. Антиген HCV выбирают из группы, состоящей из Е1, Е2 оболочечных белков, неструктурных белков NS3, NS4B, NS5B, и его фрагментов (п. 36 формулы).
Однако известно, что Е1 и Е2 белки вируса гепатита С ингибируют функции ДК (Sarobe Р, Lasarte JJ, Zabaleta A, Arribillaga L, Arina A, Melero I, Borrás-Cuesta F, Prieto J. Hepatitis С virus structural proteins impair dendritic cell maturation and inhibit in vivo induction of cellular immune responses. J Virol. 2003 Oct; 77 (20): 10862-71.) и оказывают ингибирующее действие на активацию Т-клеток (Bhattarai N, McLinden JH, Xiang J, Kaufman TM, Stapleton JT. Conserved Motifs within Hepatitis С Virus Envelope (E2) RNA and Protein Independently Inhibit T Cell Activation. PLoS Pathog. 2015 Sep 30; 11 (9): e1005183. doi: 10.1371/journal.ppat.1005183. Collection 2015), т.е. могут оказывать выраженный иммуносупрессивный эффект.
Известен способ иммунотерапии вирусной инфекции (US 2010143405, А61K 39/12, 2010), согласно которому с целью индукции клеточного иммунного ответа у больных хроническим вирусным гепатитом С (ХВГС) используют введение аутологичных дендритных клеток, генерированных и нагруженных (пульсированных) антигенами HCV в культуре in vitro. ДК больных ХГС генерируют из моноцитов, которые выделяют с помощью магнитной сепарации с использованием системы CliniMACS CD14 System. Моноциты периферической крови больных культивируют в присутствии ГМ-КСФ (1000 МЕ/мл) и ИЛ-4 (800 МЕ/мл) в течение 4-5 суток. На этом этапе клетки пульсируют антигеном, который представляет собой HLA А2-рестриктированные липопептиды, состоящие из эпитопов хелперных и цитотоксических Т-клеток (соответствующих аминокислотным последовательностям, кодируемым HCV генами Core, NS3 и NS4), соединенных с липидным остатком Pam2Cys, который одновременно является лигандом для Toll-подобных рецепторов 2 типа (TLR-2).
Используемая антигенная конструкция одновременно является лигандом для TLR-2, она способна индуцировать конечную дифференцировку ДК без добавления каких-либо дополнительных дозревающих стимулов. ДК вводят внутрикожно и внутривенно.
Однако предложенный способ имеет ограничения, в частности, может использоваться только у пациентов с HLA-A2 фенотипом, поскольку для нагрузки ДК используются HLA-A2 рестриктированные пептиды. Способ является технологически сложным и дорогостоящим. В частности, для получения моноцитов требуется проводить процедуры сепарации на оборудовании CliniMACS (Miltenyli Biotec) с использованием соответствующего одноразового расходного материала/реагентов (сетов). При этом чтобы получить необходимое количество СD14+моноцитов процедуры сепарации крови могут повторяться. Кроме того, в процессе генерации зрелых, антиген-пульсированных ДК требуется многократно обновлять культуральную среду с добавлением дорогостоящих рекомбинантных цитокинов ГМ-КСФ (1000 МЕ/мл) и ИЛ-4 (800 МЕ/мл). Получение ДК путем культивирования прилипающей фракции мононуклеарных клеток периферической крови (CD14+моноцитов) в присутствии ГМ-КСФ и ИЛ-4 является стандартным протоколам (Thurner В., Roder С., Dieckmann D., Heuer М., Kruse М., Glaser A. et al. Generation of large numbers of fully mature and stable dendritic cells from leukapheresis products for clinical applications. J Immunol Methods. 1999; 223 (1): 1-15. PMID: 10037230).
Однако генерируемые таким образом незрелые дендритные клетки (ИЛ4-ДК) обладают низкой миграционной активностью и в условиях дефицита ростовых факторов могут подвергаться обратной трансформации в моноциты и, соответственно, могут быстро терять свои уникальные антиген-презентирующие свойства. Кроме того, авторами предлагается значительную часть полученных ИЛ4-ДК вводить внутривенно. Однако анализ клинической эффективности ДК-вакцин при онкологических заболеваниях свидетельствует, что внутривенный режим вакцинотерапии менее эффективен чем подкожный/внутрикожный (Draube A, Klein-Gonzblez N, Mattheus S, et.al Brillant С, Hellmich M, Engert A, von Bergwelt-Baildon M. Dendritic cell based tumor vaccination in prostate and renal cell cancer: a systematic review and meta-analysis. PLoS One. 2011 Apr 20; 6 (4): e18801). Важно отметить, что ДК у больных ХГС несут признаки толерогенных ДК, что проявляется их незрелостью, низкой аллостимуляторной активностью и снижением продукции провоспалительных цитокинов. В то же время известно, что активация толерогенных ДК через TLR2 приводит к усилению продукции IL-10 и снижению продукции TNF-a и IL-12 (Chamorro S. TLR Triggering on Tolerogenic Dendritic Cells Results in TLR2 Up-Regulation and a Reduced Proinflammatory Immune Program. J Immunol 2009; 183: 2984-2994), что может негативным образом сказываться на способности ДК индуцировать иммунный ответа.
Кроме того, хорошо известно, что эффективность специфической иммунотерапии во многом зависит не только от иммуногенности вакцины, но и от одновременного использования неспецифической иммунотерапии с помощью различных адъювантов. Однако в способе-прототипе данный фундаментальный принцип проведения активной специфической иммунотерапии полностью игнорируется.
Таким образом протокол генерации ДК, способ их созревания через активацию TLR2, выбор HLA-A2 рестриктированных пептидов для нагрузки, использование внутривенного пути введения ДК и отсутствие адъюванта при проведении вакцинотерапии являются факторами, ослабляющими потенциальную эффективность вакцины, что может негативно отразиться на индукции противовирусного иммунного ответа в процессе иммунотерапии. Действительно, проверка авторами эффективности предложенной композиции в клинических испытаниях не выявила значительных клинических результатов. Несмотря на то, что вакцинация ДК, нагруженными липопептидами, хорошо переносилась, появление Core-специфических цитотоксических Т-лимфоцитов отмечалось только у 3 из 6 пациентов, а NS3-специфических CD8 Т-клеток у 1 из 6 пациентов, причем иммунный ответ не был устойчивым и не сопровождался снижением вирусной нагрузки (Gowans EJ, Roberts S, Jones К, Dinatale I, La tour PA, Chua B, Eriksson EM, Chin R, Li S, Wall DM, Sparrow RL, Moloney J, Loudovaris M, Ffrench R, Prince HM, Hart D, Zeng W, Torresi J, Brown LE, Jackson DC. A phase I clinical trial of dendritic cell immunotherapy in HCV-infected individuals. J Hepatol. 2010 Oct; 53 (4): 599-607.).
Известен способ лечения хронического вирусного гепатита С с помощью композиции, состоящей из дендритных клеток, полученных из моноцитов крови больного с фрагментами NS3 белка и активированных фитогемагглютинином Т-лимфоцитов больного (RU 2447899, А61K 39/29, 2011). ДК генерируют в присутствии GM-CSF и IL-4 или IL-15 или интерферон-α. Фрагмент NSS-белка включает последовательность из 192 аминокислот (1027-1218). Дендритные клетки нагружаются антигеном путем электропорации и вводятся внутрикожно в дозе 5-10 5-10^7 клеток/мл, а Т-клетки в дозе 10^7 /мл. Курс лечения продолжается в течение 5-10 недель и в комбинации с противовирусной терапией позволяет добиться снижения вирусной нагрузки у пациентов, ранее не отвечавших на противовирусную терапию. Преимуществом данной композиции авторы считают использование большого фрагмента NS3-белка для нагрузки ДК, который несет множественные антигенные детерминанты. Кроме того, ДК вводятся в комбинации с фитогемагглютинин-активированными Т-клетками для реализации Th1 ответа Т-лимфоцитами больного.
Недостатком метода является то, что он является трудоемким, в частности, требует многократных еженедельных процедур забора крови и приготовления ДК и активированных Т-клеток, а также требует специального оборудования для электропарации. Кроме того, метод имеет ограничения для клинического внедрения, поскольку используемый для активации Т-клеток фитогемагглютинин разрешен только для лабораторных исследований в силу его канцерогенности. В доказательной базе отсутствуют данные об индукции иммунного ответа.
Наиболее близким к заявленному изобретению является способ иммунотерапии хронического вирусного гепатита С (RU 2323744, А61K 39/29, 2006), включающий введение больному аутологичных дендритных клеток, которые генерируют из клеток периферической крови с помощью индукторов дифференцировки, нагруженных антигенами, кодирующими вирусные белки, и индуцированных к дальнейшему созреванию, и применение интерлейкина-2 в качестве адъюванта. В способе используют вакцину против вируса гепатита С, которая содержит полинуклеотид, кодирующий полипептидные последовательности белков HCV. Полинуклеотид может использоваться в виде экспрессирующего вектора, в частности, введен in vitro в дендритные клетки, которые впоследствии возвращают пациенту. В качестве антигена применяют полинуклеотид, кодирующий полипептидные последовательности белков HCV: core, NS3, NS4B и NS5B, где данный полинуклеотид не кодирует другой белок HCV. Полинуклеотид кодирует core-белок, который укорочен с карбоксильного конца и состоит из последовательности Core1-151, либо Core1-165. В одном из вариантов вакцины полинуклеотид может быть экспрессирован в виде одного или более слитых белков, например, представляет собой двойное слияние, состоящее из полипептидных последовательностей NS3 и Core. В полинуклеотиде, кодирующим белок NS3, протеазная активность аннулирована посредством мутации. В качестве индукторов дифференцировки дендритных клеток используют цитокины - GM-CSF, IL-4, IL-13 и/или TNF, которые добавляют в культуры моноцитов, полученных из периферической крови. Использование интерферона-α для получения ДК в описании не указано. Интерлейкин-2 среди прочих подходящих адъювантов входит в состав фармацевтической композиции, а не используется в виде отдельных подкожных инъекций.
Данный способ не позволяет индуцировать стойкий противовирусный антигенспецифический Т-клеточный ответ у пациентов ХГС, так как белок NS3 и терминальные с карбоксильного конца фрагменты белка Core, присутствующие во фрагментах Core (1-151 и 1-165), обладают иммуносупрессивными свойствами, в том числе ингибируют созревание ДК.
Задачей настоящего изобретения является разработка способа иммунотерапии хронического вирусного гепатита С, позволяющего индуцировать стойкий противовирусный антигенспецифический Т-клеточный ответ у пациентов ХГС.
Поставленная задача решается тем, что в способе иммунотерапии хронического вирусного гепатита С, включающем введение больному аутологичных дендритных клеток, которые генерируют из клеток периферической крови с помощью индукторов дифференцировки, нагруженных антигенами, кодирующими вирусные белки, и индуцированных к дальнейшему созреванию, и применение интерлейкина-2 в качестве адъюванта, в качестве антигена применяют комбинацию фрагментов рекомбинантных вирусных белков Core (1-120 ак) и NS3 (1192-1457 ак), созревание ДК индуцируют с помощью азоксимер бромида, дендритные клетки применяют 2 курсами посредством подкожных вакцинаций, сочетая введение ДК с подкожными интермиттирующими инъекциями рекомбинантного интерлейкина-2 в качестве адъювантной неспецифической терапии больным хроническим вирусным гепатитом С.
В качестве индукторов дифференцировки дендритных клеток используют гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и интерферон-альфа (ИФН-α).
Предложенный способ на наш взгляд является новым. Предложенная комбинация усеченных фрагментов структурного и неструктурного белка (Core 1-120ак) и 266 NS3 (1192-1457ак) не обладает ингибирующим действием на ДК при их нагрузке. Согласно данным литературы иммуносупрессивная активность свойственна в большей степени полноразмерным вирусным белкам, тогда как усеченные фрагменты HCV белков или их пептиды не обладают выраженными иммуносупрессивными свойствами (Krishnadas DK, Ahn JS, Han J, Kumar R, Agrawal B. Immunomodulation by hepatitis С virus-derived proteins: targeting human dendritic cells by multiple mechanisms. Int Immunol. 2010; 22 (6): 491-502; Landi A, Yu H, Babiuk LA, van Drunen Littel-van den Hurk S. Human dendritic cells expressing hepatitis С virus core protein display transcriptional and functional changes consistent with maturation. J Viral Hepat. 2011; 18: 700-13). Иммуносупрессивные свойства фрагментов белка Core, предложенные в прототипе, - известны (Zhu W., Chang Y., Wu С., Han Q., Pei R., Lu M., Chen X. The Wild-Type Hepatitis С Virus Core Inhibits Initiation of Antigen-Specific T- and B-Cell Immune Responses in BALB/c Mice Clin Vaccine Immunol. 2010 Jul; 17 (7): 1139-1147). Используемые в предложенном изобретении для нагрузки HCV Core и NS3 рекомбинантные белки представляют фрагменты, состоящие, соответственно, из 120 и 266 аминокислот, которые включают большое количество иммуногенных эпитопов, распознаваемых CD4 и CD8 Т-клетками. Важным моментом является то, что предложенные фрагментов структурного и неструктурного белка (Core 1-120ак) и 266 NS3 (1192-1457ак) являются крупными и в своем составе не ограничены HLA А2-рестриктированными эпитопами.
Для индукции созревания указанных ДК используется азоксимер бромида, который представляет адъювант DAMP-типа и способен активировать провоспалительные сигнальные пути и усиливать презентацию антигенов. В качестве индуктора дифференцировки дендритных клеток использована комбинация ГМ-КСФ с ИФН-α. Использование азоксимер бромида для созревания интерферон-α индуцированных ДК предложено нами впервые. Ранее была показана способность азоксимер бромида индуцировать созревание ДК, генерированных только в присутствие ГМ-КСФ и ИЛ-4 (RU2008102736, C12N 5/08, 2005).
Существенным моментом является то, что вакцинация ДК сочетается с подкожными интермиттирующими инъекциями рекомбинантного ИЛ-2. ИЛ-2 явлется известным активатором Т-клеток и способен повышать антигенспецифический Т-клеточный ответ при вирусной инфекции (Davey RT Jr, Murphy RL, Graziano FM, Boswell SL, Pavia AT, Cancio M, Nadler JP, Chaitt DG, Dewar RL, Sahner DK, Duliege AM, Capra WB, Leong WP, Giedlin MA, Lane HC, Kahn JO. Immunologic and virologic effects of subcutaneous interleukin 2 in combination with antiretroviral therapy: A randomized controlled trial. JAMA. 2000 Jul 12; 284 (2): 183-9.). С другой стороны, ИЛ-2 вызывает генерацию регуляторных Т-клеток с супрессорной активностью и может потенциировать иммуносупрессию (Boyman О., Sprent J. The role of interleukin-2 during homeostasis and activation of the immune system Nature Reviews Immunology 12, 180-190 March 2012). Направленность эффекта ИЛ-2 зависит от его дозы, пути и режима введения. Нами предложен режим интермиттирующего введения подкожно низких доз ИЛ-2, который не приводит к возрастанию количества регуляторных Т-клеток. Учитывая при этом способность низких доз ИЛ-2 усиливать стимуляторную активность ИФН-ДК (Леплина О.Ю., Сахно Л.В., Останин А.А., Богачев С.С, Черных Е.Р. Коррекция in vitro дисфункций интерферон-α-индуцированных дендритных клеток у больных иммунопатологическими состояниями // Вестник ВСНЦ РАМН - 2012. - №3. ч. 2. - С. 104-109), данный режим использования ИЛ-2 позволит повысить стимуляторную активность ДК без усиления генерации регуляторных Т-клеток и обеспечить тем самым устойчивость генерируемого иммунного ответа. Учитывая сниженную стимуляторную активность ДК у больных ХГС, дополнение вакцинотерапии ДК неспецифической иммунотерапией ИЛ-2 в виде подкожных инъекций позволит повысить эффективность антигенспецифического иммунного ответа, индуцированного ДК.
Заявленный способ осуществляется следующим образом.
Показанием для проведения специфической иммунотерапии является наличие РНК вируса гепатита С>10^4 копий/мл, резистентное течение заболевания при использовании стандартных методов терапии (препараты интерферона-альфа и рибавирин), отказ от проведения стандартной терапии вследствие развития осложнений или отсутствия финансовых возможностей проведения таковой. Для генерации ДК в стерильный флакон, содержащий раствор гепарина (из расчета 50 Ед/мл), забирают 200 мл венозной крови больного, отстаивают в термостате при 370 °С в течение 40 мин. Собранную лейковзвесь собирают в отдельный флакон, центрифугируют при 1000 об/мин 20 мин. Осажденные клетки лейковзвеси разводят фосфат-забуференным физиологическим раствором, наслаивают на градиент плотности фиколла-верографина и центрифугируют в течение 20 мин при 3000 об/мин. Собранные из интерфазы мононуклеарные клетки (МНК) двукратно отмывают и ресуспендируют в культуральной среде RPMI-1640, дополненной 5% аутоплазмы, 5 мМ HEPES-буфера и гентамицином в дозе 80 Ед/мл. Затем, выделенные МНК в концентрации 3×10^6/мл инкубируют в течение 2 ч при 37°С в стерильных пластиковых флаконах площадью 75 или 150 см2 (Falcon), после чего неприлипшие клетки удаляют, а фракцию прикрепившихся к пластику клеток культивируют в полной культуральной среде, дополненной 1,5% аутоплазмы, 40 нг/мл ГМ-КСФ (Sigma-Aldrich) и 1000 Ед/мл ИФН-альфа (Роферон-А, Roche, Швейцария) и в течение 3 суток при 37° в СO2-инкубаторе при 5% СO2.
Эффективность ДК-вакцин во многом зависит от свойств, генерируемых ДК. В качестве клеточной платформы для получения ДК нами выбран протокол генерации ДК из моноцитов в присутствии гранулоцитарно-макрофагального колониестимулирующего фактора и интерферон-α (ИФН-ДК). Недавние исследования показали важную роль интерферона-α в индукции дифференцировки и созревания ДК. Учитывая также, что интерферон-α продуцируется в ответ на вирусную инфекцию, можно полагать, что данный цитокин является физиологическим дифференцировочным фактором для ДК. Генерированные in vitro из моноцитов ИФН-ДК характеризуются частично зрелым фенотипом и обладают свойствами миелоидных, плазмацитоидных и натуральных киллерных клеток (Farkas А1, Kemény L. Interferon-б in the generation of monocyte-derived dendritic cells: recent advances and implications for dermatology. Br J Dermatol. 2011 Aug; 165 (2): 247-54. doi: 10.1111/j.1365-2133.2011.10301). Эти клетки отличаются стабильным фенотипом, продуцируют интерферон-α, обладают высокой миграционной активностью, а также большей эффективностью к кросспрезентации длинноразмерных пептидов, стимуляции цитотоксических Т-клеток и экспансии Т-клеток памяти, в отличие от клеток, генерируемых традиционно в присутствии ИЛ-4 (Delia Bella S., Nicola S., Riva A., Biasin M., Clerici M., Villa M.L. Functional repertoire of dendritic cells generated in granulocyte macrophage-colony stimulating factor and interferon-б. J Leukoc Biol., 2004, Vol. 75, no. 1, pp. 106-116; Ruben JM, Bontkes HJ, Westers TM, Hooijberg E, Ossenkoppele GJ, de Gruijl TD, van de Loosdrecht AA. Differential capacity of human interleukin-4 and interferon-б monocyte-derived dendritic cells for cross-presentation of free versus cell-associated antigen. Cancer Immunol Immunother. 2015, 64 (11): 1419-1427; Gessani S1, Conti L2, Del Corn M3, Belardelli F4. Type I interferons as regulators of human antigen, presenting cell functions. Toxins (Basel). 2014 May 26; 6 (6): 1696-723). Исследования in vivo на иммунодефицитных мышах подтвердили, что ИФН-ДК более эффективны в индукции вирус-специфических CD8+ Т клеток по сравнению с ИЛ4-ДК (Lapenta С, Santini SM, Spada М et al. IFN-alpha-conditioned dendritic cells are highly efficient in inducing cross-priming CD8(+) T cells against exogenous viral antigens. Eur J Immunol 2006; 36: 2046-60).
Сгенерированные ИФН-ДК нагружают (пульсируют) комбинацией из фрагментов специфических рекомбинантных вирусных антигенов - HCV Core (1-123) и NS3 (1192-1457) в дозе 5 мкг/мл во время часовой инкубации при 37°С. Созревание незрелых ИФН-ДК индуцируют путем последующего 24 ч культивирования ДК в присутствии азоксимер бромида (Полиоксидоний, НПО ПетроваксФарм, Москва) в дозе 2 нг/мл. Общее время получения ИФН-ДК, нагруженных специфическим вирусным антигеном, составляет таким образом 4 суток. Затем ИФН-ДК криоконсервируют в растворе 10% DMSO и 90% альбумина в концентрации 5,0×10^6/мл и хранят при -80°С до последующего использования. Иммунотерапию проводят в виде 2 курсов вакцинаций ДК. Первый «индукторный» курс включает 4 подкожных инъекций (в межлопаточную область) ИФН-ДК в дозе 5×10^6 клеток с 1-недельным интервалом. После завершения первого курса проводят второй поддерживающий курс ДК-вакцинаций в виде 6 подкожных инъекций ИФН-ДК в дозе 5×10^6 клеток с кратностью 1 раз в месяц. Одновременно с инъекциями ДК пациентам в качестве неспецифической адъювантной иммунотерапии подкожно в том же интермиттирующем режиме как и введение ДК интермиттирующими инъекциями вводится рекомбинантный интерлейкина-2 человека (рИЛ-2, Ронколейкин, ООО «Биотех», Санкт-Петербург) в дозе 250000ЕД в непосредственной близости к месту введения ДК.
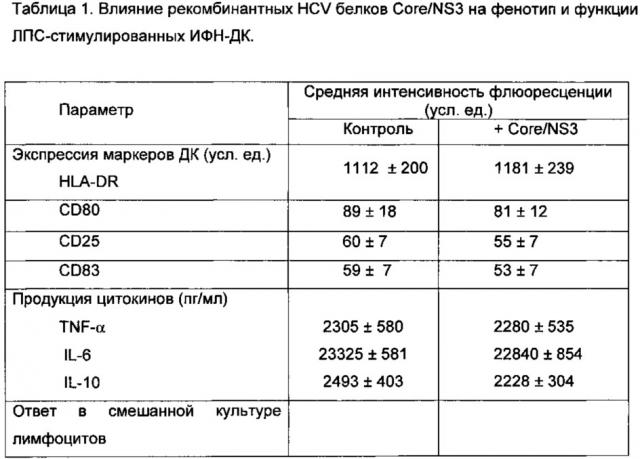
Фрагменты генов, кодирующих используемые для нагрузки ДК вирусных белков Core (1-120 ак) и NS3 (1192-1457 ак), получали с помощью обратной транскрипции с РНК HCV генотипа 1b с последующей амплификацией и клонированием в вектор pUC-18. Соответствие полученных последовательностей ДНК генам HCV генотипа 1b подтверждается секвенированием. Затем полученные фрагменты, кодирующие иммунодоминантные районы белков Core (1-120 ак) и NS3 (1192-1457 ак), переносили в плазмиду рЕТ-21 и рЕТ-28 соответственно и экспрессировали в Е. coli штамма BL21(DE3). Полученные рекомбинантные белки содержали дополнительно олигогистидиновые мотивы и очищались с помощью хроматографии на смоле His-Bind (Novagen) в соответствии с рекомендациями фирмы-производителя по денатурирующему протоколу в присутствии 8 М мочевины. Очищенные белки с помощью диализа переводились в фосфатно-солевой буферный раствор (рН=7,2) и подвергались стерилизующей фильтрации через мембрану с диаметром пор 0,2 мкм. В таблице 1 показано влияние рекомбинантных HCV белков Core/NS3 на фенотип и функции ЛПС-стимулированных ИФН-ДК.
Видно, что нагрузка ДК комбинацией рекомбинантных белков Core (1-120 ак) и NS3 (1192-1457 ак) не влияла на созревание ДК, поскольку средняя интенсивность флюоресценции HLA-DR, CD80, CD83 и CD25 в культурах ДК, нагруженных вирусными белками, и в контрольных культурах (ненагруженных вирусными антигенами) значимо не различалась. Используемые вирусные белки также не влияли на продукцию дендритными клетками TNF-α, IL-6 и IL-10. Аналогичным образом, уровень пролиферативного ответа МНК в алло-СКЛ в присутствии ИФН-ДК, нагруженных вирусными Core/NS3 белками, не отличался от такового в культурах контрольных ДК, указывая на отсутствие супрессорного влияния вирусных белков на стимуляторную активность ДК. Таким образом нагрузка ДК комбинацией рекомбина