Лекарственное средство для регуляции уровня глюкозы в крови
Иллюстрации
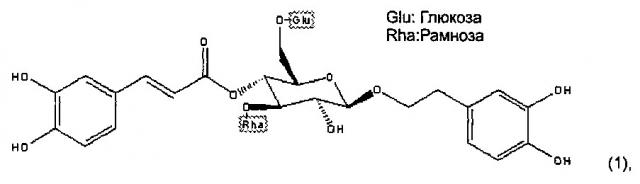
Показать всеГруппа изобретений относится к медицине, в частности к применению активного компонента для получения лекарственного средства для регуляции уровня содержания глюкозы в крови, при этом активный компонент выбирают из соединения формулы (1):
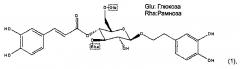
или его фармацевтически приемлемой соли, а так же к лечению сахарного диабета I типа, где активный компонент выбирают из соединения (2):
или его фармацевтически приемлемой соли. Осуществление изобретения позволяет расширить арсенал лекарственных средств для регуляции уровня сахара в крови и лечения диабета I типа. 2 н. и 16 з.п. ф-лы, 11 ил., 9 табл., 4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к лекарственному средству для повышения экспрессии мРНК SIRT1 и/или снижения экспрессии мРНК SOCS3 и, по существу, для регуляции уровня глюкозы в крови у субъектов, которые в этом нуждаются. В частности, изобретение относится к использованию активного компонента, содержащегося в экстракте цистанхе трубчатой (Cistanche tubulosa), при лечении сахарного диабета.
УРОВЕНЬ ТЕХНИКИ
Сахарный диабет - это хроническое нарушение обмена веществ, вызванное недостаточной секрецией инсулина или неэффективным применением глюкозы в тканях организма, что приводит к избыточно высокому уровню глюкозы в крови. Известно, что инсулин секретируется В-клетками поджелудочной железы. Инсулин является эффективным регулятором уровня сахара в крови и может стимулировать транспорт глюкозы в липоциты и мышечные клетки. Ожирение, старение и другие причины могут приводить к недостаточной секреции инсулина или низкой чувствительности к инсулину, вызывая повышение уровня глюкозы в крови и развитие сахарного диабета. Пациенты с сахарным диабетом могут страдать от таких симптомов, как жажда, излишне обильное мочеиспускание, нечеткость зрения и потеря веса. Длительное повышение уровня глюкозы в крови может приводить к нарушению функций и отказу различных органов.
Сахарный диабет можно в первую очередь разделить на диабет 1 типа и диабет II типа. Диабет 1 типа, также известный как инсулинозависимый сахарный диабет, вызывается инфекциями или природными токсинами, которые заставляют собственную иммунную систему пациента атаковать В-клетки поджелудочной железы. В результате этого В-клетки поджелудочной железы повреждаются, что приводит к абсолютной недостаточности инсулина и повышению уровня сахара в крови. Диабетом 1 типа страдает приблизительно 5-10% всех пациентов с сахарным диабетом. Большинству пациентов с диабетом 1 типа диагноз ставится в возрасте до 30, и поэтому диабет 1 типа также известен как ювенильный сахарный диабет.
Диабет II типа также известен как инсулиннезависимый сахарный диабет. Большинству пациентов с диабетом II типа диагноз ставится в возрасте после 40 лет, и поэтому он также известен как сахарный диабет зрелого возраста. Диабетом II типа страдает приблизительно 90-95% всех пациентов с сахарным диабетом. Диабет 2 типа вызывается развитием в клетках устойчивости к инсулину, что постепенно приводит к снижению секреции инсулина В-клетками поджелудочной железы и вызывает диабетическое нарушение обмена веществ. Пациенты с диабетом 2 типа часто одновременно страдают от гиперлипидемии, ожирения и других симптомов. Факторы риска для развития диабета 2 типа включают в себя генетические нарушения, случаи наличия диабета в семье, возраст, ожирение (в особенности абдоминальное ожирение), пониженную физическую активность, гестационный диабет, нарушения гомеостаза глюкозы и т.д.
Число больных сахарным диабетом увеличивается с каждым годом. По данным Всемирной организации здравоохранения за 2008 год, ожидается, что в 2030 году во всем мире будет насчитываться более 300 миллионов людей, страдающих сахарным диабетом. В настоящее время способы, используемые для клинического лечения сахарного диабета, включают в себя физические упражнения, диету и лекарственное средствоозное лечение. Лекарственное средствоозное лечение включает в себя инъекции инсулина, прием оральных гипогликемических лекарственных средств, например лекарств на основе сульфонилмочевины (производные сульфонилмочевины), лекарств на основе бигуанида (производные бигуанида), ингибиторов α-глюкозидазы, средств, повышающих чувствительность к инсулину, и т.д.
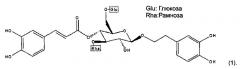
Авторы настоящего изобретения обнаружили, что соединение формулы (I) оказывает очень хорошее воздействие на повышение экспрессии мРНК SIRT1 и/или снижение экспрессии мРНК SOCS3, и является эффективным средством снижения уровня глюкозы в крови, и таким образом, может использоваться для регуляции уровня глюкозы в крови у нуждающихся в этом субъектов, в частности, для лечения диабета 1 типа и/или диабета II типа у нуждающихся в этом субъектов:
где X представляет собой Н или С1-С3-алкил; один из Y и Z представляет собой , а другой представляет собой Н, ОН или , при условии, что когда Y представляет собой , Z представляет собой ; R1-R13 независимо обозначают Н или ОН, при этом R1-R3 не являются одновременно водородом, и R8 и R9 не являются одновременно водородом. Предпочтительно, соединение формулы (I) представляет собой по меньшей мере одно из соединений (1) или (2), указанных ниже, и может быть получено из растительного экстракта, например, экстракта цистанхе трубчатой (Cistanche tubulosa),
Цистанхе трубчатая (Cistanche tubulosa) принадлежит к роду цистанхе семейства заразиховых. Активные компоненты цистанхе трубчатой в основном являются фенилэтаноидными гликозидами и включают в себя эхинакозид, актеозид и изоактеозид. Команда исследователей Шанхайского университета традиционной китайской медицины (Китай) провела исследование in vitro потребления глюкозы с применением клеток печени и провела испытания in vivo эффективности вызываемого лекарствами гипогликемического эффекта с применением мышей с диабетом 1 типа или диабетом 2 типа под действием различных лекарственное средствоов. Результаты показали, что актеозид, полученный из подорожника, эффективен в плане способствования увеличению потребления глюкозы и может снижать уровень глюкозы в крови натощак за счет повышения уровня сывороточного инсулина (см. публикацию китайского патента № CN 102283854 А, которая полностью включена в настоящее описание посредством ссылки). Исходя из этого в настоящем изобретении активные ингредиенты экстракта цистанхе трубчатой (Cistanche tubulosa) определялись путем применения животной модели сахарного диабета и теста на потребление глюкозы печеночными клетками.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение способа применения активного компонента для производства лекарственного средства, отличающегося тем, что это лекарственное средство предназначено для повышения экспрессии мРНК SIRT1 (сиртуина 1) и/или снижения экспрессии мРНК SOCS3 (супрессора цитокиновой сигнализации-3), и может использоваться для регуляции уровня глюкозы в крови у нуждающегося в этом субъекта. Активный компонент выбирается из группы, состоящей из соединения формулы (I), фармацевтически приемлемой соли соединения формулы (I) и их комбинаций,
где X представляет собой Н или С1-С3-алкил; один из Y и Z представляет собой , а другой представляет собой Н, ОН или , при условии, что когда Y представляет собой , то Z представляет собой ; R1-R13 независимо обозначают Н или ОН, при этом R1-R3 не являются одновременно водородом, и R8 и R9 не являются одновременно водородом.
Другой целью настоящего изобретения является обеспечение способа повышения экспрессии мРНК SIRT1 и/или снижения экспрессии мРНК SOCS3, или регуляции уровня глюкозы в крови у нуждающегося в этом субъекта, содержащего введение субъекту эффективного количества активного компонента, выбранного из группы, состоящей из соединения формулы (I), фармацевтически приемлемой соли соединения формулы (I) и их комбинаций.
Детальная технология и предпочтительные варианты осуществления настоящего изобретения описаны далее и показаны в сопровождающих чертежах для разъяснения специалистам в данной области техники отличительных признаков заявленного изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 - диаграмма, иллюстрирующая массу тела крыс линии Sprague-Dawley (SD), обработанных в различных условиях;
Фиг. 2 - диаграмма, иллюстрирующая кривую потребления калорий крысами линии SD, обработанных в различных условиях;
Фиг. 3 - диаграмма, иллюстрирующая кривую концентрации глюкозы в плазме крови крыс линии SD, обработанных в различных условиях;
Фиг. 4 - столбчатая диаграмма, иллюстрирующая площадь под кривой концентрации глюкозы в плазме крови крыс линии SD, обработанных в различных условиях;
Фиг. 5 - диаграмма, иллюстрирующая кривую концентрации оксида азота (NO) в плазме крови крыс линии SD, обработанных в различных условиях;
Фиг. 6 - диаграмма, иллюстрирующая кривую концентрации фактора некроза опухолей альфа (TNF-α) в плазме крови крыс линии SD, обработанных в различных условиях;
Фиг. 7 - диаграмма, иллюстрирующая кривую концентрации интерлейкина-6 (IL-6) в плазме крови крыс линии SD, обработанных в различных условиях;
Фиг. 8 - диаграмма, иллюстрирующая кривую уровня экспрессии мРНК SIRT1 в гипоталамической ткани мозга крыс линии SD, обработанных при различных условиях;
Фиг. 9 - диаграмма, иллюстрирующая кривую уровня экспрессии мРНК SOCS3 в гипоталамической ткани мозга крыс линии SD при различных состояниях;
Фиг. 10 - диаграмма результатов анализа потребления углеводов, проведенного с применением клеток печени крыс, обработанных при различных условиях; и
Фиг. 11 - диаграмма результатов анализа потребления углеводов, проведенного с применением клеток печени крыс, обработанных при различных условиях (в зависимости от дозы).
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ
Ниже приводится подробное описание некоторых вариантов осуществления настоящего изобретения. При этом без отступления от сущности настоящего изобретения следует отметить, что настоящее изобретение может быть реализовано в различных вариантах и не должно ограничиваться лишь вариантами осуществления, представленными в данном описании. Кроме того, если в описании не оговорено иное, слова, употребляемые с определенным и неопределенным артиклем и т.п. в настоящем описании (в особенности, в формуле изобретения), подразумевают как единственное, так и множественное число. Более того, термин «эффективное количество», используемый в настоящем описании, обозначает количество соединения, которое способно по меньшей мере частично облегчить состояние, в котором находится субъект, при его введении субъекту. Термин «субъект» в настоящем описании обозначает млекопитающих, включая животных и людей. Термины «лечение» или «лечить» включают в себя предотвращение соответствующих заболеваний и/или патологий, улучшение течения конкретных заболеваний и/или патологических процессов, и/или предотвращение или устранение заболеваний и/или патологий. Термин «регуляция уровня глюкозы в крови субъекта» означает доведение концентрации глюкозы в крови субъекта до нормального уровня. Единица «мг/кг массы тела», используемая в настоящем описании, означает необходимую дозировку, применяемую на кг массы тела.
Настоящее изобретение предусматривает применение активного компонента в производстве лекарственного средства, при котором лекарственное средство предназначен для повышения экспрессии мРНК SIRT1 и/или снижения экспрессии мРНК SOCS3, или для регуляции уровня глюкозы в крови у нуждающихся в этом субъектов, и этот активный компонент выбирается из группы, состоящей из соединения формулы (I), фармацевтически приемлемой соли соединения формулы (I) и их комбинаций,
где X представляет собой Н или С1-С3-алкил; один из Y и Z представляет собой , а другой представляет собой Н, ОН или , при условии, что когда Y представляет собой , то Z представляет собой ; R1-R13 независимо обозначают Н или ОН, при этом R1-R3 не являются одновременно водородом, и R8 и R9 не являются одновременно водородом.
В формуле (I), предпочтительно, X представляет собой С1-С3 алкильную группу, такую как метил, этил, линейный пропил или разветвленный пропил; Y и Z оба не представляют собой водород; и/или два из R1-R3 представляют собой ОН. Более предпочтительно, чтобы X представлял собой метил.
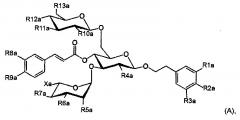
В одном из предпочтительных вариантов осуществления настоящего изобретения соединение формулы (I) имеет следующую структурную формулу (А):
где Ха представляет собой Н или С1-С3-алкил; a R1a-R13a независимо обозначают Н или ОН, где R1a-R3a не являются одновременно водородом, и R8a и R9a не являются одновременно водородом.
В формуле (А), предпочтительно, Ха представляет собой С1-С3 алкильную группу, такую как метил, этил, линейный пропил или разветвленный пропил; а два из R1a-R3a представляют собой ОН. Более предпочтительно, чтобы Ха представлял собой метил. Еще более предпочтительно, чтобы Ха представлял собой метил, два из R1a-R3a являлись ОН, a R8a и R9a оба являлись ОН. Вариантом осуществления соединения формулы (А) является соединение (1) (т.е. эхинакозид):
В другом предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) имеет структурную формулу (С):
где Хс представляет собой Н или С1-С3-алкил; Yc является Н, ОН или ; a R1c-R13c независимо обозначают Н или ОН, где R1c-R3c не являются одновременно водородом, и R8c и R9c не являются одновременно водородом.
В формуле (С), предпочтительно, Хс представляет собой C1-С3 алкильную группу, такую как метил, этил, линейный пропил или разветвленный пропил; а два из R1a-R3a представляют собой ОН. Более предпочтительно, чтобы Хс представлял собой метил. Еще более предпочтительно, чтобы Хс представлял собой метил, два из R1a-R3a являлись ОН, a R8a и R9a оба являлись ОН. Вариантом осуществления соединения формулы (С) является соединение (2) (т.е. изоактеозид):
Таким образом, в некоторых вариантах осуществления настоящего изобретения активный компонент используется в производстве лекарственного средства для повышения экспрессии мРНК SIRT1 и/или снижения экспрессии мРНК SOCS3, или для регуляции уровня глюкозы в крови у нуждающихся в этом субъектов, где активный компонент выбирают из группы, состоящей из соединения (1), фармацевтически приемлемой соли соединения (1), соединения (2), фармацевтически приемлемых солей соединения (2) и их комбинаций,
Примеры упомянутых выше фармацевтически приемлемых солей активного компонента включают в себя, помимо прочего, соли щелочных металлов, например натриевую соль, калиевую соль.
В соответствии с настоящим изобретением лекарственное средство для повышения экспрессии мРНК SIRT1 и/или снижения экспрессии мРНК SOCS3 или для регуляции уровня глюкозы в крови у нуждающихся в этом субъектов может быть получено с применением активного компонента, выбранного из группы, состоящей из соединения (1), соединения (2) и их комбинаций. В этих вариантах осуществления активный компонент может быть получен путем экстракции из растения, такого как цистанхе трубчатая (Cistanche tubulosa), и, таким образом, активный компонент может использоваться в виде экстракта.
Экстракт цистанхе трубчатой (Cistanche tubulosa), включающий в себя соединение (1) и/или соединение (2), может быть приготовлен способом, содержащим следующие шаги: (а) экстракцию цистанхе трубчатой (Cistanche tubulosa) с помощью полярного растворителя для получения раствора экстракта; и (b) необязательную сушку раствора экстракта. Полярный растворитель - это вода и/или С1-С4-спирт, например, метанол, этанол, этиленгликоль, пропанол, изопропанол, пропиленгликоль, н-бутанол, изобутанол, mpem-бутанол, бутиленгликоль или их комбинация.
Предпочтительно, чтобы полярный растворитель выбирали из группы, состоящей из воды, метанола, этанола и их комбинаций. Более предпочтительно, чтобы полярный растворитель являлся водой, этанолом или их комбинацией. Количество полярного растворителя и цистанхе трубчатой (Cistanche tubulosa) может быть необязательно скорректировано. В целом, объемное соотношение между полярным растворителем и цистанхе трубчатой (Cistanche tubulosa) может варьироваться в диапазоне от примерно 1:1 до примерно 50:1, и предпочтительно от примерно 5:1 до примерно 20:1.
Нет никаких ограничений относительно того, какие части цистанхе трубчатой (Cistanche tubulosa) можно использовать для получения экстракта Cistanche tubulosa. Например, экстракт цистанхе трубчатой (Cistanche tubulosa) может быть получен путем экстракции из стеблей, цветков или целого растения цистанхе трубчатой (Cistanche tubulosa). В соответствии с одним вариантом осуществления настоящего изобретения для получения экстракта использовались сочные стебли цистанхе трубчатой (Cistanche tubulosa).
На шаге (а) экстракция осуществляется в течение определенного периода времени для достижения необходимой эффективности экстракции. Например, при использовании воды в качестве полярного растворителя время экстракции обычно составляет по меньшей мере 15 мин, предпочтительно по меньшей мере 30 минут и более предпочтительно, чтобы оно составляло по меньшей мере 60 минут. Необязательно, экстракция может сопровождаться другими соответствующими экстракционными методами (например, вывариванием, охлаждением, фильтрацией, концентрированием при пониженном давлении, колоночной хроматографии с применением смол и т.д.) для повышения эффективности экстракции. Необязательно, можно повторить экстракционный шаг (а) один или более раз с помощью того же или другого растворителя(-ей) и объединить все полученные, таким образом, жидкие фазы для получения раствора экстракта для шага (b), чтобы извлечь как можно большее количество активных компонентов, содержащихся в растении. Более того, можно повторить цикл шага (а) и шага (b) один или более раз для удаления как можно большего количества неактивных компонентов.
В одном варианте осуществления настоящего изобретения экстракт цистанхе трубчатой (Cistanche tubulosa) был приготовлен следующим методом. Цистанхе трубчатую (Cistanche tubulosa) замачивали в воде, вываривали, фильтровали, и этот цикл повторяли три раза. Фильтраты из различных циклов объединяли и концентрировали под вакуумом для получения концентрата с удельным весом 1,10. После этого в концентрат добавляли этанол до концентрации 60% и затем замораживали в течение 12 часов. Супернатант собирали и концентрировали под вакуумом для получения суммарного экстракта с удельным весом 1,10 и затем этанол удаляли. После этого суммарный экстракт растворяли в таком же количестве горячей воды для получения смеси. Полученную смесь вводили в колонку с макропористой абсорбирующей смолой для очистки. Колонку последовательно элюировали водой и 40% раствором этанола. Этанольный элюент собирали и концентрировали высушиванием для получения экстракта цистанхе трубчатой (Cistanche tubulosa). Полученный таким образом экстракт цистанхе трубчатой (Cistanche tubulosa) содержит относительно большое количество соединения (1) и относительно небольшое количество соединения (2).
В соответствии с настоящим изобретением лекарственное средство, полученное с применением соединения формулы (I), фармацевтически приемлемой соли соединения формулы (I) или их комбинации, может использоваться для повышения экспрессии мРНК SIRT1 и/или снижения экспрессии мРНК SOCS3, и в частности, для регуляции уровня глюкозы в крови у нуждающихся в этом субъектов, например при сахарном диабете 1 типа и/или сахарном диабете II типа. Известно, что SIRT1 может способствовать секреции инсулина β-клетками поджелудочной железы и может регулировать родственные факторы, вызывающие резистентность к инсулину, такие как свободные радикалы и провоспалительные факторы, и тем самым может улучшать состояния, вызванные инсулинрезистентностью. Кроме того, известно, что уровень экспрессии SOCS3 можно использовать в качестве индикатора резистентности к лептину. По этой причине, не ограничиваясь лишь теорией, можно предположить, что лекарственное средство, предлагаемое настоящим изобретением, может использоваться для регуляции уровня глюкозы в крови у нуждающихся в этом субъектов путем повышения экспрессии мРНК SIRT1 и/или снижения экспрессии мРНК SOCS3 у этих субъектов, а также для лечения заболеваний, связанных с уровнями экспрессии SIRT1, таких как невропатия (например, болезнь Альцгеймера (AD), болезнь Паркинсона (PD), болезнь Хантингтона (HD), амиотрофический боковой склероз (ALS) и т.д.), сердечнососудистые заболевания (например, коронарная недостаточность, гипотензия, гипертензия, гипергликемия, инсульт, инфаркт миокарда, тромбоз, артериосклероз и т.д.) и ожирение.
В зависимости от того, в чем нуждается субъект, лекарственное средство, описанное в настоящем изобретении, может вводиться в любой подходящей дозировке. Например, при его приеме человеком для регуляции уровня глюкозы в крови лекарственное средство вводится в количестве от примерно 0,5 мг до примерно 100 мг (в виде соединения формулы (I)) на кг массы тела в день, и, предпочтительно, от примерно 1 мг до примерно 55 мг (в виде соединения формулы (I)) на кг массы тела в день. Тем не менее, для пациентов с обострениями заболевания дозировку можно увеличить в несколько раз или в несколько десятков раз в зависимости от требований врача.
В соответствии с настоящим изобретением данный лекарственное средство может выпускаться в любой приемлемой для введения форме и может вводиться любым подходящим способом. Например, данный лекарственное средство может выпускаться в форме, пригодной для орального применения, интраназального применения, внутривенного, внутрибрюшинного и/или подкожного введения. Поскольку лекарственное средство в форме для орального применения удобен для его самостоятельного приема, в одном предпочтительном варианте осуществления настоящего изобретения лекарственное средство производится в форме для орального применения, например, в форме таблеток, капсул, гранул, порошка, жидкого экстракта, раствора, сиропа, суспензии, эмульсии, настойки и пр. В зависимости от его формы и назначения лекарственное средство может дополнительно содержать фармацевтически приемлемый носитель.
Если использовать производство лекарственного средства, пригодного для орального применения, в качестве примера, лекарственное средство может содержать фармацевтически приемлемый носитель, не оказывающий неблагоприятного влияния на желаемое действие активного компонента (т.е. соединения формулы (I) и/или фармацевтически приемлемой соли соединения формулы (I)), такого как растворитель, масляный растворитель, разбавитель, стабилизатор, средство для замедления всасывания, разрыхлитель, эмульгатор, антиоксидант, связующее, лубриканты и поглотитель влаги. Данный лекарственное средство может быть изготовлен в форме, пригодной для орального применения, любыми подходящими способами.
Что касается лекарственного средства, пригодного для подкожного или внутривенного введения, оно может содержать один или более компонентов, таких как изотонический раствор, солевой буферный раствор (например, фосфатный буфер или цитратный буфер), солюбилизатор, эмульгатор и другие носители для изготовления лекарственного препарата для внутривенного введения, эмульсии для внутривенного введения, порошка для инъекций, суспензии для инъекций или порошка для приготовления суспензии для инъекций.
В дополнение к вышеупомянутым адъювантам, лекарственное средство может дополнительно содержать другие добавки, такие как ароматизаторы, красители, тонирующие средства и т.д. для улучшения вкуса и внешнего вида готового лекарственного средства. Для увеличения срока хранения, лекарственное средство может также содержать подходящее количество консервантов, стабилизаторов, антисептиков, противогрибковых средств и т.д. Более того, лекарственное средство, описанное в настоящем изобретении, может содержать один или более других активных компонентов, таких как антиоксиданты (например, витамин Е), усилители чувствительности рецепторов к инсулину и т.д., для дополнительного повышения эффективности лекарственного средства или простоты применения лекарственного средства и его совместимости, при условии, что другие активные компоненты не будут оказывать отрицательного влияния на соединение формулы (I) и/или на фармацевтически приемлемую соль соединения формулы (I).
В зависимости от требований субъекта лекарственное средство согласно настоящему изобретению может применяться с различной частотой, например, один раз в день, несколько раз в день, раз в несколько дней и т.д.
Настоящее изобретение также обеспечивает способ регуляции уровня глюкозы в крови у нуждающегося в этом субъекта, содержащий введение субъекту эффективного количества активного компонента, выбранного из группы, состоящей из соединения формулы (I), фармацевтически приемлемой соли соединения формулы (I) и их комбинации. Выбор активного компонента и его свойств, а также лекарственной формы и дозировки лекарственного средства осуществляется в соответствии с указанным выше описанием.
Далее настоящее изобретение будет подробно проиллюстрировано следующими конкретными примерами. Однако указанные ниже примеры приведены исключительно для иллюстрации настоящего изобретения, объем которого ими не ограничивается.
Пример 1: Приготовление экстракта цистанхе трубчатой (Cistanche tubulosa)
10 кг сочных стеблей цистанхе трубчатой (Cistanche tubulosa) разрезали на части и замачивали в восьмикратном количестве воды в течение 1 часа, вываривали в течение 2 часов, и затем профильтровывали. Фильтрат собирали. Отстой смешивали с шестикратным количеством воды и вываривали дважды, каждый раз по 1 часу, затем отфильтровывали. Три полученных фильтрата соединяли и затем концентрировали под вакуумом при температуре 50°С до удельного веса 1,10. После этого в концентрат добавляли этанол до концентрации 60% и замораживали в течение 12 часов. Прозрачный жидкий супернатант собирали и концентрировали под вакуумом при температуре 50°С для получения сырого экстракта с удельным вестом 1,10, и этанол удаляли. Получали 6 кг сырого экстракта. Затем сырой экстракт растворяли в равном объеме горячей воды для получения смеси. Полученную смесь вводили в колонку с макропористой абсорбирующей смолой. Колонку последовательно элюировали четырехкратным количеством воды и пятикратным количеством 40% этанола. Водный элюент вводили в колонку с макропористой абсорбирующей смолой и затем элюировали трехкратным количеством воды. Полученный водный элюент отбрасывали. Колонку затем элюировали четырехкратным количеством 40% раствора этанола. Два полученных после элюирования в 40% растворе этанола элюента собирали и концентрировали до высушивания для получения 1107 г экстракта цистанхе трубчатой (Cistanche tubulosa).
Пример 2: Анализ активности экстракта цистанхе трубчатой (Cistanche tubulosa)
(1) Кормление подопытных животных
4-недельных самцов крыс линии SD (Sprague-Dawley) кормили на протяжении одной недели и затем случайным образом разделяли на шесть групп (по 10 крыс в каждой группе), включая пять экспериментальных групп и контрольную группу. Крысам в экспериментальных группах вводили инъекцию никотинамида внутрибрюшинно в дозировке 230 мг/кг массы тела и затем инъекцию стрептозоцина внутрибрюшинно в дозировке 65 мг/кг массы тела для индукции сахарного диабета (группа DM). Контрольная группа получала внутрибрюшинно инъекцию того же объема цитратного буфера (рН 4,5). Через неделю у крыс с индуцированным диабетом измерялся уровень глюкозы в крови натощак для подтверждения того, что уровень глюкозы в крови натощак у них > 126 мг/л. После этого крысы получали рацион с высоким содержанием жира (45%) на протяжении 6 недель. Затем в дозировках, указанных в Таблице 1, крысы получали орально Росиглитазон (Rosiglitazone) в количестве 0,571 мг/кг массы тела (лекарство для регуляции уровня глюкозы в крови, которое является усилителем чувствительности рецепторов к инсулину) (группа DMR) или экстракт цистанхе трубчатой (Cistanche tubulosa) (СТЕ) в количестве 80 мг/кг массы тела (группа DME1), СТЕ в количестве 160 мг/кг массы тела (группа DME2) или СТЕ в количестве 320 мг/кг массы тела (группа DME4) один раз в день на протяжении 6 недель. Крысы в контрольной группе и в группе DM получали дважды дистиллированную воду один раз в день на протяжении 6 недель. Массу тела крыс измеряли еженедельно и производили расчет калорийности потребляемой пищи. Полученные результаты представлены на фиг. 1 (масса тела) и фиг. 2 (калорийность потребляемой пищи). Результаты свидетельствуют, что заметных различий в массе тела и калорийности потребляемой пищи среди крыс в каждой из групп не наблюдалось.
(2) Тест на переносимость глюкозы
После того, как крыс подвергали воздействию лечения в течение 6 недель, как описано выше, был проведен тест на переносимость ими глюкозы при оральном введении (OGTT). Крысы получали глюкозу в дозировке 2 г/кг массы тела, и затем у них измеряли концентрацию глюкозы в плазме крови через 0, 30, 90 и 120 минут после введения для определения влияния СТЕ на переносимость глюкозы у крыс после ее приема. Полученные результаты представлены на фиг. 3. Производили расчет значений площади под кривой (ППК) фиг. 3, полученные результаты представлены на фиг. 4.
Как показано на фиг. 3 и фиг. 4, по сравнению с группой DM, концентрация глюкозы в плазме крови крыс, получавших СТЕ на протяжении 6 недель (в группах DME1, DME2 и DME4), и крыс в группе DMR была снижена через 0, 30, 90 и 120 минут. Эти результаты свидетельствуют, что СТЕ может эффективно повышать усвоение глюкозы у крыс и, таким образом, снижать уровень сахара в крови.
(3) Анализ образцов плазмы крови
После вышеописанного теста на переносимость глюкозы крысы были умерщвлены и у них были отобраны образцы крови из чревной артерии. Образцы крови центрифугировали на скорости 3000 об/мин при температуре 4°С в течение 15 минут. Был отобран супернатант, который является плазмой крови. Другие ткани крыс были также отобраны и взвешены, и затем хранили при температуре -80°С для последующего анализа биохимических данных.
(3-1) Определение концентрации глюкозы
20 мкл плазмы отбирали и анализировали с помощью набора для ферментативного анализа глюкозы (FAR EAST GL-V производства компании FAR EAST COMMERCIAL CORP, Япония) для определения концентрации глюкозы в плазме крови натощак.
Концентрация глюкозы в плазме крови натощак рассчитывалась по следующей формуле:
концентрация глюкозы в плазме натощак (в мг/дл) = (Es-blank)/(Estd-blank)×200
где
Es - поглощение образца крови;
Blank - поглощение растворителя из набора (без образца крови);
Estd - поглощение стандартного реагента;
200 - концентрация стандартного реагента равна 200 мг/дл.
Полученные результаты приведены в Таблице 2.
(3-2) Определение общей концентрации триглицеридов
10 мкл плазмы крови отбирали и анализировали при помощи набора реагентов для ферментативного анализа триглицеридов (производства компании Audit Diagnostics, Корк, Ирландия) для определения общей концентрации триглицеридов в плазме крови. Общую концентрацию триглицеридов в плазме крови рассчитывали по следующей формуле:
общая концентрация триглицеридов в плазме (в мг/дл)
= (Es-blank)/(Estd-blank)×200
где
Es - поглощение образца крови;
Blank - поглощение растворителя из набора (без образца крови);
Estd - поглощение стандартного реагента;
200 - концентрация стандартного реагента равна 200 мг/дл.
Полученные результаты приведены в Таблице 2.
(3-3) Определение общей концентрации холестерина
10 мкл плазмы крови отбирали и анализировали при помощи набора реагентов для анализа холестерина (производства компании Audit Diagnostics, Корк, Ирландия) для определения общей концентрации холестерина в плазме крови. Общую концентрацию холестерина в плазме крови рассчитывали по следующей формуле:
общая концентрация холестерина в плазме (в мг/дл)
= (Es-blank)/(Estd-blank)×200
где
Es - поглощение образца крови;
Blank - поглощение растворителя из набора (без образца крови);
Estd - поглощение стандартного реагента;
200 - концентрация стандартного реагента равна 200 мг/дл.
Полученные результаты приведены в Таблице 2.
Как показано в Таблице 2, по сравнению с группой DM, уровень глюкозы в крови натощак у крыс, получавших СТЕ на протяжении 6 недель (группы DME1, DME2 и DME4), был снижен. Общее содержание триглицеридов в группе DMR и в группе DME4 было значительно снижено. Известно, что недостаточная концентрация инсулина или низкая чувствительность к действию инсулина у пациентов с сахарным диабетом могут вызывать нарушение регуляции в окружающей жировой ткани, что приводит к разложению большого количества триглицеридов в липоцитах. В результате этого концентрация свободных жирных кислот в крови повышается, что приводит к снижению чувствительности к действию инсулина в периферических тканях. С другой стороны, резистентность к инсулину приводит к снижению применения триглицеридов в жировой ткани, что приводит к накоплению триглицеридов в крови. Полученные результаты свидетельствуют, что СТЕ эффективно снижает концентрацию глюкозы в крови натощак и общую концентрацию триглицеридов у крыс-диабетиков, и, таким образом, способен снижать уровень сахара в крови.
(3-4) Определение концентрации инсулина
25 мкл плазмы отбирали и анализировали при помощи набора для твердофазного иммуноферментного анализа ELISA (производства компании Mercodia АВ Inc., Сильвениусгатан 8А, Уппсала, Швеция). Поглощение измеряли на длине волны 450 нм с помощью спектрометра твердофазного иммуноферментного анализа, и концентрацию рассчитывали на основе стандартной кривой. Полученные результаты приведены в Таблице 3.
(3-5) Определение концентрации лептина
Лептин - это белковый гормон, секретируемый липоцитами. Известно, что нарушение баланса концентрации лептина в организме вызывает ожирение и нарушение инсулинового баланса. В данном эксперименте 100 мкл плазмы отбирали и анализировали с помощью набора реагентов для количественного определения лептина методом иммуноферментного анализа (производства компании Assay Designs, Ins., Энн-Арбор, США). Поглощение измеряли на длине волны 450 нм с помощью спектрометра твердофазного иммуноферментного анализа, и концентрацию рассчитывали на основе стандартной кривой. Полученные результаты приведены в Таблице 3.
(3-6) Гомеостатическая модель для оценки резистентности к инсулину
Расчет по гомеостатической модели для оценки резистентности к инсулину (HOMA-IR) осуществлялся по следующей формуле:
HOMA-IR = концентрация инсулина в плазме натощак (в мЕ/мл) × концентрация глюкозы в плазме натощак (в ммоль/л) ÷ 22,5
Полученные результаты приведены в Таблице 3.
Как показано в Таблице 3, по сравнению с контрольной группой концентрация инсулина в плазме, концентрация лептина в плазме и HOMA-IR у крыс в группе DM были повышены. По сравнению с группой DM концентрация инсулина в плазме, концентрация лептина в плазме и HOMA-IR у крыс, получавших СТЕ на протяжении 6 недель (группы DME1, DME2 и DME4) вернулись к норме (снизились), и их концентрации, показанные для группы DME4, были самыми близкими к тем, что были зафиксированы для контрольной группы. Полученные результаты свидетельствуют, что