Иммунодепрессант
Иллюстрации
Показать всеИзобретение может быть использовано в медицине в качестве основы для создания лекарственных препаратов. Предложено применение хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния в качестве иммунодепрессанта. Технический результат: соединение в дозах, далеких от токсических (LD50 при внутрибрюшинном введении мышам – 2000 мг/кг), оказывает in vitro избирательный антипролиферативный эффект на активно делящиеся лимфоидные клетки, но не опухолевые клетки. Изобретение позволит создать на основе хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния лекарственные средства для лечения аутоиммунных и аллергических заболеваний. 2 табл., 1 пр.
Реферат
Изобретение относится к новым синтетическим иммунодепрессантам и конкретнее к иммунодепрессантам, содержащим гетероциклические соединения из класса арил-, индолилалканкарбоновых кислот, и может быть использовано в медицине в качестве основы для создания лекарственных препаратов для лечения аутоиммунных и аллергических заболеваний.
Аутоиммунные нарушения в организме обусловлены прежде всего повышением функциональной активности Т-лимфоцитов и других иммунокомпетентных клеток. К веществам, обладающим способностью активно влиять на течение аутоиммунного процесса, подавлять патологические пролиферативные процессы в лимфоидных (иммунокомпетентных) тканях, относятся иммунодепрессанты.
Известен синтетический иммунодепрессант - азатиоприн, обладающий цитостатической активностью и оказывающий иммунодепрессивный эффект (М.Д. Машковский. Лекарственные средства. 4.2, М., «Медицина», 1987, стр. 175-177). Недостатком этого иммунодепрессанта является угнетающее влияние на кроветворение, а также повреждающее действие на желудочно-кишечный тракт и вероятность развития токсического гепатита при длительном применении.
К разряду иммуносупрессоров относят также циклоспорин (циклический полипептид, состоящий из 11 аминокислот), применяемый для снижения функциональной активности Т-лимфоцитов с целью терапии аутоиммунных заболеваний и профилактики отторжения трансплантатов (Регистр лекарственных средств России. - Выпуск 9. - 2002 г. - Стр. 969). Однако данный препарат вызывает ряд серьезных побочных эффектов (действие на желудочно-кишечный тракт, нарушение функции почек и печени, анемия, повышение АД), что существенно затрудняет его широкое применение.
Задачей данного изобретения является поиск иммунодепрессанта, обладающего меньшим количеством побочных эффектов, в частности, уменьшение угнетающего влияния на кроветворение.
Известны оксазолидинины и их применение в терапии (RU98100257, С07С413/04, 2000), а также для лечения и профилактики расстройств сердечной деятельности (RU2404740, A61K 31/5377, 2012).
С целью расширения арсенала синтетических средств, обладающих иммуносупрессивными свойствами, предлагается использовать производное оксазолидиния: хлорид 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния (авт.свид. СССР №139729, C07D 263/10, 1985) - в качестве иммунодепрессанта.
Производные оксазолидиния отличаются самыми разнообразными биологическими свойствами. Хлориды 2-(алкилтиометилен)-3,3-диалкил-1,3 оксазолидиния (в т.ч. хлорид 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния обладают широким спектром антибактериального и противоопухолевого действия (Материалы 7-й отчетной конференции ГУ НИИ клинической иммунологии СО РАМН, Новосибирск, 2006, стр. 103).
Сущность изобретения заключается в том, что при изучении влияния нового синтезированного производного оксазолидиния: хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния - на пролиферативную активность клеток иммунной системы и опухолевых линий в опытах in vitro был показан его избирательный иммунодепрессивный эффект.
В работе использовали здоровых половозрелых животных мышей линии СВА, DBA/2 и гибридов (CBAxC57BL/6)F1 (CBF1) и (C57BI/6xDBA/2)F1 обоего пола, 8-10-недельного возраста, массой тела 18-20 г. Разброс в группах по исходной массе тела не превышал ±10%. Животные были одного возраста и получены одновременно из одного питомника ("Рассвет", г. Томск). До и в период эксперимента животные содержались в виварии в одинаковых условиях в стандартных пластиковых клетках 40×20×20 не более 10 особей в клетке с подстилкой из мелкой древесной стружки на стандартном рационе. Все исследования проводились в одно и то же время суток (утром).
LD50 соединения хлорид 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния при внутрибрюшинном способе введения мышам составляет 2000 мг/кг.
Пример 1. Определение влияния хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния на функциональную активность лимфоидных клеток in vitro.
Изучение влияния хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния на функциональную активность лимфоидных клеток in vitro проводили добавлением соединения в культуральную среду при тестировании спонтанной и Т- и В-митоген-индуцированной пролиферации клеток селезенки.
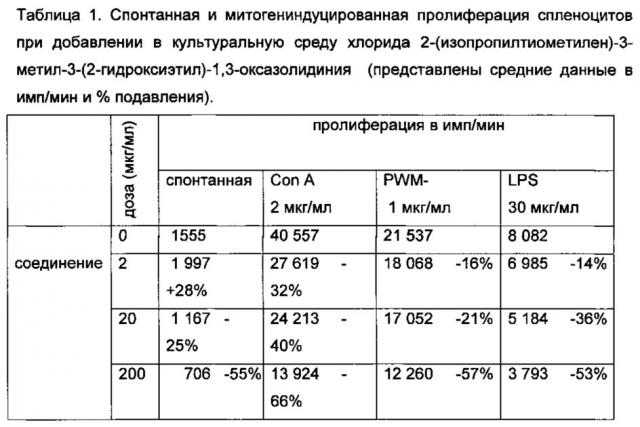
Селезенки мышей забирали в стерильных условиях и готовили клеточную суспензию: селезенки помещали во флакончики со средой, расстригали ножницами, многократно пропускали через шприц с иглами уменьшающего диаметра, фильтровали через металлическую сеточку и 3 раза отмывали центрифугированием при 1000 об/мин в течение 10 мин со сменой среды. Осадок клеток селезенки ресуспендировали в полной среде RPMI-164, содержащей 10% эмбриональной сыворотки телят, 10 мМ Hepes, 4×10-5 М 2-меркаптоэтанола, 2 Мм L-глутамина, 50 мкг/мл гентамицина, и подсчитывали их общее количество. Полученную клеточную суспензию доводили до концентрации 0,7×106 клеток/мл полной среды и помещали в 96-луночные круглодонные планшеты для культивирования по 100×103 клеток/лунку в объеме 150 мкл/лунку. Добавляли оптимальные дозы митогенов LPS E. coli 055:В5, Con A, PWM, определенные в предварительных опытах: 30 мкг/мл, 2 мкг/мл и 1 мкг/мл, соответственно, в объеме 10 мкл. Для оценки спонтанной пролиферации в лунки добавляли 10 мкл среды RPMI-1640. Все пробы проводились в триплетах. Соединения в трех дозах (2, 20 и 200 мкг/мл) вносили в лунки одновременно с митогенами. Инкубацию клеточной культуры проводили при +37°С в атмосфере, содержащей 5% СО2, в течение 72 часов. Пролиферативную активность клеток оценивали по включению Н3-тимидина в ДНК делящихся клеток. Метку вносили за 16 час до конца культивирования по 1 мкКи в каждую лунку планшета. Для этого основной раствор Н3-тимидина сначала растворяли в среде RPMI-1640 до концентрации 100 мкКи/мл, а затем по 10 мкл раствора добавляли в каждую лунку планшета. По окончании инкубации клетки собирали на стеклянно-волокнистые фильтры (Flow Lab) с помощью аппарата «Harvester» (TITERTEK). Фильтры помещали во флаконы для сцинтилляционного счета, и радиоактивность подсчитывали в сцинтилляторе (4 г дифенилоксазола и 0,1 г дифенил-оксазолилбензола на 1 л толуола) в жидкостном сцинтилляционном счетчике «Delta» (США). Результаты оценивали в имп/мин на 100×103 клеток, подсчитывали средние значения по триплету. Оценка данных проводилась как в абсолютных значениях (имп/мин), так и относительных (%). Результаты, представлены в таблице 1.
Результаты, представленные в таблице 1, указывают на дозозависимую супрессию спонтанной и Т- и В-митогениндуцированной пролиферации клеток селезенки интактных животных под влиянием хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния.
Пример 2. Определение влияния хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния на пролиферацию других тканей.
Для изучения способности соединения хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния подавлять пролиферацию других тканей оценивали его влияние на процессы деления клеток опухолевых линий.
Изучали действие препарата на пролиферацию клеток нескольких разных линий: L1210, клетки лейкоза; Г27, клетки гепатомы; В16, клетки меланомы.
Культивирование клеток и оценка их пролиферативной активности проводилась согласно протоколу для культивирования лимфоидных клеток (описано выше); количество клеток линии составляло 104/лунку, время культивирования 24 часа, 3Н-тимидин добавляли за 4 часа до конца культивирования. Препарат в разных дозах вносили в культуральную среду в начальный момент культивирования в объеме 10 мкл. В качестве растворителя препарата использовали воду (в) или спирт (с). Эффект препарата определялся в процентах как разность между пролиферацией в присутствии препарата минус пролиферация без препарата, деленная на пролиферацию без препарата и умноженную на 100% по следующей формуле:
Э=(Пп-П)/П×100%, где
Пп - пролиферация в присутствии препарата,
П - пролиферация без препарата.
Как видно из таблицы 2, хлорид 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния не оказывает заметного влияния на пролиферативную активность клеток опухолевых линий в условиях in vitro; не обнаружено какой-либо дозозависимости эффекта.
Оценивая в целом результаты, можно утверждать, что синтетическое соединение хлорид 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния в дозах, далеких от токсических, оказывает избирательный антипролиферативный эффект на активно делящиеся лимфоидные клетки, но не опухолевые клетки. Обнаруженные свойства хлорида 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния позволяют отнести его к разряду иммунодепрессантов и в будущем создавать на их основе лекарственные средства для лечения аутоиммунных и аллергических заболеваний.
Применение соединения хлорид 2-(изопропилтиометилен)-3-метил-3-(2-гидроксиэтил)-1,3-оксазолидиния в качестве иммунодепрессанта.