Способ получения фармацевтических композиций на основе полимерных наночастиц методом микрофлюидной технологии
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к способу получения фармацевтических композиций на основе полимерных наночастиц методом микрофлюидной технологии. Способ заключается в пропускании через проточный микрореактор, выполненный из боросиликатного стекла, водного раствора, содержащего поливиниловый спирт и раствор в ацетоне или ацетонитриле этопозида или никлозамида и биодеградируемого полимера в виде сополимера молочной и гликолевой кислот с характеристической вязкостью 0,41-1,0 дл/г и молярным соотношением мономерных звеньев от 25 и 75 до 75 и 25% или его смесь с полиметилметакрилатом для медицинского применения Eudragit, при этом предварительно через проточный микрореактор из боросиликатного стекла пропускают водный раствор поливинилового спирта с концентрацией от 0,5 до 1% по объему в количестве 1-100 объемов микрореактора, нагретого до температуры 55-65°С с последующим охлаждением микрореактора до комнатной температуры. Изобретение обеспечивает стабильность распределения размеров частиц относительно среднего значения и исключение возможности агрегации частиц в процессе их образования. 1 з.п. ф-лы, 5 ил., 4 табл., 2 пр.
Реферат
Уровень техники
В современной науке и производстве нанотехнология представляет собой совокупность технологий и методик, позволяющих манипулировать отдельными атомами и молекулами в масштабе 1-100 нанометров в одном измерении. В практическом аспекте нанотехнология - это технологии производства устройств и их компонентов, необходимых для создания, обработки и манипуляции наночастицами.
Инновационный метод микрофлюидной проточной технологии получения и функционализации наночастиц для медицинских и фармацевтических целей является частным случаем микрофлюидных технологий. Технически все сводится к замене стандартных реакторов (одного из основных видов оборудования на химических и фармацевтических производствах) на капиллярные. Основополагающее отличие микроструктурированных (капиллярных) реакторов от стандартных объемных заключается в ламинарности движения потоков флюидов (жидкости и газы).
Ламинарность определяется безразмерной величиной - числом Рейнольдса, прямо пропорциональной диаметру капилляра, скорости потока и плотности жидкости и обратно пропорциональной вязкости. Опытные данные показывают, что при работе с жидкими средами со стандартными значениями плотности и вязкости возможно использование капилляров с внутренним диаметром до 4 мм, не превышая при этом критическое число Рейнольдса в 2300.
Исходя из этого, использование капилляров предопределяет практически идеальное смешение реагентов, обусловленное диффузией, а их конструктивные особенности позволяют так же варьировать значения давления и температуры внутренней среды. Малый объем и большая площадь поверхности дают возможность очень быстро подводить и отводить тепло к и от реактора, практически исключая явление температурного градиента в объеме находящейся в реакторе среды. Прочностные характеристики реакторов таковы, что значительное повышение давления (в 10 - 100 раз превышающее атмосферное) не приводит к разрушению реактора и к тому же не требует соблюдения общепринятых конструктивных и организационных мер безопасности, обязательных при эксплуатации сосудов под давлением.
В отличие от турбулентного смешения реагентов в объемном режиме, смешение в ламинарном потоке почти полностью исключает образование градиентов концентраций и температуры в объеме и времени. Идеальное диффузионное смешение предопределяет высокую избирательность и чистоту реакции, и, как следствие, значительное снижение образования побочных и промежуточных продуктов. В случае, когда химических превращений в реакторе не происходит, описанные выше преимущества можно использовать для получения, например, наночастиц полимеров с однородным фракционным составом и высоким выходом готового продукта при минимизации трудозатрат (А. Гербст, В.В. Шудегов, Р.Ф. Яруллин, Л. Наземцева. Нанотехнология и микрореакторы - параллели в развитии. // Био- и нанотехнологии, №3 (16) май 2012, С. 78-88.) [1].
Наиболее близок из известных способ получения полимерных микронных и субмикронных частиц с использованием микрофлюидных проточных технологий, приведенный в работе авторов Д.Р. Раимов, В.В. Суслов. ПОЛУЧЕНИЕ ПОЛИМЕРНЫХ МИКРОННЫХ И СУБМИКРОННЫХ ЧАСТИЦ С ИСПОЛЬЗОВАНИЕМ МИКРОФЛЮИДНЬ1Х ПРОТОЧНЫХ ТЕХНОЛОГИЙ // Успехи в химии и химической технологии. ТОМ XXIX. 2015. №10, С. 118-119. [2].
Описывается получение частиц из сополимера молочной и гликолевой кислоты (массовое соотношение мономеров в полимере 50/50), в виде отдельных фракций, средний размер частиц в которых составляет от 0,7 до 4,5 микрон. Полученные частицы представляют интерес с точки зрения фармацевтической технологии, т.к. могут быть нагружены различными лекарственными веществами и после парентерального или энтерального введения в организм, действовать как препарат с регулируемым высвобождением.
Способ состоит в том, что посредством микрофлюидной установки в проточный микрореактор (чип) одновременно подается водный 2,5% (масс.) раствор поливинилового спирта и 0,5% (масс.) раствор сополимера молочной и гликолевой кислоты в органическом растворителе, несмешиваемом или ограниченно смешиваемом с водой (хлороформ, хлористый метилен). Подбирая скорости подачи водной и неводной - органической фаз, достигалось получение эмульсии, после удаления летучего растворителя из которой получались частицы микронного и субмикронного размера. Данные, касающиеся условий получения частиц, описанных в источнике[2], приведены в таблице 1.
У описанного способа есть следующие недостатки:
- при получении частиц субмикронного размера резко падает выход частиц или, соответственно, возрастает объем раствора для упаривания;
- используемые растворители ограниченно смешиваются с водой, что создает некоторые проблемы при упаривании;
- получаемые частицы субмикронного размера достаточно крупные, для практического применения предпочтительны частицы, средний размер которых составляет порядка 500 нм и менее.
Микрофлюидные технологии позволяют получать гетерогенные системы (эмульсии, суспензии) с частицами меньшего размера, но при этом необходимо обеспечить оптимальные условия в процессе формирования частицы в микрореакторе. В силу конструктивных особенностей микрореакторов соотношение площади контакта к объему реакционной смеси микрореакторов во много раз превышает площадь контакта в объемных реакторах. Удельная поверхность микроструктурных реакторов исчисляется значениями от 10000 до 50000 м2/м3, в то время как традиционных реакторов достигает максимально 100 м2/м3 [1]. Следовательно, необходимо принимать во внимание процессы, проходящие на границе раздела двух фаз (жидкость/жидкость, твердое тело/жидкость), где твердое тело - это не только формирующиеся частицы, но и стенка реактора. Влияние сил поверхностного натяжения и степень смачиваемости материала стенки реактора оказывают непосредственное влияние на форму, размер и фракционный состав получаемых частиц. Способы влияния на перечисленные выше факторы сводятся либо к введению в состав сред для получения частиц поверхностно-активных веществ (ПАВ), либо модификации поверхности стенки реактора. Также возможна и комбинация названных способов. В случае фармацевтической технологии, выбор ПАВ ограничивается веществами, разрешенными для применения на человеке.
Одним из самых распространенных способов модификации поверхности стенки реакторов является ее гидрофобизация химическими методами. Подобные методы применимы и для микрореакторов, например из боросиликатного стекла. В работе Shui, L., van den Berg, A. and Eijkel. J.C.T. (2009) 'Interfacial tension controlled W/O and O/W 2-phase flows in microchannel', Lab Chip, 9:795-801 [3] описана типичная последовательность действий для получения такого покрытия. Получаемые покрытия считаются постоянными и несмываемыми. Процесс идет в несколько стадий, в результате которого на поверхности образуется слой, обладающий требуемыми свойствами. Вещество слоя и материал стенки при этом химически связаны между собой. В процессе обработки происходит замещение водорода в поверхностной -ОН группе на гидрофобный радикал. Реакция протекает по типу нуклеофильного замещения и схематически может быть представлена следующим образом:
-Si-ОН+Cl-Si-R→-Si-О-Si-R+HCl,
где -Si-ОН - поверхность стенки стеклянного капилляра с гидроксидной группой;
Cl-Si-R - какой-либо галогенированный органосилан, обладающий выраженными гидрофобными свойствами, например такой: C10H4Cl3F17Si (FDTS - перфторододецилтрихлорсилан, CAS# 78560-44-8).
Последовательность действий для получения покрытия следующая:
1. Микрореактор промывается водой, остатки воды удаляются сушкой под вакуумом;
2. Микрореактор промывается изопропиловым спиртом, остатки спирта удаляются сушкой под вакуумом;
3. Микрореактор промывается 30% раствором перекиси водорода, остатки перекиси водорода удаляются сушкой под вакуумом;
4. Микрореактор промывается 2% (или иной концентрации) раствором органохлорсилана в неполярном растворителе, например изооктане);
5. Излишки органохлорсилана удаляются путем промывания раствором изооктана;
6. Микрореактор последовательно промывается изопропанолом и этанолом;
7. Микрореактор выдерживается под вакуумом при нагреве до 110°С для удаления остатков спиртов и выделившейся в процессе реакции соляной кислоты.
Описанный выше процесс применим только для поверхностей из стекла и помимо материала поверхности имеет ограничения, связанные с химической структурой прививаемого гидрофобного вещества.
Наиболее близким к микрофлюидным технологиям способами модификации поверхности микрореактора без образования химически связанного со стенкой реактора слоя, можно считать применяемые в методе капиллярного электрофореза способы покрытия внутренней поверхности капилляров поливиниловым спиртом. Сечение капилляров близко к сечениям микрореакторов, для их создания используются аналогичные материалы (стекло). Целью создания такого покрытия является уменьшение взаимодействия между материалом капилляра и анализируемым образцом (различные протеины, фрагменты ДНК и т.п.).
В работе Analysis of Nucleic Acids by Capillary Electrophoresis [4] описан способ нанесения временного покрытия, который сводится к тому, что через капилляр пропускают 0,05% раствор поливинилового спирта (ПВС) в буферном растворе. Покрытие получается гидрофильным и отвечает предъявляемым к нему требованиям. С практической точки зрения оно будет нестойким и капилляр будет требовать повторной обработки раствором ПВС перед каждым анализом.
Способ нанесения постоянного покрытия из ПВС сводится к обработке капилляра 10% водным раствором ПВС с последующей иммобилизацией ПВС на поверхности капилляра в токе азота при 140°С в течение нескольких часов. Полученное покрытие считается постоянным и несмываемым. Оно не требует последующих обработок буферным раствором, содержащим ПВС перед каждым анализом [4].
Оба способа нанесения покрытия из ПВС не приводят к образованию химически связанного со стенкой капилляра покрытия, но в результате получается либо нестойкое, либо постоянное (трудноудаляемое) покрытие.
Известны также способы получения химически связанного с поверхностью капилляра покрытия на основе ПВС (Tohei Moritani, Kyunghwan Yoon, Miriam Rafailovich, Benjamin Chu. DNAcapillary electrophoresis using polyvinyl alcohol. I. Inner capillary coating. Electrophoresis 2003, 24, 2764-2771) [5]. Схема его нанесения в целом повторяет описанную в работе [3] схему нанесения химически связанного гидрофобного покрытия. Отличие состоит в том, что добавляется стадия синтеза силанольного производного ПВС. Те же авторы показали возможность получения гидролитически стабильного в широком диапазоне рН покрытия стенки капилляра с более стабильной связью -Si-С-, получаемой с помощью реакции Гриньяра (Шабаров Ю. С.Органическая химия: В 2-х кн. - М.: Химия, 1994. - 352 с: ил.) [6]. Схема получения такого покрытия включает в себя отдельную стадию получения магний-галогенового производного ПВС.
Из недостатков описанных способов получения покрытий стоит отметить высокую трудоемкость, невозможность последующего удаления покрытия и необходимость тщательной очистки микрореактора после получения покрытия от побочных продуктов реакции.
Таким образом, известные на сегодняшний день способы обработки внутренних поверхностей капилляров, применимые в т.ч. и в микрореакторных технологиях, сводятся либо к образованию неудаляемых химически связанных с материалом капилляра (способы пригодны только для стеклянных капилляров) покрытий, либо к формированию трудноудалимых покрытий путем выдержки капилляра длительное время в инертной атмосфере под действием повышенных температур, либо к формированию крайне нестойких покрытий, применение которых в случае работающей длительное время установки не оправдывает себя. Серьезным препятствием для образования химически связанных покрытий может служить материал микрореактора, который может быть изготовлен не только из стекла, но и из металлов и их сплавов [1].
Для фармацевтического применения представляет интерес возможность нанесения умеренно-стойкого покрытия, которое не должно значительно разрушаться (смываться) в ходе технологического процесса, но при необходимости могло бы быть удалено доступными методами с использованием малотоксичных и легкоудаляемых в дальнейшем реактивов. Вторым важным фактором является простота и удобство нанесения такого покрытия без демонтажа микрореактора и без необходимости в последующем удалении побочных продуктов, образовавшихся в процессе формирования покрытия, т.к. такие продукты токсичны для организма человека и однозначно будут оказывать влияние на формирование наночастиц. При этом, выбор материалов для формирования покрытия крайне ограничен; наиболее перспективным с этой точки зрения по-прежнему остается ПВС в силу своих технологических свойств, биологической инертности и отсутствия токсических эффектов в применяемых дозах.
Исходя из вышеизложенного, задачей на которое направлено изобретение является разработка способа получения наночастиц методом микрофлюидной технологии, который подразумевает создание на стенке микрореактора покрытия без использования дополнительных реактивов и процессов, проведение которых является трудоемким, включает в себя длительные операции по нанесению покрытия и последующей очистки проточного микрореактора от остатков реактивов и побочных продуктов реакций, которые могут вызвать загрязнение получаемых частиц, при этом обеспечивается стабильность распределения размеров частиц относительно среднего значения, размер наночастиц в диапазоне 200-400 нм и исключение возможности агрегации частиц в процессе их образования.
Для этого предложен способ получения фармацевтических композиций на основе полимерных наночастиц методом микрофлюидной технологии, состоящий в пропускании через проточный микрореактор, выполненный из боросиликатного стекла, водного раствора, содержащего поливиниловый спирт и раствор в ацетоне или ацетонитриле этопозида или никлозамида и биодеградируемого полимера в виде сополимера молочной и гликолевой кислот с характеристической вязкостью 0,41-1,0 дл/г и молярным соотношением мономерных звеньев от 25 и 75 до 75 и 25% или его смесь с полиметилметакрилатом для медицинского применения Eudragit, при этом предварительно через проточный микрореактор из боросиликатного стекла пропускают водный раствор поливинилового спирта с концентрацией от 0,5 до 1% по объему в количестве 1-100 объемов микрореактора, нагретого до температуры 55-65°С с последующим охлаждением микрореактора до комнатной температуры.
Кроме того:
- фармацевтическая композиция представляет собой готовую лекарственную форму в виде стерильных или нестерильных лиофилизатов для последующего растворения и получения суспензий для инъекций, или ингаляций, или таблеток, или капсул, или гранул, или аэрозолей, или порошков, или мазей.
Технический результат достигается тем, что в технологический процесс получения наночастиц вводится дополнительная стадия обработки внутренней поверхности проточного микрореактора поверхностно-активным веществом, которое обладает высокой
адгезией к поверхности проточного микрореактора и входит в состав фармацевтической композиции для получения наночастиц. Таким веществом может быть раствор поливинилового спирта в концентрациях от 0,5 до 1,0% по объему, который вводится в микрореактор до начала получения наночастиц и под действием повышенной температуры за счет адгезии создает на внутренней поверхности микрореактора приемлемое с точки зрения эксплуатационных свойств покрытие, которое при необходимости может быть удалено, фармацевтическая композиция помимо поливинилового спирта будет содержать этопозид, никлозамид или иные активные фармацевтические субстанции или их смеси, применяемый в фармацевтической практике биодеградируемый полимер полилактидгликолид (сополимер молочной и гликолевой кислот - PLGA) или иные аналогичные вещества, полиметиметакрилат (Eudragit), допущенный до медицинского применения или аналогичные вещества, Полученные указанным способом фармацевтические композиции как будет показано ниже имеют средний размер частиц в интервале от 200 до 400 нм.
На фиг. 1 представлены данные по распределению размеров частиц PLGA по объему (гистограмма). Кривая показывает относительное количество частиц, размеры которых находятся ниже указанного предела. Данные получены для микрореактора из боросиликатного стекла без какой-либо предварительной обработки.
На фиг. 2 представлены данные по распределению размеров частиц PLGA по объему (гистограмма). Кривая показывает относительное количество частиц, размеры которых находятся ниже указанного предела. Данные получены для микрореактора из боросиликатного стекла через который предварительно пропускался раствор ПВС.
На фиг. 3 представлены данные по распределению размеров частиц PLGA по объему (гистограмма). Кривая показывает относительное количество частиц, размеры которых находятся ниже указанного предела. Данные получены для микрореактора из боросиликатного стекла который был обработан раствором ПВС предложенным способом.
На фиг.4 представлены данные по распределению размеров частиц, содержащих фармацевтическую композицию с этопозидом (гистограмма). Кривая показывает относительное количество частиц, размеры которых находятся ниже указанного предела. Наночастицы содержат этопозид в полимере-носителе PLGA 50/50. Для получения частиц использовалась микрофлюидная установка с реактором, прошедшим обработку внутренней поверхности ПВС.
На фиг. 5 представлены данные по распределению размеров частиц, содержащих фармацевтическую композицию с этопозидом (гистограмма). Кривая показывает относительное количество частиц, размеры которых находятся ниже указанного предела. Наночастицы содержат никлозамид в полимере-носителе PLGA 50/50 и Эудрагит (Eudragit RS РО). Для получения частиц использовалась микрофлюидная установка с реактором, прошедшим обработку внутренней поверхности ПВС.
Проводилось изучение образования частиц в микрореакторе. В качестве полимера для получения ненагруженных частиц использовался сополимер полилактидгликолид (PLGA) с соотношением сополимеров молочной и гликолевой кислот 50/50. Готовились 1% (масс.) растворы в органическом растворите (ацетонитрил). Второй раствор - 1% (масс.) водный раствор ПВС. Известно, что получаемые с использованием названных растворов частицы отличаются однородным фракционным составом и приемлемым (малым) размером. Получаемые частицы перспективны с точки зрения их использования в медицине и фармации (А. Гербст, С.А. Кедик, Д.Р. Раимов, Е.С. Жаворонок, Е.А. Петрова, А.В. Панов, В.В. Суслов, Л. Гринер, Л. Наземцева. Микрореакторные системы для микроинкапсулирования в фармации. // Разработка и регистрация лекарственных средств- 2014. - Выпуск 4 (9). - С. 76-85.) [7]. В отличие от известного способа (Xie and Smith: Fabrication of PLGA nanoparticles with a fluidic nanoprecipitation system. Journal of Nanobiotechnology 2010 8:18) [8], для получения частиц использовалась микрореакторная установка Qmix (Wingflow AG, Швейцария), объем микрореактора 0,4 мл, материал - боросиликатное стекло. Скорость подачи жидких фаз подбиралась экспериментально. В описываемом опыте она составляла для 1% раствора ПВС - 1 мл/мин, для 1% раствора PLGA 50/50 - 0,1-0,2 мл/мин при сходном результате.
Были получены частицы полимера, размер которых определялся методом лазерной дифракции света на приборе Zetasizer Nano (Malvern Instruments Ltd., Великобритания). Оценивались размер и распределение частиц по объему. На фиг. 1 показано типичное распределение для полученного образца. Обращают внимание наличие фракции микронного размера и тот факт, что 95% от общего объема частиц имеют размер менее 1090 нм. После промывания микрореактора водой и повторных опытов по получению частиц были получены сходные результаты, что указывает на систематически повторяющийся процесс, связанный со взаимодействием стенки микрореактора и поступающих в него растворов.
Были изменены условия проведения опыта и раствор поливинилового спирта начинал подаваться в микрореактор раньше, чем раствор полимера в органическом растворителе. Таким образом преследовалась цель обеспечить предварительный контакт ПВС и последующую адгезию некоторого количества ПВС на стенке капилляра для уменьшения вероятности адгезии формирующихся полимерных частиц на стенке капилляра. Результаты представлены на фиг. 2. Полученный результат мало отличался от предыдущего, но было отмечено, что 95% частиц от общего объема имеют размер 870 нм, т.е. был зафиксирован сдвиг фракционного состава в сторону меньшего размера частиц как по среднему размеру, так и в совокупности.
Опыты, где варьировались скорости подачи и концентрации растворов ПВС и полимера PLGA 50/50, показали, что очевидного решения данная проблема не имеет, т.к. налагаемые на технологический процесс ограничения зачастую непреодолимы, т.к. связаны с потерей стабильности многих активных фармацевтических субстанций при повышении температуры и падением вязкости жидких фаз, подаваемых в микрофлюидную установку (приводит к значительному укрупнению получаемых частиц). Так же были поставлены опыты с использованием в аналогичных условиях растворов полимера PLGA в другом органическом растворителе - ацетоне. Отличий в размерах полученных частиц от получаемых из раствора в ацетонитриле выявлено не было.
Был предложен способ получения фармацевтических композиций, включающий обработку внутренней поверхности микрореактора и не требующий его демонтажа. Способ заключается в том, что микрореактор обрабатывается применяемым для последующего получения наночастиц компонентом в определенных условиях. Были изучены растворы поливинилового спирта различных концентраций (от 0,5% до 2,5%) и результаты обработки ими внутренней поверхности реактора. Все перечисленные растворы использовались для обработки реактора аналогичным образом. Наилучшие результаты были получены для растворов с содержанием ПВС от 0,5 до 1,0%. Обработка сводилась к пропусканию через микрореактор растворов ПВС в объемах, от 10 до 100 объемов микрореактора при нагревании микрореактора до температуры 60°С. Нагревание выше указанной температуры сопряжено с риском нарушения тока жидкости через микрореактор по причине образования пузырьков газа (пара). Было установлено, что на результат влияет температура (с ростом температуры уменьшается время обработки). Скорость потока может оказывать влияние на результат при использовании растворов с концентрацией до 0,5% ПВС; для растворов ПВС с концентрацией свыше 1%, увеличение скорости потока свыше 1,5 мл/мин приводит к значительному росту давления в системе без каких-либо положительных эффектов, поэтому дальнейшее изучение растворов ПВС с более высокими концентрациями было признано нецелесообразным. Таким образом, были установлены оптимальные условия обработки микрореактора: концентрация раствора ПВС около от 0,5 до 1%, скорость подачи раствора от 0,5 до 1 мл/мин, нагрев до 60°С, время обработки 20-40 минут. Наличие модификации поверхности определялось через анализ размера получаемых частиц.
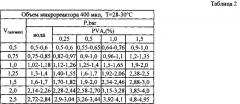
Также отмечалось увеличение давления в системе при пропускании воды через обработанный микрореактор по сравнению с давлением, отмечавшимся при пропускании воды с той же скоростью потока через необработанный микрореактор. Было достоверно установлено, что после обработки микрореактора, давление пропускаемой через него воды возрастает в среднем от 0,05 бар для скоростей подачи 0,5-0,75 мл/мин до 0,075-0,1 бар для скорости подачи 2,5 мл/мин (табл. 2).
Были получены ненагруженные полимерные наночастицы, и наночастицы содержащие активные фармацевтические субстанции. Получение наночастиц проиллюстрировано примерами фармацевтических композиций на основе наночастиц, содержащих активные фармацевтические субстанции, как имеющими практическую ценность.
Пример 1.
Получение полимерных форм этопозида с использованием микрофлюидной технологии.
Материалы:
- Раствор поливинилового спирта (Sigma-Aldrich) 0,5% или 1% (готовился непосредственно перед употреблением, фильтровался под вакуумом в горячем виде через фильтр из стекловолокна с размером пор 1 мкм).
- Раствор этопозида (соответствует требованиям USP) и сополимера молочной и гликолевой кислот PLGA 50/50 («PURAC Biochemicals») в ацетоне (ч.д.а) или в ацетонитриле (ч.д.а). Содержание этопозида в растворе - 1 мг/мл (0,1%), содержание полимера PLGA 50/50 - 10 мг/мл (1%).
Оборудование:
Микрореакторная установка Qmix (Wingflow, Швейцария):
Проточный микрореактор: объем 400 мкл, боросиликатное стекло (Wingflow, Швейцария).
Скорость подачи жидких фаз:
- 0,5% или 1% раствор поливинилового спирта: 0,5 мл/мин или 1 мл/мин (нанесение покрытия), далее 1 мл/мин;
- раствор этопозида и полимера PLGA 50/50: 0,2 мл/мин.
Получение частиц
Микрофлюидная установка включалась, устанавливалась подача раствора поливинилового спирта 0,5% или 1% со скоростью 0,5 или 1 мл/мин, включался нагрев проточного микрореактора до 60°С и подача раствора поливинилового спирта продолжалась в течение следующих 20 или 40 минут. Затем поток останавливался до охлаждения проточного микрореактора до комнатной температуры. После этого поток поливинилового спирта возобновлялся со скоростью 1 мл/мин и в установку начинал подаваться раствор этопозида и полимера PLGA 50/50 в ацетоне или ацетонитриле со скоростью 0,2 мл/мин. После начала подачи раствора этопозида и полимера проводился сбор головной фракции под контролем давления в системе. Начало образования суспензии фиксировалось по повышению давления. Головная фракция собиралась в течение 3 минут от начала повышения давления и в дальнейшем отбрасывалась. Сбор основной фракции осуществлялся до израсходования растворов.
Далее основная фракция упаривалась под вакуумом на ротационном испарителе до удаления летучего органического растворителя и части воды. При необходимости проводилось удаление излишков поливинилового спирта путем центрифугирования и удаления излишков супернатанта. После чего к осадку прибавлялось необходимое для ресуспендирование количество воды и проводилось ресуспендирование с использованием механического встряхивателя, либо ультразвуковой бани. Далее к полученной суспензии добавляли рассчитанное заранее количество D-маннитола (криопротектора). В случае, если стадия центрифугирования-ресуспедирования не проводилась, криопротектор добавляли сразу после упаривания на ротационном испарителе. Суспензия с криопротектором подвергалась заморозке в жидком азоте и далее осуществлялась лиофильная сушка суспензии. Готовый продукт представляет собой пористую лиофильную массу, которая может быть использована в качестве готовой лекарственной формы, либо в качестве полупродукта для ее получения.
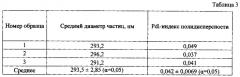
Качество получаемых серий оценивалось по среднему размеру частиц и индексу полидисперсности (таблица 3).
Пример 2.
Получение полимерных форм никлозамида с использованием микрофлюидной технологии.
Материалы:
- Раствор поливинилового спирта (Sigma-Aldrich) 0,5% или 1% (готовился непосредственно перед употреблением, фильтровался под вакуумом в горячем виде через фильтр из стекловолокна с размером пор 1 мкм).
- Раствор никлозамида (соответствует требованиям ЕР), сополимера молочной и гликолевой кислот PLGA 50/50 («PURAC Biochemicals») и Eudragit® RS PO (Эудрагит) («Evonik Pharma Polymers») в ацетоне (ч.д.а.) или ацетонитриле (ч.д.а). Содержание никлозамида в растворе - 1 мг/мл (0,1%), содержание полимера PLGA 50/50 - 6 мг/мл (0,6%), содержание Эудрагита - 4 мг/мл (0,4%).
Оборудование:
Микрореакторная установка Qmix (Wingflow, Швейцария):
Проточный микрореактор: объем 400 мкл, боросиликатное стекло (Wingflow, Швейцария).
Скорость подачи жидких фаз:
- 0,5% или 1% раствор поливинилового спирта: 0,5 мл/мин или 1 мл/мин (нанесение покрытия), далее 1 мл/мин;
- раствор никлозамида и полимеров (PLGA, Эудрагит): 0,2 мл/мин.
Получение частиц
Микрофлюидная установка включалась, устанавливалась подача раствора поливинилового спирта 0,5% или 1% со скоростью 1 мл/мин, включался нагрев проточного микрореактора до 60°С и подача раствора поливинилового спирта продолжалась в течение следующих 20 или 40 минут. Затем поток останавливался до охлаждения проточного микрореактора до комнатной температуры. После этого поток поливинилового спирта возобновлялся с прежней скоростью и в установку начинал подаваться раствор никлозамида и полимеров (PLGA, Эудрагит) в ацетоне или ацетонитриле со скоростью 0,2 мл/мин. После начала подачи раствора этопозида и полимеров проводился сбор головной фракции под контролем давления в системе. Начало образования суспензии фиксировалось по повышению давления. Головная фракция собиралась в течение 3 минут от начала повышения давления и в дальнейшем отбрасывалась. Сбор основной фракции осуществлялся до израсходования растворов.
Далее основная фракция упаривалась под вакуумом на ротационном испарителе до удаления летучего органического растворителя и части воды. При необходимости проводилось удаление излишков поливинилового спирта путем центрифугирования и удаления излишков супернатанта. После чего к осадку прибавлялось необходимое для ресуспендирование количество воды и проводилось ресуспендирование с использованием механического встряхивателя, либо ультразвуковой бани. Далее к полученной суспензии добавляли рассчитанное заранее количество D-маннитола (криопротектора). В случае, если стадия центрифугирования-ресуспедирования не проводилась, криопротектор добавляли сразу после упаривания на ротационном испарителе. Суспензия с криопротектором подвергалась заморозке в жидком азоте и далее осуществлялась лиофильная сушка суспензии. Готовый продукт представляет собой пористую лиофильную массу.
Качество получаемых серий оценивалось по среднему размеру частиц и индексу полидисперсности (таблица 4).
Как показано выше, изобретение позволяет получить наночастицы в диапазоне 200-400 нм с однородным распределением значений размеров частиц относительно среднего, что подтверждается значениями индекса полидисперсности, не превышающего 0,2. Получаемый из наносуспензии лиофилизат представляет собой готовый к использованию продукт. Стерильность получаемого лиофилизата может быть достигнута как производством в асептических условиях, так и введением дополнительной стадии стерилизации. Свойства получаемого лиофилизата позволяют осуществить его растворение с ресуспендированием наночастиц в объеме и применять в виде суспензий для инъекций, ингаляций, наружного и внутреннего применения; таблеток, капсул, гранул, аэрозолей, порошков и мазей в составе готовых лекарственных форм.
Источники информации
1. А. Гербст, В.В. Шудегов, Р.Ф. Яруллин, Л. Наземцева. Нанотехнология и микрореакторы - параллели в развитии. // Био- и нанотехнологии, №3 (16) май 2012, С. 78-88.
2. Д.Р. Раимов, В.В. Суслов. ПОЛУЧЕНИЕ ПОЛИМЕРНЫХ МИКРОННЫХ И СУБМИКРОННЫХ ЧАСТИЦ С ИСПОЛЬЗОВАНИЕМ МИКРОФЛЮИДНЫХ ПРОТОЧНЫХ ТЕХНОЛОГИЙ // Успехи в химии и химической технологии. ТОМ ХХIХ. 2015. №10, С. 118-119.
3. Shui, L., van den Berg, A. and Eijkel. J.C.T. (2009) 'Interfacial tension controlled W/O and O/W 2-phase flows in microchannel', Lab Chip, 9: 795-801.
4. Heller, Christoph. Analysis of Nucleic Acids by Capillary Electrophoresis. Braunschweig: Vieweg, 1997. Print., 143.
5. Tohei Moritani, Kyunghwan Yoon, Miriam Rafailovich, Benjamin Chu. DNAcapillary electrophoresis using polyvinyl alcohol). I. Inner capillary coating. Electrophoresis 2003, 24, 2764-2771.
6. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.: Химия, 1994. - 352 с: ил.
7. А. Гербст, С.А. Кедик, Д.Р. Раимов, Е.С. Жаворонок, Е.А. Петрова, А.В. Панов, В.В. Суслов, Л. Гринер, Л. Наземцева. Микрореакторные системы для микроинкапсулирования в фармации // Разработка и регистрация лекарственных средств - 2014. - Выпуск 4 (9). - С. 76-85.
8. Xie and Smith: Fabrication of PLGA nanoparticles with a fluidic nanoprecipitation system. Journal of Nanobiotechnology 2010 8:18.
1. Способ получения фармацевтических композиций на основе полимерных наночастиц методом микрофлюидной технологии, состоящий в пропускании через проточный микрореактор, выполненный из боросиликатного стекла, водного раствора, содержащего поливиниловый спирт и раствор в ацетоне или ацетонитриле этопозида или никлозамида и биодеградируемого полимера в виде сополимера молочной и гликолевой кислот с характеристической вязкостью 0,41-1,0 дл/г и молярным соотношением мономерных звеньев от 25 и 75 до 75 и 25% или его смесь с полиметилметакрилатом для медицинского применения Eudragit, при этом предварительно через проточный микрореактор из боросиликатного стекла пропускают водный раствор поливинилового спирта с концентрацией от 0,5 до 1% по объему в количестве 1-100 объемов микрореактора, нагретого до температуры 55-65°С с последующим охлаждением микрореактора до комнатной температуры.
2. Способ по п. 1, отличающийся тем, что фармацевтическая композиция представляет собой готовую лекарственную форму в виде стерильных или нестерильных лиофилизатов для последующего растворения и получения суспензий для инъекций, или ингаляций, или таблеток, или капсул, или гранул, или аэрозолей, или порошков, или мазей.