Штамм streptomyces virginiae - продуцент вирджиниамицина и способ получения вирджиниамицина
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Предложен штамм микроорганизма Streptomyces virginiae - продуцент антибиотика вирджиниамицина, депонированный в ВКМ под регистрационным номером ВКМ Ac-2738D и способ получения антибиотика вирджиниамицина. Способ получения антибиотика вирджиниамицина предусматривает культивирование штамма микроорганизма Streptomyces virginiae ВКМ Ac-2738D, сорбцию антибиотика из культуральной жидкости во время биосинтеза на полимерные смолы DIAION™ НР20 или DIAION™ НР21 с последующим отделением смолы фильтрацией и элюированием антибиотика ацетоном, метиленхлоридом или спиртами и концентрацией элюата в вакууме до сухого вещества. Группа изобретений позволяет упростить выделение и очистку получаемого антибиотика. 2 н.п. ф-лы, 7 пр.
Реферат
Изобретение относится к биотехнологии, в частности к технологии получения биологически активного соединения вирджиниамицина на основе нового высокопродуктивного штамма, и касается способа его получения, выделения и очистки для использования в качестве антибиотика немедицинского применения.
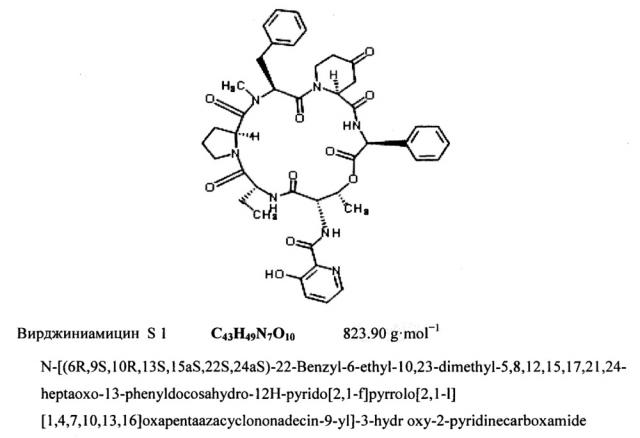
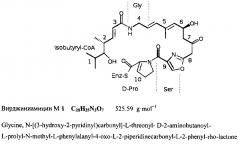
Вирджиниамицин относится к природным антибиотикам стрептограминовой группы и представляет собой смесь макроциклических пептидолактонов М и S. Фактор М вирджиниамицина - макроциклический лактон, содержащий оксазолиновое кольцо; он состоит из компонентов M1 и М2. Фактор S состоит из циклопептидного лактонового кольца и содержит пять компонентов (S1-S5). Основными компонентами антибиотика являются M1 (VM) и S1 (VS). Вирджиниамицины обладают синергическим действием, причем максимум антибактериальной активности проявляется, когда соотношение компонентов M1 и S1 равно 70-75:25-30.
Вирджиниамицин обладает бактериостатическим действием, в основном, против грамположительных бактерий и имеет очень низкую токсичность. Вирджиниамицин M1 (М фактор) эффективен в отношении стафилококков и стрептококков, устойчивых к другим антибиотикам - пенициллину, стрептомицину, эритромицину, тетрациклину и др. Фактор S более активен в отношении бацилл, но мало активен в отношении кокковых культур; его активность для них составляет только 3-4% от общей активности фактора М. Активность вирджиниамицина является результатом суммарного (синергического) действия двух факторов. Максимум синергического действия вирджиниамицина наблюдается в присутствии 25-40% фактора S, при этом активность фактора М увеличивается в 3,5-4 раза.
При пероральном введении вирджиниамицин не всасывается в желудочно-кишечном тракте и не подвергается воздействию пищеварительных ферментов, поэтому создается его высокая концентрация, что способствует длительному антимикробному действию в желудочно-кишечном тракте. Вирджиниамицин не накапливается в органах и тканях, из организма выводится в неизменном виде с фекалиями. Применяется в животноводстве для профилактики и лечения некротического энтерита у цыплят-бройлеров, кур, а также для стабилизации кишечной микрофлоры, увеличения привесов, улучшения усвоения кормов. Высокая эффективность вирджиниамицина делает его применение особенно ценным в животноводстве в качестве антибиотической добавки при откорме сельскохозяйственных животных и птиц, способствуя выживаемости молодняка, снижению заболеваемости, повышая ежедневную прибавку в весе и улучшая эффективность питания.
Продуцентом вирджиниамицина является микроорганизм Streptomyces virginiae. Впервые описание способа получения антибиотика этой культурой было опубликовано в журнале Antibiotics and Chemotherapy [1], и одновременно была подготовлена заявка на патент (US 758483). Первый коммерческий препарат вирджиниамицина промышленного производства (Stafac 500) был получен в Бельгии в 1966 г. в компании Pfizer и поступил на рынок в 1972 г.
Исходя из литературных данных, предпочтительным способом получения штамма суперпродуцента вирджиниамицина является многостадийный индуцированный мутагенез в комбинации с селективным отбором. В качестве мутагена применяется УФ облучение, использование которого не требует наличия сложного оборудования и отличается простотой.
К настоящему времени существует информация об успешном использовании метода индуцированного мутагенеза для получения штаммов-суперпродуцентов, значительно превосходящих по своей продуктивности исходные штаммы. Так, активность некоторых мутантных штаммов S. virginiae может достигать 550 [2], 650 [3] и даже 1200 ед./мл (~1.9 г/л) [4], в то время как активность родительского штамма не превышает 20-30 ед/мл (30-50 мг/л). Дополнительно увеличить продуктивность штаммов возможно путем подбора оптимального состава ферментационной среды и условий ферментации, однако даже в этом случае производительность существующих в настоящее время промышленных штаммов остается в основном в пределах 3-4 г/л (1875-2500 ед/мл) [5, 6], и лишь в одном случае заявленный уровень продуктивности достигает 5 г/л (3125 ед/мл) [7]. При этом авторы практически всех существующих публикаций и патентов не приводят данных о соотношении ключевых компонентов вирджиниамицина M1 и S1 в общем выходе получаемого ими антибиотика. Отсутствие такой информации не дает возможности объективно оценить качество получаемого препарата. При нарушении синергического соотношения компонентов M1 и S1 в конечном продукте эффективность вирджиниамицина как противомикробного препарата снижается, что требует либо включения в процесс производства дополнительных технологических этапов, связанных с коррекцией этого соотношения в готовой субстанции, либо разделением компонентов в процессе выделения и очистки с целью последующего их смешивания в нужной пропорции.
Прототипом настоящего изобретения является способ получения запатентованного в России мутантного штамма S. virginiae S-1046 [3], обладающего высокой продуктивностью (650 ед/мл или 1,04 г/л) и высоким уровнем устойчивости к продуцируемому им вирджиниамицину до 500 мкг/мл, что важно при промышленном производстве. Однако авторы не указывают, каково соотношение компонентов M1 и S1 в получаемом целевом продукте, что не позволяет оценить качество получаемого вирджиниамицина.
Таким образом, недостатками существующих штаммов-продуцентов вирджинамицина являются относительно невысокая базовая продуктивность при неизвестном качестве (не указывается соотношение компонентов M1 и S1 в конечном продукте).
Целью предлагаемого изобретения является получение нового высокопродуктивного штамма-продуцента вирджиниамицина, способного продуцировать вирджиниамицин с соотношением компонентов M1 и S1, обеспечивающих синергизм их действия, а также разработка способа получения антибиотика, пригодного для создания технологии его промышленного получения.
Цель достигается получением нового высокопродуктивного штамма S. virginiae IB 25-8, обеспечивающего получение вирджиниамицина высокого качества (соотношение M1 (75±5)% + S1 (25±5)%) и депонированного во Всероссийской коллекции микроорганизмов под регистрационным номером ВКМ Ac-2738D.
Новый штамм S. virginiae IB 25-8 получен методом многоступенчатого индуцированного мутагенеза (УФ облучение) и селекции (направленных методов отбора модификантов исходного штамма S. virginiae ВКПМ Ас790 с продуктивностью 375 ед/мл (0.6 г/л)) и обладает повышенной продуктивностью вирджиниамицина (5,6 г в 1,0 л культуральной жидкости - 3500 ед/мл).
Культурально-морфологические и физиологические признаки штамма S. vireiniae IB 25-8
Клетки мицелия нитевидной формы, спороносцы прямые, споры овальные, гладкие, под микроскопом неотличимы от исходного штамма Streptomyces virginiae Ас-790. Мутантный штамм S. virginiae IB 25-8 отличается от родительского штамма ВКПМ Ас-790 цветом колоний на агаризованной среде (серые с белым ободком вместо однородных темно-серых), субстратного мицелия (темно-коричневый вместо бежевого), и культуральной жидкости в конце ферментации (темно-серый вместо коричневого).
Рост на агаризованных средах (на 10-е сутки роста при 28°С)
На среде Гаузе 1 стандартного состава штамм образует слегка выпуклые круглые колонии диаметром 7-9 мм. Поверхность колонии гладкая, споры серого цвета, по краям колонии узкий (0,5 мм) светлый ободок. Субстратный мицелий коричневый. Вокруг колонии - нечеткая зона гидролиза крахмала диаметром 3-5 мм.
На других стандартных средах - (среда №1 Красильникова с глюкозой, среда №1 Красильникова с сахарозой, среда №1 Красильникова с крахмалом) штамм образует кремовые или коричневые колонии со складчатой поверхностью и волнистыми краями. Споры белого цвета немногочисленны, субстратный мицелий коричневый.
Рост на жидких средах
На жидкой ферментационной среде штамм образует незначительные сплетения гифов, клетки мицелия нитевидной формы, спороносцы прямые, споры овальной формы. По окончании ферментации культуральная жидкость приобретает темно-серый цвет.
Усвоение углеводов
Аналогично исходному штамму, новый штамм S. virginiae IB 25-8 способен усваивать глюкозу и мальтозу. В отличие от исходного штамма, штамм S. virginiae IB 25-8 усваивает сахарозу. На других проверенных углеводах (арабинозе, галактозе, ксилозе, лактозе, рамнозе, рафинозе, фруктозе) рост культуры отсутствует. Штамм IB 25-8 слабо разжижает желатин, хорошо гидролизует крахмал.
Отношение к источникам азота
Как и исходный штамм S. virginiae ВКПМ Ас-790, новый штамм S. virginiae IB 25-8 усваивает азот из солей аммония. Не растет на мочевине, хорошо растет на органических источниках азота.
Отношение к антибиотикам
В отличие от родительского штамма, мутантный штамм S. virginiae IB 25-8 устойчив к повышенной концентрации собственного антибиотика (4.0 мг/мл) и тилозину 200 (до 0.5 мг/мл). В отношении других проверенных антибиотиков (эритромицин, линкомицин, пенициллин, канамицин, тетрациклин, стрептомицин, гентамицин, рифампицин, левомицетин) чувствительность штамма не отличается от таковой родительского штамма.
Антагонистические свойства
Штамм S. virginiae IB 25-8 при росте на агаризированных средах умеренно угнетает рост грамположительных бактерий Staphylococcus aureus, Bacillus subtilis, Bacillus mycoides, Micrococcus luteus, устойчивых к другим антибиотикам - пенициллину, стрептомицину, тетрациклину, эритромицину. Штамм почти не действует на грамотрицательные бактерии Escherichia coli и Salmonella.
Питательные среды
Агаризованная питательная среда
Для поддержания, хранения и приготовления посевного материала культуры используется агаризованная среда Гаузе 1 состава, (г/л): агар-агар - 20, кукурузный крахмал - 20, KH2PO4 - 0.5, MgSO4⋅7H2O - 0.5, KNO3 - 1.0, NaCl - 5.0, FeSO4 - 0.01, дистиллированная вода - до 1.0 л (рН до стерилизации - 6.8-7.0).
Хранение не более трех месяцев при температуре около 5°С в холодильной камере. Для длительного хранения культуру лиофилизируют или хранят в жидком глицерине при -70°С.
Вегетативная питательная среда
Поддержание культуры осуществляют на вегетативной среде следующего состава (г/л): глюкоза - 1.0, мясной экстракт - 3.0, крахмал растворимый - 10.0, дрожжевой автолизат - 5.0, гидролизат казеина - 5.0, MgSO4⋅7Н2О - 0.08, кальций углекислый - 0.5, вода дистиллированная - до 1.0 л (рН до стерилизации - 7.0-7.2).
Для поддержания уровня продуктивности культуры, перед каждым пересевом ее на свежие питательные среды, проводят моноспоровый рассев на чашки Петри.
Выращивание культуры продуцента в чашках Петри проводят в течение 6-7 суток при температуре 28°С.
Ферментационная питательная среда
Состав базовой ферментационной среды (г/л): кукурузный глютен - 5.0, дрожжевой экстракт - 1.0, пептон ферментативный - 2.5, солодовый экстракт - 10.0, кальций углекислый - 5.0, глюкоза - 5.0, вода дистиллированная - до 1.0 л (рН до стерилизации - 7.0-7.2). Культуру выращивали в колбах на качалке при 250 об/мин, температуре 28°С в течение 96 часов.
Количественное определение вирджиниамицина в культуральной жидкости осуществляют методом ВЭЖХ с использованием стандартного образца антибиотика с содержанием вирджиниамицина в М и S форме (75+25) % и стандартных образцов вирджиниамицина M1 и S1 (Sigma). Содержание антибиотика в культуральной жидкости к концу ферментации (через 96 ч) составляет 5.6 г/л.
Преимуществом заявленного штамма по сравнению с прототипом является в 8.5-9 раз повышенная продуктивность штамма, а именно содержание антибиотика в культуральной жидкости исходного штамма 0.6 г/л, а в заявленном штамме - 5.6 г/л, а также способность штамма продуцировать антибиотик высокого качества с синергичным соотношением М и S форм препарата (75+25)%.
Выделение вирджиниамицина
Согласно литературным данным выделение препарата осуществляют отделением биомассы от культуральной жидкости путем фильтрации или центрифугирования подкисленной культуральной жидкости с последующей экстракцией антибиотика из нативного раствора органическими растворителями, такими как метилизобутилкетон, амилацетат, эфиры, кетоны. В дальнейшем целевой продукт может быть осажден из экстракта n-гексаном с последующим растворением осадка в хлороформе и подвергнут выпариванию при пониженном давлении и температуре, не превышающей 50°С.
Полученный технический препарат вирджиниамицина может быть очищен путем растворения в полярном водном органическом растворителе, например уксусной кислоте (80%), осажден путем добавления избытка воды, далее подвергнут фильтрации, растворению в хлороформе или метиленхлориде и очистке на сорбенте (силикат магния). Альтернативный путь - осаждение из хлороформа путем добавления избыточного количества гексана [8, 9].
Другим вариантом очистки вирджиниамицина является очистка на неорганических полярных сорбентах, таких как силикагель или оксид алюминия. Экстракт вирджиниамицина наносят на сорбент, промывают неполярным растворителем (петролейный эфир, метиленхлорид) для удаления примесей, затем элюируют вирджиниамицин полярным растворителем (изопропанол, ацетон) и упаривают в вакууме [10].
Возможны также выделение и очистка вирджиниамицина на гидрофобных неполярных сорбентах, таких как Amberlite XAD-2. Для этого нативный раствор, содержащий вирджиниамицин, пропускают через слой сорбента, сорбент отмывают водой и элюируют вирджиниамицин с помощью растворителя, способного в любых соотношениях смешивается с водой (низшие спирты, ацетон и т.п.), и далее чистят, как описано выше.
Согласно настоящему изобретению предлагается следующий способ выделения и очистки препарата
При выборе оптимальных условий культивирования штамма S. virginiae IB 25-8 было установлено, что в процессе роста мутантных штаммов с повышенной продуцирующей способностью, в культуральную среду помимо целевого продукта выделяется большое количество метаболитов. Данные вещества оказывают негативное влияние как на рост и развитие самой культуры, так и препятствуют повышению биосинтеза целевого вещества.
Для снижения эффектов цитотоксичности и самоингибирования авторы использовали в процессе культивирования штамма IB 25-8 различные синтетические адсорбирующие смолы, выводящие избыточное количество целевого продукта из зоны синтеза. Смолы добавлялись в ферментационную среду перед стерилизацией в количестве 20 г/л. Это позволило избирательно связывать и выводить образовавшийся в результате биосинтеза вирджиниамицин из зоны синтеза. Лучшие результаты были получены при использовании полимерных смол DIAION™ НР20 и НР21. В результате использования этого приема удалось повысить продуктивность штамма S. virginiae IB 25-8 до 5.6 г/л, что значительно превосходит продуктивность известных штаммов продуцентов вирджиниамицина, а также существенно упростить последующее выделение антибиотика из культуральной жидкости.
Подобранные эмпирическим путем смолы DIAION™ НР20 и НР21, которые добавляют прямо в культуральную жидкость перед проведением биосинтеза и которые позволяют очень избирательно сорбировать антибиотик из культуральной жидкости, способствовали также значительному упрощению схемы выделения целевого продукта. Сорбент обеспечивает практически полное устранение сопутствующих целевому продукту примесей - минорных компонентов, пигментов, продуктов белкового характера, солей и др., которые остаются в культуральной жидкости. По завершении ферментации сорбент отделяют от культуральной жидкости фильтрацией, тщательно отмывают водой и десорбируют антибиотик со смолы органическим растворителем (таким как ацетон, метиленхлорид или спирты) с последующим упариванием полученного элюата в вакууме досуха. Получают целевой продукт с выходом не менее 87% и содержанием основного вещества не менее 90% (соотношение M1:S1 - 75:25).
Предложенный способ позволяет существенно упростить выделение и очистку целевого продукта при сохранении высокого выхода и качества субстанции (5-6 стадий вместо 10-14 в существующих способах).
Это позволило сделать способ экономически целесообразным за счет:
значительного сокращения длительности процесса;
уменьшения количества используемых органических растворителей;
исключения стадий, требующих специального дорогостоящего оборудования (хроматографическая очистка).
Таким образом, получен новый мутантный штамм S. virginiae IB 25-8, отличающийся от исходного по характеру роста на диагностических агаризованных средах, по степени усвоения источников углерода (сахароза), по устойчивости к собственному антибиотику и по продуктивности, которая в 8.5-9 раз превосходит продуктивность исходного штамма - S. virginiae ВКПМ Ас-790 (0.6 г/л). Продуктивность нового штамма, определенная методом ВЭЖХ составляет 5.1-5.6 г/л, в зависимости от условий культивирования, что значительно превосходит продуктивность известных штаммов продуцентов вирджиниамицина, при этом соотношение компонентов вирджиниамицина M1 и S1 в конечном продукте составляет M1 (75±5)% + S1 (25±5)%), что является оптимальным для проявления антимикробных свойство антибиотика. Использование нового штамма S. virginiae IB 25-8 как продуцента для биосинтеза вирджиниамицина позволяет значительно увеличить выход целевого продукта высокого качества в культуральной жидкости, а смолы, применяемые в процессе проведения биосинтеза целевого продукта не только способствуют повышению продуктивности штамма S. virginiae IB 25-8, но и очень существенно упрощают выделение и очистку антибиотика.
Авторами также проведено успешное масштабирование процесса биосинтеза в 100-литровом ферментере, и тем самым продемонстрирована возможность проведения процесса биосинтеза в промышленном масштабе.
Изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1
Мутагенез
В качестве мутагенного фактора были использованы УФ-лучи с длиной волны, находящейся в диапазоне 250-280 нм (лампа Mineralight, мощность 12.5 Вт). Суспензию, содержащую споры и обрывки мицелия и полученную путем смыва с поверхности агаризованной среды, фильтровали через стерильный ватный фильтр или через фильтровальную воронку Шотта (размер пор 100 мкм). В полученной суспензии при помощи камеры Горяева-Тома подсчитывали концентрацию спор. При необходимости суспензию разводили до концентрации (1,5-2)*106 спор/мл. После подсчета и разведения суспензия подвергалась облучению в открытой чашке Петри на расстоянии 40 см от лампы. Время экспозиции составляло 15-20 минут. Далее суспензию, подвергшуюся облучению, в количестве 100-200 мкл переносили на поверхность агаризованной среды и равномерно распределяли по поверхности. Культивирование на твердой агаризованной среде проводили в течение 12-14 суток при температуре 29°С. По окончанию культивирования из выросших на агаризованной среде колоний отбирали от 20 до 50 морфологически измененных колоний и повторно пересевали на агаризованную среду, а затем культивировали в колбах с использованием ферментационной среды и определяли их продуктивность методом (ВЭЖХ). Изоляты, обладающие максимальной продуктивностью, использовали в следующем цикле УФ-мутагенеза и отбора. Продуктивность полученного в итоге штамма S. virginiae IB 25-8 на исходной ферментационной среде в условиях стабилизации рН на уровне 6.8-7.0 составила 2.95 г/л, соотношение M1:S1 составило 72:28.
Пример 2
Культивирование S. virginiae IB 25-8 с использованием жидкой питательной среды в ферментере.
Для поддержания, хранения и приготовления посевного материала использовали агар Гаузе 1 с гороховой мукой (г/л): кукурузный крахмал - 20; гороховая мука - 10.0, KH2PO4 - 0.5, MgSO4 - 0.5, NaCl - 0.5, FeSO4 - 0.01, KNO3 - 1.0, агар - 20, рН - 6.8-7.0. После инкубации в течение 7-10 суток на твердой среде при 28°С споровый материал с мицелием засевали в жидкую питательную среду (г/л): глюкоза - 1.0, растворимый крахмал - 10.0, мясной экстракт - 3.0, дрожжевой автолизат - 1.0, гидролизат казеина - 5.0, кальций углекислый - 0.5 и выращивали при 28°С в течение 24 ч на термостатируемой качалочной установке (эксцентриситет 5 см, 220 об/мин). Посевной материал проходил две генерации: 50 мл среды в колбах Эрленмейера объемом 0.25 л (инкубация 44-48 ч), и 500 мл среды в колбах Эрленмейера объемом 2 л (инкубация 24 ч). Выросший посевной материал в объеме 3.5 л засевали в 100-л ферментационную установку.
Ферментацию проводили на среде следующего состава (г/л): сахароза - 35.0, гороховая мука - 10.0, глютен кукурузный - 5.0, пептон ферментативный - 2.5, дрожжевой экстракт - 5.0, солодовый экстракт - 10.0, NaCl - 3.0, MgSO4 - 1.0, CaCO3 - 5.0, (NH4)2SO4 - 1.0, KH2PO4 - 1.6, Na2HPO4 - 1.0, вода дистиллированная; рН до стерилизации 6.8-7.0. Общий объем среды в ферментере - 65 л. Перед стерилизацией в ферментер добавляют 1.4 кг смолы DIAION™ НР21 (из расчета 20 г/л). Питательную среду в ферментере стерилизовали при температуре 121-123°С в течение 1 часа, после чего охлаждали до 28±1°С, поддерживая давление 0.03-0.05 МПа путем подачи стерильного воздуха. Процесс стерилизации и охлаждения проводят при непрерывно работающей мешалке (250 об/мин). Выращивание штамма-продуцента в ферментере ведут при следующих условиях:
• температура (28±1)°С;
• аэрация 35 л/мин от 0 до 24 часов роста от 24 часов роста до конца ферментации - 70 л/мин.
После засева ферментера температуру культуральной жидкости поддерживают на уровне 28±1°С. В ферментер непрерывно подают стерильный воздух в количестве 35-70 л/мин и поддерживают давление от 0,05 до 0,08 МПа. Перемешивают со скоростью 250-350 об/мин.
С 48 часов роста начинают непрерывную подачу 50% раствора сахарозы из расчета 10 г/л в сутки. Подачу продолжают трое суток. Начиная с 72 часов, ведут контроль содержания вирджиниамицина методом ВЭЖХ.
В качестве контроля используют стандартный образец антибиотика с содержанием вирджиниамицина в М и S форме (75+25) % и стандартные образцы вирджиниамицина M1 и S1 (Sigma). Время ферментации - 92-96 ч.
Параметры культуральной жидкости на момент окончания процесса биосинтеза:
- посторонняя микрофлора - отсутствует;
- микроскопическая картина - ветвящиеся короткие гифы, протоплазма в гифах дифференцирована;
- содержание вирджиниамицина в культуральной жидкости - 5,6 г/л, соотношение M1 (75±5)% + S1 (25±5).
Пример 3
Выделение вирджиниамицина из культуральной жидкости
Выделение антибиотика из культуральной жидкости, содержащей сорбент Diaion НР21
Культуральную жидкость объемом 70 л, полученную после ферментации, в ферментере объемом 100 л, с концентрацией вирджиниамицина 5.6 г/л (392 г вирджиниамицина), с рН 6,5 и содержащую 1.4 кг сорбента Diaion НР21, фильтруют через нутч-фильтр, дважды промывают сорбент 10 л воды, освобождая от остатков культуральной жидкости, и десорбируют антибиотик с сорбента путем двукратной обработки ацетоном (2×10 л). Ацетоновые экстракты объемом 20 л концентрируют в вакууме досуха (остаточное давление 10-15 мм.рт.ст.) при температуре 40°С и получают 341 г светлого порошкообразного продукта. Выход в расчете на культуральную жидкость 87,2%. Содержание основного вещества 91. 2% (соотношение M1 75% + S1 25%).
Пример 4
Выделение антибиотика из культуральной жидкости, содержащей сорбент Diaion НР20
Биосинтез и выделение препарата вирджиниамицина проводят аналогично примеру 3, используя для увеличения продуктивности штамма продуцента и последующего выделения антибиотика полимерную смолу Diaion НР20. Выход в расчете на культуральную жидкость 85,0%. Содержание основного вещества 90.3% (соотношение M1 73% + S1 27%).
Пример 5
Выделение антибиотика из культуральной жидкости, содержащей сорбент DIAION™ НР20
Биосинтез и выделение препарата вирджиниамицина проводят аналогично примеру 3, используя для увеличения продуктивности штамма продуцента и последующего выделения антибиотика полимерную смолу DIAION™ НР20, а элюируют антибиотик со смолы путем двукратной обработки изопропанолом (2×10 л). Выход в расчете на культуральную жидкость 86,7%. Содержание основного вещества 89. 9% (соотношение M1 73% + S1 27%)
Пример 6
Выделение антибиотика из культуральной жидкости, содержащей сорбент DIAION™ НР21
Биосинтез и выделение препарата вирджиниамицина проводят аналогично примеру 3, используя для элюирования антибиотика с сорбента двукратную обработку метанолом (2×10 л). Выход в расчете на культуральную жидкость 87,0%. Содержание основного вещества 90. 5% (соотношение M1 73% + S1 27%).
Пример 7
Выделение антибиотика из культуральной жидкости, содержащей сорбент DIAION™ НР20
Биосинтез и выделение препарата вирджиниамицина проводят аналогично примеру 3, используя для увеличения продуктивности штамма продуцента и последующего выделения антибиотика полимерную смолу DIAION™ НР20 и элюируют антибиотик с сорбента путем двукратной обработки метиленхлоридом (2×10 л). Выход в расчете на культуральную жидкость 85,9%. Содержание основного вещества 90. 0% (соотношение M1 73% + S1 27%).
Источники информации
1. De Somer P., Van Dijck P. (1955) A preliminary report on antibiotic number 899, a streptogramin-like substance // Antibiotics & Chemotherapy. V. 5. - P. 632.
2. Prikrylova V., Blumauerova M., Sedmera P., Vanek Z., Marsalek J., Kristan V. (1987) Strain development in Streptomyces virginiae, a producer of virginiamycyn // Biotechnol. Bioind. V. 2. - No. 2. - P. 20-22.
3. Звенигородский В.И., Тяглов Б.В., Владимирова E.C., Жданов В.Г. Штамм Streptomyces virginiae - продуцент антибиотика вирджиниамицина // Патент RU 2007458. – 1994.
4. Biot A.M. (1984) Virginiamycins: properties, biosynthesis, and fermentation. In: Biotechnology of Industrial Antibiotics (Vandamme E.J. ed.). New York-Basel: Dekker. P. 695-720.
5. Zhao W., Zhang Z., Cheng Q. Culture medium for biosynthesis of virginiamycin M // Patent CN 101538539. - 2011.
6. Han F., Li G., Zou J., Deng J., Huang L. Method for biosynthesizing virginiamycin by streptomycete // Patent CN 102943102. - 2013.
7. Yong R. Culture medium for producing virginiamycin through Streptomyces virginiae fermentation and feeding method of culture medium // Patent CN 104480174. - 2015.
8. Nott K., Paquot M., Heilporn S., Gossel F., Giard J., Gerbaux P., Lognay G., Wathelet B. A fast and reliable chromatographic procedure for the purification of virginiamycin M1 factor // Chromatographia. - 2002. - V. 56. - P. 331-335.
9. Chapin F., Wishousky Т., Towner D., Petka L., Villani A., Biot A., Menon G., Wang R. Purified 14C virginiamycin // J. Liquid Chromatogr. - 1988. - V. 11. - No. 11. - P. 2367-2373.
10. De Somer P., Vanderhaeghe H., van Dijck P., van de Voorde H. Antibiotic factor S and compositions containing same // Patent US 3325359. - 1967.
1. Штамм Streptomyces virginiae ВКМ Ac-2738D - продуцент антибиотика вирджиниамицина.
2. Способ получения антибиотика вирджиниамицина путем биосинтеза с использованием штамма-продуцента Streptomyces virginiae ВКМ Ac-2738D, сорбции антибиотика полимерной смолой DIAION™ НР20 или DIAION™ НР21 во время биосинтеза из культуральной жидкости, ее отделением путем фильтрации после окончания процесса и элюирования препарата ацетоном, метиленхлоридом или спиртами с последующей концентрацией элюата в вакууме досуха.