Фотосенсибилизатор на основе карбоцианинового красителя для фотодинамической терапии опухолей
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины, в частности к созданию фотосенсибилизаторов для фотодинамической терапии онкологических заболеваний, и может быть использовано для разработки новых препаратов, обладающих высокой селективностью и эффективностью терапевтического воздействия. В качестве нового фотосенсибилизатора для фотодинамической терапии опухолей предложен нековалентный комплекс, включающий карбоцианиновый краситель 2,6-бис-(3,7-ди-N-метил-бенз[1,2-d:4,3-d']бистиазол-)-[N-метил-3,3'-диметил-индокарбоцианина] перхлорат и средство адресной доставки препарата в опухоль, представляющее собой ренатурированный ступенчатым диализом химерный рекомбинантный белок АрЕ1, характеризующийся аминокислотной последовательностью рецептор-связывающего домена альфа-фетопротеина человека с присоединенным к С-концу фрагментом, состоящим из последовательности, включающей 22 остатка глутаминовой кислоты и аффинную метку 6His-таг. Комплекс характеризуется высоким выходом активного триплетного состояния при фотовозбуждении, растворимостью в водных средах и устойчивостью в присутствии сывороточного альбумина человека. 2 табл., 4 ил.
Реферат
Изобретение относится к области биотехнологии и медицины, в частности к созданию фотосенсибилизаторов (ФС) для фотодинамической терапии (ФДТ) онкологических заболеваний, и может быть использовано для разработки новых препаратов, обладающих высокой селективностью и эффективностью терапевтического воздействия.
Фотодинамическая терапия представляет собой метод терапии опухолей, основанный на одновременном использовании двух факторов, совместно вызывающих уничтожение раковых клеток: введения фотосенсибилизатора и локального облучения светом определенной длины волны видимого или ИК-диапазона. Поскольку непосредственной причиной смертельного повреждения опухолевой клетки являются активные (синглетные) формы кислорода, эффективность ФДТ напрямую зависит от наличия и концентрации кислорода в опухолевой ткани.
Процедура ФДТ выполняется в виде двух последовательных этапов: на первом этапе внутривенно или местно вводится фотосенсибилизатор, который за счет пассивного биораспределения или энергозависимого транспорта избирательно накапливается в опухоли; на втором этапе проводится облучение источником света с длиной волны, максимально соответствующей спектру поглощения ФС. Эффективный ФС должен хорошо растворяться в водной среде и интенсивно поглощать свет в так называемом фототерапевтическом окне - в области наибольшей спектральной прозрачности тканей (650-850 нм), передавая поглощенную световую энергию на кислород, который в результате переходит в триплетное возбужденное состояние, окисляет биомолекулы и вызывает гибель клеток. Возможен также альтернативный путь генерации активной формы кислорода - супероксиданион-радикала, за счет прямой передачи электрона с триплетного состояния красителя на молекулярный кислород.
При любой из описанных схем эффективный ФС должен давать максимальный выход триплетного возбужденного состояния при фотовозбуждении за счет перехода из первичного короткоживущего синглетного состояния. Красители, не способные переходить в триплетное состояние, рассеивают поглощенную энергию в виде тепловых колебаний и не пригодны для использования в качестве ФС, хотя они могут обладать при этом высоким квантовым выходом флуоресценции [Schaberle F.A. et al., Spectrochim. Acta A Mol. Biomol. Spectrosc. 2009, 72(4), 863-867]. Предсказать способность красителя переходить в триплетное состояние на основании известного строения молекулы невозможно.
В качестве фотосенсибилизаторов для применения в ФДТ предложено множество препаратов, относящихся к разным классам химических соединений, например фуллерены [Li Q. et al., Nanosci. Nanotechnol. 2016, 16(6): 5592-5597; Yu C. et al. J. Nanosci. Nanotechnol. 2016, 16(1): 171-181], цианины [Shi C. et al., J. Biomed Opt. 2016, 21(5): 50901], гиперицин [Huntosova V. & Stroffekova K. Cancers (Basel) 2016, 8(10), pii: E93], неорганические композиции со свойствами полупроводников (квантовые точки) [Colombeau L. et al., Top Curr. Chem. 2016, 370, 113-134]. Однако в настоящее время в практике ФДТ наиболее широко применяют ФС, в состав которых входят тетрапиррольные макроциклы, в частности порфирины, хлорины, бактериохлорины, фталоцианины. Красители, как правило, используют в форме комплексов с белком-носителем, способствующим повышению биодоступности, специфичности и эффективности терапевтического воздействия препаратов. Один из известных подходов связан с использованием в качестве белка-носителя сывороточного альбумина, который образует с гидрофобными молекулами противоопухолевых агентов растворимые в плазме крови прочные комплексы, обладающие высокой тропностью к опухолям вследствие высокого уровня катаболической активности опухолевых клеток по сравнению с собственными клетками организма. [Mishra P.P. et al., J. Phys. Chem. B. 2006, 110, 21238]. Так, например, в патенте США [US 9211283 В2, опубл. 15.12.2015] описана система, основанная на доставке в опухоль гидрофобного тетрапиррольного фотосенсибилизатора в форме наночастиц, включающих ФС-препарат, стабилизированный человеческим сывороточным альбумином (ЧСА). В публикации [WO 2012006780 А1, опубл. 2012] описан ФС, представляющий собой комплекс фталоцианина с сывороточным альбумином. Использование сывороточного альбумина в композициях с ФС позволяет стабилизировать плохо растворимые в водной среде соединения, а также повысить эффективность их накопления в опухоли, однако при этом не обеспечивается необходимая селективность доставки ФС в опухоль, поскольку ЧСА поглощается не только опухолями, но и здоровыми тканями, хотя и с меньшей, по сравнению с опухолью, скоростью.
Анализ уровня техники показывает, что такой класс фотохимически активных соединений, как карбоцианиновые красители, до сих пор не нашел практического применения в фотодинамической терапии опухолей. В качестве прототипа нами взят практически единственный, известный препарат для диагностики и фотодинамической терапии нейроэндокринных опухолей, содержащий карбоцианиновый краситель, описанный в группе патентов [US 7510700 В2, опубл. 31.03.2009, US 7252815 В2, опубл. 07.08.2007 и др.]. Согласно прототипу опухолеспецифичный фототерапевтический и фотодиагностический препарат представляет собой ковалентный комплекс (биоконъюгат), включающий три различающихся функционально компонента: в качестве визуализирующего компонента он содержит бензиндольный карбоцианиновый краситель, в структуре молекулы которого имеются химически активные электрофильные группы, позволяющие ковалентно присоединять молекулу фотосенсибилизатора для ФДТ и сайт-специфичные средства адресной доставки препарата в опухоль. Следует отметить, что входящий в состав комплекса карбоцианиновый краситель по замыслу авторов предназначен для ковалентной сшивки компонентов между собой, а также для визуализации опухолевого процесса в диагностических исследованиях. Способность карбоцианинового красителя выполнять функцию фотосенсибилизирующего агента авторами не рассматривается. ФС-активность комплекса обеспечивается присутствием в его составе классического фотосенсибилизатора тетрапиррольного типа 2-[1-гексилоксиэтил]-2-дивинилпирофеофорбид-α (НРРН). В качестве средства адресной доставки препарата в опухоль прототип включает синтетический полипептид октреотид или бомбезин - аналоги соматостатина, обладающего сродством к поверхностным рецепторам нейроэндокринных опухолей. Несмотря на то что авторам удалось получить приемлемый выход предложенного ими трехкомпонентного конъюгата, очевидно, что использование в структуре препарата одновременно трех сложных компонентов, включая 8-10-членные пептиды, получаемые твердофазным синтезом, выводит себестоимость его получения на уровень, в десятки раз превышающий затраты на получение любого традиционного ФС тетрапиррольного или фталоцианинового типа. Для синтеза биоконъюгата необходимо получать промежуточные активированные формы компонентов путем введения изотиоцинатной или сукцинимидной групп, необходимых для ковалентной сшивки. Это не только усложняет и удорожает синтез, но и приводит к возникновению небиогенных ковалентных связей в месте сочленения пептида с активированным красителем, что неизбежно повышает побочную токсичность фотосенсибилизатора. К недостаткам этого технического решения также следует отнести высокое сродство НРРН к сывороточному альбумину, которое, как известно, характерно для соединений этого класса. Концентрация альбумина в плазме крови на несколько порядков превышает концентрацию рецепторов опухолеспецифичных пептидов на поверхности клеток нейроэндокринных желез и опухолевых тканей, образующихся при их злокачественном перерождении. Из-за этого практически весь конъюгат при попадании в кровь окажется связанным альбумином, эффективно поглощаемым различными типами нормальных клеток организма человека. В результате специфичность доставки препарата в опухоль на практике будет мало отличаться от специфичности мономерного НРРН, несмотря на существенно более высокую стоимость конъюгата по сравнению с мономерным красителем. Недостатком аналога также является узкий спектр терапевтической активности, ограниченный опухолями нейроэндокринной природы, составляющими около 0,1% от встречающихся на практике онкологических заболеваний [Rose D.B. et al., J. Med. Econ. 2016, 16, 1-19].
Техническая проблема, решение которой обеспечивается данным изобретением - расширение арсенала средств для фотодинамической терапии опухолей за счет введения в практику нового фотосенсибилизатора на основе красителя карбоцианиновой группы.
Сущность изобретения состоит в том, что новый фотосенсибилизатор для фотодинамической терапии опухолей представляет собой комплекс, включающий карбоцианиновый краситель и средство адресной доставки препарата в опухоль, отличающийся тем, что в качестве карбоцианинового красителя комплекс включает 2,6-бис-(3,7-ди-N-метил-бенз[1,2-d:4,3-d']бистиазол-)-[N-метил-3,3'-диметил-индокарбоцианина] перхлорат, в качества средства адресной доставки препарата в опухоль комплекс включает ренатурированный ступенчатым диализом рекомбинантный белок АрЕ1, характеризующийся аминокислотной последовательностью рецептор-связывающего домена 3 альфа-фетопротеина человека rhAFP3d с присоединенным к С-концу фрагментом, состоящим из последовательности, включающей 22 остатка глутаминовой кислоты и аффинную метку 6His-таг, при этом комплекс образован за счет нековалентных межмолекулярных взаимодействий между названным карбоцианиновым красителем и названным средством адресной доставки препарата в опухоль.
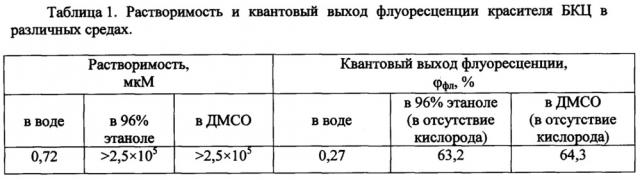
Соединение 2,6-бис-(3,7-ди-N-метил-бенз[1,2-d:4,3-d']бистиазол-)-[N-метил-3,3'-диметил-индокарбоцианина] перхлорат (далее - БКЦ) имеет молекулярную массу 718 г/моль и относится к бискарбоцианиновым полиметиновым красителям. Строение молекулы БКЦ и спектр поглощения в 96% этаноле показаны на Фиг. 1. Молекула БКЦ обладает симметричной структурой, включает хромофоры индоленинового и бензтиазольного типа, сопряженные друг с другом через цепочку метановых групп, и несет два положительных заряда при физиологических значениях рН. БКЦ мало растворим в воде, хорошо растворим в полярных органических растворителях, например 96% этаноле и диметалсульфоксиде (ДМСО). Получение БКЦ описано в работе [Киприанов А.И. и Мушкало И.Л., Журн. Орг. Хим., 1965, 1(4), 744-750]. Известно применение этого соединения в качестве фотосенсибилизатора галогенидов серебра, применяемых в цветной фотографии [Дядюша Е.Е. и соавт., Журн. Научн. Прикл. Фотограф. Кинематограф., 1981, 26, 174].
Проведенные авторами исследования фотохимических свойств красителя БКЦ показали, что при прямом фотовозбуждении раствора красителя БКЦ в этаноле образуется короткоживущий интермедиат триплетной природы с максимумом поглощения при 640 нм, который эффективно тушится кислородом. При концентрации кислорода в этиловом спирте 2×10-3 М это приводит к сокращению времени жизни триплета до 1 мкс. Прямое доказательство способности БКЦ переходить в триплетное состояние получено в экспериментах по Т-Т переносу энергии от донора (антрацен) на молекулу БКЦ при УФ-фотовозбуждении, в которых наблюдалось сенсибилизированное заселение триплетного уровня молекулы красителя с одновременным тушением триплета донора. Эти результаты доказывают, что в гидрофобном окружении молекула БКЦ приобретает способность переходить в триплетное состояние, что является необходимой предпосылкой для возможности использования БКЦ в качестве фотосенсибилизатора. Аналогичные процессы имеют место и при образовании нековалентного комплекса молекулы красителя с белком, что, как будет показано ниже, проявляется в повышении квантового выхода флуоресценции и непосредственно связанного с ним выхода триплетного возбужденного состояния [Schaberle F.A. et al. Spectrochim. Acta A Mol. Biomol. Spectrosc. 2009, 72(4), 863-867].
Выбор соединения 2,6-бис-(3,7-ди-N-метил-бенз[1,2-d:4,3-d']бистиазол-)-[N-метил-3,3'-диметил-индокарбоцианина] перхлорат в качестве потенциального ФС основан также на результатах, описанных в работе [Murakami L.S. et al. Biochim. Biophys. Acta. 2015, 1850(6), 1150-1157], в которой показано, что в среде культивирования опухолевых клеток меланомы in vitro вещество накапливается в них и вызывает их фотоиндуцированную гибель. После инкубирования в течение 5 часов препарата в концентрации 5 мкМ с клетками меланомы в среде, содержащей около 100 мкМ сывороточного альбумина в составе добавленной в нее фетальной сыворотки, и последующего облучения светом с длиной волны 500 нм, фотоиндуцированная гибель клеток составляет 100%. В качестве биологической особенности соединения показана его тропность к митохондриям клеток и его способность накапливаться в перинуклеарном пространстве. В совокупности эти факты показывают принципиальную возможность применения данного соединения в качестве фотосенсибилизатора для разрушения раковых клеток, однако для реализации этой возможности - создания эффективного фотосенсибилизирующего средства для практического применения в ФДТ, требуется преодолеть следующие ограничения:
- растворимость соединения в водных средах составляет менее 1 мкМ, что недостаточно для использования его в свободном виде, поскольку для достижения терапевтического эффекта потребуются высокие дозы препарата;
- соединение показывает незначительный квантовый выход триплетного состояния в водных средах, что определяет его неприемлемо низкую для практического применения фотосенсибилизирующую способность в свободном состоянии;
- необходимо обеспечить специфичность действия препарата in vivo путем адресной доставки соединения в опухолевую ткань.
В отличие от используемых в настоящее время в практике ФДТ фталоцианинов, имеющих четыре циклически расположенные индолениновые группировки, и полностью аналогичных по своим фотохимическим характеристикам тетрапирролам структура карбоцианинов, и БКЦ в частности, характеризуется линейным расположением полиметиновых цепей, соединяющих гетероароматические хромофорные группы. В водной среде полиметиновая цепь чрезвычайно подвижна и не обеспечивает сопряжения хромофоров, необходимого для достижения высокого квантового выхода флуоресценции, и линейно зависящего от него, выхода триплетного состояния (если оно возможно для конкретной структуры). Кроме того, в водных средах из-за высокой гидрофобности происходит димеризация, увеличивающая число степеней свободы тепловых колебаний молекулы красителя и снижающая тем самым квантовый выход флуоресценции и выход триплетного состояния. В окружении растворителей, менее полярных, чем вода, например в этаноле, ДМСО, глицерине, происходит фиксация полиметиновой цепи и разрушение димеров, что приводит к резкому увеличению квантового выхода флуоресценции и триплетного состояния [Schaberle F.A. et al. Spectrochim. Acta A Mol. Biomol. Spectrosc. 2009, 72(4), 863-867].
В Табл. 1 приведены данные по растворимости и квантовому выходу флуоресценции ϕфл 2,6-бис-(3,7-ди-N-метил-бенз[1,2-d:4,3-d']бистиазол)-[N-метил-3,3'-диметил-индокарбоцианин] перхлората в различных средах. Значения ϕфл определены, как описано в работе [Schaberle F.A. et al. Spectrochim. Acta A Mol. Biomol. Spectrosc. 2009, 72(4), 863-867].
Эти данные показывают, что практическое применение БКЦ в свободной форме в качестве фотосенсибилизирующего средства для ФДТ невозможно, поскольку в организме в водной среде он не будет обеспечивать необходимого уровня фотоактивности.
Общеизвестный подход к повышению эффективности и специфичности противоопухолевых средств основан на получении ковалентных комплексов путем химической сшивки молекул действующего вещества с активированными молекулами белков-носителей, обеспечивающих векторную доставку препарата в опухоль. Примером такого подхода для получения фотосенсибилизатора для ФДТ является техническое решение, рассмотренное выше в качестве прототипа. В отличие от прототипа в настоящем изобретении проблема перевода потенциально эффективного в качестве ФС соединения в пригодную для практического применения форму решена путем получения нековалентного комплекса типа «гость - хозяин», в котором молекула красителя образует комплекс с белком-носителем за счет межмолекулярных нековалентных взаимодействий. Наряду с гидрофобными взаимодействиями между молекулой красителя и участком молекулы белка, характеризующимся наличием «гидрофобного кармана», прочность нековалентного комплекса дополнительно обусловлена кулоновским взаимодействием между противоположно заряженными участками молекул красителя и белка.
В качестве белка-носителя взят химерный рекомбинантный белок АрЕ1 (молекулярная масса около 30 кДа), характеризующийся аминокислотной последовательностью рецептор-связывающего домена 3 альфа-фетопротеина (АФП) человека rhAFP3d с присоединенной к С-концу искусственной последовательностью, включающей 22 тандемно расположенных остатка глутаминовой кислоты и аффинную метку 6His-таг. Получение, свойства и аминокислотная последовательность белка АрЕ1, показанная на Фиг. 2, описаны в работе [Pozdniakova N.V. et al., J. Biomed. Biotechnol, 2012, art. ID 469756, 5 pages doi:10.1155/2012/469756]. По данным авторов, белок ApE1, аналогично рецептор-связывающему домену 3 альфа-фетопротеина человека, эффективно связывается рецепторами АФП опухолевых клеток. Наличие в молекуле белка аффинной метки 6His-таг облегчает его очистку металло-хелатной хроматографией, позволяющей получить белок высокой степени очистки, пригодной для парентерального применения. Последовательность из 22 тандемно расположенных остатков глутаминовой кислоты, сообщающая структуре мощный отрицательный заряд, способствует улучшению выхода ренатурации ApE1 in vitro, препятствуя межмолекулярной агрегации. Последовательность альфа-фетопротеина человека, включающая аминокислотные остатки с 404 по 609 полноразмерного белка, депонирована в базе данных NCBI Gene Bank Protein под названием rhAFP.
Белок получают с помощью процедуры ренатурации in vitro телец включения, образующихся в клетках рекомбинантного штамма Е. coli, получаемого путем введения плазмиды pAFP28D3PolyGlu [Pozdniakova N.V. et al., J. Biomed. Biotechnol, 2012, art. ID 469756, 5 pages doi:10.1155/2012/469756] в коммерчески доступный штамм-хозяин BL21 (DE3).
Сведений об использовании белка ApE1 для получения нековалентных комплексов с фотоактивными соединениями карбоцианиновой группы в уровне техники нами не обнаружено.
Нами показано, что при взаимодействии карбоцианинового красителя 2,6-бис-(3,7-ди-N-метил-бенз[1,2-d:4,3-d']бистиазол-)-[N-метил-3,3'-диметил-индокарбоцианин] перхлората, растворенного в ДМСО, с водным раствором белка ApE1 образуется растворимый в воде комплекс, характеризующийся резким, 100-кратным по сравнению со свободным красителем, повышением квантового выхода флуоресценции и триплетного состояния. Образующийся комплекс имеет нековалентную природу, т.к. формируется за счет нековалентного связывания гидрофобной молекулы красителя в «гидрофобном кармане», который имеется в структуре белка ApE1, подобно области гидрофобного связывания в молекуле АФП. Дополнительным комплексообразующим фактором может являться кулоновское взаимодействие между отрицательно заряженными остатками Glu и положительно заряженными молекулами красителя. Связывание молекулы красителя белком сопровождается разрушением димеров, существующих в водном окружении, и фиксацией полиметиновой цепи. В совокупности, как и в случае попадания в среду органического растворителя, это приводит к эффективному сопряжению хромофорных циклов в молекуле и, как следствие, к резкому возрастанию квантового выхода флуоресценции и повышению выхода триплетного возбужденного состояния.
Перечень графических изображений, иллюстрирующих изобретения, приведен ниже
Фиг. 1. Строение молекулы красителя 2,6-бис-(3,7-ди-N-метил-бенз[1,2-d:4,3-d']бистиазол-)-[N-метил-3,3'-диметил-индокарбоцианин] перхлората (БКЦ) и спектр его поглощения в 96% этаноле (концентрация 12 мкМ).
Фиг. 2. Аминокислотная последовательность белка ApE1 [Pozdniakova N.V. et al., J. Biomed. Biotechnol, 2012, art. ID 469756, 5 pages doi:10.1155/2012/469756].
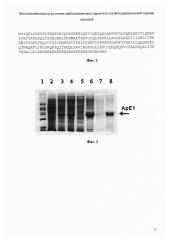
Фиг. 3. Электрофореграммы фракций клеточного лизата штамма Е. coli В121 (DE3), полученные в ходе препаративной очистки белка ApE1 (диск-электрофорез в 12,5% денатурирующем полиакриламидном геле, окрашенном R-250):
1 - стандарты молекулярных масс (14,4-18,4-25,0-35,0-45,0-66,2-116,0 кДа);
2 - биомасса продуцента до индукции;
3 - биомасса продуцента после индукции;
4 - осветленный лизат перед нанесением на ионообменную смолу;
5 - фракция не связавшихся с ионообменной смолой примесей;
6 - элюат после ионообменной хроматографии;
7 - фракция примесей, не связавшихся с Ni-NTA сефарозой;
8 - элюат после металло-хелатной хроматографии.
Дорожки 2 и 3 нормализованы по оптической плотности биомассы при 600 нм, дорожки 4-8 нормализованы по суммарной концентрации белка, определенной модифицированным методом Лоури с бицинхониновой кислотой.
Фиг. 4. Зависимость доли красителя БКЦ, связанного с белком (θ), от концентрации белка в буферном растворе:
Кривая 1 соответствует комплексу БКЦ с ApE1;
Кривая 2 соответствует комплексу БКЦ с ЧСА.
Изобретение осуществляют следующим образом.
Получение белка ApE1
Получение биомассы рекомбинантного штамма Е. coli BL-21 (DE3), содержащего плазмиду pAFP28D3PolyGlu.
Базовым штаммом для получения белка ApE1 является штамм Е. coli BL-21 (DE3) (New England Biolabs, кат. № C2527). Для получения штамма-продуцента перед каждой препаративной процедурой проводят трансформацию, вводя в базовый штамм BL21 (DE3) коллекционную ДНК плазмиды pAFP28D3PolyGlu. Трансформанты отбирают на агаризованной селективной среде с добавлением 50 мкг/мл канамицина. Колонию трансформанта возрастом не более 24 часов с момента засева чашки после трансформации засевают микробиологической петлей в пробирку с 3 мл среды LB с добавлением 50 мкг/мл канамицина и выращивают в течение 12-16 часов при 37°С при интенсивной аэрации. Выросшую культуру немедленно используют в качестве посевного материала, пересевая ее в теплую питательную среду из расчета 5 мл культуры на 1 литр среды.
Биомассу рекомбинантного штамма получают культивированием в течение 24 часов при комнатной температуре на барботажной установке на среде ZYP5052 состава: триптон 10 г/л; дрожжевой экстракт 5 г/л; добавка 5052 (50×) - глицерин 250 г/л, D-глюкоза 25 г/л, лактоза 100 г/л; добавка NPS (20×) - (NH4)2SO4 66 г/л, KH2PO4 136 г/л, Na2HPO4 142 г/л; MgSO4 1 мМ; раствор смеси микроэлементов; тиамин 2 мкг/мл; канамицин 50 мкг/мл. Внесения индуктора экспрессии не требуется, так как активация синтеза целевого белка в данной системе происходит автоматически при переходе на утилизацию лактозы, как основного источника углерода. После наращивания биомассу собирают центрифугированием и хранят при -20°С.
Для детекции целевого белка в биомассе отбирают образцы для электрофореза в полиакриламидном геле через 3 часа после пересева. Результаты показаны на Фиг. 3: дорожка 2 - до индукции, дорожка 3 - после индукции,
Гомогенизация биомассы
Биомассу (10 мл влажного осадка) лизируют в 50 мл буфера, содержащего 20 мМ Трис-HCl (рН 7,4), 2 мМ AEBSF (4-(2-аминоэтил)бензилсульфонилфторида гидрохлорид), 1 мМ ЭДТА, 0,5 мг/мл лизоцима в течение 1,5 часов при комнатной температуре. Разрушение клеток проводят ультразвуком на ледяной бане при мощности воздействия 350 W в режиме 10 с, 14 раз. Далее лизат замораживают и через сутки повторяют процедуру. Полученный лизат осветляют центрифугированием для освобождения от клеточного дебриса и добавляют навеску мочевины до конечной концентрации 8 М и β-меркаптоэтанол до конечной концентрации 50 мМ, после чего инкубируют 30 мин в денатурирующих условиях при комнатной температуре. После окончания инкубации лизат осветляют центрифугированием, отбирают супернатант и используют его для дальнейшей очистки.
Выделение и очистка белка
Очистку проводят методом ионообменной хроматографии (этап 1), а затем методом металло-хелатной хроматографии (этап 2). Ионообменную хроматографию проводят на колонке со смолой DEAE-сефароза CL-6B (35 мл). Колонку уравновешивают буфером, содержащим 20 мМ Трис-HCl (рН 9,0), 8 М мочевину, 50 мМ β-меркаптоэтанол, 0.1 М NaCl. На колонку наносят 75 мл осветленного лизата при комнатной температуре в течение 1 часа. Колонку промывают 250 мл буфера [20 мМ Трис-HCl 9,0, 8 М мочевина, 50 мМ β-меркаптоэтанол, 0,1 М NaCl], после чего элюируют целевой белок буфером [20 мМ Трис-HCl, рН 9,0, 8 М мочевина, 50 мМ β-меркаптоэтанол, 0,5 М NaCl] (60 мл). Металло-хелатную хроматографию проводят с использованием смолы Ni-NTA Sepharose-FF. Колонку уравновешивают буфером, содержащим 20 мМ Трис-HCl (рН 9,0), 8 М мочевину, 50 мМ β-меркаптоэтанол и 10 мМ имидазол. Элюат (60 мл), полученный на этапе 1, наносят на смолу при комнатной температуре в течение 40 минут. Колонку промывают 250 мл буфера (20 мМ Трис-HCl (рН 9,0), 8 М мочевина, 50 мМ β-меркаптоэтанол, 10 мМ имидазол и 0,3 М NaCl). Элюцию проводят 50 мл буфера (20 мМ Трис-HCl (рН 9,0), 8 М мочевина, 50 мМ β-меркаптоэтанол и 0,5 М имидазол), собирают элюат (общий объем 30 мл).
Ренатурация белка
Ренатурацию белка проводят ступенчатым диализом:
1) элюат, полученный на этапе 2 очистки, диализуют против буфера, содержащего 20 мМ Трис-HCl (рН 9,0), 10 мМ β-меркаптоэтанол, в течение 4 часов при комнатной температуре и в течение 12 часов продолжают диализ против того же буфера при +4°С;
2) проводят диализ против буфера состава: (20 мМ Трис-HCl (рН 8,5), 5 мМ β-меркаптоэтанол) в течение 12 часов при +4°С;
3) проводят диализ против фосфатно-солевого буфера (137 мМ NaCl; 2,7 мМ KCl; 4,3 мМ Na2HPO4; 1,47 мМ KH2PO4) рН 8,0 в течение 24 часов при +4°С;
4) проводят диализ против фосфатно-солевого буфера (137 мМ NaCl; 2,7 мМ KCl; 4,3 мМ Na2HPO4; 1,47 мМ KH2PO4) рН 7,4 в течение 24 часов при +4°С.
Полученный раствор белка с соблюдением требований асептики подвергают стерилизующей фильтрации через мембранные фильтры с диаметром пор 0,22 нм, отбирают аликвоту для анализа и хранят в криопробирках до использования в течение 6 месяцев при температуре минус 20°С. Полноту ренатурации оценивают по исчезновению свободных сульфгидрильных групп в растворе белка, исходя из того, что в нативном состоянии ApE1 содержит 6 дисульфидных связей [Ellman G.L., Arch. Biochem. Biophys., 1959, 82(1), 70-77].
На Фиг. 3 показаны электрофореграммы фракций клеточного лизата, полученные в ходе препаративной очистки белка ApE1 (диск-электрофорез в 12,5% денатурирующем полиакриламидном геле, окрашенном R-250). Концентрацию белка в каждой фракции определяют с помощью модифицированного метода Лоури с использованием бицинхониновой кислоты (Sigma-Aldrich, USA) и бычьего сывороточного альбумина в качестве стандарта согласно [Smith Р.K. et al., Anal Biochem. 1985, 150(1), 76-85]. Количество целевого белка ApE1 на разных стадиях очистки определяют методом денситометрии (Gel Analyzer 2010а) после электрофореза в 12,5% денатурирующем полиакриламидном геле, используя для калибровки стандартные растворы бычьего сывороточного альбумина. Выход целевого белка определяют как отношение доли целевого белка к общему белку отдельно в водорастворимой и водонерастворимой фракциях клеточного лизата. Содержание белка ApE1 в исходной культуре в разных экспериментах составляет 55-60 мг/на литр, выход очищенного целевого белка в пересчете на литр исходной культуры в среднем составляет около 35 мг. Таким образом, ренатурация белка с использованием описанной процедуры ступенчатого диализа позволяет получить выход белка, достигающий 65% от его исходного содержания в биомассе, что существенно превышает показатели выхода продукта, описанные в работе [Pozdniakova N.V. et al., J. Biomed. Biotechnol, 2012, art. ID 469756, 5 pages doi:10.1155/2012/469756].
Краситель БКЦ получен, как описано в работе [Киприанов А.И. и Мушкало И.Л. Журн. Орг. Хим., 1965, 1(4), 744-750].
Нековалентный комплекс красителя с белком-носителем получают простым смешением растворов БКЦ в ДМСО и ApE1 в фосфатно-солевом буфере (ФСБ) (0,2 М фосфат натрия, рН 7,4, 0,3 М NaCl) в требуемом соотношении. Подбор концентраций растворов белка и красителя осуществляют, исходя из требования обеспечения максимального выхода триплетного состояния при минимальном содержании свободного красителя в растворе.
Для выяснения оптимального количественного соотношения компонентов проведено исследование зависимости квантового выхода флуоресценции образующегося комплекса от концентрации раствора белка при постоянной концентрации раствора красителя.
Для приготовления базового (стокового) раствора красителя 5 мг сухого БКЦ растворяют в 1 мл тщательно осушенного ДМСО квалификации «для спектроскопии» при комнатной температуре. Истинная концентрация стокового раствора, определенная по спектру поглощения (см. Фиг. 1) с использованием величины коэффициента экстинкции 1,1×105 M-1см-1 при 590 нм [Борисевич Ю.Е. и соавт., Доклады Акад. Наук СССР, 1976, 228(2), 375], равна 10 мМ. Стоковый раствор красителя хранят при -20°С в темноте не более 3 месяцев.
К аликвотам стокового раствора красителя объемом 800 мкл при комнатной температуре прибавляют растворы белка ApE1 в ФСБ с концентрацией от 0,1 до 12,8 мкМ. Объем доводят до 1000 мкл добавлением ФСБ, перемешивают в темноте в течение 20 мин, после чего немедленно используют для измерений. Определение квантового выхода флуоресценции ϕфл. проводят на флуориметре Panorama при длине волны возбуждающего света 514 нм с шагом сканирования 2 нм в диапазоне длин волн от 500 до 750 нм. Содержание ДМСО в образцах около 0,8% не оказывает существенного влияния на фотохимическую активность фотосенсибилизатора.
Было показано, что высокое значение квантового выхода флуоресценции ϕфл, напрямую коррелирующее с выходом триплетного состояния красителя, определяющего его эффективность, как потенциального фотосенсибилизатора, достигается при соотношении компонентов в смеси, близком к эквимолярному. Дальнейшее увеличение содержания белка в смеси сопровождается некоторым, относительно невысоким повышением ϕфл, однако использование высоких концентраций растворов белка экономически нецелесообразно, поскольку приведет к существенному удорожанию препарата при незначительном повышении его эффективности.
Поскольку in vivo молекулы фотосенсибилизатора находятся в окружении молекул сывороточного альбумина, содержание которого в крови составляет не менее 50 мг/мл, важное практическое значение приобретает вопрос об относительной устойчивости заявляемого нековалентного комплекса в присутствии ЧСА, конкурирующего с ApE1 за связывание с красителем. Для ответа на этот вопрос определены константы связывания К молекулы БКЦ с молекулами белков конкурентов по методу [Phillips D., Prog. Reaction Kinetics. 1997, 22 (3/4), 17]. На Фиг. 4 показаны зависимости доли красителя, связанного с белком (θ), от содержания в растворе белка при неизменной концентрации исходного раствора красителя. Кривая 1 соответствует комплексу БКЦ с ApE1, кривая 2 - комплексу БКЦ с ЧСА.
θ=K/(1+K),
где K - константа связывания комплекса. Константу связывания К рассчитывают, исходя из того, что
θ=(I-I0)/(I∞-I0),
где I0, I∞ и I - величины интенсивности флуоресценции при нулевом, полном и промежуточном насыщении красителя белком соответственно, измеренные при возбуждении светом длиной волны 514 нм. [Phillips D., Prog. Reaction Kinetics. 1997, 22 (3/4), 17]. Величину I∞ находят экстраполяцией экспериментальных значений к предельному значению при высоких концентрациях белка. Из полученных данных константы связывания К рассчитывают с помощью программного обеспечения GraphPadPrizm 6.0.
Полученные величины констант связывания комплексов БКЦ с ApE1 и с ЧСА сопоставлены в Табл. 2.
Как видно из таблицы, константа связывания красителя БКЦ с белком ApE1 более чем втрое превышает константу связывания красителя с человеческим сывороточным альбумином, что говорит о значительно более высокой прочности заявляемого комплекса по сравнению с комплексом с ЧСА. В составе заявляемого нековалентного комплекса БКЦ с белком-носителем ApE1 молекула красителя, локализованная в «гидрофобном кармане» белка-носителя, защищена от возможности связывания с сыворточным альбумином. Этот факт имеет важное практическое следствие, которое состоит в том, что при введении заявляемого препарата в кровоток in vivo он будет сохранять стабильность в присутствии большого количества сывороточного альбумина, концентрация которого в плазме крови достигает 50 мг/мл. Благодаря способности молекул ApE1 специфически связываться с клетками опухоли, обеспечивается специфичность и адресность доставки фотосенсибилизатора в опухолевую ткань. В результате препарат способен избирательно поглощаться клетками опухоли, а его проникновение в клетки здоровых тканей, имеющих высокое сродство к альбумину, минимизировано.
Изменение квантового выхода ϕфл красителя при образовании комплекса (см. Табл. 2) оценивают величиной отношения интенсивности флуоресценции БКЦ в смеси с белком-носителем к интенсивности флуоресценции свободного красителя в буфере в отсутствие белка при одинаковой интенсивности возбуждающего излучения. Как видно из таблицы, образование нековалентного комплекса БКЦ с белком-носителем ApE1 сопровождается 100-кратным повышением квантового выхода флуоресценции красителя. Для комплекса БКЦ с сывороточным альбумином эта величина почти на 30% ниже. Высокий квантовый выход активного состояния красителя в составе комплекса позволяет снижать терапевтические дозировки фотосенсибилизатора и, как следствие, уменьшать его неспецифическую фотоиндуцированную активность в отношении нормальных клеток и внеклеточных структур организма.
Кинетику флуоресценции красителя в свободном виде и в составе комплекса с белком исследовали, как описано в работе [Phillips D., Prog. Reaction Kinetics. 1997, 22 (3/4), 17]. Время жизни флуоресценции образцов τ1 и τ2 регистрируют на флуориметре FluoTime 300 (PicoQuantGmbH, Германия) с временным разрешением с функцией счета одиночных фотонов. Флуоресценцию возбуждают импульсным лазерным источником с длиной волны 510 нм и частотой импульсов 20 МГц. Сигнал регистрируют на длине волны 640 нм с разрешением 4 пс и накоплением до 10000 индивидуальных событий. Полученные данные обрабатывают с помощью программного обеспечения FluoFit (PicoQuantGmbH, Германия). Данные по динамике затухания флуоресценции, характеризуемой временами жизни флуоресценции τ1 и τ2 (см. Табл. 2), свидетельствуют о существовании двух альтернативных сайтов связывания красителя в молекуле ApE1. Аналогичный результат показывают и данные по временам жизни комплекса красителя с ЧСА. Однако если сайты связывания с более длительным временем жизни активированного состояния в молекулах обоих белков сходны по фотохимическим свойствам комплекса с красителем, то сайты с более коротким временем жизни существенно различны. Это говорит о том, что более высокая устойчивость заявленного комплекса по сравнению с комплексом красителя с ЧСА, по-видимому, достигается за счет высокоаффинного сайта связывания молекулы красителя с белком, тогда как структура низкоаффинного сайта обоих белков оказывается сходной. Вывод о наличии двух различных центров связывания молекулы красителя с белками подтверждается тем, что нарастание флуоресценции комплексов БКЦ с ApE1 и с ЧСА продолжается с разной скоростью при увеличении количества белка в растворе по отношению к содержанию красителя сверх эквимолярного.
Таким образом, приведенные выше результаты показывают, что заявляемый нековалентный комплекс красителя БКЦ с белком-носителем ApE1 обладает совокупностью свойств, позволяющих рассматривать его в качестве нового перспективного фотосенсибилизатора для фотодинамической терапии опухолей:
1. Хорошая растворимость в воде, приближающаяся к растворимости в водных растворах белка-носителя (около 1 мМ), позволяет использовать его для парентерального введения.
2. Достижение высокого выхода триплетного состояния обеспечивает высокую фотосенсибилизирующую и противоопухолевую активность препарата.
3. Обеспечение целенаправленного транспорта фотосенсибилизатора в опухоль за счет сродства белка-носителя ApE1 к АФП-рецепторам на поверхности опухолевых клеток.
4. Высокая специфичность фотосенсибилизатора к опухолевым клеткам в присутствии ЧСА.
5. Низкая побочная токсичность за счет высокой устойчивости комплекса в присутствии ЧСА. Дополнительным фактором, снижающим токсичность, является то, что комплекс, в отличие от известных ковалентных конъюгатов низкомолекулярных биологически активных соединений с белками, не содержит небиогенных, не свойственных живому организму связей, возникающих при химическо