Способ выявления и оценки уровня патогенности возбудителей оппортунистических инфекций у женщин репродуктивного возраста и новорожденных детей для прогнозирования течения и развития осложнений инфекционных заболеваний
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к акушерству, гинекологии, неонатологии, микробиологии, молекулярной генетике, клинической лабораторной диагностике. Cпособ нацелен на выявление возбудителей оппортунистических инфекций и маркеров их патогенности у женщин репродуктивного возраста и новорожденных детей. Для исследования у женщин используют соскобы эпителиальных клеток из влагалища (заднебоковые своды) и цервикального канала, биоптат эндометрия, метроаспират, содержимое абсцесса, экссудат брюшной полости, кровь, мочу. Для исследования у новорожденного используют соскобы со слизистых оболочек желудочно-кишечного тракта (кал, зев), отделяемое глаз, содержимое везикул, отделяемое пупочной ранки, кровь, мочу, содержимое венозного катетера. Выполняют ПЦР в режиме реального времени. В образцах биоматериала определяют общую бактериальную массу, количество геномов представителей условно-патогенной микрофлоры, относящихся к одиннадцати таксонам: семейство Enterobacteriaceae, роды: Streptococcus, Enterococcus, Staphylococcus, Candida, виды: Streptococcus agalactiae, Enterococcus faecalis, Staphylococcus aureus, Escherichia coli, Gardnerella vaginalis, Candida albicans, и наличие восемнадцати маркерных локусов, ассоциированных с патогенностью основных условно-патогенных микроорганизмов: G. vaginalis sialidase, G. vaginalis lacZ, G. vaginalis fucA, S. agalactiae sialidase, S. agalactiae ST-17, S. agalactiae ST-19/23, S. aureus tsst, S. aureus lukS, S. aureus lukF, S. aureus icaA, S. aureus icaD, E. faecalis cylA, E. faecalis cylB, E. coli cnf1, E. coli vat, E. colipapC, E. coli stx1, E. coli stx2. В зависимости от наличия/отсутствия возбудителя, его количества и маркерных генов патогенности проводят оценку уровня патогенности возбудителей инфекций и дают прогноз течения и развития осложнений заболевания. В соответствии с прогнозом осуществляют тактику ведения пациента. 7 табл., 3 пр.
Реферат
Изобретение относится к области медицины, а именно к акушерству, гинекологии, неонатологии, микробиологии, молекулярной генетике, клинической лабораторной диагностике, и может быть использовано для выявления возбудителей оппортунистических инфекций и оценки уровня их патогенности при прогнозировании течения и развития осложнений инфекционных заболеваний у пациентов медицинских учреждений акушерского, гинекологического и неонатологического профиля. Кроме того, изобретение можно использовать в научно-исследовательской практике.
Инфекции в гинекологии, акушерстве и неонатологии - одна из самых актуальных социальных проблем на протяжении всей истории человечества, поскольку такие инфекции являются одним из важнейших факторов, влияющих на демографическую ситуацию. Прямые осложнения инфекций: проблемы зачатия, потери беременности вследствие невынашивания, материнская и перинатальная смертность, ранняя инвалидизация.
Условно-патогенные микроорганизмы (УПМ) - возбудители оппортунистических инфекций - являются основной причиной инфекционно-воспалительных заболеваний репродуктивной системы и приводят к тяжелым дисфункциям, акушерским инфекциям, послеродовым осложнениям. Нарушения репродуктивного здоровья населения являются одной из наиболее важных причин низкой рождаемости в нашей стране. В настоящее время основными бактериальными возбудителями оппортунистических инфекций влагалища и органов малого таза у женщин являются Streptococcus agalactiae, Escherichia coli, Staphylococcus aureus, Enterococcus faecalis, Gardnerella vaginalis. Эти же возбудители (кроме G. vaginalis) преобладают и в этиологической структуре врожденных инфекций у новорожденных.
В настоящее время не вызывает сомнений тот факт, что мать является первичным источником колонизации, а иногда и инфицирования своего ребенка [1]. Данные микробиологического исследования плацентарной ткани и образцов амниотической жидкости при преждевременных родах показывают, что инфекция может быть причиной преждевременных родов примерно в 25% случаев, что впоследствии и определяет тяжесть состояния новорожденного ребенка, обусловленного недостаточным иммунным ответом и развитием у этого контингента детей инфекционно-воспалительных заболеваний.
Микробиота влагалища женщины является подвижной экосистемой, оказывающей влияние на состояние здоровья женщины. Во влагалище здоровой женщины при культуральном исследовании одновременно может быть обнаружено до 20 различных видов бактерий. В отдельных локусах полового тракта в норме могут присутствовать различные микроорганизмы, которые при определенных условиях становятся вирулентными и участвуют в развитии воспалительных заболеваний. Ярким примером служит золотистый стафилококк (S. aureus), который нередко выделяется из влагалища здоровых женщин (вариант бессимптомного носительства), и сам факт его наличия не свидетельствует о патологии. Однако в определенных условиях он может стать основной причиной инфекционного заболевания. Штаммы золотистого стафилококка, продуцирующие экзотоксин, могут вызывать синдром токсического шока, который у женщин репродуктивного возраста может быть обусловлен накоплением возбудителя на тампонах во влагалище во время менструации.
На настоящее время эффективная диагностика инфекций, вызванных оппортунистическими патогенами, в акушерстве, гинекологии и перинатологии остается нерешенной задачей и требует комплексного подхода. Современное решение проблемы диагностики оппортунистических инфекций возможно только при интегральной оценке видовой принадлежности возбудителя и его биологических свойств. Развитие заболевания, вызванного оппортунистическими патогенами, - сложный и многофакторный процесс взаимоотношений УПМ, обладающих определенным набором молекулярно-генетических параметров, индивидуальных для различных штаммов, с макроорганизмом хозяина, в частности с состоянием его иммунной системы.
Представление о совокупности биологических свойств микроорганизма способствует более глубокому пониманию патогенеза инфекционно-воспалительных заболеваний, вызванных УПМ, и раскрывает перспективы новых подходов в диагностике и терапии. Многофакторность взаимодействия микроорганизмов с организмом человека и интенсивное развитие новых методических возможностей для микробиологических исследований диктует необходимость разработки инновационных комплексных диагностических инструментов, позволяющих оценить генетические свойства, в частности выявить факторы, ассоциированные с повышенным уровнем патогенности у отдельно взятых клинически значимых штаммов УПМ. Поэтому представляется целесообразным и практически актуальным для использования в клинической практике создание молекулярно-генетического способа выявления основных возбудителей оппортунистических инфекций у женщин репродуктивного возраста и новорожденных детей и оценки уровня их патогенности для прогнозирования развития инфекционных заболеваний, их течения и развития возможных осложнений.
Помимо бактериальных инфекционных заболеваний существуют и грибковые инфекционные заболевания. Дрожжевые грибы рода Candida также относятся к группе УПМ и входят в состав нормальной микрофлоры слизистых оболочек ротовой полости, влагалища и толстой кишки большинства здоровых людей. В то же время, они могут вызывать кандида-инфекции у женщин и новорожденных детей.
Классическим методом («золотым стандартом») этиологической лабораторной диагностики инфекционного процесса, в том числе вызванного УПМ, является культуральное исследование. С помощью культурального исследования можно выявить видовую принадлежность штаммов УПМ, но сложно оценить уровень патогенности штаммов. Существенным недостатком культурального метода является длительность исследования (в среднем 7 дней) и необходимость поддержания жизнеспособности микроорганизмов до момента поступления биоматериала в лабораторию.
В настоящее время широко распространены способы молекулярной диагностики, основанные на методе полимеразной цепной реакции (ПЦР) [2]. Суть метода ПЦР состоит в том, что в исследуемый образец, предположительно содержащий тот или иной микроорганизм, вносятся искусственно синтезированные нуклеотидные последовательности (праймеры), специфически комплементарные генетическому материалу искомого микроорганизма. В процессе ПЦР при наличии искомого микроорганизма нарастание концентрации специфических молекул ДНК происходит в геометрической прогрессии, и после 30-40 циклов она достигает значений, при которых становится возможной визуальная регистрация результатов реакции.
Способ позволяет в течение короткого времени (в течение несколько часов) идентифицировать различные микроорганизмы: аэробные, факультативно- и облигатно-анаэробные; условно-патогенные и абсолютные патогены. Так, например, в соответствии с данными Европейских стандартов диагностики и лечения заболеваний, передаваемых половым путем (2004), чувствительность ПЦР в диагностике хламидийной инфекции составляет 70-95%, специфичность 97-99%. Диагностическая ценность признана во всем мире и метод широко используется в лабораторной практике.
Существуют способы молекулярной диагностики, позволяющие идентифицировать основных возбудителей оппортунистических заболеваний. В последние годы появился новый подход к исследованию УПМ - метод ПЦР в режиме реального времени - «Фемофлор 16», который дает возможность исследовать микрофлору и оценить степень и характер дисбаланса микробиоты влагалища у женщин. Существует также метод диагностики дисбаланса микробиоты различных биотопов человека и степени его выраженности (RU 2362808). Суть метода заключается в том, что с помощью метода ПЦР в режиме реального времени в исследуемой биопробе определяют общее число геномов микроорганизмов, характерных для конкретного биотопа, число геномов нормобиоты и условно-патогенной биоты. Полученные величины сравнивают между собой, определяют соотношение между числом геномов нормобиоты и условно-патогенной биоты и при превышении числа геномов нормобиоты относительно числа геномов условно-патогенной биоты в 1000 раз констатируют отсутствие дисбаланса, оценивая данный показатель как вариант нормы. При значении данного показателя менее чем 1000 раз диагностируют дисбаланс и устанавливают степень его выраженности путем определения соотношения между числом геномов нормобиоты и общим числом геномов микроорганизмов, присутствующих в исследуемой пробе, а также между числом геномов условно-патогенной биоты и нормобиоты и при снижении числа геномов нормобиоты относительно общего числа геномов микроорганизмов в 10-100 раз и снижении числа геномов условно-патогенной биоты относительно числа геномов нормобиоты в 100-1000 раз устанавливают легкую степень дисбаланса. При превышении числа геномов нормобиоты относительно общего числа геномов микроорганизмов более чем в 100 раз и превышении числа геномов условно-патогенной биоты относительно числа геномов нормобиоты в 10 раз и более устанавливают выраженную степень дисбаланса. В основу способа положена впервые предлагаемая авторами комплексная оценка микробиоты человека методом ПЦР в режиме реального времени с проведением сравнительного анализа конкретных представителей нормо- и условно-патогенной биоты с общим количеством микроорганизмов с целью определения дисбаланса биоты, степени его выраженности при условии контроля качества получения исследуемой биопробы.
Другой способ диагностики инфекционно-воспалительных урогенитальных заболеваний у женщин предложен М.Н. Болдыревой и соавторами [3]. Авторы с помощью ПЦР в режиме «реального времени определяют общую бактериальную массу, а также присутствие в биоматериале следующих микроорганизмов: Lactobacillus spp, Enterobacteriaceae spp, Streptococcus spp, Mobiluncus spp/Corynebacterium spp, Lachnobacterium spp/Clostridium spp, Peptostococcus spp, Eubacterium spp, Prevotella bivia/Porphyromonas spp, Megasphera spp/Veilonella spp/Dialister spp, Sneathia spp/Leptotrihia spp/Fusobacterium spp, Atopobium vaginae, Gardnerella vaginalis, Candida albicans. В зависимости от качественного и количественного состава микрофлоры авторы проводят микробиологическую диагностику (анаэробный вагиноз, аэробный вагинит, смешанный аэробно-анаэробный вагинит), а также оценивают степень выраженности нарушений: 1 степень (слабовыраженный) или 2 степень (выраженный).
Описанные выше способы позволяют проводить видовую идентификацию представителей УПМ, но не позволяют оценить уровень патогенности штаммов. На настоящее время не существует комплексных решений, которые позволяют определять те или иные наборы факторов, ассоциированных с патогенностью различных видов УПМ. Имеются отдельные наборы праймеров, позволяющие с помощью методов на основе ПЦР определять те или иные факторы патогенности. Чаще всего, такие наборы используются в научно-исследовательских целях.
Задачей изобретения является создание способа, предназначенного для выявления и оценки уровня патогенности возбудителей оппортунистических инфекций у женщин репродуктивного возраста и новорожденных детей для прогнозирования течения и развития осложнений инфекционных заболеваний. В качестве технологической основы для разработки тест-системы выбрана технология ПЦР с детекцией результатов в режиме реального времени, обладающая высокой специфичностью и чувствительностью. Кроме того, методы, основанные на ПЦР, позволяют получить результаты очень быстро, как правило, в течение нескольких часов. Представленный способ будет востребован сетью акушерских и гинекологических стационаров, перинатальными центрами, женскими консультациями, а также коммерческими медицинскими центрами и лабораториями. Кроме того, изобретение можно использовать в научно-исследовательской практике.
Использование изобретения позволяет получить следующий технический результат. Способ позволяет в короткие сроки (в течение нескольких часов) выполнить видовую идентификацию основных возбудителей оппортунистических инфекций с их количественной характеристикой и выявить маркеры их патогенности у женщин репродуктивного возраста и новорожденных детей. На основе полученных данных проводится оценка уровня патогенности основных возбудителей инфекций и дается прогноз течения и возможности развития осложнений заболевания. В результате производится оптимизация антибактериальной терапии.
Способ предназначен для количественного выявления ДНК возбудителей оппортунистических инфекций и оценки уровня их патогенности путем анализа ДНК микроорганизмов методом ПЦР в режиме реального времени у женщин репродуктивного возраста и новорожденных детей.
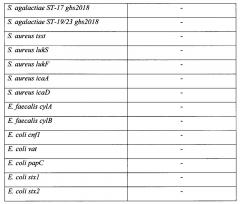
Предлагается осуществлять идентификацию следующих показателей (табл.1) в биоматериале: общая бактериальная масса (ОБМ), количество геномов представителей условно-патогенной микрофлоры, относящихся к одиннадцати таксонам: семейство Enterobacteriaceae, роды: Streptococcus, Enterococcus, Staphylococcus, Candida, виды: Streptococcus agalactiae (S. agalactiae), Enterococcus faecalis (E. faecalis), Staphylococcus aureus (S. aureus), Escherichia coli (E. coli), Gardnerella vaginalis (G. vaginalis), Candida albicans (C. albicans), а также наличие восемнадцати маркерных локусов, ассоциированных с патогенностью основных условно-патогенных микроорганизмов.
Предлагаемый к патентованию способ отличается от других способов тем, что предусматривает комплексное решение, учитывающее специфику выявления инфекционных заболеваний, вызванных УПМ у женщин репродуктивного возраста и новорожденных детей. Способ предусматривает идентификацию основных УПМ - возбудителей оппортунистических инфекций, а также детектирование наиболее распространенных генов, ассоциированных с их патогенностью. Кроме того, изобретение отличается уникальным набором предоставляемых показателей.
Способ предусматривает количественное определение следующих таксонов микроорганизмов:
1. Определение принадлежности бактерий к роду Streptococcus.
2. Определение принадлежности бактерий к виду Streptococcus agalactiae.
3. Определение принадлежности бактерий к роду Enterococcus.
4. Определение принадлежности бактерий к виду Enterococcus faecalis.
5. Определение принадлежности бактерий к роду Staphylococcus.
6. Определение принадлежности бактерий к виду Staphylococcus aureus.
7. Определение принадлежности бактерий к семейству Enterobacteriaceae.
8. Определение принадлежности бактерий к виду Escherichia coli.
9. Определение принадлежности бактерий к роду Gardnerella vaginalis.
10. Определение принадлежности грибов к роду Candida.
11. Определение принадлежности грибов к виду Candida albicans.
В тест-системе используется идентификация следующих генов, ассоциированных с патогенностью основных УПМ:
1. Gardnerella vaginalis
1.1. Ген, кодирующий сиалидазу. Сиалидаза - многофункциональный фермент, принимающий участие в адгезии, межклеточной коммуникации (в том числе и в формировании биопленки) и снижающий защитные возможности слизистой влагалища и цервикального канала. Некоторыми авторами сиалидаза рассматривается как инструмент инвазии [4]. Однако ген, кодирующий сиалидазу (sld), содержат не все штаммы. Последовательности генов сиалидазы вариабельны и могут быть классифицированы на 4-6 подтипов. Имеются данные, полученные из литературных источников, а также и собственные данные, свидетельствующие о том, что наличие гена, кодирующего сиалидазу, коррелирует с патогенностью штамма Gardnerella vaginalis. Поэтому представляется целесообразным включить ген, кодирующий сиалидазу, в перечень наиболее информативных маркеров патогенности Gardnerella vaginalis.
1.2. Ген lacZ, кодирующий β-галактазидазу - фермент, который относится к группе гликозилгидролаз, разрушает гликозидную связь и осуществляет гидролиз β-галактозидов до моносахаридов. Данный ген входит в группу генов, которые встречаются у патогенных штаммов, и является маркером патогенности Gardnerella vaginalis.
1.3. Ген fucA, кодирующий α-L-фукозидазу - фермент, который относится к группе гликозилгидролаз и расщепляет фукозу (6-дезоксигалактозу). Данный ген входит в группу генов, которые встречаются у патогенных штаммов, и является маркером патогенности гарднерелл.
2. Streptococcus spp. / Streptococcus agalactiae
2.1. Аллель гена gbs2018, специфичный для клонального комплекса сиквенс-типа ST-17. По данным, опубликованным в литературе [5], ген gbs2018 полиморфен, и одна из его аллельных форм высокоспецифична для штаммов Streptococcus agalactiae, относящихся к клональному комплексу сиквенс-типа ST-17. Считается, что существенная часть инвазивных штаммов S. agalactiae относится к серотипу III [5]. Штаммы серотипа III по результатам мультилокусного типирования (MLST) достаточно разнообразны, однако большая часть штаммов с этим серотипом относится к ряду филогенетически близких сиквенс-типов, входящих в состав клонального комплекса ST-17. Возможность определения принадлежности штамма к данному клональному комплексу по специфичной для него аллельной форме гена gbs2018 входит в число показателей, выявляемых предлагаемым способом.
2.2. Аллель гена gbs2018, специфичный для инвазивных сиквенс-типов ST-19 и ST-23. По данным, опубликованным в литературе [6], ген gbs2018 полиморфен, и одна из его аллельных форм высокоспецифична для штаммов S. agalactiae, относящихся к сиквенс-типам ST-19 и ST-23. К данным сиквенс-типам относится существенная часть инвазивных штаммов [6]. Возможность определения принадлежности штамма к данным сиквенс-типам по специфичной для него аллельной форме гена gbs2018 входит в число показателей, выявляемых предлагаемым способом.
2.3. Ген, кодирующий сиалидазу. Сиалидаза встречается у ряда групп УПМ и является многофункциональным ферментом, принимающим участие в адгезии и межклеточной коммуникации (в том числе, и в формировании биопленки). Сиалидаза у S. agalactiae выполняет функции, аналогичные функциям сиалидазы у G. vaginalis, и обнаруживается не у всех штаммов. Базируясь на собственных данных, есть основания полагать, что присутствие сиалидазы у S. agalactiae коррелирует с патогенностью штаммов.
3. Enterococcus spp. / Enterococcus faecalis
3.1. Гены cylA и cylB, принимающие участие в синтезе цитолизина. По данным, опубликованным в литературе [7], продукция цитолизина Enterococcus faecalis приводит к эндокардитам и эндофтальмитам у модельных животных, а у человека такие штаммы энтерококков часто приводят к развитию заболеваний. В ходе собственных исследований выявлено, что гены цитолизина cylA и cylB были присущи только штаммам, вызывавшим инфекционные заболевания у новорожденных и женщин. Поэтому представляется целесообразным возможность идентификации данных генов как перспективных биомаркеров патогенности энтерококков.
4. Staphylococcus spp. / Staphylococcus aureus
4.1. Ген tsst. Известно, что патогенность штаммов стафилококков во многом обусловлена наличием широкого спектра различных факторов вирулентности, в том числе и продукцией различных токсинов [8]. Наиболее значимым в акушерстве и гинекологии является экзотоксин, вызывающий синдром токсического шока. Токсин кодируется геном tsst, характерен для S. aureus и обладает свойствами суперантигена. Синдром токсического шока часто связан с применением вагинальных тампонов у женщин.
4.2. Группа генов lukPV. Гены кодируют еще один стафилококковый токсин - лейкоцидин Пантон-Валентайна, обладающий цитотоксическим эффектом и связанный с дермато-некротическими поражениями внебольничной природы, а также ассоциированный с метициллин-резистентностью. Данный фактор патогенности несут в себе порядка 5% штаммов S. aureus. Наличие данной группы генов является абсолютным маркером патогенности, и возможность ее идентификации входит в состав предлагаемого к патентованию способа. Оперон lukPV, содержащий гены, кодирующие лейкоцидин Пантона-Валентайна, включает в себя два структурных гена, кодирующих токсин: lukS и lukF. Продукт первого структурного гена - LukS (или LukS-PV) - белок с молекулярной массой 33 кДа, продукт второго гена - LukF (или LukF-PV) - белок с молекулярной массой 34 кДа. Лейкоцидин работает в форме гетеродимера, собираясь из мономеров LukS и LukF. В состав предлагаемого способа включена возможность идентификации обоих структурных генов: lukS и lukF.
4.3. Гены ica-оперона: icaA-D. Формирование биопленок у стафилококков связано с несколькими факторами, такими как поверхностные белки и межклеточные полисахаридные адгезины. Секреция межклеточных полисахаридных адгезинов регулируется генами ica-оперона. В состав ica-оперона входят следующие гены: icaA, icaB, icaC, icaD. Функция белка, кодируемого геном icaB, заключается в деацетилировании поли-N-ацетилглюкозамина. Деацетилирование полисахаридных адгезинов необходимо для их прикрепления к поверхности клетки, а также для формирования биопленок. Присутствие этих генов является прогностическим признаком образования биопленки у стафилококков. Для корректной идентификации ica-оперона необходимо и достаточно включить в панель два маркерных гена: icaA и icaD.
5. Enterobacteriaceae / Escherichia coli
5.1. Ген цитонекротического фактора cnf1. Этот фактор обнаруживается у ряда патогенных штаммов Е. coli [9]. Ген имеет хромосомную локализацию. Штаммы, содержащие ген цитонекротического фактора, способны вызывать неонатальные энтериты.
5.2. Ген токсина вакуолярного транспортера vat. Этот фактор обнаруживается у ряда патогенных штаммов Е. coli, которые способны вызывать респираторные заболевания и сепсисы.
5.3. Ген papC, обуславливающий образование P-пилей. Показана роль пилей P-типа в адгезии энтеробактерий к клеткам макроорганизма. Синтез белков, формирующих P-пили, кодируется геном papC, частота встречаемости которого среди клинических изолятов энтеробактерий по данным отечественных авторов составляет 3-26%. Поэтому возможность идентификации гена P-пилей papC входит в состав тест-системы.
5.4. Гены stx1 и stx2, кодирующие шигаподобные токсины. У некоторых патогенных штаммов Е. coli встречаются шигаподобные токсины [10]. Их два: Stx1 и Stx2. Каждый токсин кодируется двумя генами: stx1a, stx1b и stx2a, stx2b, соответственно. Токсины являются гомологичными белками с уровнем гомологии аминокислотной последовательности примерно 55%. По данным литературы, бактерии, способные секретировать шигаподобные токсины, могут приводить к тяжелым осложнениям, в том числе, они способны вызвать гемолитико-уремический синдром. Поэтому возможность идентификации генов, кодирующих шигаподобные токсины, входит в состав тест-системы.
Идентификация специфических участков ДНК происходит с использованием метода ПЦР с детекцией результатов в режиме реального времени. Принцип метода ПЦР основан на использовании процесса амплификации ДНК, заключающегося в повторяющихся циклах температурной денатурации ДНК, отжига праймеров с комплементарными последовательностями и последующей достройке полинуклеотидных цепей с этих праймеров Taq-полимеразой.
Для повышения чувствительности и специфичности реакции предусмотрено применение «горячего» старта, который обеспечивается путем приготовления реакционной смеси, состоящей из двух слоев, разделенных прослойкой из парафина, что исключает неспецифический отжиг праймеров на ДНК-мишени при начальном прогреве пробирки.
В реакционную смесь для проведения ПЦР введены ДНК-зонды, каждый из которых несет флуоресцентную метку и гаситель флуоресценции. При образовании специфичного продукта ДНК-зонд разрушается, действие гасителя на флуоресцентную метку прекращается, что ведет к возрастанию уровня флуоресценции. Количество разрушенных зондов (а, следовательно, и уровень флуоресценции) возрастает пропорционально количеству образовавшихся специфических ампликонов и измеряется на каждом цикле амплификации.
Для проведения ПЦР используются детектирующие амплификаторы. После прохождения амплификации по показателю индикаторного цикла программное обеспечение прибора отмечает наличие общей бактериальной массы и присутствие в анализируемом образце ДНК избранных ДНК-локусов, ассоциированных с патогенностью.
Способ лабораторной диагностики осуществляется следующим образом.
Для обследования женщин используют биологический материал с высокой степенью бактериальной обсемененности в норме (I группа), а также биоматериал, стерильный в норме, но имеющий высокую обсемененность при патологическом (инфекционном) процессе (II группа). К I группе образцов относятся соскобы эпителиальных клеток из влагалища (заднебоковые своды) и цервикального канала у женщин, соскобы со слизистых оболочек ЖКТ (кал, зев) у новорожденных. Ко II группе биоматериалов относятся: биоптат эндометрия, метроаспират, содержимое абсцесса, экссудат брюшной полости, кровь, моча - у женщин; у новорожденного - отделяемое глаз, содержимое везикул, отделяемое пупочной ранки, кровь, моча, содержимое венозного катетера. Биоматериал, взятый одноразовым стерильным зондом, помещают в одноразовую пластиковую пробирку с транспортной средой для реакции ПЦР. Из взятого биоматериала стандартными процедурами выделяют суммарные нуклеиновые кислоты.
В пробирки, каждая из которых содержит буфер для ПЦР, термостабильную ДНК-полимеразу, дезоксинуклеотидтрифосфаты, а также специфичные для каждого определяемого микроорганизма праймеры и флуоресцентные зонды, добавляют образец выделенных суммарных нуклеиновых кислот (ДНК). ПЦР выполняется на приборах, обеспечивающих техническую возможность постановки реакции ПЦР в режиме реального времени. Реакция выполняется с наборами реагентов, обеспечивающими возможность исследования конкретных микроорганизмов: 1) реагенты для определения общего количества микроорганизмов; 2) реагенты для определения бактерий, относящихся к одиннадцати таксонам (семейство: Enterobacteriaceae, роды: Streptococcus, Enterococcus, Staphylococcus, Candida, виды: Streptococcus agalactiae, Enterococcus faecalis, Staphylococcus aureus, Escherichia coli, Gardnerella vaginalis, Candida albicans); 3) реагенты для определения восемнадцати маркерных локусов, ассоциированных с патогенностью основных УПМ; 4) реагенты для определения геномной ДНК человека (ген рецептора гормона роста).
По номеру цикла ПЦР в режиме «реального времени», на котором прибор начинает регистрировать флуоресценцию (чем больше искомой ДНК микроорганизма в образце, тем раньше прибор для проведения ПЦР в режиме «реального времени» начинает регистрировать флуоресцентный сигнал), определяют количество геномов того или иного микроорганизма и генома человека в исследуемом образце.
Для удобства представления результатов математическим путем значения номера цикла переводят в значения Log10 геномов по формуле 50-Ct/3,4. В результате этой операции количество геномов микроорганизмов будет выражено в привычной для врача форме 10n. Например: общее количество бактерий - 108, Gardnerella vaginalis - 107 и т.д.
В результате исследования выдается отчет, в котором отражены результаты определения каждого из показателей (табл.1): результаты определения количества геномов того или иного микроорганизма приводятся в форме 10n, а наличие или отсутствие соответствующих маркерных локусов ДНК говорит о наличии/отсутствии соответствующих участков ДНК, ассоциированных с патогенностью микроорганизмов.
Условием проведения анализа является определение геномной ДНК человека в количестве не менее чем 104 геномов. Если взятого материала недостаточно или он взят неправильно, результат ПЦР-исследования считается недостоверным.
При интерпретации полученных результатов врач должен обращать внимание на общую бактериальную массу образца (ОБМ), исходя из которой далее будет проводиться оценка результатов исследования. В таблице результатов представлена возможность идентификации пяти групп (семейство, род) УПМ (Enterobacteriaceae spp., Streptococcus spp., Enterococcus spp., Staphylococcus spp., Candida spp.), каждая из которых включает по одному виду основных возбудителей оппортунистических инфекций (Escherichia coli, Streptococcus agalactiae, Enterococcus faecalis, Staphylococcus aureus, Candida albicans), дополнительно в панель включен вид Gardnerella vaginalis. Для каждой из групп определяют количество геномов/образец в исследуемом биоматериале, выявляют группу (группы) с диагностически значимым количеством геномов/образец, далее обращают внимание на соотношение количества вида микроорганизма, относящегося к данной группе (Enterobacteriaceae spp. - Escherichia coli, Streptococcus spp. - Streptococcus agalactiae, Enterococcus spp. - Enterococcus faecalis, Staphylococcus spp. - Staphylococcus aureus, Candida spp. - Candida albicans), и количество геномов/образец более крупной таксономической единицы. Если количество геномов/образец крупной таксономической единицы совпадает с количеством соответствующего группе вида, то эта группа представлена только этим видом и этот вид является возбудителем. В случае если количество геномов/образец более крупного таксона значительно (в 2 раза и более) превышает количество геномов/образец относящегося к нему вида, то в образце помимо этого вида присутствуют еще и другие представители данной группы. Значит, имеет место микробная ассоциация с другим видом, и количественная оценка должна проводиться по более крупной группе. Таким способом определяется этиология инфекции. После того как возбудитель определен, необходимо перейти к оценке его патогенных свойств. Для каждого вида микроорганизмов в предлагаемом способе диагностики определены наиболее значимые маркеры патогенности, обуславливающие манифестацию заболевания, тяжесть его течения и способность к рецидивированию. Эти маркеры количественно не определяются, поскольку важен сам факт их выявления. Так, для G. vaginalis наличие генов: sld, кодирующего сиалидазу, lacZ, кодирующего β-галактозидазу, fucA, кодирующего α-L-фукозидазу, расщепляющего фукозу, определяет высокую вероятность к рецидиву бактериального вагиноза. Для S. aureus наличие гена tsst определяет риск развития синдрома токсического шока, генов lukPV - высокий риск гнойно-септических осложненний, наличие генов icaAD - высокий риск формирования биопленок на поверхности полимерных имплантов. Для E. coli наличие генов stx1 и stx2 определяет высокий риск развития колитов и других тяжелых осложнений у новорожденных, гена vat - увеличение риска развития сепсиса и пневмонии у новорожденных, cnf - способность вызывать неонатальные энтериты, наличие гена papC определяет повышенную адгезию к клеткам тела человека, что является дополнительным к вышеперечисленным факторам маркером патогенности - его наличие в сочетании с другими факторами говорит об увеличении вероятности возникновения инфекции. Для Е. faecalis - наличие генов cylA и cylB определяет синтез цитолизина, ассоциированного с запуском каскада воспалительных реакций в тканях сердца, глаза, кишечника и т.д. Для S. agalactiae принадлежность к сиквенс-типам ST-17, ST-19/23 определяет высокий патогенный потенциал и увеличивает риск развития послеродовых гнойно-септических осложнений и раннего неонатального сепсиса у новорожденных.
Клинические примеры
Пример 1. Пациентка Р. 32 лет, обратилась в научно-консультативное отделение ФГБУ «НЦАГиП им. В.И. Кулакова» Минздрава России с жалобами на жидкие пенистые выделения из половых путей с неприятным запахом, которые периодически повторяются. По данным клинического осмотра в соответствии с критериями Amsel R. верифицирован диагноз - бактериальный вагиноз. Биологический материал (вагинальное отделяемое) направлен на микробиологическое исследование. Пациентке выполнено культуральное исследование в аэробных и анаэробных условиях и проведена микроскопия вагинальных мазков, окрашенных по Граму. На основании комплексной микробиологической диагностики подтвержден диагноз «бактериальный вагиноз». Из этиологически значимых микроорганизмов выделена G. vaginalis (107 КОЕ/мл) и Candida albicans (104 КОЕ/мл). Параллельно образец вагинального отделяемого исследован предлагаемым к патентованию способом. Установлено присутствие в исследуемом образце G. vaginalis в количестве 107 геномов/образец, обнаружен полный набор генов, ассоциированных с патогенностью G. vaginalis (гены sld, lacZ, fucA), и присутствие Candida albicans (104 геномов/образец) (таблица 2).
Пациентке Р. с учетом выявленного микробного спектра и наличием выраженного патогенного потенциала G. vaginalis назначена этиотропная терапия (антианаэробный препарат клиндамицин, вагинорм C, флуконазол). Учитывая высокий риск рецидивирования бактериального вагинита, пациентке рекомендовано: противорецидивная терапия и динамическое наблюдение в течение 6 месяцев.
Пример 2. Пациентка В. 25 лет, обратилась в научно-консультативное отделение ФГБУ «НЦАГиП им. В.И. Кулакова» Минздрава России по поводу предгравидарной подготовки, жалоб не предъявляла. По данным клинического осмотра: выделения в умеренном количестве белого цвета, нормальной консистенции; pH 5,0; аминотест положительный; «ключевые» клетки во влажном неокрашенном препарате не исследовали. В соответствии с критериями Amsel R., диагноз «бактериальный вагиноз» верифицирован не был, но наличие двух признаков, характерных для бактериального вагиноза, послужило поводом для лабораторного исследования. Биологический материал (вагинальное отделяемое) направлен на микробиологическое исследование. Пациентке выполнено культуральное исследование в аэробных и анаэробных условиях и микроскопия вагинальных мазков, окрашенных по Граму. Из этиологически значимых микроорганизмов выделена G. vaginalis (106 КОЕ/мл). Кроме того, выделены Lactobacillus crispatus (106 КОЕ/мл) и Staphylococcus epidermidis (104 КОЕ/мл). Параллельно образец вагинального отделяемого исследован предлагаемым к патентованию способом. Установлено присутствие в исследуемом образце G. vaginalis в количестве 106 геномов/образец, гены sld, lacZ, fucA не выявлены. Также установлено присутствие в биоматериале Staphylococcus spp. (104 геномов/образец), относящегося к группе коагулазоотрицательных стафилококков, не имеющих включенных в панель факторов патогенности (таблица 3).
Пациентке В. с учетом отсутствия клинических симптомов бактериального вагиноза и выявления штамма G. vaginalis с низким патогенным потенциалом предложено динамическое наблюдение с последующим визитом через две недели. При плановом клинико-лабораторном исследовании через две недели состояние микробиоценоза соответствовало критериям нормы.
Пример 3. Пациентка К. 24 лет, поступила в родильное отделение ФГБУ «НЦАГиП им. В.И. Кулакова» Минздрава России для родоразрешения в сроке гестации - 39 недель по каналу скорой медицинской помощи. Самопроизвольные роды протекали без особенностей. Однако на вторые сутки жизни состояние ребенка ухудшилось за счет нарастания вялости, появления и нарастания одышки с участием вспомогательной мускулатуры и повторными апноэ. Лабораторно: OAK Hb - 96 г/л, Ht 0,3, L - 2,3⋅109 г/л, Tp. - 56⋅109/л. Посев крови - положительная гемокультура через 5 часов культивирования (обильный рост стрептококка группы В), слизистые оболочки ЖКТ также колонизированы S. agalactiae в титре 104 КОЕ/мл. Параллельно образцы биоматериала (кал и зев) исследованы предлагаемым к патентованию способом. Установлено присутствие в исследуемых образцах S. agalactiae в количестве 104 геномов/образец, кроме того, выявлены гены, ассоциированные с патогенностью S. agalactiae: ген sld, кодирующий сиалидазу, и аллель гена gbs2018, специфичный для инвазивного сиквенс-типа ST-17. Результат исследования одного из образцов биоматериала (кал) предлагаемым способом приведен в таблице (таблица 4).
Ребенку поставлен диагноз: сепсис (внутриутробная инфекция). С учетом выявленного возбудителя (S. agalactiae) назначена этиотропная терапия: ампициллин в суточной дозе 100 мг/кг в/в. Для подтверждения врожденной инфекции у ребенка и для решения вопроса о тактике ведения женщины с учетом риска развития послеродового эндометрита исследовано отделяемое цервикального канала на наличие S. agalactiae и степень его патогенности. Микробиологическое исследование подтвердило колонизацию цервикального канала женщины S. agalactiae в высоком титре (106 КОЕ/мл). Параллельно образец отделяемого цервикального канала проанализирован предлагаемым способом. Получены идентичные результаты: установлено присутствие в исследуемом образце Streptococcus agalactiae в количестве 106 геномов/образец, кроме того, выявлены гены, ассоци