Способ определения маркеров раннего и позднего ремоделирования супраренального и инфраренального отделов аорты у пациентов с разной степенью артериальной гипертензии ультразвуковыми методами
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к ультразвуковой диагностике. Используют два метода одновременно: дуплексное ангиосканирование и импульсно-волновую тканевую допплерографию. Посредством дуплексного ангиосканирования выявляют изменения структурно-функциональных свойств брюшной аорты: снижение систоло-диастолического прироста диаметра аорты ΔД, снижение коэффициента податливости СС и коэффициента растяжимости CD и повышение показателей жесткости SI, модуля эластичности Петерсона Ер и модуля упругости Юнга Einc аорты, увеличение циркумферентного напряжения CWS на стенки аорты. С помощью метода импульсно-волновой тканевой допплерографии определяют маркеры раннего ремоделирования аорты, характеризующие изменения фазовой структуры спектра движения передней и задней стенок супраренального и инфраренального отделов аорты: появление двухфазной кривой движения стенок аорты в результате отсутствия пиков Е и S2, снижение пиковых скоростей VS1max, VDmax и увеличение длительности движения стенок аорты в диастолу TVDmax. Определяют маркеры позднего ремоделирования супраренального и инфраренального отделов аорты: увеличение диастолического диаметра Дд супраренального отдела аорты и толщины комплекса «интима-медиа» ТКИМ стенок супраренального и инфраренального отделов аорты, увеличение длительности движения стенок аорты в систолу TVS1max. Способ позволяет провести комплексную ультразвуковую оценку структурно-функционального состояния супраренального и инфраренального отделов аорты у пациентов с разной степенью артериальной гипертензии неинвазивным способом, что обеспечивает возможность для коррекции лечения и проведения первичной профилактики сосудистых осложнений у пациентов с артериальной гипертензией. 3 ил., 2 табл.
Реферат
Изобретение относится к области медицины, а именно к ультразвуковой диагностике. Может применяться для оценки ремоделирования супраренального и инфраренального отделов аорты ультразвуковыми методами у пациентов с артериальной гипертензией.
На протяжении последних десятилетий артериальная гипертензия остается главной причиной инвалидизации и смертности российского населения, зачастую трудоспособного возраста. Одним из органов-мишеней артериальной гипертензии являются сосуды. Патологический процесс охватывает всю сеть периферических, церебральных, коронарных, висцеральных сосудов, которые подвержены характерным структурным изменениям. Гемодинамические нарушения, возникающие при этом, играют существенную роль в патогенезе различных заболеваний, в том числе заболеваний органов брюшной полости: желудка, поджелудочной железы, печени, кишечника. В работах Звенигородской Л.А. 2008 г., Самсоновой Н.Г. 2010 г., Лазебника Л.Б. 2013 г. отражено негативное влияние высоких цифр артериального давления на кровоснабжение органов брюшной полости вследствие уменьшения сердечного выброса, нарушения тонуса магистральных артерий органов пищеварения с преобладанием спастического типа микроциркуляции, приводящего к возникновению трофических изменений органов пищеварения.
При артериальной гипертензии происходят структурно-функциональные изменения сосудов - ремоделирование [1, 3]. Ремоделирование является адаптивным процессом, включающим две стадии: 1) стадию функциональных изменений сосудов, связанную с вазоконстрикторными реакциями в ответ на изменение трасмурального давления и нейрогуморальную стимуляцию (активация катехоламинов, калликреин-кининовой системы, тромбоцитарного ростового фактора, b1 трансформирующего фактора и т.д.) и следующую за ней 2) морфологическую стадию, при которой не только утолщается медиальный слой, но и происходит перестройка сосудистой стенки с изменением взаимоположения ее составляющих, что выражается изменением соотношения «стенка/просвет» [3, 11, 15]. Различают концентрическое («вовнутрь») ремоделирование, при котором уменьшается просвет сосуда, и эксцентрическое («кнаружи»), при котором просвет увеличивается [3, 12]. В отношении сосудистой массы выделяют эутрофический, гипертрофический и гипотрофический типы ремоделирования в зависимости от снижения и отсутствия изменений или увеличения клеточных компонентов (у больных с артериальной гипертензией чаще выявляются структурные изменения сосудов, преимущественно по гипертрофическому типу) [3, 13]. При гипертрофическом ремоделировании происходит увеличение массы сосуда за счет утолщения его мышечного и субэндотелиального слоя интимы вследствие пролиферации и миграции гладкомышечных клеток, а также перестройки клеточных элементов и экстрацеллюлярного матрикса сосудистой стенки за счет дилатации. Увеличение толщины сосудистой стенки приводит к снижению ее эластических свойств, к ригидности [3]. Это потенцирует атеросклеротические осложнения, способствующие формированию аневризм, тромбозов, расслоений [14].
Заболевание аорты начинается в абдоминальном отделе, что со временем приводит к ее ремоделированию и формированию аневризмы [4]. Аневризма брюшной аорты по частоте занимают одно из ведущих мест среди поражений аорты. Остается невыясненным: атеросклеротическое поражение или артериальная гипертензия становятся первичным предиктором заболевания [9, 14]. Поэтому поиск маркеров ремоделирования брюшной аорты при артериальной гипертензии является весьма актуальной задачей. Для диагностики ремоделирования сосудов в клинической практике широко используются такие неинвазивные методы, как дуплексное ангиосканирование и тканевое допплеровское исследование артерий, измерение скорости распространения пульсовой волны. В работах Ross R., 1999, Groner J. A. et al, 2006, Лебедева П.А., 2004, Олейникова В.Э. с соавт, 2006, широко освещаются вопросы диагностики эндотелиальной дисфункции и повышенной жесткости сосудистой стенки как ранних признаков сосудистого поражения при артериальной гипертензии.
При анализе литературы за последние 10-15 лет можно заметить, что акцент в изучении структурно-функциональных особенностей сосудов у больных артериальной гипертензией ставится на механические параметры сосудистой стенки: толщину комплекса интима-медиа, скорость пульсовой волны [Laurent S. et al., 2006, Кобалава Ж.Д. с соавт., 2009]. Однако отсутствие общепринятых стандартов и нормативных показателей, неполная оценка их информативности обусловливают необходимость совершенствования диагностических технологий в этой области. В литературе в основном встречаются данные оценки ремоделирования и изменения эластичности каротидных и бедренных артерий методом дуплексного ангиосканирования и методом тканевой допплерографии, т.к. они легко доступны для ультразвукового исследования вследствие своего поверхностного анатомического расположения и их визуализацию можно проводить линейным датчиком 5-15 Гц, имеющим большую разрешающую способность. А более глубинно залегающая брюшная аорта изучена хуже.
В научной литературе встречаются данные дуплексного ангиосканирования брюшного отдела аорты у здоровых лиц и у пациентов с различными заболеваниями (атеросклероз, артериальная гипертензия, воспалительные заболевания, сахарный диабет). Ранее считалось, что толщину комплекса «интима-медиа» (ТКИМ) стенки сосуда ультразвуковым методом можно измерить только в поверхностных артериях, но рядом авторов было доказано обратное. В работе Dahlen Е. и соавторов показатели ТКИМ инфраренального отдела аорты, измеренные в В-режиме и М-режиме, у здоровых мужчин и женщин в возрасте от 21 до 31 лет составили 0,061±0,012 см, 0,054±0,013 см соответственно, что, вероятно, было связано с более молодым возрастом исследуемых [6]. По данным отечественных авторов, в работах которых значения ТКИМ в зависимости от возраста здоровых испытуемых колебались в пределах 0,9-3 мм, что, вероятно, свидетельствовало о преимущественном влиянии процесса старения на увеличение ТКИМ [Щупакова А.Н, 2005, Гольцова Е.Е., 2007, Бурцева Е.А., 2009, Валеева О.В., 2012, Макаров О.А., 2012]. В литературе встречаются данные измерения показателей упругоэластических свойств брюшной аорты при различных заболеваниях. Так, при изучении эластичности стенок брюшной аорты в различных возрастных группах было показано, что значения модуля эластичности (Ер) линейно увеличиваются с возрастом (в возрасте старше 60 лет Ер - 3,80±2,05×105 Н/м2, у людей от 35 до 60 лет - Ер - 1,55±,0,68×105 Н/м2 и у людей до 35 лет - Ер - 0,99±0,34×105 Н/м2) [7]. Были выявлены тендерные различия показателей ригидности брюшной аорты. Авторы установили, что диаметр брюшной аорты увеличивался с возрастом, причем у мужчин этот процесс происходил быстрее, т.к. аорта у мужчин изначально была шире, чем у женщин. У мужчин увеличение модуля эластичности Петерсона (Ер) и жесткости (β) брюшной аорты происходило в более молодом возрасте, чем у женщин. Жесткость брюшной аорты (β) по результатам исследования составила 5,8±1,5 усл. ед. для здоровых мужчин и 5,4±1,81 усл. ед. для здоровых женщин; модуль эластичности (Ер) увеличивался линейно с возрастом у женщин от 0,18×105 Н/м2 до 1,17×105 Н/м2, а жесткость - от 1,85 до 8,51 усл. ед. [10]. Ahlgren A.R. и соавторы в работах показали достоверное возрастание жесткости стенки брюшной аорты у пациентов с артериальной гипертензией (по данным исследования у мужчин-гипертоников β БрА составила 6,9±1,3 усл. ед., у мужчин без АГ - 5,8±1,5 усл. ед.; у женщин-гипертоников 6,1±1,9 усл. ед. и у женщин без АГ - 5,4±1,7 усл. ед., соответственно). В литературе встречаются и данные измерения циркумферентного напряжения на стенку брюшной аорты. По данным Astrand Н. и соавторов значения напряжения стенки брюшной аорты для мужчин и женщин от 30 до 85 лет составили: 10,7±2,2×105 дин/см2, 9,0±1,8×105 дин/см2 [5].
Karamitsos Т.D. при помощи сравнительно новой ультразвуковой технологии - импульсно-волновой тканевой допплерографии изучал показатели эластичности и скорости движения передней стенки аорты у больных сахарным диабетом 1-го типа. Было выявлено, что движение стенки аорты уменьшалась с увеличением продолжительности заболевания (r=-0,48, р<0,05). В группе лиц, больных сахарным диабетом, зарегистрированные значения скорости движения стенки аорты были ниже по сравнению со здоровой группой (4,9±1,2 см/с и 5,7±0,9 см/с соответственно). Кроме того, отмечалась высокая корреляция между индексом жесткости и скоростью движения аортальной стенки (r=-0,49, р<0,05) как в группе здоровых лиц, так и в группе с диабетом 1-го типа. Т.е с увеличением жесткости стенки скорость ее движения снижалась [10].
Аналогом предложенной нами методики исследования движения стенок аорты является работа Huang Y., Bing. Ни, которые изучали при помощи импульсно-волновой тканевой допплерографии различия в значениях скорости движения стенки брюшного отдела аорты у здоровых людей и гипертоников. В группе лиц, больных гипертонией, значения систолической скорости движения стенки брюшной аорты (пика S1) у мужчин и женщин были ниже по сравнению со здоровой группой (6,05+1,43 см/с у мужчин-гипертоников, 6,01+1,81 см/с у женщин-гипертоников и 4,59+1,23 см/с у здоровых мужчин и 5,26+1,49 см/с у здоровых женщин соответственно). В группе лиц больных гипертонией значения диастолической скорости движения стенки брюшной аорты (пика D) у мужчин и женщин были ниже по сравнению со здоровой группой (3,17+0,45 см/с у мужчин-гипертоников, 3,16+0,71 см/с у женщин-гипертоников и 2,84+0,62 см/с у здоровых мужчин и 2,81+0,64 см/с у здоровых женщин соответственно). Но различий в скорости движения аортальной стенки между здоровыми женщинами и женщинами, страдающими гипертонией, не было. Т.е. скорость движения аортальной стенки зависела от пола. Также была выявлена обратная корреляционная связь с возрастом и со скоростью движения стенки брюшной аорты (r=-0,354, р<0,05) [8].
Вышеуказанный способ имеет такие недостатки:
1) Измерялись только скоростные показатели движения стенки брюшной аорты.
2) Исследовалась только задняя стенка супраренального отдела аорты.
3) Не были выявлены отличия в показателях движения задней стенки брюшной аорты у пациентов с разной степенью артериальной гипертензии.
В настоящее время появились новые методы оценки эластических свойств стенки брюшной аорты. Аналогом предложенной нами методики исследования движения стенок аорты является методика автоматизированной оценки скорости деформации движущихся структур аорты с помощью рабочей станции Multivox. На рабочей станции Multivox с помощью специально разработанного модуля, который обеспечивает слежение за движением помеченных участков ультразвукового изображения, возможно строить графики кривых смещения, их скоростей и измерять скорости смещения между отмеченными областями стенки сосудов. Возможна оценка эластичности артериальной стенки по изменению скорости ее деформации при автоматизированной обработке ультразвуковых изображений. Сандриковым В.А. и соав. были исследованы пациенты с атеросклеротическим поражением брюшной аорты и аневризмой брюшной аорты. В работе оценивали максимальную скорость поперечного растяжения (смещения) стенки инфраренального отдела брюшной аорты за 3-5 кардиоцикла в систолу и диастолу и были построены графики кривых движения и скорости смещения выделенных фрагментов стенки брюшной аорты (по оси X откладывали время в секундах, по оси Y - скорость смещения стенок аорты в каждый момент времени). Показатель скорости, расположенный выше изолинии, означал смещение стенки аорты в систолу, а ниже - в диастолу. Автоматически проводились математические расчеты скорости смещения стенки аорты на данном отрезке. У пациентов с аневризмой брюшной аорты оценивали скорость смещения стенок аорты выше аневризмы и в ее центральной части. Проведенный анализ графиков показал, что у здоровых людей скорость смещения в систолу составила: Vs=9,7±1,4 мм/с, в диастолу - Vd=3,9±0,8 мм/с. У пациентов с атеросклеротическим поражением стенок аорты без аневризмы скорости были снижены - Vs=3,5±1,1 мм/с, Vd=1,5±0,5 мм/с. В группе пациентов с аневризмой брюшного отдела аорты на сохранном участке скорость была также низкой - Vs=4,8±1,4 мм/с, Vd=2,2±0,9 мм/с, на аневризматически измененном участке аорты скорость стенки была выше - Vs=7,1±3,4 мм/с, Vd=3,1±1,7 мм/с. Было отмечено, что формирование аневризмы ведет к возникновению значительной разницы скорости смещения отдельных участков стенки аорты: при диаметре аневризматического мешка более 6,0 см средняя скорость смещения стенок аневризмы в 2,2 раза превышала аналогичные показатели в сохранных отделах аорты над аневризмой (р<0,05) [4].
Вышеуказанный способ имеет такие недостатки:
1) Необходимо наличие рабочей станции Multivox с модулем постпроцессинговой обработки.
2) Дается количественная оценка скоростных показателей смещения стенки брюшной аорты.
Из патентной литературы известен способ, близкий по технической сущности «Способ оценки эластических свойств стенки общей сонной артерии» (Патент №2465831, кл. МПК А61В 8/06. Опубликован 10.11.2012 г.). Изобретение относится к области медицины, а именно к кардиологии. Способ осуществляется следующим образом: во время ультразвукового сканирования линейным датчиком получают изображение дистального отдела общей сонной артерии по длинной оси на уровне приблизительно 1-2 см проксимальнее ее бифуркации, затем поворачивают датчик на 90 градусов с целью получения изображения артерии по короткой оси. Затем курсор M-режима размещают так, чтобы он проходил перпендикулярно через центр просвета артерии, увеличивают изображение задней стенки артерии и при скорости развертки М-режима 50-100 мм/с, получают изображение движения задней стенки артерии. Измеряют скорость систолического движения задней стенки артерии Vpws от самой высокостоящей до самой низкорасположенной точки внутренней поверхности задней стенки артерии либо в автоматическом режиме, либо как отношение расстояния от самой высокостоящей до самой низкорасположенной точки к временному интервалу между ними. При величине Vpws меньше 5,0 мм/с судят о снижении эластических свойств стенки общей сонной артерии.
Вышеуказанный способ имеет такие недостатки:
1) Исследуется только задняя стенка артерии.
2) Импульсно-волновой допплеровский режим подразумевает исследование скорости тока крови внутри сосуда, следовательно, измерение с помощью импульсно-волнового допплеровского режима скорости движения стенки сосуда будет иметь погрешность.
Также известен «Способ ранней диагностики ремоделирования артерий при формировании артериальной гипертонии» (Патент №2414849, кл. МПК А61В 5/02, 2009 г. Опубликовано 27.03.2011 г.). Поставленная задача решается тем, что в способе ранней диагностики ремоделирования артерий при формировании артериальной гипертонии, включающем определение скорости распространения пульсовой волны на участке сосудистого русла между сонной и бедренной артериями, при значении скорости распространения пульсовой волны, больше или равной 12 м/с, диагностируют наличие сосудистого ремоделирования. Согласно изобретению после определения исходного значения скорости распространения пульсовой волны дополнительно проводят функциональную пробу с периферическим вазодилататором и вновь измеряют скорость распространения пульсовой волны на том же участке, если после функциональной пробы скорость распространения пульсовой волны снизилась или нормализовалась, то диагностируют отсутствие процессов ремоделирования, если скорость распространения пульсовой волны не изменилась или увеличилась, то диагностируют наличие сосудистого ремоделирования.
Вышеуказанный способ имеет такие недостатки:
1) Необходимо наличие сфигмографической приставки для выполнения исследования.
2) Необходимость в проведении пробы с периферическим вазодилататором.
3) Способ не предусматривает визуализации исследуемых артерий и использование косвенных показателей, характеризующих процесс ремоделирования артерий.
Также известен «Способ оценки состояния сосудистого русла у здоровых лиц с факторами риска развития сердечно-сосудистых заболеваний и больных сердечно-сосудистыми заболеваниями» (Патент №2508900, кл. МПК А61В 5/00. Опубликовано: 10.03.2014 г.). Изобретение относится к медицине, а именно к кардиологии. Испытуемым проводят контурный анализ пульсовой волны, зарегистрированной методом фотоплетизмографии. На основании параметра индекса жесткости оценивают состояние стенки крупных сосудов. При значении индекса жесткости более 8 м/с регистрируют структурные изменения стенки крупных сосудов (Ск+), менее 8 м/с говорят об отсутствии структурных изменений крупных сосудов (Ск-). Одновременно проводят компьютерную капилляроскопию околоногтевого ложа и кожи дорсальной поверхности пальца. На основании параметра ремоделирования капилляров более 1,33, плотности капиллярной сети в покое более 45 кап/мм2, а также плотности капиллярной сети после пробы с венозной окклюзией более 56 кап/мм2 говорят об отсутствии структурных изменений микрососудов (См-). При наличии отклонения от нормальных значений хотя бы одного параметра говорят о наличии структурных изменений микрососудов (См+). Затем выполняют фотоплетизмографию с окклюзионной пробой для оценки функциональных изменений крупных сосудов и сосудов микроциркуляторного русла на основании параметров сдвига фаз и индекса окклюзии. При значении параметра сдвиг фаз менее 10 м/с говорят о наличии функциональных нарушений крупных сосудов (Фк+), при его значении более 10 м/с - об отсутствии (Фк-). При значении индекса окклюзии более 1,8 говорят о наличии функциональных изменений стенки микрососудов (Фм+), при значении данного индекса менее 1,8 - об отсутствии (Фм-). Затем определяют структурно-функциональные изменения крупных сосудов, сосудов микроциркуляторного русла и их сочетания, на основании чего судят о состоянии сосудистого русла. При сочетании (Фк-Ск-; Фм-См-) оценивают отсутствие поражения сосудистого русла как 0 степень. При (Фк-Ск-; Фм+См-), (Фк+Ск-; Фм+См-), (Фк+Ск-; Фм-См-) оценивают как 1 степень поражения сосудистого русла. Сочетания (Фк-Ск+; Фм-См-) и (Фк+Ск+; Фм-См-) оценивают как 2 степень поражения. Сочетания (Фк-Ск+; Фм+См-) оценивают как 3 степень поражения. Сочетания (Фк-Ск-; Фм-См+) и (Фк-Ск-; Фм+См+) оценивают как 4 степень поражения. Сочетания (Фк+Ск-; Фм-См+), (Фк-Ск+; Фм-См+), (Фк+Ск+; Фм-См+), (Фк+Ск-; Фм+См+), (Фк-Ск+; Фм+См+), (Фк+Ск+; Фм+См+), (Фк+Ск+; Фм+См-) оценивают как 5 степень поражения сосудистого русла. Способ позволяет провести комплексную оценку состояния сосудистого русла на разных уровнях с определением варианта изменений сосудистой стенки и степени поражения сосудистого русла, при этом методы являются высокоспецифичными, высоковоспроизводимыми, неинвазивными и не имеют противопоказаний, что создает возможность для более эффективного проведения первичной профилактики сердечно-сосудистых заболеваний.
Вышеуказанный способ имеет такие недостатки:
1) Не во всех амбулаториях есть в наличии компьютерные капилляроскопы и фотоплетизмографы.
2) Метод довольно продолжительный по времени в условиях скринингового обследования.
Задачей изобретения является выявление маркеров раннего и позднего ремоделирования супраренального и инфраренального отделов брюшной аорты у пациентов с разной степенью артериальной гипертензии ультразвуковыми методами исследования.
Техническим результатом предлагаемого изобретения является доступная, точная информативная, применимая для пациентов разного возраста ультразвуковая диагностика ремоделирования супраренального и инфраренального отделов брюшной аорты при разной степени артериальной гипертензии.
Поставленная задача решается благодаря тому, что способ оценки раннего и позднего ремоделирования супраренального и инфраренального отделов аорты при артериальной гипертензии включает применение методов дуплексного ангиосканирования и импульсно-волновой тканевой допплерографии.
Сущность предложенного способа заключается в следующем:
1. Методом дуплексного ангиосканирования в М-режиме с синхронной записью ЭКГ определяются показатели:
- Дс (см) - систолический диаметр супраренального и инфраренального отделов аорты,
- ДД (см) - диастолический диаметр супраренального и инфраренального отделов аорты,
- ΔД (см) - систоло-диастолический прирост диаметра супраренального и инфраренального отделов аорты,
- ТКИМ (см) - толщина комплекса «интима - медиа» задней стенки супраренального и инфраренального отделов аорты.
2. Методом импульсно-волновой тканевой допплерографии с синхронной записью ЭКГ определяются показатели:
- фазовая структура движения передней и задней стенок супраренального и инфраренального отделов аорты,
- VS1max (см/с) - максимальная скорость антеградной волны движения стенки в фазу систолы,
- VDmax (см/с) - максимальная скорость ретроградной волны движения стенки в фазу диастолы,
- TVS1max (см/с) - длительность максимальной скорости антеградной волны движения стенки в фазу систолы,
- TVDmax (см/с) - длительность максимальной скорости ретроградной волны движения стенки в фазу диастолы.
Используя полученные показатели при помощи М-режима дуплексного ангиосканирования, возможно рассчитать показатели упругоэластических свойств брюшной аорты [2].
Модуль эластичности (жесткости) Петерсона
Ер=ПАД*Дд/ΔД (дин/см2)
Индекс жесткости
SI=ln(САД/ДАД)*Дд/(Дс-Дд)
Коэффициент податливости
СС=π*(Дс2-Дд2)/4*ПАД (см4/дин)
Коэффициент растяжимости
CD=(Дс2-Дд2)/Дд2*ПАД (см2/дин)
Модуль Юнга
Ер=ПАД*Дд2/ΔД*ТКИМ (дин/см)
Циркумферентное (окружное) напряжение стенки аорты (CWS, дин/см2)
Wall stress=(ДАД*Дд/2)/ТКИМ
Некоторые авторы считают целесообразным миллиметры ртутного столба переводить в дины, для чего используют соотношения 1 мм рт.ст.=1333 дин/см2 или 10 дин/см2=0,0075 мм рт.ст. [5].
По изменению предложенных показателей у пациентов с 1-й, 2-й, 3-й степенью артериальной гипертензии, отличных от значений показателей здоровых лиц, определяют раннее или позднее ремоделирование супраренального и инфраренального отделов аорты
В соответствии с изобретением сканирование начинают в эпигастральной области. Датчик ориентируют параллельно и немного левее срединной линии живота. В процессе сканирования датчик смещают вдоль сосуда в подвздошную область. Исследование проводят в момент задержки пациентом дыхания на высоте вдоха. Сначала получают изображение брюшной аорты в М-режиме перпендикулярно, пересекая центр просвета сосуда при скорости развертки 25 мм/сек в следующих участках: 1 - в супраренальном отделе брюшной аорты (в месте отхождения от аорты чревного ствола до отхождения почечных артерий), 2 - в инфраренальном отделе (в отделе, расположенном от отхождения почечных артерий до бифуркации брюшной аорты). Измеряют систолический и диастолический диаметры супраренального и инфраренального отделов аорты за 3 последовательных сердечных цикла. За диаметр принимают расстояние между внутренними поверхностями передней и задней стенок аорты. Минимальный диаметр полости сосуда в диастолу (Дд) измеряют вскоре после волны R на ЭКГ. Измерение диаметра и толщины комплекса «интима-медиа» супраренальной аорты проводят на участке на 0,5 см дистальнее места отхождения чревного ствола, а измерение диаметра инфраренальной аорты - на участке - 1-2 см дистальнее места отхождения почечных артерий. За толщину комплекса «интима-медиа» принимают толщину внутреннего и среднего слоя стенки брюшной аорты. За условный эталон при оценке эхогенности интимы принимают эхогенность окружающих сосуд тканей, медии - эхогенность просвета сосуда. Толщину комплекса «интима-медиа» определяют как среднее из 5 измерений.
Предлагаемый способ проиллюстрирован (Фигура 1. Измерение комплекса «интима - медиа» супраренального отдела аорты).
Анализ движения аортальных стенок проводят в режиме импульсно-волновой тканевой допплерографии с синхронной записью ЭКГ при задержке дыхания пациента на протяжении 5-10 сердечных циклов. Выбранный контрольный объем размещается в области продольного изображения передней (ПС) и задней стенки (ЗС) супраренального отдела аорты на участке на 0,5-1 см дистальнее отхождения чревного ствола от аорты и в области передней и задней стенки инфраренального отдела аорты на участке на 1-2 см дистальнее почечных артерий. Точкой начала отсчета временных фаз считают зубец R ЭКГ.
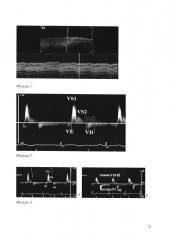
Предлагаемый способ проиллюстрирован (Фигура 2. График скорости движения передней стенки инфраренальной аорты на импульсно-волновой допплерограмме в норме).
На каждом графике смещения допплеровских частот, отражающем скорости движения передней и задней стенок супраренального и инфраренального отделов аорты, получают изображения антеградной волны (S1), которая появляется в результате систолического расширения аорты пульсовой волной в месте измерения (Фигура 2. График скорости движения передней стенки инфраренальной аорты на импульсно-волновой допплерограмме в норме). Антеградная волна (S2) возникает вследствие отражения пульсовой волны от периферических артерий. Ретроградная волна (D) формируется во время ранней диастолы в результате эластической тяги артериальной стенки. В фазу поздней диастолы по мере уменьшения диаметра аорты появляется ретроградная волна (Е).
Для решения поставленной цели были обследованы здоровые лица и пациенты, находившиеся на амбулаторном лечении с 2011 по 2013 г. в отделении функциональной диагностики филиала 2 поликлиники №109 ДЗМ.
Предлагаемым комплексным методом ультразвуковой диагностики было обследовано 147 пациентов (76 мужчин и 71 женщина) в возрасте 35-68 лет (средний возраст составил 52,16±8,9 лет). Группы формировались в зависимости от степени повышения клинического АД и по показателям суточного АД по данным СМАД согласно рекомендациям Российского медицинского общества по артериальной гипертонии/Всероссийского научного общества кардиологов (РМОАГ/ВНОК) по диагностике и лечению АГ (2010). Первую группу составили 38 (21,47%) пациентов с АГ 1 степени (с клиническим АД 140-159/90-99 мм рт.ст., с суточным АД. 125-139/80-89 мм рт.ст.), из них 19 мужчин (50%) и 19 женщин (50%). Вторая группа включала 37 (20,9%) пациентов с АГ 2 степени (с клиническим АД 160-179/100-109 мм рт.ст., с суточным АД 140-147/88-93 мм рт.ст.), из них 20 мужчин (54,05%), 17 женщин (45,95%). Третья группа состояла из 30 (16,95%) пациентов с АГ 3 степени (с клиническим АД≥180/110 мм рт.ст., с суточным АД более 148/94 мм рт.ст.), из них 15 мужчин (50%), 15 женщин (50%). В группу сравнения (контрольную) вошли 42 (23,72%) практически здоровых добровольца с цифрами АД менее 139/89 мм рт.ст., с суточным АД-24 ч по данным СМАД менее 125/80 мм рт.ст. Из них 22 мужчины (53,38%) и 20 женщин (47,62%).
Критерии исключения из обследования: вторичная форма АГ, сахарный диабет, митральный и аортальный стеноз, митральная и аортальная регургитация более 1 степени, фракция выброса левого желудочка менее 50%, выраженное атеросклеротическое поражение периферических артерий, аневризма и окклюзионное поражение брюшной аорты, воспалительные заболевания.
Структурные изменения брюшной аорты оценивали методом дуплексного ангиосканирования в М-режиме на ультразвуковом сканере «MyLab 70» (Esaote, Италия), «VIVID 7 Dimension)) (GE, США) фазированным датчиком частотой 1-4 МГц с синхронной записью мониторного отведения ЭКГ.
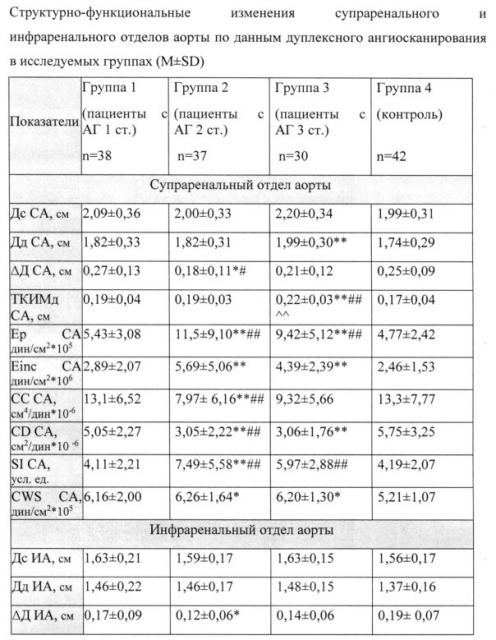
Полученные данные обследования представлены в табл. 1.
Таблица 1
В нашем исследовании толщина стенки, систолический и диастолический диаметры супраренального отдела аорты у здоровых лиц составили: 0,17±0,04 см, 1,99±0,31 см, 1,74±0,29 см. Эти же показатели инфраренального отдела аорты составили: 0,15±0,04 см, 1,56±0,17 см, 1,37±0,16 см.
В диастоле достоверное расширение отмечалось супраренальнного отдела аорты у пациентов 3-ей группы (1,99±0,30 см), различие достоверно с контрольной группой (р<0,001). Наименьшие значения систоло-диастолического прироста диаметра супраренального (СА) и инфраренального отделов аорты (ИА) были у пациентов 2-й группы (0,18±0,11 см, 0,12±0,06 см) в сравнении с 1-й и контрольной группами (р<0,05). Достоверное увеличение ТКИМ СА и ИА было выявлено у пациентов 3-й группы (0,22±0,03 см, 0,20±0,03 см), что статистически отличалось от значений ТКИМ 1-й, 2-й и контрольной групп (р<0,001).
Достоверное снижение коэффициента растяжимости (CD) СА и ИА было выявлено во 2-й (3,05±2,22 см2/дин*10-6, 2,52±1,65 см2/дин*10-6) и в 3-й группах (3,06±1,76 см2/дин*10-6, 2,68±1,37 см2/дин*10-6) в сравнении с группой здоровых (р<0,001). Значение коэффициента податливости (СС) СА было достоверно ниже во 2-й (7,97±6,16, см4/дин*10-6), а в ИА во 2-й (4,19±3,02 см4/дин*10-6) и в 3-й группах (4,54±2,32 см4/дин*10-6) в сравнении с 1-й и группой контроля (р<0,001). Наибольшее значение индекса жесткости (SI) СА и ИА отмечалось у пациентов 2-й (7,49±5,58 усл. ед., 8,44±6,39 усл. ед.) и 3-й групп (5,97±2,88 усл. ед., 7,06±5,58 усл. ед.) в сравнении с показателями 1-й и контрольной групп (р<0,001). Статистически отличались показатели модуля Юнга СА и ИА во 2-й (5,69±5,06 дин/см2*106, 5,62±4,86 дин/см2*106), 3-й группах (4,39±2,39 дин/см2*106, 4,24±3,19 дин/см2*106) с показателями группы здоровых лиц (р<0,001). Увеличение значений модуля Петерсона СА отмечалось во 2-й (11,5±9,10 дин/см2*105, 13,2±11,1 дин/см2*105), в 3-й группах (9,42±5,12 дин/см2*105, 11,2±9,42 дин/см2*105) в сравнении со значениями 1-й и контрольной групп (р<0,001).
В работе было рассчитано циркумферентное напряжение стенки СА и ИА. С увеличением степени и тяжести АГ увеличивалось напряжение на стенку сосуда. У лиц 2-й (6,26±1,64 дин/см2*105) и 3-й групп (6,20±1,30 дин/см2*105) в сравнении с группой здоровых (р<0,05) было выявлено достоверное увеличение напряжения стенки только супраренального отдела аорты. Величины напряжения стенки инфраренального отдела аорты были не достоверны в исследуемых группах.
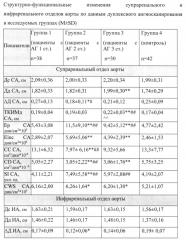
Анализ движения аортальных стенок проводили в режиме импульсно-волновой тканевой допплерографии с синхронной записью ЭКГ при задержке дыхания пациента на протяжении 5-10 сердечных циклов. В норме график смещения допплеровских частот, отражающий скорости движения передней и задней стенки супраренального и инфраренального отделов аорты, имеет четырехфазную кривую, состоящую из последовательных волн Е, S1, S2, D (Фигура 3. Спектр скорости движения передней стенки супраренального отдела аорты в норме (А). Спектр скорости движения передней стенки супраренального отдела аорты при ее ремоделировании (Б)). Но по мере снижения эластичности аорты вследствие дегенеративных изменений и ремоделирования стенок аорты при артериальной гипертензии у пациентов 1-й, 2-й, 3-й групп исчезал пик Е. Также отмечалось притупление и слияние пиков S1, S2. Нарушение фазности кровотока было связано с нарушением эластических свойств аорты, что приводило к раннему отражению пульсовой волны и волна S1 накладывалась на профиль скорости стенки аорты в фазу ранней систолы. Отсутствие волны Е, вероятно, объясняется тем, что при повышенной жесткости аорты в фазу поздней диастолы диаметр аорты оставался практически неизменным и волна Е не формировалась. Т.к. у всех пациентов на графике смещения допплеровских частот, отражающем смещение движения передней и задней стенки брюшной аорты, регистрировались систолическая волна S1 и диастолическая волна D, а диастолическая волна Е и систолическая волна S2 отражались не на всех графиках, то в работе измерялись максимальные скорости волны S1 (VS1max) и волны D (VDmax) их длительность (TVS1max, TVDmax). Движение передней и задней стенок супраренального и инфраренального отделов аорты были однонаправленными. Данные проведенного исследования приведены в таблице 2.
Таблица 2
Частота сердечных сокращений у пациентов исследуемых групп не отличалась между собой. В ходе работы были получены следующие показатели движения стенок супраренального и инфраренального отделов аорты. В контрольной группе систолическая и диастолическая скорости движения передней и задней стенок супраренального отдела аорты составили: VS1max ПС - 5,20±1,13 см/сек, VDmax ПС - 2,97±0,68 см/сек, VS1max ЗС - 5,03±1,37 см/сек, VDmax ЗС - 2,80±0,79 см/сек и инфраренального отдела аорты - VS1max ПС - 4,37±1,17 см/сек, VDmax ПС - 2,55±0,61 см/сек, VS1max ЗС - 4,01±1,22 см/сек, VDmax ЗС - 2,16±0,74 см/сек соответственно. У здоровых лиц длительности систолической и диастолической волны движения передней и задней стенок супраренального отдела аорты составили: TVS1maxПС - 163,31±31,80 мс, TVDmax ПС - 112,54±13,85 мс, TVS1max ЗС - 160,98±21,35 мс, TDmax ЗС - 110,57±12,69 мс и инфраренального отдела аорты - TVS1max ПС - 163,71±27,32 мс, TVDmax ПС - 114,428±19,65 мс, TVS1max ЗС - 159,38±31,48 мс, TVDmax ЗС - 107,55±17,07 мс.
Наименьшие значения систолической скорости передней и задней стенок СА (VS1max) были у пациентов 2-й (4,30±1,06 см/с, 4,29±1,20 см/с), 3-й групп (4,20±0,87 см/с, 4,08±1,63 см/с) относительно показателей 1-й и контрольной групп (р<0,001). Показатели диастолической скорости передней и задней стенок СА (VDmax) достоверно снижались у пациентов 2-й (2,03±0,71 см/с, 1,85±1,09 см/с), 3-й групп (2,21±0,84 см/с, 1,91±1,13 см/с) относительно показателей 1-й и контрольной групп (р<0,001). Показатели систолической скорости передней и задней стенок ИА (VS1max) достоверно снижались у пациентов 2-й (3,52±0,97 см/с, 3,43±0,92 см/с), 3-й групп (3,45±0,92 см/сек, 3,31±0,98 см/сек) относительно значений 1-й и контрольной групп (р<0,001). Показатели диастолической скорости передней и задней стенок ИА (VDmax) были достоверно ниже у пациентов 2-й (2,06±0,50 см/с, 1,65±0,52 см/с) и 3-й групп (1,89±0,52 см/с, 1,64±0,55 см/с), чем показатели в 1-й и контрольной группах (р<0,001). Продолжительности систолической волны (TVS1max) движения передней и задней стенок СА были достоверно больше в 3-й группе (203,00±38,13 мс, 198,53±35,47 мс) в сравнении с показателями 1-й и контрольной групп (р<0,05). Значения TVDmax движения передней и задней стенок СА были достоверно больше во 2-й (123,16±15,99 мс; 116,78±14,31 мс), 3-й группах (122,41±14,13 мс; 115,97±12,02 мс) в сравнении с показателями группы здоровых лиц (р<0,05). Продолжительность систолической волны (TVS1max) движения передней и задней стенок ИА в 3-й группе (198,96±28,47 мс, 179,77±33,64 мс) имела достоверно большие значения в сравнении с 1-й и контрольной группами (р<0,05). Достоверно длительнее диастолическая волна (TVDmax) движения передней и задней стенок ИА была во 2-й (130,73±15,06 мс, 120,68±11,52 мс), 3-й группах (131,60±17,33 мс, 120,03±12,30 мс) в сравнении с 1-й и контрольной группами (р<0,05).
Между совокупностью существенных признаков заявляемого объекта и достигаемым техническим результатом существует причинно-следственная связь, а именно выявлено, что при артериальной гипертензии 2-й степени начинается раннее ремоделирование супраренального и инфраренального отделов аорты, которое характеризуется снижением систоло-диастолического прироста диаметра аорты (менее 0,18 см для супраренального отдела аорты и 0,12 см для инфраренального отдела), изменением функциональных показателей (снижение податливости и растяжимости и повышения показателей жесткости, модуля эластичности Петерсона и модуля упругости Юнга аорты). Отмечается двухфазная кривая движения стенок аорты (отсутствие пико Е и S2), снижение пиковых скоростей (VS1max ниже 4 см/сек, VDmax ниже 2 см/сек для супраренального отдела аорты и VS1max ниже 3,5 см/сек, VDmax ниже 2 см/сек для инфраренального отдела аорты) и увеличение длительности движения стенок аорты в диастолу (TVDmax более 120 мс). При артериальной гипертензии 3-й степени происходит позднее ремоделирование супраренального отдела аорты, характеризующееся увеличением диастолического диаметра (более 2 см) и толщины комплекса «интима-медиа» стенки аорты (более 0, 22 см) и инфраренального отдела за счет увеличения только комплекса «интима-медиа» стенки аорты (более 0,20 см). Отмечается увеличение длительности движения стенок аорты в систолу (TVS1max более 0,200 мс для супраренальной аорты, бо