Способ получения двухкомпонентного препарата для лечения повреждения суставов путем малоинвазивного введения в суставную сумку и препарат, полученный этим способом
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к способу получения двухкомпонентного препарата для лечения повреждения суставов. Способ получения двухкомпонентного препарата для лечения повреждения суставов, осуществляемого путем малоинвазивного введения в суставную сумку, упомянутого препарата в виде двух компонентов - основного и инициирующего, заключающийся в том, что для получения основного компонента препарата плазму крови переносят с помощью шприца и переходного фильтра с размером пор, достаточным для обеспечения стерильности, в одно из отделений криопакета и выдерживают до полного замораживания, затем замороженную плазму крови частично размораживают, перемещают первую оттаявшую фракцию плазмы крови в пустое отделение криопакета и удаляют её из криопакета шприцом, подсоединенным к порту пакета, а оставшийся в криопакете криопреципитат плазмы крови размораживают, затем в упомянутом криопреципитате плазмы крови ресуспендируют клетки, предшественники хондроцитов, в количестве, достаточном для обеспечения терапевтического эффекта, а для изготовления инициирующего компонента препарата смешивают раствором хлорида кальция и тромбина в сбалансированном солевом растворе с добавлением аминокапроновой кислоты в количестве не более максимальной рекомендованной дозы для однократного введения в суставную сумку, при определенных условиях. Двухкомпонентный препарат для лечения повреждения суставов. Вышеописанный способ позволяет обеспечить локализацию клеток в месте введения, позволяющую клеткам мигрировать из клея к месту повреждения и сохранять функциональную активность .2 н. и 6 з.п. ф-лы, 5 ил.
Реферат
Изобретение относится к области клеточной биологии и биотехнологии, в частности к способам получения клеточных препаратов для применения в травматологии, ортопедии и челюстно-лицевой-хирургии.
Локальные посттравматические повреждения хряща, а также дегенеративно-дистрофические повреждения хряща, такие как болезнь Кенига, остеоартроз 1-2 стадии являются распространенными заболеваниями. В некоторых странах от данной группы заболеваний страдает до 22% населения, что делает поиск подходов для восстановления дефектов хряща одним из наиболее актуальных направлений современной ортопедии и травматологии. Дегенеративные процессы в суставной хрящевой ткани приводят к возникновению болей и утрате функции различных суставов как у пожилых людей в силу возрастных изменений, так и у молодых, подвергающих суставы высоким и сверхвысоким нагрузкам во время тренировок и соревнований.
В настоящее время не существует адекватного способа регенерации суставной поверхности, который обеспечивал бы полное и долговременное восстановление структуры и функциональной активности поврежденного сустава. Описано два основных подхода к лечению повреждения суставного хряща: консервативное и оперативное. Консервативное лечение суставов проводится на основе препаратов хондропротекторного ряда или нестероидных противовоспалительных препаратов, и имеет очень ограниченный срок действия, а также целый ряд противопоказаний и осложнений при длительном приеме указанных препаратов. Оперативное лечение суставов очень инвазивно, сопровождается рядом осложнений, таких как инфекции, асептическое расшатывание компонентов эндопротеза, износ вкладыша, болевой синдром, стресс-шилдинг и остеолиз, а также зачастую требует повторного проведения операции, невозможной в силу возраста пациента и высокой инвазивности процедуры. Таким образом, в настоящее время существует потребность в усовершенствовании существующих или поиске принципиально новых способов лечения повреждений суставов.
Один из перспективных подходов к лечению повреждений суставов заключается в малоинвазивном введении аутологичных хондроцитов, прехондроцитов, либо аутологичных или аллогенных мезенхимных стромальных клеток, иммобилизованных в специальных поддерживающих системах.
Для иммобилизации клеток в области инъекции, а также для увеличения терапевтического эффекта клетки могут быть ресуспендированы в нетоксичных, биоразлагаемых жидкостях или гелях. К таким жидкостям относятся, например, жидкости и гели на основе фибриногена (фибриновый клей, его коммерческие аналоги - Tissucol®, Tisseel®, Baxter, США).
В статье Ahmed ТА, Giulivi A, Griffith М, Hincke М. Fibrin glues in combination with mesenchymal stem cells to develop a tissue-engineered cartilage substitute // Tissue Eng Part A. - 2011 - Vol. 17 - №3-4 - p. 323-335 описан фибриновый клей с мезенхимными стволовыми клетками (МСК) и способ его получения. Способ заключается в том, что из донорской крови получают криопреципитат с помощью устройства CryoSeal® FS (Asahi Kasei Medical Co., Ltd) и тромбин с помощью устройства Thrombin Processing Device™ (Thermogenesis corporation), причем концентрация фибриногена в криопреципитате составила 20,1 мг/мл, а концентрация тромбина - 38 Ед/мл. Для стимуляции хондрогенной дифференцировки МСК культивируют в среде DMEM, содержащей 10-7 М дексаметазона, 50 мг/мл 2-фосфата аскорбиновой кислоты, 100 мг/мл пирувата натрия, 40 мг/мл L-пролина, 1% инсулин-трансферрин-селеновой смеси (BD Bioscience Pharmingen), 100 Ед/мл пенициллина, 100 мг/мл стрептомицина и 10 нг/мл ТФР-β2 (R&D Systems). 85 мл криопреципитата смешивают с 30 мл человеческих МСК или хондроцитов с концентрацией 2×107 клеток/мл, затем добавляют 85 мл тромбина. Полученный в результате осуществления описанного способа препарат позволяет иммобилизовать клетки, предшественники хондроцитов. Однако описанный способ требует дополнительного дорогостоящего оборудования, кроме того, полученный в результате осуществления описанного способа препарат имеет высокую концентрацию фибриногена, и клей (скаффолд, каркас) получается настолько плотным, что препятствует свободной миграции клеток.
В статье Kim YS, Choi YJ, Suh DS, Heo DB, Kim YI, Ryu JS, Koh YG. Mesenchymal stem cell implantation in osteoarthritic knees: is fibrin glue effective as a scaffold? // Am J Sports Med. - 2015 - №43(1) - c. 176-85 описан способ получения фибринового клея, содержащего МСК, заключающийся в том, что используют коммерчески доступный фибриновый клей Greenplast kit (Greencross), поставляющийся в двух шприцах, в шприц, содержащий лиофилизованный препарат фибриногена из человеческой плазмы с концентрацией 71,5-126,5 мг/мл добавляют раствор апротинина с концентрацией 1100 калликреин инактивирующих единиц в мл, а в другой шприц, содержащий тромбин с концентрацией 4,9-11 мг/мл, растворенный в растворе хлорида кальция с концентрацией 13,9-15,6 мг/мл, добавляют клеточную суспензию стромальной васкулярной фракции жировой ткани, содержащей МСК в соотношении 1:1 по объему. Для получения фибринового клея клеточно-тромбиновую суспензию смешивают с раствором фибриногена в соотношении 1:1 по объему с помощью системы «Duploject» в момент введения на поверхность повреждения хряща. Авторам удалось показать восстановление хрящевой ткани коленного сустава после артроскопического введения препарата фибринового клея с МСК. Однако используемый в описанном способе фибриновый клей содержит апротинин в качестве катализатора образования фибринового сгустка. В настоящее время показано, что апротинин высокотоксичен и может вызывать повреждения почек и сердечно-сосудистой системы. FDA рекомендует замену апротинина на препараты аминокапроновой кислоты. Также, стромальная васкулярная фракция жировой ткани, используемая в качестве клеточного компонента фибринового клея, содержит относительно небольшое количество МСК. В отсутствие индукции дифференцировки не все МСК, содержащиеся в используемой фракции, смогут дифференцироваться в хондроцитарном направлении. Концентрация фибриногена в клее, полученном описанным способом, достаточно высока для того, чтобы иммобилизовать клетки, но слишком высока, чтобы обеспечить им свободное перемещение к поврежденной поверхности сустава и дифференцировку в этом месте. Кроме этого, в описанном способе используется коммерческий источник фибриногена - препарат GreenPlast, то есть материал является аллогенным для пациента, что повышает риск осложнений, увеличивает стоимость процедуры, создает зависимость от уникальных производителей. Описанный способ является наиболее близким к заявляемому изобретению и выбран в качестве прототипа.
Задачей настоящего изобретения является создание способа получения препарата, предназначенного для лечения повреждения суставов, осуществляемого путем малоинвазивного введения в суставную сумку и обеспечивающего локализацию клеток в месте введения, позволяющую клеткам мигрировать из места введения к месту повреждения и сохранять функциональную активность. Такой способ должен удовлетворять требованиям стерильности и чистоты, достаточным для клинического применения препарата.
Поставленная задача решается тем, что в способе получения препарата для лечения повреждения суставов готовят два раздельных компонента - основной и инициирующий, при этом для получения основного компонента препарата свежую плазму крови переносят с помощью шприца и переходного фильтра с размером пор, достаточным для обеспечения стерильности, в одно из отделений криопакета и выдерживают при температуре минус 80°С до полного замораживания, затем замороженную плазму крови частично размораживают при 4°С, перемещают первую оттаявшую фракцию плазмы крови в пустое отделение криопакета и удаляют ее из криопакета шприцом, подсоединенным к порту пакета. Оставшийся в криопакете криопреципитат плазмы крови размораживают. Клетки, предшественники хондроцитов, получают из жировой или костной ткани пациента, или из пупочного канатика стандартным методом, описанным в статье: Айзенштадт А.А., Енукашвили Н.И., Золина Т.Л., Александрова Л.В., Смолянинов А.Б. Сравнение пролиферативной активности и фенотипа МСК, полученных из костного мозга, жировой ткани и пупочного канатика // Вестник Северо-западного государственного медицинского университета им. И.И. Мечникова - 2015. - Т. 7. - №2. - С. 14-22. В одном из вариантов осуществления способа, клетки выдерживают в присутствии факторов, стимулирующих дифференцировку в хондрогенном направлении, например, в смеси 2×10-8 М дексаметазона, 0,5 мкМ аскорбиновой кислоты, 0,5% пролина, 0,5% пирувата и 5 нМ ТФР-β3. Перед применением клетки ресуспендируют в криопреципитате плазмы крови. Для изготовления инициирующего компонента препарата готовят 0,1-1,0% хлорида кальция, 32,5-500 Ед/мл тромбина в сбалансированном солевом растворе, например физиологическом растворе, с добавлением аминокапроновой кислоты в количестве не более максимальной рекомендованной дозы для однократного введения в суставную сумку. Перед введением основной и инициирующий компоненты препарата помещают в разные отделы системы одновременного введения препаратов, например, шприца «Duploject».
Препарат, полученный при осуществлении заявляемого способа, представлен в виде двух компонентов - основного и инициирующего, при этом основной компонент препарата представляет собой криопреципитат, полученный из плазмы крови, с концентрацией фибриногена 2-18 мг/мл, в который добавлены клетки, предшественники хондроцитов, а инициирующий компонент препарата содержит 32,5-500 Ед/мл тромбина, 0,1-1,0% хлорида кальция и аминокапроновую кислоту в количестве не более максимальной рекомендованной дозы для однократного введения в суставную сумку, в сбалансированном солевом растворе, например в физиологическом растворе. Оба компонента препарата предназначены для введения в суставную сумку одновременно и независимо, например, с помощью шприца «Duploject» с двумя раздельными выходами или комбинации «Duploject» с длинной двухпросветной иглой, при этом смешивание компонентов препарата и формирование клея происходит непосредственно в момент введения в суставную сумку.
В отличие от прототипа, заявляемый способ отличается применением обычного оборудования типа морозильной камеры и холодильника для приготовления криопреципитата плазмы крови, а использование криопакета, вакуумной пробирки и переходного фильтра с диаметром пор, достаточным для обеспечения стерильности, например 0,22 мкн, позволяет провести весь цикл приготовления криопреципитата плазмы крови в закрытой системе, обеспечивая стерильность, необходимую для препарата, предназначенного для введения пациенту. Заявляемый способ получения криопреципитата плазмы крови позволяет приготовить препарат с содержанием фибриногена, достаточным для локализации клеток в месте введения, и позволяющим клеткам мигрировать к поверхности поврежденного сустава. Полученный в результате осуществления заявляемого способа препарат содержит меньшую концентрацию фибриногена, 2-18 мг/мл вместо 71,5-126,5 мг/мл. Это позволяет создать необходимую плотность фибринового клея, достаточную для локализации клеток в месте введения, и при этом позволяющую клеткам мигрировать к поверхности поврежденного сустава. Количество клеток, вводимых в основной компонент препарата, не ограничивается заявляемым способом, и зависит от способа лечения и материала, используемого для получения клеток. При лечении различных повреждений суставов требуется различное количество клеток, предшественников хондроцитов, поэтому в препарат вводится такое количество этих клеток, которое может произвести терапевтический эффект. Использование МСК, индуцированных в хондрогенном направлении путем выдерживания в растворе индукторов дифференцировки, например, в смеси 2×10-8 М дексаметазона, 0,5 мкМ аскорбиновой кислоты, 0,5% пролина, 0,5% пирувата и 5 нМ ТФР-β3, позволяет увеличить количество активных клеток и их функциональную активность в отношении дифференцировки в хондроциты и дальнейшей репарации повреждения хряща, а также ускоряет процессы регенерации. Кроме того, в отличие от прототипа, клетки входят в состав основного компонента препарата, содержащего фибриноген, поскольку хлорид кальция в инициирующем компоненте препарата значительно снижает функциональную активность клеток. Хлорид кальция в инициирующем компоненте препарата обеспечивает полимеризацию фибриногена в концентрации не ниже 0,1%, однако в концентрации выше 1,0% вызывает выраженный апоптоз хондроцитов [Amin А.K., Huntley J.S., Bush P.G., Simpson A.H.R.W., Hall A.C. Chondrocyte death in mechanically injured articular cartilage - the influence of extracellular calcium. Journal of Orthopaedic Research. 2009. - Vol. 27. - P. 778-784]. Заявляемый способ не ограничивает количество аминокапроновой кислоты, вводимой в инициирующий компонент препарата. Аминокапроновая кислота угнетает фибринолиз и, таким образом, улучшает характеристики фибринового клея. Количество вводимой аминокапроновой кислоты может быть ограничено только медицинскими показаниями, которые позволят определить максимальную дозу для введения в суставную сумку без выраженных побочных эффектов на организм пациента.
В одном из вариантов осуществления способа, для получения основного компонента препарата используют аутологичную плазму крови, для этого у пациента забирают кровь в вакуумную пробирку с антикоагулянтом, например гепарином, ЭДТА или любым другим, разделяют плазму крови и форменные элементы крови путем центрифугирования. Применение аутологичной плазмы крови позволяет избежать рисков, связанных с применением аллогенных материалов, и получить полностью неиммуногенный препарат.
В другом варианте осуществления способа, для получения основного компонента препарата используют плазму пуповинной крови, для этого пуповинную кровь забирают в вакуумную пробирку с антикоагулянтом, например гепарином, ЭДТА или любым другим, разделяют плазму крови и форменные элементы крови путем центрифугирования. Применение плазмы пуповинной крови позволяет снизить риск инфицирования донора, т.к. используется длительно хранимый, заранее протестированный материал. Кроме этого плазма пуповинной крови значительно более богата биологически активными веществами, улучшающими выживаемость клеток и графтообразование по сравнению с кровью взрослого донора.
Изобретение иллюстрируется следующими графическими материалами.
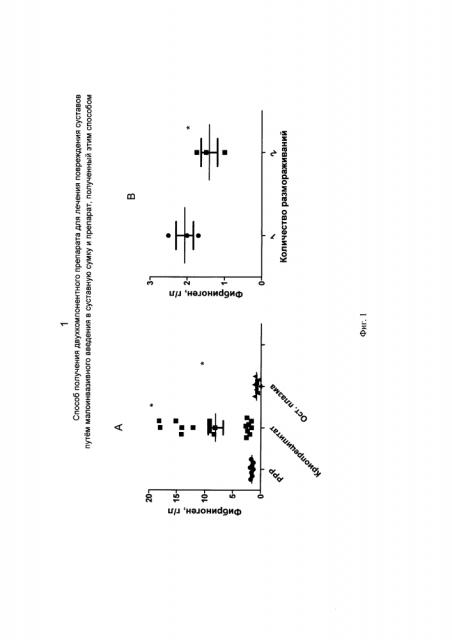
На Фиг. 1 представлено содержание фибриногена в лишенной тромбоцитов плазме (РРР), криопреципитате и остаточной плазме (А) и зависимость его концентрации в криопреципитате от количества циклов замораживания-оттаивания (В). Данные представлены в виде среднего, ошибки среднего, также приведены значения всех элементов выборки. * - достоверные отличия, p<0,05.
На Фиг. 2 представлено время полимеризации фибринового клея в зависимости от концентрации тромбина.
На Фиг. 3 представлены микрофотографии МСК в фибриновом клее на 4-й день культивирования при концентрации фибриногена в криопреципитате плазмы крови 18 г/л (А) и на 2-й (Б) и 4-й (В) день культивирования при концентрации фибриногена в криопреципитате плазмы крови 2,4 г/л, и контрольной культуры МСК на 4-й день культивирования (Г). Масштаб - 100 мкм.
На Фиг. 4 представлены результаты определения иммунофенотипа МСК, мигрировавших из фибринового клея, до начала дифференцировки (МСК) и на 7-е сутки (Прехондроциты). (А) Таблица с результатами определения процентного содержания клеток, позитивных по наличию поверхностных маркеров МСК. (Б) Гистограмма интенсивности окрашивания клеток антителами к поверхностному маркеру CD44. Показано увеличение экспрессии CD44, характерное для начала дифференцировки в хондроцитарном направлении.
На Фиг. 5. представлены микрофотографии МСК, окрашенных антителами к коллагену II типа (I) до дифференцировки (А) и на 7-е сутки после начала дифференцировки в хондроцитарном направлении (Б). Ядра окрашены DAPI (II). Совмещенное изображение представлено на Фиг. 5 (III).
Способ осуществляли следующим образом.
Пример осуществления изобретения.
Приготовление тромбинового раствора.
Смешивали 40 мкл 5% аминокапроновой кислоты, 20 мкл 10% хлорида кальция, и 940 мкл фосфатно-солевого буфера или физиологического раствора (0,9% хлорид натрия). Тромбин (Baxter или Технология-Стандарт, Новосибирск) растворяли до концентрации 500 U/мл или 32.5 U/мл в полученной смеси. Время полимеризации фибринового клея при введении препарата зависит от концентрации тромбина (Фиг. 2).
Приготовление криопреципитата плазмы крови.
Венозную кровь собирали в стандартную вакуумную пробирку для сбора крови объемом 9 мл, содержащую антикоагулянт, например литий-гепарин, затем транспортировали упомянутую пробирку в лабораторию. Центрифугировали кровь, например, на центрифуге СМ-6М (Elmi, Латвия), 15 мин при 2200 g. Не открывая пробирку, отбирали надосадочную жидкость, или плазму, с помощью гиподермической иглы, подсоединенной к шприцу. Удаляли гиподермическую иглу, к шприцу с плазмой подсоединяли фильтр с диаметром пор 0,22 мкм соответствующей стороной, luer female. Ко второму выходу фильтра, luer male, подсоединяли иглу с калибром не больше 21-23G. Вводили эту иглу порт криопакета, например, Macopharma, после чего выдавливали плазму из шприца в одно из отделений криопакета. Замораживали собранную плазму при -80°С, например в морозильной камере Sanyo MDF-U74V Ultra-low Temperature Laboratory Freezer. Помещали криопакет с замороженной плазмой в контейнер с температурой +2-4°С, например в холодильнике фармацевтическом ХФ-250-3 "POZIS". Как только содержимое пакета достигало консистенции «снежной кашицы» с небольшим количеством жидкости, сдавливали охлажденным пинцетом «кашицу», выдавливая жидкую фракцию в пустое отделение криопакета, затем быстро удаляли ее через порт криопакета. После этого размораживали оставшееся в криопакете содержимое. Уровень фибриногена определяли с использованием коагулометрического метода по Клаусу.
Получение и культивирование МСК
МСК выделяли из жировой ткани или пупочного канатика, как было описано в: Айзенштадт А.А., Енукашвили Н.И., Золина Т.Л., Александрова Л.В., Смолянинов А.Б. Сравнение пролиферативной активности и фенотипа МСК, полученных из костного мозга, жировой ткани и пупочного канатика // Вестник Северо-западного государственного медицинского университета им. И.И. Мечникова - 2015. - Т. 7. - №2. - С. 14-22. Образцы подкожной жировой ткани измельчали, затем выдерживали при 37°С в 0,2% растворе коллагеназы в фосфатно-солевом буфере, после чего центрифугировали, например, на центрифуге СМ-6М (Elmi, Латвия), 10 мин при 400 g. Удаляли супернатант, осадок помещали в культуральный флакон площадью 75 см2, в который предварительно было добавлено 10-15 мл полной культуральной среды, например среды МЕМ-α / Advanced Stem Cell Media (HyClone, Германия) с добавлением 20% фетальной коровьей сыворотки для МСК или заменителя сыворотки Advanced Supplement for Stem Cells (HyClone, Германия). Помещали флаконы в СО2-инкубатор, например BBD 6220 (Thermo, Германия).
Сосуды пупочного канатика промывали сбалансированным солевым раствором, например раствором Версена, с помощью шприца, заполняли 0,2% раствором коллагеназы в том же буфере, промывали и повторно заполняли раствором коллагеназы в PBS. Затем клеммировали пупочный канатик с двух сторон, помещали в чашку Петри и выдерживали в шейкере-инкубаторе, например, ES-20 (Biosan, Латвия), в течение 1 ч при температуре 37°С и слабом помешивании. После этого упомянутый раствор коллагеназы собирали и тщательно промывали пупочную вену физиологическим солевым раствором, например раствором PBS. Раствор коллагеназы и солевой раствор после промывок собирали и центрифугировали, например, на центрифуге СМ-6М (Elmi, Латвия), 10 минут при 400 g. Удаляли супернатант, осадок помещали в культуральный флакон площадью 75 см2, в который предварительно было добавлено 10-15 мл полной культуральной среды, например, среды МЕМ-α или Advanced Stem Cell Media (HyClone, Германия) с добавлением 20% фетальной коровьей сыворотки для МСК или заменителя сыворотки Advanced Supplement for Stem Cells (HyClone, Германия). Помещали флаконы в CO2-инкубатор, например, BBD 6220 (Thermo, Германия).
При достижении клетками 50% конфлюэнтности добавляли в флакон с культурой клеток факторы, стимулирующие дифференцировку в хондрогенном направлении, например, смесь 2×10-8 М дексаметазона, 0,5 мкМ аскорбиновой кислоты, 0,5% пролина, 0,5% пирувата и 5 нМ ТФР-β3. Минимальное время инкубации составляло 1 час, максимальное - 5-7 дней.
Приготовление фибринового клея с локализованными в нем клетками.
Стерильно отбирали 1 мл криопреципитата плазмы крови, например, с помощью шприца, присоединенного к порту криопакета. Из флаконов с культурой клеток, предшественников хондроцитов, предназначенных для трансплантации, удаляли культуральную жидкость, затем добавляли в упомянутые флаконы 0,25% раствор трипсина, предварительно нагретого до 37°С и сразу же жидкость с клетками из флакона собирали в пробирку, центрифугировали, например, на центрифуге СМ-6М (Elmi, Латвия), 7 минут при 300-500 g. Супернантант удаляли, добавляли в пробирку 2,5% стерильный раствор альбумина в физиологическом растворе и ресуспендировали осадок. Затем жидкость из флакона собирали в пробирку, центрифугировали, например, на центрифуге СМ-6М (Elmi, Латвия), 7 минут при 300-500 g. Супернантант удаляли, добавляли в пробирку 1 мл криопреципитата плазмы крови и ресуспендировали осадок.
Отбирали 1 мл криопреципитата плазмы крови с клетками в шприц. В другой шприц отбирали 1 мл инициирующего раствора.
Смешивали 0,5 мл криопреципитата плазмы крови с клетками и 0,5 мл инициирующего раствора с помощью аппликационного набора Duploject (Baxter), системы из двух шприцов с общей иглой, или с помощью двух стандартных медицинских шприцов объемом 2 мл, непосредственно внося компоненты в лунки 6-луночного планшета.
После завершения полимеризации фибринового клея с клетками, предшественниками хондроцитов, в лунки планшета добавляли 2 мл полной культуральной среды, закрывали планшеты и выдерживали при 37°С в течение 7 дней. Смену среды осуществляли каждые 2 дня. Исследовали клетки как растущие в геле, так и покинувшие его. Методами световой микроскопии оценивали внешний вид клеток, число клеток, растущих вне геля, число одиночных клеток и колоний в геле. Через 7 дней фибриновый сгусток удаляли, а покинувшие его клетки (примерно 20% от общего числа клеток в лунке) использовали для изучения способности клеток из фибринового клея дифференцироваться в хондроцитарном направлении.
Клетки, покинувшие гель, культивировали до достижения ими 60-70% конфлюэнтности и далее переносили в хондрогенную культуральную среду, содержащую 10% хондрогенного заменителя сыворотки (hMSC Mesenchymal Stem Cell Chondrocyte Differentiation Medium, Lonza) и культивировали согласно протоколу производителя. Методами световой микроскопии морфологию клеток оценивали на 2 и 4 день от переноса в хондрогенную среду (Фиг. 3). При низкой концентрации фибриногена (Б) часть клеток покидает фибриновый сгусток в течение 48 часов после начала культивирования. Далее такие клетки распластываются на субстрате и пролиферируют. На 4 сутки культура клеток, покинувших фибриновый клей (В), морфологически неотличима от контрольной (МСК, выделенные и культивируемые по стандартному протоколу) (Г). Методами проточной цитометрии оценивали иммунофенотип клеток до и после начала дифференцировки (Фиг. 4). В процессе дифференцировки наблюдается увеличение экспрессии маркера CD44 - рецептора к гиалуроновой кислоте, что характерно для хондроцитов.
Успешность дифференцировки также оценивали по появлению клеток, окрашиваемых антителами к коллагену II (Фиг. 5). Начало экспрессии в клетках коллагена II типа является ранним признаком дифференцировки в хондрогенном направлении.
Полученный препарат может быть введен в суставную сумку методом артроскопии или артротомии для лечения врожденных или приобретенных дегенеративных повреждений хряща. Перечень заболеваний, к которым может быть применен данный метод, включает в себя (но не ограничивается ими) следующие заболевания: острый или хронический остеоартрит, формирование хрящевой ткани при эндопротезировании, артроз, болезнь Кенига, анкилоз.
Заявитель просит рассмотреть представленные материалы заявки «Способ получения двухкомпонентного препарата для лечения повреждения суставов путем малоинвазивного введения в суставную сумку и препарат, полученный этим способом» на предмет выдачи патента РФ на изобретение.
1. Способ получения двухкомпонентного препарата для лечения повреждения суставов, осуществляемого путем малоинвазивного введения в суставную сумку, упомянутого препарата в виде двух компонентов - основного и инициирующего, заключающийся в том, что для получения основного компонента препарата плазму крови переносят с помощью шприца и переходного фильтра с размером пор, достаточным для обеспечения стерильности, в одно из отделений криопакета и выдерживают при температуре минус 80°С до полного замораживания, затем замороженную плазму крови частично размораживают при 4°С, перемещают первую оттаявшую фракцию плазмы крови в пустое отделение криопакета и удаляют ее из криопакета шприцом, подсоединенным к порту пакета, а оставшийся в криопакете криопреципитат плазмы крови размораживают, затем в упомянутом криопреципитате плазмы крови ресуспендируют клетки, предшественники хондроцитов, в количестве, достаточном для обеспечения терапевтического эффекта, а для изготовления инициирующего компонента препарата смешивают раствор 0,1-1,0% хлорида кальция, 32,5-500 Ед/мл тромбина в сбалансированном солевом растворе с добавлением аминокапроновой кислоты в количестве не более максимальной рекомендованной дозы для однократного введения в суставную сумку.
2. Способ по п. 1, при котором в качестве плазмы крови используют аутологичную плазму крови пациента.
3. Способ по п. 1, при котором в качестве плазмы крови используют плазму пуповинной крови.
4. Способ по п. 1, при котором в качестве клеток, предшественников хондроцитов, используют мезенхимные стволовые клетки, полученные из жировой или костной ткани пациента.
5. Способ по п. 4, при котором клетки, предшественники хондроцитов, перед использованием выдерживают в присутствии факторов, стимулирующих дифференцировку в хондрогенном направлении.
6. Способ по п. 1, при котором в качестве клеток, предшественников хондроцитов, используют мезенхимные стволовые клетки, полученные из пупочного канатика.
7. Способ по п. 6, при котором клетки, предшественники хондроцитов, перед использованием выдерживают в присутствии факторов, стимулирующих дифференцировку в хондрогенном направлении.
8. Двухкомпонентный препарат для лечения повреждения суставов, осуществляемого путем малоинвазивного введения в суставную сумку, полученный способом по любому из пп. 1-7.