Способ определения маркеров наличия опухолевых в-лимфобластов
Иллюстрации
Показать всеИзобретение относится к области медицины и предназначено для определения маркеров наличия опухолевых В-лимфобластов для установления первичной структуры мажорных генов тяжелой цепи иммуноглобулинов. Отсутствие мажорных продуктов амплификации локуса BCR указывает на отсутствие опухолевых В-лимфобластов. В случае преобладания клонов В-лимфобластов с перестройками определяют минимальную остаточную болезнь при острых лейкозах у детей. Изобретение обеспечивает эффективное определение типа преобладающих V(D)J-перестроек генов тяжелой цепи иммуноглобулинов и установление первичной структуры перестроенного гена. 1 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к области медицины и предназначено для идентификации маркеров наличия опухолевых В-лимфобластов при детекции минимальной остаточной болезни (МОБ) у пациентов с острыми лейкозами, в первую очередь у детей.
Известны три комплементарные технологии для детекции МОБ при острых лимфобластных лейкозах: 1) проточная цитометрия с детекцией популяции лимфоцитов, выделяемой на основании аберрантного иммунофенотипа; 2) RT qPCR (количественная полимеразная цепная реакция в реальном времени, кПЦР-РВ) с детекцией химерного транскрипта; 3) RT qPCR с детекцией индивидуального генетического маркера, образованного в результате клональной реарранжировки гена В-клеточного рецептора. Метод проточной цитометрии реализован в различных модификациях (US 20040224371 A1, 11.11.2004; US 20060263833 A1, 23.11.2006; ЕР 2259065 А1, 08.12.2010; WO 2013187765 A3, 24.04.2014; CN 204142732 U, 04.02.2015), но характеризуется относительно невысокой чувствительностью даже при использовании 10- или 12-цветных зондов: не более 104, то есть 1 опухолевая клетка на 10000 проанализированных (Fossat et al., 2014; Appelbaum, 2013). Количественная ПЦР-амплификация перестроек генов В-клеточных рецепторов более информативна (Flohr et al., 2008). Предложены модификации метода, разработаны наборы реагентов для анализа отдельных локусов (CN 1814791 A, 09.08.2005; CN 103627810 A, 12.03.2013; CN 104328209 A, 04.02.2015). Результат во многом определяется обоснованным выбором амплифицируемых локусов генома и качеством дизайна олигонуклеотидных праймеров для постановки реакции (van der Velden et al., 2014). Технология усовершенствована применением глубокого массированного секвенирования продуктов амплификации (Faham et al., 2012). С ее помощью удалось повысить чувствительность метода до 105, то есть 1 опухолевая клетка на 100000 проанализированных (теоретически - до 106) (Logan et al., 2014; Ladetto et al., 2014).
Задачей изобретения является высокоточная детекция минимальной остаточной болезни при острых лейкозах, в первую очередь у детей.
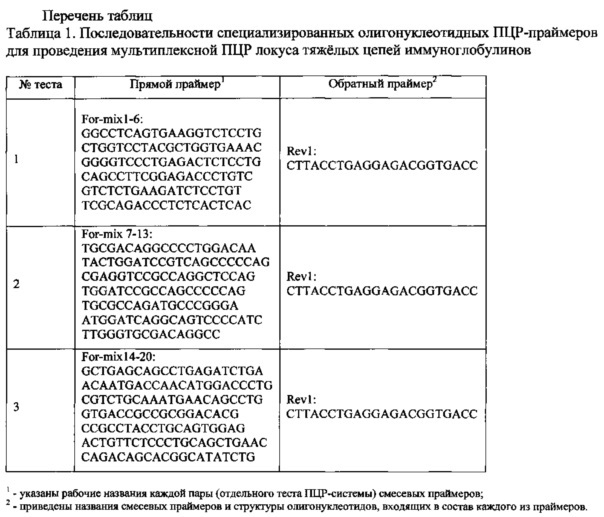
Предложенный способ сочетает в себе использование мультиплексной ПЦР и секвенирования продуктов амплификации. Техническим результатом предложенного изобретения является определение типа преобладающих V(D)J-перестроек генов тяжелой цепи иммуноглобулинов (маркеры наличия опухолевых В-лимфобластов), уровней их содержания в диагностическом образце индивидуальной геномной ДНК и установление первичной структуры высокопредставленных генов для последующей детекции МОБ при острых лейкозах. Технический результат достигается за счет использования ранжированного набора специализированных олигонуклеотидных ПЦР-праймеров для локуса BCRH (таблица) и секвенирования. Выбранные сочетания смесевых праймеров характеризуются воспроизводимостью результатов на четырех вариантах модельной системы, ложнопозитивных и ложнонегативных сигналов, отсутствием комплементарного ингбирования уровня праймирования в смеси, исчерпывающей информативностью.
Предлагаемый способ реализуется следующим образом.
Проводят выделение мононуклеарных клеток периферической крови (РВМС-фракция) из диагностического образца пациента, а затем - выделение геномной ДНК из РВМС-фракции. Для этого клеточный осадок РВМС-фракции помещают в лизирующий буфер (60 мМ Трис, 100 мМ EDTA, 0.5% SDS), в который добавляют 0,4 мг РНКазы А и помещают на 1 час в термостатируемый ротационный шейкер на 37°С. Затем в раствор добавляют 1,5 мг протеиназы К и инкубируют в термостатируемом ротационном шейкере в течение ночи при 50°С. Экстракцию ДНК из раствора осуществляют фенол-хлороформным методом. После этого с помощью флюориметра и совместимого с ним набора реагентов определяют количество и концентрацию ДНК, отбирают аликвоту и доводят концентрацию ДНК в анализируемом образце до значения 60 нг/мкл путем разведения в ТЕ буферном растворе.
ПЦР проводят в формате 96-луночного планшета и/или стрипованных серий пробирок. Для постановки серийных мультиплексных ПЦР используют общую для серии реакционную смесь, не содержащую ДНК анализируемой матрицы и праймеров. Каждая пробирка серии содержит предварительно подбираемую комбинацию смесевых прямых и обратных праймеров, соответствующих определенным участкам - V, D и J-сегментам анализируемого локуса (см. Таблицу 1). Матрицу индивидуальной геномной ДНК добавляют независимо для каждой серии из расчета от 6 нг (min), соответствующих 103 клеток анализируемого образца, до 60 нг (max), соответствующих 104 клеток, на каждую реакцию в зависимости от доступного клеточного содержания полученного для анализа клинического образца. В результате реакционная смесь каждой из серии реакций содержит:
| буфер для ДНК-полимеразы Hs Taq | 1x |
| смесь дезоксирибонуклеозидтрифосфатов | по 0,25 мкМ каждого |
| комбинация прямых праймеров (V- или D-сегменты) | 0,12 мкМ каждого |
| комбинация обратных праймеров (J-сегменты) | 0,12 мкМ каждого |
| ДНК-матрица от | 6 нг |
| ДНК-полимераза Hs Taq | 1 u |
| H2O (mQ) | до 20 мкл |
Перед началом целевой амплификации проводят процедуру «hot start» для всей серии путем предварительного прогрева реакционных смесей в течение 120 с при 94°С в амплификаторах с нагреваемой крышкой. Профиль амплификации для приготовления библиотек фланкирующих последовательностей Alu:
| денатурация ДНК | 20 с при 94°С |
| отжиг праймеров | 15 с при 60°С |
| элонгация ДНК | 60 с при 72°С |
После амплификации проводят финальное достраивание концов молекул ДНК при 72°С в течение 4 мин. Количество циклов амплификации составляет 20 для тестовых серий и определения систем компоновки праймеров и 25 - для анализа геномной ДНК индивидуальных клинических образцов. Анализ результатов ПЦР-тестирования проводили с помощью электрофореза в агарозном геле или - в случаях количественной ПЦР - в режиме «реального времени» определения кривых плавления ПЦР-продуктов.
По окончании реакции из каждой пробирки отбирают аликвоту 5 мкл для полуколичественного анализа. Проводят электрофорез отобранных аликвот в 1%-ном агарозном геле в присутствии маркера длин фрагментов ДНК и образцов положительного контроля. Количество V(Т))J-перестроек, связанных с опухолевыми клонами, определяют по количеству высокопредставленных продуктов амплификации, детектируемых при помощи электрофореза. Отсутствие высокопредставленных продуктов указывает на отсутствие опухолевых В-лимфобластов, и дальнейшие операции не проводят. По результатам денситометрии электрофореграмм определяют суммарную интенсивность всех ПЦР-продуктов и интенсивность высокопредставленных ПЦР-продуктов. Проводят элюцию высокопредставленных продуктов и выполняют дополнительную очистку элюатов с использованием микроколонок QIAquick PCR purification system. Проводят секвенирование по Сэнгеру элюированных ПЦР-продуктов с использованием ПЦР-праймеров на соответствующие J-сегменты генов BCR. Установленные секвенированием последовательности V(D)J-перестроек генов TCR являются идентифицированными маркерами наличия опухолевых В-лимфобластов. Описание стандартных операционных процедур и используемого оборудования приведено в «Методике идентификации и количественного определения маркеров наличия опухолевых В-лимфобластов» (2015).
На рисунке 1 представлены в качестве примера результирующие электрофореграммы, демонстрирующие перестройки иммуноглобулиновых локусов: А - электрофореграмма здорового донора, Б - пациента с B-ALL. В лимфоцитах здорового донора относительно равномерно представлены любые типы перестроек иммуноглобулиновых генов и не наблюдается случаев выраженной клональной экспансии В-клеток. Напротив, в клетках РВМС-фракций диагностических образцов как периферической крови, так и костного мозга больного острым лейкозом В-клеточного типа наблюдается ярко выраженное преобладание нескольких, предположительно опухолевых клонов с немногими характеристическими перестройками.
Таким образом, на элекрофореграмме могут быть представлены один или несколько мажорных (высокопредставленных) ПЦР-продуктов (флюоресцирующих полос). Каждый из этих продуктов является результатом амплификации гена BCR соответствующего гиперпредставленного клона В-лимфобластов. Гиперпредставленность клона В-лимфобластов говорит о его неконтролируемом размножении, что означает злокачественную трансформацию. Флуоресценция мажорных ПЦР-продуктов соответствует злокачественным клонам В-лимфобластов, суммарная флуоресценция соответствует всей популяции В-лимфобластов. Соотношение интенсивностей говорит о доле злокачественного клона (злокачественных клонов) в общей популяции В-лимфобластов. Нуклеотидная последовательность гена или последовательности генов BCR, соответствующих злокачественным клонам В-лимфобластов, являются маркерами наличия опухолевых В-лимфобластов.
Перечень литературных источников
1. Fossat С, Roussel М, Arnoux I, Asnafi V, Brouzes С, Garnache-Ottou F, Jacob MC, Kuhlein E, Macintyre-Davi E, Plesa A, Robillard N, Tkaczuk J, Ifrah N, Dombret H, MC, Baruchel A, Garand R; for the French Multicenter Study Groups for Pediatric and Adult ALL. Methodological aspects of minimal residual disease assessment by flow cytometry in acute lymphoblastic leukemia: A french multicenter study. Cytometry В Clin Cytom. 2014 Nov 1. doi: 10.1002/cyto.b.21195.
2. Appelbaum FR. Measurement of minimal residual disease before and after myeloablative hematopoietic cell transplantation for acute leukemia. Best Practice and Research Clinical Haematology. 2013 Sep; 26 (3): 279-284.
3. Flohr T, Schrauder A, Cazzaniga G, R, van der Velden V, Fischer S, Stanulla M, Basso G, Niggli FK, BW, Sutton R, Koehler R, Zimmermann M, Valsecchi MG, Gadner H, Masera G, Schrappe M, van Dongen JJ, Biondi A, Bartram CR; International BFM Study Group (I-BFM-SG). Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP-BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia. 2008 Apr; 22 (4): 771-782.
4. van der Velden VH, Noordijk R, Brussee M, Hoogeveen PG, Homburg C, de Haas V, van der Schoot CE, van Dongen JJ. Minimal residual disease diagnostics in acute lymphoblastic leukaemia: impact of primer characteristics and size of junctional regions. British Journal of Haematology. 2014; 164 (3): 451-453.
5. Faham M, Zheng J, Moorhead M, Carlton VE, Stow P, Coustan-Smith E, Pui CH, Campana D. Deep-sequencing approach for minimal residual disease detection in acute lymphoblastic leukemia. Blood. 2012 Dec 20; 120 (26): 5173-5180.
6. Logan AC, Zhang B, Narasimhan B, Carlton V, Zheng J, Moorhead M, Krampf MR, Jones CD, Waqar AN, Faham M, Zehnder JL, Miklos DB. Minimal residual disease quantification using consensus primers and high-throughput IGH sequencing predicts post-transplant relapse in chronic lymphocytic leukemia. Leukemia. 2013; 27 (8): 1659-1665.
7. Ladetto M, M, Monitillo L, Ferrero S, Pepin F, Drandi D, Barbero D, Palumbo A, Passera R, Boccadoro M, Ritgen M, N, Zheng J, Carlton V, Trautmann H, Faham M, Pott C. Next-generation sequencing and real-time quantitative PCR for minimal residual disease detection in B-cell disorders. Leukemia. 2014; 28 (6): 1299-1307.
Способ определения маркеров наличия опухолевых В-лимфобластов для установления первичной структуры мажорных генов тяжелой цепи иммуноглобулинов на основе мультиплексной полимеразной цепной реакции с использованием специализированных олигонуклеотидных праймеров For1 GGCCTCAGTGAAGGTCTCCTG, For2 CTGGTCCTACGCTGGTGAAAC, For3 GGGGTCCCTGAGACTCTCCTG, For4 CAGCCTTCGGAGACCCTGTC, For5 GTCTCTGAAGATCTCCTGT, For6 TCGCAGACCCTCTCACTCAC, For7 TGCGACAGGCCCCTGGACAA, For8 TACTGGATCCGTCAGCCCCCAG, For9 CGAGGTCCGCCAGGCTCCAG, For10 TGGATCCGCCAGCCCCCAG, For11 TGCGCCAGATGCCCGGGA, For12 ATGGATCAGGCAGTCCCCATC, For13 TTGGGTGCGACAGGCC, For14 GCTGAGCAGCCTGAGATCTGA, For15 ACAATGACCAACATGGACCCTG, For16 CGTCTGCAAATGAACAGCCTG, For17 GTGACCGCCGCGGACACG, For18 CCGCCTACCTGCAGTGGAG, For19 ACTGTTCTCCCTGCAGCTGAAC, For20 CAGACAGCACGGCATATCTG, Rev1 CTTACCTGAGGAGACGGTGACC для локуса BCR для определения типа преобладающих V(D)J-перестроек генов и для электрофоретического определения мажорных продуктов амплификации с последующим секвенированием, где отсутствие мажорных продуктов указывает на отсутствие опухолевых В-лимфобластов, а в случае преобладания клонов В-лимфобластов с перестройками определяют минимальную остаточную болезнь при острых лейкозах у детей.