Таблетки биотина с замедленным высвобождением и способ их получения
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой фармацевтический состав в виде таблетки, содержащий биотин в качестве активного компонента с замедленным высвобождением, и вспомогательные вещества, отличающийся тем, что содержит следующие компоненты, масс. %: биотин 50-60, стабилизатор 15-21, эмульгатор 6-10, загуститель 16.5-17, связывающее вещество 1,5-3, разрыхлитель 0,4-1, лубрикант 0.6-1. Изобретение обеспечивает контролируемое высвобождение фармацевтического состава биотина при наличии устойчивых технологических свойств и стабильности. 2 н. и 1 з.п. ф-лы, 1 табл., 5 пр.
Реферат
Настоящее изобретение относится к области химико-фармацевтической промышленности и медицины и касается новых составов лекарственных форм средств лечения демиелинизирующих заболеваний, в частности рассеянного склероза.
Демиелинизирующие заболевания - заболевания, основным патологическим процессом при которых является демиелинизация, то есть разрушение миелиновой оболочки нейронов центральной или периферической нервной системы. Это повреждение ухудшает проводимость сигналов в пострадавших нервах. Наиболее распространенным демиелинизирующим заболеванием является рассеянный склероз, характеризующийся поражением сразу нескольких отделов ЦНС.
Рассеянный склероз (PC) - дегенеративное, воспалительное, неврологическое заболевание и характеризуется демиелинизацией центральной нервной системы. Заболевание в основном поражает молодых людей, с более высокой частотой у женщин.
Рассеянный склероз (PC) - самое частое заболевание центральной нервной системы у лиц молодого возраста. В подавляющем большинстве случаев в начале заболевания течение PC ремитирующее, когда периоды проявления разнообразной симптоматики сменяются фазами полного благополучия или значительного улучшения состояния. Однако со временем болезнь начинает неуклонно прогрессировать и, почти с неизбежностью, приводит к значительной инвалидизации пациентов.
Это хроническое прогрессирующее заболевание, характеризующееся множественными очагами поражения в центральной нервной системе. До сих пор так и не найдено какого-нибудь одного фактора, являющегося непосредственной причиной заболевания. Поэтому наиболее распространенной является гипотеза о мультифакторной природе PC. Под этим термином понимается сочетанное воздействие внешних и генетических факторов, приводящее к развитию хронического воспалительного, демиелинизирующего и нейродегенеративного процессов.
До недавнего времени не существовало лекарственных средств, которые могли бы существенно повлиять на течение PC. Два последних десятилетия изменили представление об этом заболевании как о некурабельном. Это произошло в связи с внедрением в клиническую практику препаратов иммуномодулирующего ряда - интерферонов, глатирамера ацетата, финголимода и др. Иммуномодулирующая терапия позволяет значительно сократить число обострений PC и замедлить нарастание инвалидизации пациентов. В настоящее время принято назначать иммуномодулирующую терапию сразу же после установления диагноза, так как отсроченное назначение лечения снижает его эффективность. В связи с этим очевидно, что важна правильная постановка диагноза на самых ранних этапах заболевания. Несмотря на то, что сейчас имеются такие дополнительные методы исследования, как МРТ (магнитно-резонансная томография) и исследование вызванных потенциалов (ВП), примерно половине пациентов правильный диагноз ставится только через 5 лет после начала заболевания, и это время для проведения лечения оказывается упущенным [РМЖ "Человек и лекарство" 10 марта 2010 г., №5].
Симптомы заболевания включают усталость, онемение, дрожь, покалывание, дизестезию, нарушения зрения, головокружение, когнитивные нарушения, урологические дисфункции, снижение подвижности и депрессии. Различают четыре типа классификации клинических моделей болезни: ремитирующий, вторично-прогрессирующий, первично-прогрессирующий и прогрессивно-рецидивирующий [S.L. Hauserand D.Е. Goodkin, Multiple Sclerosis and Other Demyelinating Diseasesin Harrison's Principles of Internal Medicine 14thEdition, vol. 2, Mc Graw-Hill, 1998, pp. 2409-2419].
Современные методы терапии направлены на облегчение симптомов заболевания, насколько это возможно. В зависимости от типа препарата лечение обычно предполагает использование иммуномодулирующих агентов, таких как интерфероны (интерферон бета-1-, бета-1-б- и альфа-2), глатиромерацетат или кортикостероиды, такие как метилпреднизолон и преднизолон. Кроме того, химиотерапевтические средства, такие как метотрексат, азатиоприн, циклофосфамид кладрибин, финголимод, терифлуномид, диметилфумарат и циклоспорина активно используются в терапии PC.
Недавно были представлены перспективные результаты исследований у людей с прогрессивными формами рассеянного склероза (MS) с использованием высоких доз биотина (http://www.ncbi.nlm.nih.gov/pubmed/25787192).
Биотин (витамин Н, витамин В7) является водорастворимым витамином группы В, кофактором в метаболизме жирных кислот, лейцина и в процессе глюконеогенеза.
Биотин регулирует уровень сахара в крови и очень важен для углеводного обмена, контролирует процессы глюконеогенеза, отвечая за участие глюкозы в обмене веществ. Биотин играет важную роль в усвоении белка и сжигании жира.
Витамин Н необходим для нормальной деятельности нервной системы.
Дефицит т.н. голокарбоксилазысинтетазы (Holocarboxylasesynthetase - HLCS) считается автосомальным рецессивным заболеванием, a HLCS является ферментом, который катализирует инкорпорацию биотина в карбоксилазу и гистоны. Больные дети, имеющие мутантную форму HLCS, хорошо отвечают на целевую терапию биотином [Y. Suzukietal., 2005].
Кофермент ацетилкарбоксилазы - биотинзависимый фермент, катализирует карбоксилацию ацетила-СоА, чтобы воспроизвести малонил-СоА. Он играет большую роль в жировом обмене. Исследование молекулярного механизма функционирования описываемого кофермента - это важный шаг к созданию новых лекарственных препаратов с улучшением метаболизма липидов [L. Tong, 2005].
Достаточно убедительно показано, что биотин (водорастворимый витамин) является простетической группой карбоксилаз. Кроме того, он не только выступает в роли карбоксилазного кофактора, но и участвует в иммунитете и во многих проявлениях метаболизма.
Предполагается, что коррекция содержания в организме биотина может способствовать снижению активности процессов старения [B. Ames, Н. Atamna, D. Killilea, 2005].
Установлено, что Биотин регулирует экспрессию генов, ответственных за метаболизм инсулина и глюкозы. Он стимулирует работу генов, ответственных за усвоение глюкозы крови (через продукцию инсулина, через инсулиновые рецепторы, панкреатическую и печеночную глюкокиназу). Напротив, Биотин уменьшает экспрессию печеночной фосфоэнолпируваткарбооксикиназы - фермента, стимулирующего производство глюкозы печенью. Таким образом, Биотин регулирует деятельность генов, которые обеспечивают интермедиаторный обмен, особенно углеводный и жировой.
Обнаружение того факта, что недостаток биотина можно представить как тяжелое и диффузное миелинизирующее нарушение, послужило в дальнейшим поддержкой идеи о том, что биотин вовлечен в миелиновый метаболизм (MultScler. 2015 Jul 8, Biotin and demyelinating diseases - a new connection?, Tourbah A).
В настоящее время выпускаются таблетки Волвит, содержащие биотин (biotin) 5 мг и вспомогательные вещества: целактозу 80, Na лаурилсульфат, Na кроскармеллозу, магний стеариновокислый, кремния диоксид коллоидный (безводный), покрытие Opadry II 85 G 54348 розовый (http://compendium.com.ua/info/171919/kusum/volvit-sup-sup-).
Известна заявка WO 2014016003, в которой раскрывается применение Биотина в высоких дозировках, 50-700 мг в день, для лечения рассеянного склероза. Отмечается, что биотин может использоваться в форме гелевых капсул, таблеток, в том числе с пленочным покрытием, пастилок и пилюль. В заявке раскрывается ряд наполнителей, которые можно использовать для лекарственных форм, такие как тальк, микрокристаллическая целлюлоза, лактоза, манноза, крахмал (в частности, кукурузный крахмал), стеарат магния (Е572) и стеариновая кислота (Е570). Этот список не является исчерпывающим. Когда этот состав подготовлен в форме капсул, предпочтительным наполнителем является микрокристаллическая целлюлоза. Когда состав находится в форме таблетки, покрытой оболочкой, покрытие пленки может быть сформировано из любого вещества, известного в данной области, такого как гипромелоза (Е464), этилцеллюлоза, макрогол, тальк, диоксид титана (Е171) или оксид железа (Е172). Хотя в источнике и перечислены некоторые вспомогательные вещества, отсутствуют данные о наличии разработанных и описанных конкретных готовых лекарственных форм с высокими дозировками Биотина. Из источника не ясно, удалось ли авторам создать формы с высоким процентным содержанием вещества или их нужно принимать несколько для приема определенной дозы. Данный источник может быть указан в качестве ближайшего аналога-прототипа.
Задача изобретения: разработка способа получения и фармацевтического состава биотина - лекарственного средства замедленного высвобождения с более высоким содержанием активного компонента при наличии устойчивых технологических свойств и стабильности, а также воспроизводимой кинетики высвобождения активного вещества.
Задача решается новым составом твердой лекарственной формы с замедленным высвобождением активного начала (варианты).
Фармацевтический состав в виде таблетки, содержащий биотин в качестве активного компонента с замедленным высвобождением, и
вспомогательные вещества, отличающийся тем, что содержит следующие компоненты, масс. %:
| Биотин | 50-60 |
| Стабилизатор | 15-21 |
| Эмульгатор | 6-10 |
| Загуститель | 16.5-17 |
| Связывающее вещество | 1,5-3 |
| Разрыхлитель | 0,4-1 |
| Лубрикант | 0.6-1 |
Наиболее предпочтительный состав содержит, масс. %:
| Биотин | 50-60 |
| Метоцел (METHOCEL) К100 LV | 15-21 |
| Метоцел (METHOCEL) К4М | 6-10 |
| Микрокристаллическая целлюлоза | 16.5-17 |
| Коповидон | 1,5-3 |
| Коллоидный диоксид кремния | 0,4-1 |
| Фармацевтически приемлемая соль | |
| стеариновой кислоты | 0.6-1 |
Еще одним из вариантов выполнения состава в виде таблетки может быть состав, который содержит следующие компоненты, масс. %:
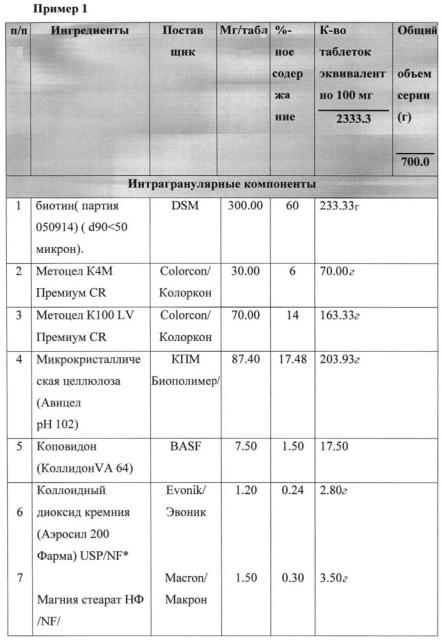
| Биотин | 60 |
| Метоцел (METHOCEL) К100 LV | 14 |
| Метоцел (METHOCEL) К4М | 6 |
| Микрокристаллическая целлюлоза | 17,48 |
| Коповидон | 1,5 |
| Коллоидный диоксид кремния | 0,42 |
| Фармацевтически приемлемая соль | |
| стеариновой кислоты | 0.6 |
Целевой профиль заявленных составов замедленного высвобождения составляет по меньшей мере 20-24 часа.
В качестве фармацевтически приемлемой соли стеариновой кислоты может быть использован магния стеарат, кальция стеарат, их смесь.
Предлагаемые препаративные формы (в частности, таблетки, капсулы, гранулы) обеспечивают Биотин в высоких дозировках в частности для применения при Рассеянном Склерозе.
Наполнители, включающие Стабилизатор, Эмульгатор, Загуститель, связывающее вещество, Разрыхлитель, Лубрикант, добавляют к активному веществу с целью гомогенизации готового лекарственного средства и подобраны таким образом, чтобы обеспечить высокую биодоступность, оптимальные показатели сыпучести, насыпной плотности.
Нами было обнаружено, что влажная грануляция проявляет тенденцию к потенциальному воздействию на стабильность вследствие влияния влаги и вероятности термического разложения лекарственного вещества во время сушки. Для сухой грануляции методом вальцевания порошкообразные частицы лекарственного вещества и наполнители соединяются под высоким давлением для образования ленты, а перед прессованием (таблетирование) разбиваются для образования гранул размалыванием. Также нами обнаружено, что риск неудовлетворительной однородности состава таблетки и отклонение массы таблетки с биотином может быть снижен при осуществлении контроля фракционного состава и свойств сыпучести. Еще одним объектом изобретения является способ получения таблеток биотина замедленного высвобождения методом вальцевания, предпочтительно при использовании субстанции биотина микронизированной с распределением частиц по размеру d90<50 микрон. В частности, гранулометрический состав частиц с d90<50 микрон: d90-62.62 мкм, d50-25.86 мкм, d10-8.23 мкм.
Способ получения предпочтительного фармацевтического состава в виде таблетированной формы с замедленным высвобождением характеризуется тем, что Битотин, комбинацию Метоцел К4М и Метоцел К100 LV, микрокристаллическую целлюлозу и коповидон просеивают вместе, перемешивают до однородности, добавляют фармацевтически приемлемую соль стеариновой кислоты, коллоидный диоксид кремния, перемешивают, смесь уплотняют вальцеванием, добавляют коллоидный диоксид и перемешивают вместе с предварительно уплотненными гранулами с последующим добавлением фармацевтически приемлемой соли стеариновой кислоты, перемешиванием и формованием твердой лекарственной формы.
Таблетки могут быть спрессованы в капсулообразной форме. Либо полученная таблет-смесь, может быть рассыпана в капсулы.
Предпочтительно перемешивание ведут при скорости мешалки 20 об/минуту. Любую из стадий перемешивания осуществляют до однородного состояния, предпочтительно в течение 3-6 минут. На стадии вальцевания может использоваться сетка размером 1.6 мм для предварительной грануляции и 0.63 мм - для тонкой грануляции, и процесс осуществляют предпочтительно при гидравлическом давлении 90 бар.
Указанный способ лишь иллюстрирует изобретение. Способ с использованием других функционально указанных в п. 1 компонентов имеет те же стадии.
Предложенный способ обеспечивает особенно хорошую текучесть, однородность и сжимаемость в готовой смеси при использовании определенных вспомогательных компонентов согласно предложенному составу.
Возможность осуществления изобретения продемонстрирована ниже представленными примерами.
Пример 3. Способ получения
1. Просеивание интрагранулярных компонентов
Через сито ASTM#30 просеивали вместе субстанцию Биотина, комбинацию Метоцел К4М и Метоцел К100 LV, Авицел рН 102 и Коллидон VA64.
Через сито ASTM#20 просеивали Коллоидный диоксид кремния. Через сито ASTM#60 просеивали Магния стеарат.
2. Смешивание (предварительное компактирование)
Просеянные вспомогательные вещества перемешивали в смесителе. Длительность перемешивания составила 6 минут при 20 об/мин.
Просеянный Магния стеарат и Коллоидный диоксид кремния добавляли к предыдущей фазе и вновь перемешивали. Длительность перемешивания составила 3 минуты при 20 об/мин.
3. Уплотнение (компактирование) вальцеванием
Вышеуказанную смесь поместили в роликовый пресс (Alexanderwerk WP120), оснащенный вальцами 25 мм. Пресс был запущен в работу согласно нижеприведенным параметрам, использовалась сетка размером 1.6 мм для предварительной грануляции и 0.63 мм - для тонкой грануляции.
4. Просеивание экстрагранулярных вспомогательных субстанций
Через сито ASTM#20 просеивали Аэросил
Через сито ASTM#60 просеивали Магния стеарат
5. Смешивание (предварительное смазывание)
В смеситель емкостью 1 л помещали просеянный Аэросил вместе с предварительно уплотненными гранулами. Длительность перемешивания составила 4 мин при 20 об/мин.
Просеянный магния стеарат поместили в вышеупомянутый смеситель.
Смеситель запустили в работу на 2 минуты при 20 об/мин.
6. Прессование
Пластифицированную смесь помещают в таблеточный пресс с пуансонами типа D, прессуют согласно следующим параметрам:
| Насыпная плотность (г/мл) | 0.516 |
| Плотность после уплотнения (г/мл) | 0.727 |
| Индекс Карра (%) | 29.03 |
| Соотношение по Хауснеру | 1.41 |
Прессование составов, как в случае примера 1, так и в случае примера 2 было равномерным, с минимизированным отклонением от установленных параметров (менее 0,31% в отличие от прототипа с 0,96%). Среднее значение прочности 20.63 Кр.
Пример 4. Способ получения
1. Просеивание интрагранулярных компонентов
Через сито ASTM#30 просеивали вместе субстанцию Биотина, комбинацию Метоцел К4М и Метоцел К100 LV, Авицел рН 102 и Коллидон VA64.
Через сито ASTM#20 просеивали Коллоидный диоксид кремния. Через сито ASTM#60 просеивали Магния стеарат.
2. Смешивание (предварительное компактирование)
Просеянные вспомогательные вещества перемешивали в смесителе. Длительность перемешивания составила 6 минут при 20 об/мин.
Просеянный Магния стеарат и Коллоидный диоксид кремния добавляли к предыдущей фазе и вновь перемешивали. Длительность перемешивания составила 3 минуты при 20 об/мин.
3. Уплотнение (компактирование) вальцеванием
Вышеуказанную смесь поместили в роликовый пресс (Alexanderwerk WP120), оснащенный вальцами 25 мм. Пресс был запущен в работу согласно нижеприведенным параметрам, использовалась сетка размером 1.6 мм для предварительной грануляции и 0.63 мм - для тонкой грануляции.
| Винтовой питатель, об/мин | 30 |
| Вальцы, об/мин | 5 |
| Тонкий гранулятор, об/мин | 60 |
| Ширина зазора между вальцами | 2 мм |
| Гидравлическое давление | 90 бар |
4. Просеивание экстрагранулярных вспомогательных субстанций
Через сито ASTM#20 просеивали Аэросил
Через сито ASTM#60 просеивали Магния стеарат
5. Смешивание (предварительное смазывание)
В смеситель емкостью 1 л помещали просеянный Аэросил вместе с предварительно уплотненными гранулами. Длительность перемешивания составила 4 мин при 20 об/мин.
Просеянный магния стеарат поместили в вышеупомянутый смеситель.
Смеситель запустили в работу на 2 минуты при 20 об/мин.
Затем на капсуляторе рассыпается в капсулы №3, или №2, или №1, или №0 и капсулируется.
Способ обеспечивает высокую точность заполнения капсул наполнителем (с допуском не превышающим ±3%).
Пример 5
В качестве экспериментальной патоморфологической модели рассеянного склероза в эксперименте применяется аллергический энцефаломиелит (ЭАЭ) (Cross А.Н., Stark J.L. 2005. Humoral immunity in multiple sclerosis an dits animal model, experimental autoimmune encephalomyelitis // Immunol. Res. 32, N 1-3. P. 8598).
Для моделирования аутоиммунного энцефаломиелита у животных приготовляется энцефалитогенная эмульсия (гомогенат гомологичного мозга животных в полном адьюванте Фрейнда), которая вводится в подушечки задних лап морских свинок (Абдурасулова И.Н., Сердюк С.Е., Гмиро В.Е. 2007. // Нейроиммунология. V, N 1. С. 4-10). В настоящее время описано более 20 белков миелина (Baumann, Pham-Dinh, 2001), из которых обладают иммуногенными свойствами и наиболее часто используются для индукции ЭАЭ: основной белок миелина - ОБМ, протеолипидный протеин - ПЛП, гликопротеины: миелин ассоциированный гликопротеин - МАГ и миелин олигодендроцитарный гликопротеин - МОГ, олигодендроцитарный специфический белок - ОСБ. Выявлено, что не только целые белки, но и определенные фрагменты этих белков способны при введении животным вызывать ЭАЭ.
Группа животных №10 - контрольная группа, им вводилась энцефалитогенная эмульсия, без лечения. Животным, составляющим опытные группы, на фоне введения энцефалитогенной эмульсии с первого дня индуцирования патологического процесса, ежедневно, в течение 15 дней перорально вводились физиологический раствор и ГЛС Биотин 300 мг по примеру 1, в пересчете на животный вес, в соответствии с формулой эквивалентные дозы человека (ЭДЧ) - Таблица 1.
Для оценки эффективности терапевтического действия исследуемого препарата на модели ЭАЭ рассчитывали следующие показатели:
1) общее число заболевших животных (в % от числа животных в группе);
2) средний клинический индекс (КИ) на фазе заболевания;
3) количество смертельных случаев.
Показатели сопоставлялись с соответствующими показателями животных контрольной группы (с индуцированным ЭАЭ, но без введения препаратов и с введением физ. раствора).
Результаты развития у животных проявлений аллергического энцефаломиелита приведены в таблице 1 и регистрируют высокую потенциальную клиническую эффективность ГЛС Биотина.
Анализ средних клинических индексов у животных контрольных и опытных групп свидетельствует, что применение ГЛС Биотина уменьшает показатель КИ в 2,0-2,5 раза, т.е. существенно нивелирует развитие клинических симптомов экспериментального аллергического энцефаломиелита у животных.
Существенная разница между опытными и контрольными результатами свидетельствует о выраженном профилактическом эффекте Биотина на развитие аутоиммунного энцефаломиелита при моделировании рассеянного склероза у животных.
Заявленные композиции могут быть применены в качестве лекарственных средств для лечения демиелинизирующих заболеваний, в частности: при диффузном склерозе, оптикомиелите, остром поперечном миелите, острый рассеянный энцефаломиелите и т.п., предпочтительно при лечении рассеянного склероза в медицине.
1. Фармацевтический состав в виде таблетки, содержащий биотин в качестве активного компонента с замедленным высвобождением и вспомогательные вещества, отличающийся тем, что содержит следующие компоненты, масс. %:
| Биотин | 50-60 |
| Стабилизатор | 15-21 |
| Эмульгатор | 6-10 |
| Загуститель | 16.5-17 |
| Связывающее вещество | 1,5-3 |
| Разрыхлитель | 0,4-1 |
| Лубрикант | 0.6-1 |
2. Фармацевтический состав в виде таблетки по п. 1, отличающийся тем, что в качестве вспомогательных веществ содержит смесь Метоцел К100 LV и Метоцел К4М, микрокристаллическую целлюлозу, коповидон, коллоидный диоксид кремния и фармацевтически приемлемую соль стеариновой кислоты при следующем содержании, масс. %:
| Биотин | 50-60 |
| Метоцел (METHOCEL) К100 LV | 15-21 |
| Метоцел (METHOCEL) К4М | 6-10 |
| Микрокристаллическая целлюлоза | 16.5-17 |
| Коповидон | 1,5-3 |
| Коллоидный диоксид кремния | 0,4-1 |
| Фармацевтически приемлемая соль | |
| стеариновой кислоты | 0.6-1 |
3. Фармацевтический состав в виде таблетки, содержащий биотин в качестве активного компонента с замедленным высвобождением и вспомогательные вещества, отличающийся тем, что содержит следующие компоненты, масс. %:
| Биотин | 60 |
| Метоцел (METHOCEL) К100 LV | 14 |
| Метоцел (METHOCEL) К4М | 6 |
| Микрокристаллическая целлюлоза | 17,48 |
| Коповидон | 1,5 |
| Коллоидный диоксид кремния | 0,42 |
| Фармацевтически приемлемая соль | |
| стеариновой кислоты | 0.6 |