Синтез карбамоилпиридоновых ингибиторов интегразы вич и промежуточных соединений
Иллюстрации
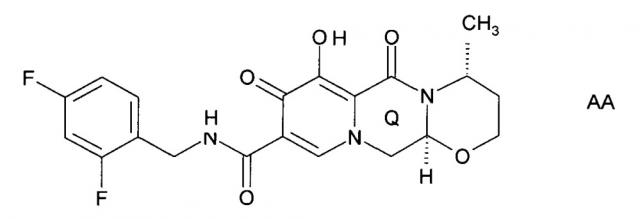
Показать всеИзобретение относится к новым кристаллическим формам натриевой соли или моногидрата натриевой соли соединения общей формулы (АА). Соединение обладает ингибиторной активностью в отношении интегразы ВИЧ. Соединение АА соответствует следующей структурной формуле:
Кристаллическая форма натриевой соли соединения АА имеет (a) характеристические дифракционные пики при углах 2-тета, равных 6,4±0,2°; 9,2±0,2°; 13,8°±0,2°; 19,2±0,2° и 21,8°±0,2°, на картине дифракции рентгеновских лучей на порошке и/или (b) характеристические инфракрасные спектры поглощения при 1641 см-1 ± 2 см-1, 1536 см-1 ± 2 см-1, 1503 см-1 ± 2 см-1 и 1424 см-1 ± 2 см-1 и/или (c) 13С-ЯМР спектры в твердом состоянии, по существу как показано на Фиг. 3. Кристаллическая форма моногидрата натриевой соли соединения АА имеет (d) характеристические дифракционные пики при углах 2-тета, равных 8,0°±0,2°; 9,3°±0,2°; 11,3°±0,2°; 16,0°±0,2° и 22,8°±0,2°, на картине дифракции рентгеновских лучей на порошке и/или (e) характеристические инфракрасные спектры поглощения при 1637 см-1 ± 2 см-1, 1536 см-1 ± 2 см-1, 1501 см-1 ± 2 см-1 и 1422 см-1 ± 2 см-1 и имеет по существу картины дифракции рентгеновских лучей, как показано на Фиг. 4. Изобретение также относится к фармацевтической композиции содержащей указанные кристаллические формы, а также к способу получения кристаллической формы моногидрата натриевой соли соединения АА. Способ включает стадии: а) растворения натриевой соли соединения формулы (АА) в растворе ТГФ (тетрагидрофуран) - вода, б) добавления к полученному раствору водного NaOH, в) перемешивания полученной смеси, г) фильтрования полученного осадка, промывания его раствором ТГФ - вода и ТГФ и сушки. Кристалические формы натриевой соли и ее моногидрата показывают высокую растворимость в воде или физиологическом растворе, обладают высокой биодоступностью, повышенной стабильностью к действию тепла и света и упрощают использование соединения. 3 н. и 10 з.п. ф-лы, 7 ил., 3 пр.
Реферат
Область изобретения
Настоящее изобретение включает модификации известных способов синтеза соединений, обладающих ингибиторной активностью в отношении интегразы ВИЧ.
Предшествующий уровень техники
В публикации международной заявки WO 2006/116764, опубликованной 2 ноября 2006 года, включенной посредством ссылки во всей своей полноте, описаны различные соединения и подробные схемы синтеза их получения. В частности, последовательность реакций показана на странице 79 указанной заявки, где 3-бензилокси-2-метил-1H-пиридин-4-он формулы 3 бромируют до бромпиридина 4, который затем подвергают взаимодействию с метанолом и монооксидом углерода с получением метилового эфира никотиновой кислоты 5, который после нескольких стадий подвергают взаимодействию с бензиламином с образованием пиридина с амид-содержащей боковой цепью 10. Таким образом, амидная боковая цепь находится на месте перед образованием кольца Z1Z2 конечного продукта формулы (I) по реакции, показанной на странице 80, из соединения 16 до соединения 17-1.
Вторая последовательность реакций показана на странице 113 в WO 2006/116764, где пирролидиновому соединению 102 дают возможность конденсации до трициклического соединения 103, которое затем бромируют с получением соединения брома 104, которое затем подвергают взаимодействию с бензиламином с образованием трициклического соединения с амид-содержащей боковой цепью 105. Таким образом, бромирование происходит после образования кольца Z1Z2 конечного продукта формулы (I).
N-Метокси-N-метиламиды могут быть получены посредством Pd-катализируемого аминокарбонилирования арилбромидов, как описано J.R. Martinelli et al in Organic Letters, Vol.8, No.21, pages 4843-4846 (2006). Броманилины и броманизолы превращают в сложные эфиры, как описано J. Albaneze-Walker et al in Organic Letters, Vol.6, No.13, pages 2097-2100 (2004).
Краткое изложение сущности изобретения
Предложены способы, в которых использована ранняя стадия бромирования при получении соединений, полезных как обладающих ингибиторной активностью в отношении интегразы ВИЧ, как изложено в WO 2006/116764. Бромирование обеспечивает уходящую группу для присоединения амидной боковой цепи к пиридоновому кольцу.
Подробное описание изобретения
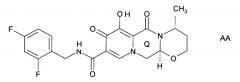
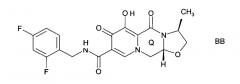
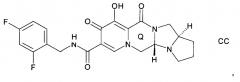
Предложен способ синтеза пиридонового соединения следующей формулы (AA), (BB) или (CC):
включающий стадии:
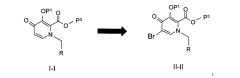
P-1) бромирования соединения следующей формулы (I-I) с получением соединения брома следующей формулы (II-II):
где
R представляет собой -CHO, -СН(OH)2, -CH(OH)(OR4), -СН(OH)-CH2OH или -CH(OR5)(OR6);
Р1 представляет собой H или защитную группу гидроксила;
Р3 представляет собой Н или защитную группу карбоксила;
R4 представляет собой низший алкил;
R5 и R6 независимо представляют собой низший алкил, или R5 и R6 могут представлять собой низший алкил и могут быть соединены с образованием 5-, 6- или 7-членного кольца,
и
Р-2) образования боковой цепи 2,4-ди-фторфенил-СН2-NH-С(O)- с использованием реагентов 2,4-ди-фторфенил-CH2-NH2 и монооксида углерода.
Термин «низший алкил», отдельно или в комбинации с любым другим термином, относится к насыщенному алифатическому углеводородному радикалу с прямой или разветвленной цепью, содержащему от 1 до 6 атомов углерода. Примеры алкильных радикалов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, н-гексил и тому подобное, но не ограничиваются ими.
Термин «низший циклоалкил» относится к насыщенному или частично насыщенному карбоциклическому кольцу, состоящему из 3-6 атомов углерода в любой химически стабильной конфигурации. Примеры подходящих карбоциклических групп включают циклопропил, циклобутил, циклопентил, циклогексил и циклогексенил.
Термин «низший алкенил», отдельно или в комбинации с любым другим термином, относится к алкильной группе с прямой или разветвленной цепью с одной или двумя углерод-углеродными двойными связями. Примеры алкенильных радикалов включают этенил, пропенил, изопропенил, бутенил, изобутенил, пентенил, гексенил, гексадиенил и тому подобное, но не ограничиваются ими.
Термин «низший алкилен» относится к двухвалентному углеводородному радикалу с прямой или разветвленной цепью, предпочтительно имеющему от одного до шести атомов углерода, если не оговорено особо. Примеры «алкилена», как он использован здесь, включают метилен, этилен, пропилен, бутилен, изобутилен и тому подобное, но не ограничиваются ими.
Термин «низший алкенилен» относится к двухвалентному углеводородному радикалу с прямой или разветвленной цепью, имеющему одну или две углерод-углеродные двойные связи.
Термин «низший алкокси» относится к алкиловому эфирному радикалу, где термин «алкил» определен выше. Примеры подходящих алкиловых эфирных радикалов включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси и тому подобное, но не ограничиваются ими.
Термин «галоген» относится к фтору (F), хлору (Cl), брому (Br) или иоду (I),
Термин «арил», отдельно или в комбинации с любым другим термином, относится к карбоциклической ароматической группировке (такой как фенил или нафтил), содержащей 6 атомов углерода, и более предпочтительно от 6-10 атомов углерода. Примеры арильных радикалов включают фенил, нафтил, инденил, азуленил, флуоренил, антраценил, фенантренил, тетрагидронафтил, инданил, фенантридинил и тому подобное, но не ограничиваются ими. Если не оговорено особо, термин «арил» также включает каждый возможный позиционный изомер ароматического углеводородного радикала, такой как 1-нафтил, 2-нафтил, 5-тетрагидронафтил, 6-тетрагидронафтил, 1-фенантридинил, 2-фенантридинил, 3-фенантридинил, 4-фенантридинил, 7-фенантридинил, 8-фенантридинил, 9-фенантридинил и 10-фенантридинил. Примеры арильных радикалов включают фенил, нафтил, инденил, азуленил, флуоренил, антраценил, фенантренил, тетрагидронафтил, инданил, фенантридинил и тому подобное, но не ограничиваются ими. Термин «аралкил» относится к алкильной группе, замещенной арилом. Примеры аралкильных групп включают бензил и фенетил, но не ограничиваются ими.
Термины «гетероциклическая группа» и «гетероцикл», как они использованы здесь, относятся к 3-7-членной моноциклической гетероциклической кольцевой или 8-11-членной бициклической гетероциклической кольцевой системе, любое кольцо которой является насыщенным, частично насыщенным или ненасыщенным, и которая, в случае если она является моноциклической, может быть возможно конденсированной с бензольным кольцом. Каждый гетероцикл состоит из одного или более чем одного атома углерода и от одного до четырех гетероатомов, выбранных из группы, состоящей из N, O и S, и где гетероатомы азота и серы могут быть возможно окисленными, и атом азота может быть возможно четвертичным, и включая любую бициклическую группу, в которой любое из определенных выше гетероциклических колец конденсировано с бензольным кольцом. Гетероциклическое кольцо может быть присоединено по любому атому углерода или гетероатому, при условии, что присоединение приводит к образованию стабильной структуры. Предпочтительные гетероциклы включают 5-7-членные моноциклические гетероциклы и 8-10-членные бициклические гетероциклы. Когда гетероциклическое кольцо имеет заместители, понятно, что заместители могут быть присоединены к любому атому в кольце, будь то гетероатом или атом углерода, при условии, что в результате получается стабильная химическая структура. «Гетероароматические группы» или «гетероарил» включены в гетероциклы, как они определены выше, и обычно относятся к гетероциклу, в котором кольцевая система представляет собой ароматический моноциклический или полициклический кольцевой радикал, содержащий от пяти до двадцати атомов углерода, предпочтительно от пяти до десяти атомов углерода, в котором один или более чем один кольцевой атом углерода, предпочтительно от одного до четырех, каждый замещен гетероатомом, таким как N, О, S и Р. Предпочтительные гетероарильные группы включают 5-6-членные моноциклические гетероарилы и 8-10-членные бициклические гетероарилы. Кроме того, в объем термина «гетероцикл», «гетероциклический» или «гетероциклил» включена группа, в которой неароматическое кольцо, содержащее гетероатом, конденсировано с одним или более чем одним ароматическим кольцом, например как в индолиниле, хроманиле, фенантридиниле или тетрагидрохинолиниле, где радикал или точка присоединения находится в неароматическом кольце, содержащем гетероатом. Если не оговорено особо, термин «гетероцикл», «гетероциклический» или «гетероциклил» также включает каждый возможный позиционный изомер гетероциклического радикала, например как 1-индолинил, 2-индолинил, 3-индолинил. Примеры гетероциклов включают имидазолил, имидазолиноил, имидазолидинил, хинолил, изохинолил, индолил, индазолил, индазолинолил, пергидропиридазил, пиридазил, пиридил, пирролил, пирролинил, пирролидинил, пиразолил, пиразинил, хиноксолил, пиперидинил, пиранил, пиразолинил, пиперазинил, пиримидинил, пиридазинил, морфолинил, тиаморфолинил, фурил, тиенил, триазолил, тиазолил, карболинил, тетразолил, тиазолидинил, бензофураноил, тиаморфолинилсульфон, оксазолил, оксадиазолил, бензоксазолил, оксопиперидинил, оксопирролидинил, оксоазепинил, азепинил, изоксозолил, изотиазолил, фуразанил, тетрагидропиранил, тетрагидрофуранил, тиазолил, тиадиазоил, диоксолил, диоксинил, оксатиолил, бензодиоксолил, дитиолил, тиофенил, тетрагидротиофенил, сульфоланил, диоксанил, диоксоланил, тетрагидрофуродигидрофуранил, тетрагидропиранодигидрофуранил, дигидропиранил, тетрагидрофурофуранил и тетрагидропиранофуранил.
Возможные заместители представляют собой гидрокси, галоген, амино и низший алкил.
Защитные группы могут быть выбраны из групп, известных специалистам в данной области техники, включая защитные группы, раскрытые в Greene, Theodora W.; Wuts, Peter G.M.. Protective Groups in Organic Synthesis. 2nd Ed. (1991), 473 pp. или Kocienski, Philip J. Protecting Groups. 3rd Ed. 2005, (2005), 679 pp.
Пиридоновое кольцо, изображенное в формуле (I-I) и (II-II), то есть к которому непосредственно присоединен -OP1, превращается в формуле AA, BB и CC в кольцо, которое показано соседним с кольцом Q, а именно:
Таким образом, стадия (Р-2) может быть проведена до или после образования кольца Q, и такие стадии образования кольца Q описаны здесь и в WO 2006/1116764.
Согласно настоящему изобретению предложен способ, как описано выше, где указанную стадию (Р-2) проводят до образования кольца Q, и где указанное пиридоновое соединение представляет собой соединение формулы AA, или формулы BB, или формулы CC.
Согласно настоящему изобретению предложен способ, как описано выше, где указанную стадию (Р-2) проводят после образования кольца Q, и где указанное пиридоновое соединение представляет собой соединение формулы АА, или формулы ВВ, или формулы СС.
Согласно настоящему изобретению предложен способ, как описано выше, где указанное пиридоновое соединение представляет собой соединение формулы АА.
Согласно настоящему изобретению предложен способ, как описано выше, где указанное пиридоновое соединение представляет собой соединение формулы ВВ.
Согласно настоящему изобретению предложен способ, как описано выше, где указанное пиридоновое соединение представляет собой соединение формулы СС.
Кроме того, часть настоящего изобретения представляют собой новые промежуточные соединения, такие как соединения следующей ниже формулы (DD):
где Р1 является таким, как описано выше, в частности бензилом.
Предложен способ получения пиридонового соединения следующей формулы (АА), (ВВ) или (СС):
включающий стадии:
Р-1) бромирования соединения следующей формулы (I-I) с получением соединения брома следующей формулы (II-II):
где
R представляет собой -CHO, -СН(OH)2, -CH(OH)(OR4), -СН(OH)-CH2OH или -CH(OR5)(OR6);
P1 представляет собой H или защитную группу гидроксила;
P3 представляет собой H или защитную группу карбоксила;
R4 представляет собой низший алкил;
R5 и R6 независимо представляют собой низший алкил, или R5 и R6 могут представлять собой низший алкил и могут быть соединены с образованием 5-, 6- или 7-членного кольца,
и
Р-2) образования боковой цепи 2,4-ди-фторфенил-CH2-NH-С(O)- с использованием реагентов 2,4-ди-фторфенил-СН2-NH2 и монооксида углерода с получением соединения формулы III-III
Р-3) конденсации и дебензилирования соединения формулы III-III с получением соединения формулы АА, ВВ или СС.
Согласно настоящему изобретению также предложены способы, как описано выше, где P1 представляет собой бензил; P3 представляет собой метил; и R представляет собой -CHO, -CH(OH)(OR4), -CH(OR5)(OR5), где R4 и R5 представляют собой низший алкил.
Кроме того, здесь описан способ получения соединения следующей формулы (I):
где
R представляет собой -CHO, -СН(OH)2 или -CH(OH)(OR4);
Р1 представляет собой Н или защитную группу гидроксила;
Р3 представляет собой Н или защитную группу карбоксила;
R3 представляет собой H, галоген, гидрокси, возможно замещенный низший алкил, возможно замещенный циклоалкил, возможно замещенный низший алкенил, возможно замещенный низший алкокси, возможно замещенный низший алкенилокси, возможно замещенный арил, возможно замещенный арилокси, возможно замещенную гетероциклическую группу, возможно замещенный гетероциклокси и возможно замещенный амино;
R4 представляет собой низший алкил;
Rx представляет собой Н, галогено или R2-X-NR1-C(O)-;
R2 представляет собой возможно замещенный арил;
X представляет собой простую связь, гетероатомную группу, выбранную из О, S, SO, SO2 и NH, или низший алкилен или низший алкенилен, в каждый из которых может быть встроен гетероатом; и
R1 представляет собой Н или низший алкил,
включающий стадии:
1) взаимодействия соединения формулы (II):
с амином формулы (III) или (IV):
где R5 и R6 независимо представляют собой низший алкил, или R5 и R6 могут представлять собой алкил и могут быть соединены с образованием 5-, 6-или 7-членного кольца
с получением промежуточного соединения формулы (V) или (VI), соответственно:
и
2) перефункционализации соединения формулы (V) или (VI) с получением соединения формулы (I).
Конкретные соединения, используемые в этих способах, включают соединения следующих формул (IIa), (VIa), (VIb) и (Ia), использованные в разделе «Примеры» ниже:
Продукт (Ia) последовательности синтеза можно конденсировать с амином, например формулы H2NCH2CH2CH2OH, бромировать, если Rx представляет собой H, карбонилировать и амидировать и, наконец, дебензилировать с получением соединения по WO 2006/116764, обозначенного (I-7) на странице 240, где (R)m представляет собой 4-F, и Ra представляет собой H. Альтернативно, такое соединение может быть синтезировано, начиная с соединения формулы (I), где Rx представляет собой пара-F-фенил-CH2-NH-С(O)-, R3 представляет собой H, P1 представляет собой бензил (Bn), и Р3 представляет собой защитную группу карбоксила.
Более конкретно, стадия (1) может быть проведена в протонном или апротонном растворителе, таком как EtOH, ТГФ (тетрагидрофуран) или ДМФА (диметилформамид), при температуре примерно 50-150°C в течение примерно 1-10 часов.
Более конкретно, стадия (2) может быть проведена для исходного вещества диольного типа (VI) с использованием окислителя, такого как NalO4, RuO4 или Pb(OAc)4, в растворителе, таком как H2O, MeOH или CH3CN, при температуре окружающей среды в течение одного или более чем одного часа. Для исходного вещества ацетального типа, такого как (V), взаимодействие может быть проведено в кислоте, такой как HCl, CF3COOH или HCOH, возможно при нагревании.
Стадия (2) может также включать перефункционализацию по положению Rx, например Rx=H в Rx=Br возможно с последующей перефункционализацией в Rx=R2-X-NR1-C(O)-. Стадия (2) может также включать перефункционализацию Р3, например Р3=H в P3=Me.
Более конкретно, стадия (Р-1) может быть проведена посредством обработки соединения формулы I-I источником брома, включая N-бромсукцинимид или бром, но не ограничиваясь ими, в растворителе, таком как N,N-диметилформамид, ТГФ или уксусная кислота и тому подобное. Это превращение может быть проведено, в частности, при температуре от -10°C до 50°C с получением соединения формулы II-II.
Более конкретно, стадия (Р-2) может быть проведена посредством обработки соединения формулы II-II 2,4-дифторфенил-CH2-NH2, монооксидом углерода, подходящим основанием и источником палладия(О) и, возможно, соответствующим лигандом в инертном растворителе, возможно при нагревании. Монооксид углерода может находиться при атмосферном давлении (14,7 фунт/кв.дюйм (101 кПа)) или при повышенном давлении, в частности в пределах вплоть до 60 фунт/кв.дюйм (413,7 кПа), но в некоторых случаях может потребоваться более высокое давление. Основания включают третичные амины, такие как диизопропилэтиламин и триэтиламин и тому подобное, но не ограничиваются ими. Неорганические основания, такие как ацетат калия и фосфат калия, также имеют важное значение. Подходящие источники Pd(0) включают тетракис(трифенилфосфин)палладий(0), но не ограничиваются им. В некоторых случаях Pd(II) предшественник может быть использован для получения Pd(0) in situ. Подходящие Pd(II) предшественники включают Pd(OAc)2, Pd(OCOCF3)2, но не ограничиваются ими, и лиганды включают Xantphos (9,9-диметил-4,6-бис(дифенилфосфино)ксантен), дифенилфосфиноферроцен (dppf), трифенилфосфин и тому подобное. Растворители включают N,N-диметилформамид, ТГФ, толуол, ДМСО (диметилсульфоксид) и тому подобное. Возможно используют нагревание смеси в пределах от температуры окружающей среды до 150°C.
Согласно настоящему изобретению также предложены кристаллические формы соли соединения формулы АА (соединение 13, пример 1) и ее гидрата. Согласно настоящему изобретению предложены:
1) соль или гидрат соли соединения формулы АА:
2) кристаллическая форма натриевой соли или гидрата натриевой соли соединения формулы АА:
3) кристаллическая форма соединения (2), имеющая одно или более чем одно физическое свойство, выбранное из группы, состоящей из (1) и (2):
1) имеющая характеристические дифракционные пики при углах 2-тета, равных 6,4°±0,2°; 9,2°±0,2°; 13,8°±0,2°; 19,2°±0,2° и 21,8°±0,2°, на картине дифракции рентгеновских лучей на порошке; и
2) имеющая характеристические инфракрасные спектры поглощения при 1641 см-1±2 см-1, 1536 см-1±2 см-1, 1503 см-1±2 см-1 и 1424 см-1±2 см-1;
4) кристаллическая форма соединения (2), имеющая характеристические дифракционные пики при углах 2-тета, равных 6,4°±0,2°; 9,2°±0,2°; 13,8°±0,2°; 19,2°±0,2° и 21,8°±0,2°, на картине дифракции рентгеновских лучей на порошке;
5) кристаллическая форма соединения (2), имеющая характеристические дифракционные пики при углах 2-тета, равных 6,4°±0,2°; 9,2°±0,2°; 13,8°±0,2°; 14,6°±0,2°; 15,2°±0,2°; 17,6°±0,2°; 19,2°±0,2°; 21,8°±0,2°; 24,1°±0,2° и 28,7°±0,2°, на картине дифракции рентгеновских лучей на порошке;
6) кристаллическая форма соединения (2), имеющая характеристические инфракрасные спектры поглощения при 1641 см-1±2 см-1, 1536 см-1±2 см-1, 1503 см-1±2 см-1 и 1424 см-1±2 см-1;
7) кристаллическая форма соединения (2), имеющая характеристические инфракрасные спектры поглощения при 1641 см-1±2 см-1, 1536 см-1±2 см-1, 1503 см-1±2 см-1, 1424 см-1±2 см-1, 1282 см-1±2 см-1, 1258 см-1±2 см-1, 1093 см-1±2 см-1 и 1069 см-1±2 см-1;
8) кристаллическая форма соединения (2), имеющая один или более чем один спектр, выбранный из группы, состоящей из (а)-(с):
a) картины дифракции рентгеновских лучей на порошке, по существу как показано на Фиг.1;
b) инфракрасных спектров поглощения, по существу как показано на Фиг.2; и
c) 13С-ЯМР спектров в твердом состоянии, по существу как показано на Фиг.3.
9) кристаллическая форма соединения (2), имеющая одно или более чем одно физическое свойство, выбранное из группы, состоящей из (3) и (4):
3) имеющая характеристические дифракционные пики при углах 2-тета, равных 8,0°±0,2°; 9,3°±0,2°; 11,3°±0,2°; 16,0°±0,2° и 22,8°±0,2°, на картине дифракции рентгеновских лучей на порошке; и
4) имеющая характеристические инфракрасные спектры поглощения при 1637 см-1+2 см-1, 1536 см-1±2 см-1, 1501 см-1±2 см-1 и 1422 см-1±2 см-1;
10) кристаллическая форма соединения (2), имеющая характеристические дифракционные пики при углах 2-тета, равных 8,0°±0,2°; 9,3°±0,2°; 11,3°±0,2°; 16,0°±0,2° и 22,8°±0,2°, на картине дифракции рентгеновских лучей на порошке;
11) кристаллическая форма соединения (2), имеющая характеристические дифракционные пики при углах 2-тета, равных 8,0°±0,2°; 9,3°±0,2°; 11,3°±0,2°; 15,4°±0,2°; 16,0°±0,2°; 18,7°±0,2°; 19,1°±0,2°; 19,8°±0,2°; 22,8°±0,2° и 26,8°±0,2°, на картине дифракции рентгеновских лучей на порошке;
12) кристаллическая форма соединения (2), имеющая характеристические инфракрасные спектры поглощения при 1637 см-1±2 см-1, 1536 см-1±2 см-1, 1501 см-1±2 см-1 и 1422 см-1±2 см-1;
13) кристаллическая форма соединения (2), имеющая характеристические инфракрасные спектры поглощения при 1637 см-1±2 см-1, 1536 см-1±2 см-1, 1501 см-1±2 см-1, 1422 см-1±2 см-1, 1277 см-1±2 см-1, 1258 см-1±2 см-1, 1093 см-1±2 см-1 и 1069 см-1±2 см-1;
14) кристаллическая форма соединения (2), имеющая один или более чем один спектр, выбранный из группы, состоящей из (d) и (e):
d) картины дифракции рентгеновских лучей на порошке, по существу как показано на Фиг.4; и
e) инфракрасных спектров поглощения, по существу как показано на Фиг.5;
15) фармацевтическая композиция, содержащая кристаллическую форму, как она определена в любом из (2)-(14);
16) способ получения кристаллических форм, как они определены в любом из (2)-(14).
Согласно настоящему изобретению предложены кристаллические формы соли соединения формулы АА, в частности натриевой соли.
Согласно настоящему изобретению предложены кристаллические формы гидрата соли соединения формулы АА, в частности натриевой соли.
Это изобретение также включает кристаллическую форму соединения формулы АА (соединение 12, пример 1). Подробности показаны в подпунктах с (17) по (22):
17) кристаллическая форма соединения формулы АА:
имеющая одно или более чем одно физическое свойство, выбранное из группы, состоящей из (5) и (6):
5) имеющая характеристические дифракционные пики при углах 2-тета, равных 5,4°±0,2°; 10,7°±0,2°; 12,3°±0,2°; 15,2°±0,2° и 16,4°±0,2°, на картине дифракции рентгеновских лучей на порошке; и
6) имеющая характеристические инфракрасные спектры поглощения при 1658 см-1±2 см-1, 1628 см-1±2 см-1, 1540 см-1±2 см-1 и 1498 см-1±2 см-1;
18) кристаллическая форма соединения формулы АА:
имеющая характеристические дифракционные пики при углах 2-тета, равных 5,4°±0,2°; 10,7°±0,2°; 12,3°±0,2°; 15,2°±0,2° и 16,4°±0,2°, на картине дифракции рентгеновских лучей на порошке;
19) кристаллическая форма соединения формулы АА:
имеющая характеристические дифракционные пики при углах 2-тета, равных 5,4°±0,2°; 10,7°±0,2°; 12,3°±0,2°; 14,3°±0,2°; 15,2°±0,2°; 16,4°±0,2°; 21,7°±0,2°; 24,9°±0,2°; 25,4°±0,2° и 27,9°±0,2°, на картине дифракции рентгеновских лучей на порошке;
20) кристаллическая форма соединения формулы АА:
имеющая характеристические инфракрасные спектры поглощения при 1658 см-1±2 см-1, 1628 см-1±2 см-1, 1540 см-1±2 см-1 и 1498 см-1±2 см-1;
21) кристаллическая форма соединения формулы АА:
имеющая характеристические инфракрасные спектры поглощения при 1658 см-1±2 см-1, 1628 см-1±2 см-1, 1540 см-1±2 см-1, 1498 см-1±2 см-1, 1355 см-1±2 см-1, 1264 см-1±2 см-1, 1238 см-1±2 см-1, 1080 см-1±2 см-1 и 1056 см-1±2 см-1;
22) кристаллическая форма соединения формулы АА:
имеющая один или более чем один спектр, выбранный из группы, состоящей из (f) и (g):
f) картины дифракции рентгеновских лучей на порошке, по существу как показано на Фиг.6; и
g) инфракрасных спектров поглощения, по существу как показано на Фиг.7.
Кристаллы соединения 13 и 13b (моногидратная форма соединения 13) демонстрируют высокую растворимость в воде или физиологическом растворе, высокую биодоступность (БД), высокую максимальную концентрацию лекарственного средства (Cmax), короткое время достижения максимальной концентрации лекарственного средства (Tmax), высокую стабильность к действию тепла и света и/или легкость в обращении. Поэтому, кристаллы соединения 13 и 13b подходят в качестве фармацевтических ингредиентов.
В следующих ниже примерах и в этом описании могут быть использованы следующие сокращения: Me (метил), Bn (бензил), водн. (водный), Et (этил), C (по Цельсию).
ПРИМЕРЫ
В следующие примеры, в которых показаны реакции бромирования и амидирования по настоящему изобретению, включены примеры C, пример 2 и пример CC.
Следующие примеры предназначены только для иллюстрации и не предназначены для ограничения объема изобретения.
Примеры 1 и 3
Исходным веществом в примере 1e и 3e является соединение формулы (IIa), которое также показано как соединение 5 ниже и соединение #101 на странице 113 в WO 2006/116764. Продукт, показанный ниже как соединение 8, является соединением формулы (I). Конечный продукт, показанный ниже как соединение 13, является соединением формулы (I-7) на странице 240 в WO 2006/116764, где (R)m представляет собой 2,4-ди-F, и Ra представляет собой H, при условии, однако, что в положении, обозначенном R16 в формуле (XXVI) на странице 65, находится альфа-метил.
Таким образом, в вышеприведенной последовательности по примеру 1, соединение 5 является идентичным соединению 101 на странице 113 в WO 2006/116764 и соединению формулы (IIa) способа по настоящему изобретению; вышеприведенное соединение 6 является идентичным соединению формулы (VIa) способа по настоящему изобретению; вышеприведенное соединение 7 является идентичным соединению формулы (VIb) способа по настоящему изобретению; и соединение 8 является идентичным соединению формулы (Ia) способа по настоящему изобретению. Стадия (1) способа по изобретению включает соединения с 5 по 6, приведенные выше, тогда как стадия (2) включает соединения с 6 по 8.
Пример 1а
К суспензии 2000 г соединения 1 (1,0 экв.) в 14,0 л MeCN добавляли 2848 г бензилбромида (1,05 экв.) и 2630 г K2CO3 (1,2 экв.). Смесь перемешивали при 80°C в течение 5 часов и охлаждали до 13°C. Осадок отфильтровывали и промывали 5,0 л MeCN. Фильтрат концентрировали и к остатку добавляли 3,0 л ТГФ. Этот раствор ТГФ концентрировали с получением 3585 г неочищенного соединения 2 в виде масла. Соединение 2 использовали на следующей стадии без дополнительной очистки.
1H-ЯМР (300 МГц, CDCl3) δ 7.60 (d, J=5,7 Гц, 1Н), 7.4-7.3 (m, 5Н), 6.37 (d, J=5,7 Гц, 1Н), 5.17 (s, 2Н), 2.09 (s, 3Н).
Пример 1b
К 904 г неочищенного соединения 2 добавляли 5,88 л ТГФ и этот раствор охлаждали до -60°C. 5,00 л 1,0 М бис(триметилсилиламида) лития в ТГФ (1,25 экв.) по каплям добавляли в течение 2 часов к раствору соединения 2 при -60°C. Затем добавляли раствор 509 г бензальдегида (1,2 экв.) в 800 мл ТГФ при -60°С, и эту реакционную смесь выдерживали при -60°C в течение 1 часа. Раствор ТГФ выливали в смесь 1,21 л конц. HCl, 8,14 л ледяной воды и 4,52 л EtOAc при температуре ниже 2°C. Органический слой промывали 2,71 л рассола (дважды) и водный слой экстрагировали 3,98 л EtOAc. Объединенные органические слои концентрировали. К смеси добавляли 1,63 л толуола и концентрировали (дважды) с получением толуольной суспензии соединения 3. Фильтрация, промывка 0,90 л холодного толуола и сушка дали 955 г соединения 3 (выход 74% от соединения 1) в виде кристаллического вещества.
1H-ЯМР (300 МГц, CDCl3) δ 7.62 (d, J=5,7 Гц, 1Н), 7.5-7.2 (m, 10Н), 6.38 (d, J=5,7 Гц, 1Н), 5.16 (d, J=11,4 Гц, 1Н), 5.09 (d, J=11,4 Гц, 1Н), 4.95 (dd, J=4,8, 9,0 Гц, 1Н), 3.01 (dd, J=9,0, 14,1 Гц, 1Н), 2.84 (dd, J=4,8, 14,1 Гц, 1Н).
Пример 1c
К раствору 882 г соединения 3 (1,0 экв.) в 8,82 л ТГФ добавляли 416 г Et3N (1,5 экв.) и 408 г метансульфонилхлорида (1,3 экв.) при температуре ниже 30°C. После подтверждения того, что соединение 3 полностью израсходовано, к этой реакционной смеси при температуре ниже 30°C добавляли 440 мл NMP и 1167 г DBU (1,8-диазабицикло[5.4.0]ундец-7-ен) (2,8 экв.) и реакционную смесь выдерживали в течение 30 минут. Смесь нейтрализовали 1,76 л 16% серной кислоты и органический слой промывали 1,76 л 2% водн. Na2SO3. После концентрирования органического слоя добавляли 4,41 л толуола и смесь концентрировали (три раза). После добавления 4,67 л гексана смесь охлаждали на ледяной бане. Фильтрация, промывка 1,77 л гексана и сушка дали 780 г соединения 4 (выход 94%) в виде кристаллического вещества.
1H-ЯМР (300 МГц, CDCl3) δ 7.69 (d, J=5,7 Гц, 1Н), 7.50-7.25 (m, 10Н), 7.22 (d, J=16,2 Гц, 1H), 7.03 (d, J=16,2 Гц, 1H), 6.41 (d, J=5,7 Гц, 1H), 5.27 (s, 2H).
Пример 1d
К смеси 822 г соединения 4 (1,0 экв.) и 11,2 г RuCl3⋅nH2O (0,02 экв.) в 2,47 л MeCN, 2,47 л EtOAc и 2,47 л H2O добавляли 2310 г NalO4 (4,0 экв.) при температуре ниже 25°C. После выдерживания в течение 1 часа к этой смеси при температуре ниже 25°C добавляли 733 г NaClO2 (3,0 экв.). После выдерживания в течение 1 часа осадок отфильтровывали и промывали 8,22 л EtOAc. К фильтрату добавляли 1,64 л 50% водн. Na2S2O3, 822 мл H2O и 630 мл конц. HCl. Водный слой экстрагировали 4,11 л EtOAc и органические слои объединяли и концентрировали. К остатку добавляли 4 л толуола и смесь концентрировали и охлаждали на водяной бане. Фильтрация, промывка 1 л толуола и сушка дали 372 г соединения 5 (выход 56%) в виде кристаллического вещества.
1H-ЯМР (300 МГц, CDCl3) δ 7.78 (d, J=5,7 Гц, 1Н), 7.54-7.46 (m, 2Н), 7.40-7.26 (m, 3Н), 6.48 (d, J=5,7 Гц, 1Н), 5.6 (brs, 1Н), 5.31 (s, 2Н).
Пример 1e
Смесь 509 г соединения 5 (1,0 экв.) и 407 г 3-амино-пропан-1,2-диола (2,5 экв.) в 1,53 л EtOH перемешивали при 65°C в течение 1 часа и при 80°C в течение 6 часов. После добавления 18,8 г 3-амино-пропан-1,2-диола (0,1 экв.) в 200 мл EtOH смесь перемешивали при 80°C в течение 1 часа. После добавления 18,8 г 3-амино-пропан-1,2-диола (0,1 экв.) в 200 мл EtOH смесь перемешивали при 80°C в течение 30 минут. После охлаждения и добавления 509 мл H2O смесь концентрировали. К остатку добавляли 2,54 л H2O и 2,54 л AcOEt. После разделения водный слой промывали 1,02 л EtOAc. К водному слою добавляли 2,03 л 12% серной кислоты при температуре ниже 12°C с получением кристаллического соединения 6. Фильтрация, промывка 1,53 л холодной H2O и сушка дали 576 г соединения 6 (выход 83%) в виде кристаллического вещества.
1H-ЯМР (300 МГц, ДМСО-d6) δ 7.67 (d, J=7,5 Гц, 1Н), 7.5-7.2 (m, 5Н), 6.40 (d, J=7,5 Гц, 1Н), 5.07 (s, 2Н), 4.2-4.0 (m, 1Н), 3.9-3.6 (m, 2Н), 3.38 (dd, J=4,2, 10,8 Гц, 1Н), 3.27 (dd, J=6,0, 10,8 Гц, 1Н).
Пример 1f
К суспензии 576 г соединения 6 (1,0 экв.; содержит 5,8% H2O) в 2,88 л NMP добавляли 431 г NaHCO3 (3,0 экв.) и 160 мл метилиодида (1,5 экв.) и эту смесь перемешивали при комнатной температуре в течение 4 часов. После охлаждения до 5°C к этой смеси при температуре ниже 10°C добавляли 1,71 л 2 н. HCl и 1,15 л 20% водн. NaCl с получением кристаллического соединения 7. Фильтрация, промывка 1,73 л H2O и сушка дали 507 г соединения 7 (выход 89%) в виде кристаллического вещества.
1H-ЯМР (300 МГц, ДМСО-d6) δ 7.59 (d, J=7,5 Гц, 1Н), 7.40-7.28 (m, 5Н), 6.28 (d, J=7,5 Гц, 1Н), 5.21 (d, J=5,4 Гц, 1Н), 5.12 (d, J=10,8 Гц, 1Н), 5.07 (d, J=10,8 Гц, 1Н), 4.83 (t, J=5,7 Гц, 1Н), 3.97 (dd, J=2,4, 14,1 Гц, 1Н), 3.79 (s, 3Н), 3.70 (dd, J=9,0, 14,4 Гц, 1Н), 3.65-3.50 (m, 1Н), 3.40-3.28 (m, 1Н), 3.26-3.14 (m, 1Н).
Пример 1g
К смеси 507 г соединения 7 (1,0 экв.) в 5,07 л MeCN, 5,07 л H2O и 9,13 г AcOH (0,1 экв.) добавляли 390 г NalO4 (1,2 экв.) и эту смесь перемешивали при комнатной температуре в течение 2 часов. После добавления 1,52 л 10% водн. Na2S2O3 смесь концентрировали и охлаждали до 10°C. Фильтрация, промывка H2O и сушка дали 386 г соединения 8 (выход 80%) в виде кристаллического вещества.
1H-ЯМР (300 МГц, ДМСО-d6) δ 7.62 (d, J=7,5 Гц, 1Н), 7.42-7.30 (m, 5Н), 6.33 (d, J=6,0 Гц, 2Н), 6.29 (d, J=7,5 Гц, 1Н), 5.08 (s, 2Н), 4.95-4.85 (m, 1Н), 3.80 (s, 3Н), 3.74 (d, J=5,1 Гц, 2Н).
Пример 1h
После растворения смеси 378 г соединения 8 (1,0 экв.) в 3,78 л MeOH при нагревании этот раствор концентрировали. К остатку добавляли 1,51 л толуола и эту смесь концентрировали. К остатку добавляли 1,89 л толуола, 378 мл AcOH и 137 г (R)-3-амино-бутан-1-ола (1,3 экв.) и эту смесь нагревали до 90°C, перемешивали при 90°C в течение 2,5 часа и концентрировали. К остатку добавляли 1,89 л толуола и смесь концентрировали. Остаток экстрагировали 3,78 л и 1,89 л CHCl3 и промывали 2×1,89 л H2O. Органические слои объединяли и концентрировали. К остатку добавляли 1,89 л EtOAc и эту смесь концентрировали. После добавления 1,89 л EtOAc, фильтрации, промывки 1,13 л EtOAc и сушки получили 335 г соединения 9 (выход 83%) в виде кристаллического вещества.
1H-ЯМР (300 МГц, CDCl3) δ 7.70-7.58 (m, 2Н), 7.40-7.24 (m, 3Н), 7.14 (d, J=7,5 Гц, 2Н), 6.47 (d, J=7,5 Гц, 1Н), 5.35 (d, J=10,2 Гц, 1Н), 5.28 (d, J=10,2 Гц, 1Н), 5.12 (dd, J=3,9, 6,3 Гц, 1Н), 5.05-4.90 (m, 1Н), 4.07 (dd, J=3,9, 13,5 Гц, 1Н), 4.00-3.86 (m, 3Н), 2.23-2.06 (m, 1Н), 1.48 (ddd, J=2,4, 4,5, 13,8 Гц, 1Н), 1.30 (d, J=6,9 Гц, 3Н).
Пример 1i
К суспензии 332 г соединения 9 (1,0 экв.) в 1,66 л NMP добавляли 191 г NBS (N-бромсукцинимид) (1,1 экв.) и эту смесь перемешивали при комнатной температуре в течение 2 часов. После добавления 1,26 л H2O смесь перемешивали в течение 30 минут. После добавления 5,38 л H2O и выдерживания смеси при 10°C в течение 30 минут и при 5°C в течение 1 часа, фильтрации, промывки 1,33 л холодной H2O и сушки получили 362 г соединения 10 (выход 89%) в виде кристаллического вещества.
1H-ЯМР (300 МГц, CDCl3) δ 7.69-7.63 (m, 2Н), 7.59 (s, 1Н), 7.38-7.24 (m, 3Н), 5.33 (d, J=10,2 Гц, 1Н), 5.25 (d, J=9,9 Гц, 1Н), 5.12 (dd, J=3,9, 5,7 Гц, 1Н), 5.05-4.90 (m, 1Н), 4.11 (dd, J=3,9, 13,2 Гц, 1Н), 4.02-3.88 (m, 3Н), 2.21-2.06 (m, 1Н), 1.49 (ddd, J=2,4, 4,5, 14,1 Гц, 1Н), 1.31 (d, J=6,9 Гц, 3Н).
Пример 1j
В атмосфере монооксида углерода смесь 33,5 г соединения 10 (1,0 экв.), 34,8 мл изо-Pr2NEt (2,5 экв.), 14,3 мл 2,4-дифторбензиламина (1,5 экв.) и 4,62 г Pd(PPh3)4 (0,05 экв.) в 335 мл ДМСО перемешивали при 90°C в течение 5,5 часов. После охлаждения осадок отфильтровывали и промывали 50 мл 2-пропанола. После добавления 502 мл H2O и 670 мл AcOEt к фильтрату органический слой промывали 335 мл 0,5 н. водн. HCl и 335 мл H2O и водный слой экстрагировали 335 мл AcOEt. Органические слои объединяли и концентрировали. К остатку добавляли 150 мл 2-пропанола и эту смесь концентрировали. После добавления 150 мл 2-пропанола, концентрирования, охлаждения до 20°C и фильтрации получили неочищенное кристаллическое соединение 11. После растворения неочищенного кристаллического веще