Режим введения для нитрокатехолов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к способу профилактики или лечения расстройства центральной и периферической нервной системы. Способ профилактики или лечения расстройства центральной и периферической нервной системы, включающий введение пациенту, страдающему от указанного расстройства, терапевтически эффективного количества соединения 5-[3-(2,5-дихлор-4,6-диметил-1-оксипиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитробензол-1,2-диол или его фармакологически приемлемых солей, сложных эфиров, карбаматов и фосфатов в комбинации с катехоламиновым лекарственным средством леводопой, где указанное соединение вводят в виде однократной суточной дозы по меньшей мере за час или через час после введения последней суточной дозы леводопы. Способ профилактики или лечения расстройства центральной и периферической нервной системы, включающий введение пациенту, страдающему от указанного расстройства, терапевтически эффективного количества соединения 5-[3-(2,5-дихлор-4,6-диметил-1-оксипиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитробензол-1,2-диол или его фармакологически приемлемых солей, сложных эфиров, карбаматов и фосфатов без пищи и/или между приемами пищи. Способ профилактики или лечения расстройства центральной и периферической нервной системы, включающий введение пациенту, страдающему от указанного расстройства, терапевтически эффективного количества соединения 5-[3-(2,5-дихлор-4,6-диметил-1-оксипиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитробензол-1,2-диол или его фармакологически приемлемых солей, сложных эфиров, карбаматов и фосфатов, в комбинации с катехоламиновым лекарственным средством леводопой, где указанное соединение вводят один раз в сутки по меньшей мере через 1 ч после введения последней суточной дозы леводопы и менее чем за 90 минут перед тем, как лечь в постель, или при наступлении времени сна. Способ профилактики или лечения болезни Паркинсона, включающий введение пациенту, страдающему от указанной болезни, терапевтически эффективного количества соединения 5-[3-(2,5-дихлор-4,6-диметил-1-оксипиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитробензол-1,2-диол или его фармакологически приемлемых солей, сложных эфиров, карбаматов и фосфатов в комбинации с катехоламиновым лекарственным средством леводопой, где указанное соединение вводят один раз в сутки по меньшей мере через 1 ч после введения последней суточной дозы катехоламинового лекарственного средства и менее чем за 90 минут перед тем, как лечь в постель, или при наступлении времени сна и по меньшей мере через 1 ч после последнего приема пищи и по меньшей мере за 1 ч до следующего приема пищи. Вышеописанные способы эффективны для профилактики или лечения расстройства центральной и периферической нервной системы. 4 н. и 15 з.п. ф-лы, 3 ил., 4 табл., 3 пр.
Реферат
Данное изобретение относится к применению замещенных нитрокатехолов формулы (I) в лечении расстройств центральной и периферической нервной системы в соответствии с определенным режимом введения (дозирования).
Основная причина применения ингибиторов СОМТ (катехол-О-метилтрансфераза) как вспомогательных средств к терапии леводопой/ингибитором декарбоксилазы ароматических L-аминокислот (AADCi) основана на их способности уменьшать метаболическое О-метилирование леводопы в 3-O-метил-леводопу (3-OMD). Продолжительность вызванного леводопой клинического улучшения является небольшой вследствие короткого периода полувыведения леводопы in vivo, который резко отличается от длительного периода полувыведения 3-OMD. Кроме того, 3-OMD конкурирует с леводопой за транспорт через гематоэнцефалический барьер (ВВВ), что означает, что только очень ограниченная часть перорально введенной дозы леводопы действительно достигает места действия, то есть мозга. Как правило, в течение всего лишь нескольких лет от начала терапии леводопой в обычном режиме введения, вызванное леводопой клиническое улучшение уменьшается к концу каждого цикла дозировки, приводя к так называемой картине «изнашивания» двигательных флуктуаций. Была описана тесная взаимосвязь между феноменом «изнашивания» и накоплением 3-OMD (Tohgi, Н., et al., Neurosci. Letters, 132:19-22, 1992). Было выдвинуто предположение, что это может происходить в результате нарушения проникновения леводопы в мозг вследствие конкуренции с 3-OMD за систему транспорта через ВВВ (Reches, А. et al., Neurology, 32:887-888, 1982) или, проще говоря, меньше леводопы доступно для того, чтобы достичь мозга (Nutt, J.G., Fellman, J.H., Clin. Neuropharmacol., 7:35-49, 1984). В действительности, ингибирование СОМТ защищает леводопу от метаболического разрушения O-метилированием на периферии и особенно в кишечнике, так что при повторных введениях доз леводопы средняя концентрация леводопы в плазме повышается. Дополнительно к уменьшению конкуренции за транспорт в мозг значительно более высокий процент от перорально введенной дозы леводопы получает возможность достичь места действия. Таким образом, ингибирование СОМТ служит для повышения биодоступности леводопы, и продолжительность антипаркинсонического действия увеличивается при однократных введениях леводопы (Nutt, J.G., Lancet, 351:1221-1222, 1998).
Наиболее мощными ингибиторами СОМТ, о которых сообщалось до сих пор, являются 3,4-дигидрокси-4'-метил-5-нитробензофенон (Толкапон, патент Австралии AU-B-69764/87) и (E)-2-циано-N,N-диэтил-3-(3,4-дигидрокси-5-нитрофенил)акриламид (Энтакапон, патент Германии DE 3740383 A1).
Несмотря на то что они имеют по существу одинаковый фармакофор, толкапон отличается от энтакапона тем, что он легко проникает в центральную нервную систему (CNS) и способен ингибировать как мозговую СОМТ, так и периферическую СОМТ. Вскоре после его выхода на рынок толкапон был изъят с рынка после того, как появились сообщения о нескольких случаях гепатотоксичности, включая три несчастных случая гибели от молниеносного гепатита с летальным исходом. Сегодня толкапон может применяться только у пациентов с болезнью Паркинсона, невосприимчивых к другим способам лечения и только при регулярном мониторинге функции печени, что дорого и неудобно для пациента. Хотя действительные механистические причины печеночной токсичности, связанной с толкапоном, неполностью понятны, исследования in vitro показали, что толкапон может метаболически восстанавливаться в активные промежуточные соединения, и было выдвинуто предположение, что они могут образовывать ковалентные аддукты с белками печени, приводя к повреждению клеток печени (Smith, K.S. et al, Chem. Res. Toxicol., 16:123-128, 2003).
Энтакапон, с другой стороны, хотя и имеет такой же нитрокатехоловый фармакофор, как и толкапон, не связан с печеночной токсичностью и обычно рассматривается как безопасное лекарственное средство. К сожалению, однако, энтакапон является значительно менее мощным ингибитором СОМТ, чем толкапон, и имеет гораздо более короткий период полувыведения in vivo. Это означает, что энтакапон оказывает очень ограниченный по продолжительности эффект и, как следствие, лекарственное средство должно быть введено в очень высоких дозах с каждой дозой леводопы, принимаемой пациентом. Как таковая, клиническая эффективность энтакапона была поставлена под вопрос, действительно, в недавнем исследовании (Parashos, S.A. et al., Clin. Neuropharmacol., 27(3): 119-123, 2004) было выявлено, что основная причина прекращения лечения энтакапоном пациентов с болезнью Паркинсона заключалась в ощутимом недостатке эффективности.
Более того, относительно короткий период полувыведения in vivo известных ингибиторов СОМТ требует длительных режимов лечения, обычно включающих введение нескольких доз в сутки, что многие пациенты сочтут обременительным. Например, толкапон должен быть введен три раза в сутки. Поэтому этот фактор может помешать соблюдению пациентом режима и схемы лечения и нанести ущерб качеству жизни пациента.
Соответственно, все еще существует потребность в ингибиторах СОМТ, проявляющих сбалансированные свойства биоактивности, биодоступности и безопасности. В частности, существует потребность в ингибиторах СОМТ, имеющих большую продолжительность периода полувыведения in vivo и, следовательно, продолжительное действие на СОМТ, позволяя меньшим количеством доз достичь желаемого терапевтического эффекта.
Заявитель ранее обнаружил соединения, которые, несмотря на то, что они имеют относительно короткий период полувыведения, являются очень мощными ингибиторами СОМТ, обладающими исключительно большой продолжительностью действия по сравнению с ингибиторами СОМТ из предшествующего уровня техники (см. WO 2007/013830).
Эти соединения, которые показаны ниже как соединения общей формулы (I), также заметно увеличивают биодоступность леводопы и увеличивают доставку леводопы к мозгу. Эти соединения значительно повышают уровни дофамина в мозге на продолжительный период времени.
Еще более удивительно то, что повышенные уровни леводопы сохраняются стабильными в течение продолжительных периодов времени. Эти устойчивые эффекты на активность СОМТ и на биодоступность леводопы после введения соединений общей формулы (I) заметно более сильны, чем эффекты, наблюдаемые для толкапона, единственного ингибитора СОМТ, для которого к настоящему времени известно, что он обладает относительно большой продолжительностью действия (толкапон имеет конечный период полувыведения примерно 2 ч и должен быть введен примерно 3 раза в сутки.) Более того, соединения общей формулы (I) дают стабильное увеличение доставки леводопы к мозгу на протяжении длительных периодов времени, что резко отличается от того, что наблюдается для толкапона, который склонен вызывать заметные колебания в доставке леводопы в мозг. Таким образом, более вероятно, что соединения общей формулы (I) будут обладать терапевтическими преимуществами вследствие устойчивого постоянного повышения уровней леводопы, в то время как вероятно, что применение толкапона вызывает нежелательные побочные эффекты, такие как дискинезия, вследствие резких повышений и понижений уровней леводопы.
Настоящее изобретение основано на режиме введения, обладающем неожиданными преимуществами для введения соединений формулы (I), который максимально увеличивает ингибиторный эффект данных соединений в отношении СОМТ.
Соответственно, в первом аспекте настоящее изобретение относится к соединению формулы (I)
где R1 и R2 одинаковые или разные и обозначают атомы водорода, группы, гидролизуемые при физиологических условиях, или возможно замещенные алканоилы или ароилы; X обозначает метиленовую группу; Y представляет собой O, S или NH; n равно 0, 1, 2 или 3; m равно 0 или 1; R3 обозначает пиридиновую N-оксидную группу формулы A, B или C, которая присоединена, как обозначено "открытой" связью:
где R4, R5, R6 и R7 одинаковые или разные и обозначают водород, алкил, тиоалкил, алкокси, арилокси, тиоарил, алканоил, ароил, арил, амино, алкиламино, диалкиламино, циклоалкиламино, гетероциклоалкиламино, алкилсульфонил, арилсульфонил, галоген, галогеналкил, трифторметил, циано, нитро или гетероарил; или два или более чем два из R4, R5, R6 и R7 вместе взятые обозначают алифатические или гетероалифатические кольца или ароматические или гетероароматические кольца; термин "алкил", включая его вариант "алк-" в таких терминах, как "алкокси", "алканоил", обозначает углеродные остатки, прямые или разветвленные, содержащие от одного до шести атомов углерода; термин "арил" обозначает фенильную или нафтильную группу; термин "гетероциклоалкил" обозначает циклическое кольцо, от четырехчленного до восьмичленного, возможно включающее по меньшей мере один атом кислорода, серы или азота; термин "гетероарил" обозначает пятичленное или шестичленное кольцо, включающее по меньшей мере один атом серы, кислорода или азота; термин "галоген" обозначает фтор, хлор, бром или йод; и если R4, R5, R6 и R7 обозначают алкил или арил, они возможно замещены одной или более чем одной группой гидрокси, алкокси или галоген; или его фармацевтически приемлемой соли, сложному эфиру, карбамату или фосфату, для применения в профилактике или лечении расстройства центральной и периферической нервной системы, где соединение формулы (I) вводят до сна, до наступления времени сна или при наступлении времени сна.
Во втором аспекте настоящее изобретение относится к соединению формулы (I)
где R1 и R2 одинаковые или разные и обозначают атомы водорода, группы, гидролизуемые при физиологических условиях, или возможно замещенные алканоилы или ароилы; X обозначает метиленовую группу; Y представляет собой O, S или NH; n равно 0, 1, 2 или 3; m равно 0 или 1; R3 обозначает пиридиновую N-оксидную группу формулы A, B или C, которая присоединена, как обозначено, "открытой" связью:
где R4, R5, R6 и R7 одинаковые или разные и обозначают водород, алкил, тиоалкил, алкокси, арилокси, тиоарил, алканоил, ароил, арил, амино, алкиламино, диалкиламино, циклоалкиламино, гетероциклоалкиламино, алкилсульфонил, арилсульфонил, галоген, галогеналкил, трифторметил, циано, нитро или гетероарил; или два или более чем два из R4, R5, R6 и R7 вместе взятые обозначают алифатические или гетероалифатические кольца или ароматические или гетероароматические кольца; термин "алкил", включая его вариант "алк-" в таких терминах, как "алкокси", "алканоил", обозначает углеродные остатки, прямые или разветвленные, содержащие от одного до шести атомов углерода; термин "арил" обозначает фенильную или нафтильную группу; термин "гетероциклоалкил" обозначает циклическое кольцо, от четырехчленного до восьмичленного, возможно включающее по меньшей мере один атом кислорода, серы или азота; термин "гетероарил" обозначает пятичленное или шестичленное кольцо, включающее по меньшей мере один атом серы, кислорода или азота; термин "галоген" обозначает фтор, хлор, бром или йод; и если R4, R5, R6 и R7 обозначают алкил или арил, они возможно замещены одной или более чем одной группой гидрокси, алкокси или галоген; или его фармацевтически приемлемой соли, сложному эфиру, карбамату или фосфату для применения в профилактике или лечении расстройства центральной и периферической нервной системы, где соединение формулы (I) вводят без пищи и/или между приемами пищи.
В третьем аспекте изобретение предусматривает применение соединения формулы (I) для изготовления лекарственного средства для применения в профилактике или лечении расстройства центральной и периферической нервной системы, где указанное соединение вводят без пищи, между приемами пищи, до сна, до наступления времени сна и/или при наступлении времени сна.
В четвертом аспекте изобретение предусматривает способ профилактики или лечения расстройства центральной и периферической нервной системы, включающий введение пациенту, страдающему от указанного заболевания, терапевтически эффективного количества соединения формулы (I) без пищи, между приемами пищи, до сна, до наступления времени сна и/или при наступлении времени сна.
Неожиданно заявитель обнаружил преимущество введения соединений формулы (I) пациенту, пищеварительная система которого не содержит пищи в той степени, насколько это возможно. Следовательно, соединения формулы (I) предпочтительно следует вводить пациенту без пищи и/или между приемами пищи, например между приемами пищи, перед сном, до наступления времени сна или при наступлении времени сна. Введение соединения таким образом приводит к улучшению активности соединений формулы (I), например более продолжительному и усиленному ингибированию СОМТ.
Далее, как упоминается, ингибиторы СОМТ формулы (I) применяются как вспомогательное средство в терапии катехоламинами с тем, чтобы снизить метаболизм катехоламинового лекарственного средства, вызванный СОМТ. Заявитель также неожиданно обнаружил, что, когда соединение формулы (I) вводят пациенту, уже принимающему катехоламин, такой как леводопа (L-DOPA), эффекты соединения формулы (I) улучшаются, если соединение формулы (I) вводят последовательно с катехоламином. В частности, неожиданно было обнаружено, что соединение формулы (I) неблагоприятно воздействует на биодоступность леводопы, и леводопа неблагоприятно воздействует на биодоступность соединения формулы (I). Следовательно, согласно изобретению соединение формулы (I) вводят перед сном, до наступления времени сна или при наступлении времени сна, до или после того как пациенту была дана последняя суточная доза леводопы и перед введением дозы леводопы следующих суток. Следовательно, соединение формулы (I) и катехоламиновое лекарственное средство не находятся одновременно в пищеварительной системе пациента и/или по существу не всасываются в одно и то же время.
Для целей данного изобретения, термины "последняя суточная доза", "последняя доза суток", "последнее суточное введение" и "последнее введение суток" имеют одинаковое значение и могут использоваться взаимозаменяемо.
Далее настоящее изобретение описано со ссылками на сопровождающие графические материалы.
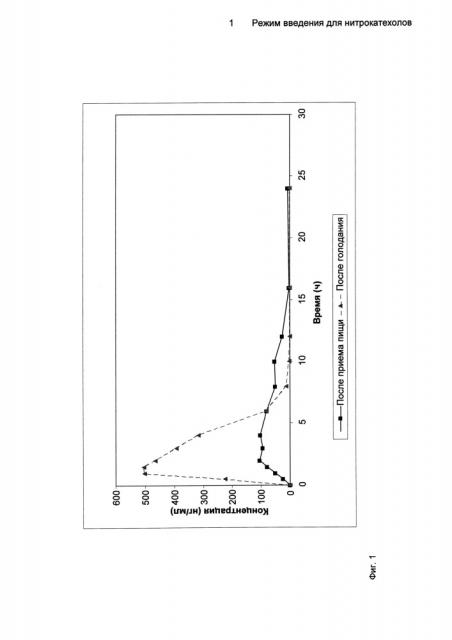
На Фиг.1 показан профиль зависимости средних концентраций 5-[3-(2,5-дихлор-4,6-диметил-1-оксипиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитробензол-1,2-диола (Соединение A) в плазме от времени в условиях голодания и приема пищи.
На Фиг.2 показаны профили зависимости средних концентраций леводопы в плазме от времени после однократного перорального введения 100/25 мг только Sinemet® (леводопа/карбидопа), 100/25 мг Sinemet®, введенного с 50 мг Соединения A с интервалом в 1 ч и введенного совместно с 50 мг Соединения A.
На Фиг.3 показаны профили средней активности S-COMT (образованный метанефрин, пмоль/мг белка/ч) от базового уровня (до введения дозы): после однократного перорального введения 100/25 мг только Sinemet®, 100/25 мг Sinemet®, введенного с 50 мг Соединения A с интервалом в 1 ч и введенного совместно с 50 мг Соединения A и после введения только Соединения A.
Как упоминалось, из-за того, что соединения формулы (I) являются очень мощными, они потенциально могут быть введены в виде однократной суточной дозы.
Соединения формулы (I) предпочтительно вводят перед сном, до наступления времени сна или при наступлении времени сна. Термин "перед сном" означает, что соединение формулы (I) вводят незадолго перед тем, как пациент ложится спать, например менее чем за 90 мин до сна, в частности менее чем за 1 ч до сна, менее чем за 30 мин до сна или непосредственно перед сном.
Термин "до наступления времени сна" (то есть перед тем, как лечь в постель) означает, в частности, менее чем за 90 мин до того, как лечь в постель, в частности менее чем за 60 мин до того, как лечь в постель, или менее чем за 30 мин до того, как лечь в постель. Термин "при наступлении времени сна" означает менее чем за 5 мин до наступления времени сна, например во время укладывания в постель.
Другими словами, пациент принимает соединение формулы (I) до того, как пациент ложится в постель (то есть до наступления времени сна или при наступлении времени сна), например менее чем за 90 мин до наступления времени сна, в частности менее чем за 60 мин до наступления времени сна, менее чем за 30 мин до наступления времени сна или менее чем за 5 мин до наступления времени сна.
Как будет ясно, в контексте данного изобретения, термин "перед сном" или "до наступления времени сна" не означает любое время дня перед сном или перед тем, как лечь в постель, и в частности не включает, например, 12 ч до сна или до того как лечь в постель. Скорее этот термин означает, что лекарственное средство принимают в период, близкий к тому, когда пациент ложится спать и, вероятно, как часть рутинной подготовки пациента ко сну.
В одном воплощении соединение формулы (I) вводят в форме комбинированной терапии с катехоламиновым лекарственным средством. Предпочтительно катехоламиновое лекарственное средство представляет собой леводопу.
Как таковые, режимы введения соединения формулы (I) и катехоламинового лекарственного средства могут различаться: каждый может быть введен в одно и то же время или в разное время. Поэтому будет ценным то, что соединения комбинации могут быть введены последовательно (например, до или после) или совместно - либо в одной и той же фармацевтической композиции (то есть вместе), либо в различных фармацевтических композициях (то есть раздельно). Одновременно в одной и той же композиции значит в единой композиции, в то время как одновременно в разных фармацевтических композициях значит не в единой. Режим введения каждого из двух или более чем двух соединений в комбинированной терапии также может отличаться в отношении пути введения.
Заявитель неожиданно обнаружил, что соединения формулы (I) и катехоламиновое лекарственное средство оказывают неблагоприятный эффект на биодоступность друг друга.
В частности, соединения формулы (I) вводят перед сном, до наступления времени сна или при наступлении времени сна, до или после последнего введения суток катехоламинового лекарственного средства и до первого введения катехоламинового лекарственного средства следующих суток. Следовательно, это позволяет избежать негативных последствий, которые каждое лекарственное средство оказывает на биодоступность другого. Предпочтительно, ингибиторная активность соединений формулы (I) в отношении СОМТ имеет место до введения катехоламинового лекарственного средства.
В одном воплощении соединение формулы (I) вводят за 30-150 мин до последнего суточного введения катехоламинового лекарственного средства или через 30-150 мин после последнего суточного введения катехоламинового лекарственного средства. Например, соединение формулы (I) вводят по меньшей мере за 30-50 мин, предпочтительно по меньшей мере за 1 ч, до последнего суточного введения катехоламинового лекарственного средства или через 30-50 мин, предпочтительно по меньшей мере через 1 ч после последнего суточного введения катехоламинового лекарственного средства.
В другом воплощении соединение формулы (I) вводят по меньшей мере за 1 ч до или через 1 ч после последнего суточного введения катехоламинового лекарственного средства, и предпочтительно соединение формулы (I) вводят один раз в сутки по меньшей мере за 1 ч до последнего суточного введения катехоламинового лекарственного средства или через 1 ч после последнего суточного введения катехоламинового лекарственного средства. В воплощениях изобретения рассматривают период по меньшей мере два, три, четыре, пять или шесть часов между введением катехоламина и соединений формулы (I).
Предпочтительно, при последовательном введении катехоламин вводят по меньшей мере через два, более предпочтительно через три и наиболее предпочтительно через по меньшей мере шесть часов после введения соединения формулы (I). Соответствующим образом, при последовательном введении катехоламин вводят через 12 ч или 23 ч после введения соединения формулы (I). Предпочтительно, последовательное введение катехоламинового лекарственного средства представляет собой первую суточную дозу катехоламинового лекарственного средства следующих суток.
Дополнительно, режим введения согласно изобретению включает введение соединения формулы (I), когда пищеварительная система пациента не содержит пищи. Заявитель обнаружил, что соединения формулы (I) имеют улучшенную биодоступность при введении пациенту, когда в пищеварительной системе пациента отсутствует пища. В частности, соединение формулы (I) следует вводить пациенту до сна, до наступления времени сна или при наступлении времени сна без пищи, после последнего на данные сутки приема пищи пациентом.
Термин "пищеварительная система не содержит пищи" означает, что часть пищеварительной системы, где происходит большая часть всасывания соединения формулы (I), например желудок, тонкая кишка (двенадцатиперстная кишка, тощая кишка, подвздошная кишка), не содержит пищи.
В одном воплощении изобретения соединение формулы (I) вводят по меньшей мере через 1 ч после последнего приема пищи и по меньшей мере за 1 ч до следующего приема пищи.
В одном воплощении изобретения соединение формулы (I) вводят через 0,25-12 ч, предпочтительно через 0,5-6 ч, более предпочтительно через 0,75-4 ч после приема пищи. В одном воплощении изобретения соединение формулы (I) вводят после 0,25-10 ч ночного голодания.
В одном воплощении изобретения соединение формулы (I) вводят за 0,25-2 ч до приема пищи, предпочтительно за 0,5-1,5 ч до приема пищи.
Предпочтительно соединение формулы (I) вводят до сна и более предпочтительно менее чем за 1 ч до сна.
Наиболее предпочтительно, с целью избежать взаимодействия между соединением формулы (I) и катехоламиновым лекарственным средством и также для введения соединения формулы (I) в условиях, когда пищеварительная система пациента не содержит пищи, соединение формулы (I) вводят один раз в сутки до сна, до наступления времени сна или при наступлении времени сна.
Как он используется здесь, термин «эффективная суточная доза» обозначает эффективное суточное количество введенного соединения, которое вводят в соответствии с периодичностью дозировки.
В настоящем изобретении эффективные суточные дозы соединений общей формулы (I) находятся в пределах от примерно 1 до примерно 1200 мг/сутки, предпочтительно от примерно 1 до примерно 900 мг/сутки, более предпочтительно от примерно 5 до примерно 400 мг/сутки, еще более предпочтительно от примерно 25 до примерно 300 мг/сутки, например конкретные суточные дозы в 1 мг, 3 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 50 мг, 100 мг, 200 мг, 400 мг, 800 мг или 1200 мг.
Как он используется здесь, термин «единица дозировки» относится к количеству соединения, введенного в каждом введении периодичности дозировки.
Предпочтительно, чтобы индивидуальные единицы дозировки соединений общей формулы (I) находились в пределах от примерно 1 до примерно 2400 мг, более предпочтительно от примерно 1 до примерно 1200 мг, еще более предпочтительно от примерно 1 до примерно 800 мг, например 1 мг, 3 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 50 мг, 100 мг, 200 мг, 400 мг, 800 мг или 1200 мг.
Как упоминалось выше, ингибиторы СОМТ часто применяются как вспомогательные средства к катехоламиновым соединениям, потому что они уменьшают их метаболическое О-метилирование. В частности, ингибиторы СОМТ часто применяются как вспомогательные средства к терапии леводопой/ингибитором декарбоксилазы ароматических L-аминокислот (AADCi), потому что они уменьшают метаболическое О-метилирование леводопы в 3-О-метил-леводопу (3-OMD).
Поэтому предпочтительно, чтобы патологические состояния, которые лечат этими соединениями, представляли собой расстройства, связанные с центральной и периферической нервной системой человека, на которые введение ингибитора СОМТ оказывает благоприятное воздействие.
Когда соединение формулы (I) вводят в комбинации с катехоламиновым лекарственным средством, возможно, что катехоламиновое лекарственное средство вводят последовательно или совместно с AADCi, в частности кардидопой или бенсеразидом.
Соединения общей формулы (I), катехоламиновое лекарственное средство и AADCi могут быть введены раздельно или в любой комбинации. Они могут быть введены совместно (например, одновременно) или последовательно и с одинаковой или разной периодичностью дозировки. Например, соединения общей формулы (I) можно вводить совместно или последовательно с катехоламиновым лекарственным средством.
Применение соединений согласно изобретению предназначено для профилактики или лечения расстройств центральной и периферической нервной системы. Расстройство центральной и периферической нервной системы представляет собой, например, аффективное расстройство, желудочно-кишечное расстройство, состояние формирования отека, гипертензию или двигательное расстройство. Предпочтительно, расстройства представляют собой двигательные расстройства, включая расстройства, включающие паркинсонизм, болезнь Паркинсона и синдром беспокойных ног. Наиболее предпочтительное расстройство центральной и периферической нервной системы представляет собой болезнь Паркинсона.
Как он используется здесь, термин "лечение" и такие его вариации, как "лечить" и "процесс лечения", относятся к любому режиму, который может быть благоприятным для человека или животного, не являющегося человеком. Дополнительно соединения формулы (I) можно применять для профилактики (профилактического лечения). Лечение может включать лечебное, облегчающее или ослабляющее симптомы действие, такие действия, относящиеся к одному или более чем одному симптому, связанному с расстройствами центральной и периферической нервной системы.
Одно конкретное воплощение изобретения, которое можно упомянуть, представляет собой соединение формулы (I), в частности 5-[3-(2,5-дихлор-4,6-диметил-1-оксипиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-3-нитробензол-1,2-диол и его фармакологически приемлемые соли, сложные эфиры, карбаматы и фосфаты, для применения в комбинации с катехоламиновым лекарственным средством, в частности леводопой, для профилактики или лечения расстройства центральной и периферической нервной системы, особенно двигательного расстройства, такого как болезнь Паркинсона, где соединение формулы (I) вводят перорально один раз в сутки по меньшей мере за 1 ч до приема последней суточной дозы катехоламинового лекарственного средства или через 1 ч после приема последней суточной дозы катехоламинового лекарственного средства и до сна, до наступления времени сна или при наступлении времени сна и/или без пищи, и/или между приемами пищи, и/или по меньшей мере через 1 ч после последнего приема пищи и по меньшей мере за 1 ч до следующего приема пищи.
Согласно другому аспекту данного изобретения предложен способ лечения по меньшей мере одного патологического состояния у пациента, нуждающегося в этом, включающий введение пациенту фармакологически эффективной дозы соединения общей формулы (I), как определено выше, без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Согласно другому аспекту данного изобретения предложен способ ингибирования СОМТ у субъекта, включающий введение субъекту эффективной дозы соединения общей формулы (I), как определено выше, без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Согласно другому аспекту данного изобретения предложен способ повышения уровней леводопы в мозге субъекта, которого лечат леводопой, включающий введение субъекту эффективной дозы соединения общей формулы (I), как определено выше, без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Согласно другому аспекту данного изобретения предложен способ повышения уровней леводопы в плазме субъекта, которого лечат леводопой, включающий введение субъекту эффективной дозы соединения общей формулы (I), как определено выше, без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Согласно другому аспекту данного изобретения предложен способ понижения уровней 3-О-метил-леводопы (3-OMD) в мозге субъекта, которого лечат леводопой, включающий введение субъекту эффективной дозы соединения общей формулы (I), как определено выше, без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Согласно другому аспекту данного изобретения предложен способ понижения уровней 3-OMD в плазме субъекта, которого лечат леводопой, включающий введение субъекту эффективной дозы соединения общей формулы (I), как определено выше, без пищи и/или между приемами пищи и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Согласно другому аспекту данного изобретения предложен способ увеличения биодоступности леводопы в мозге субъекта, которого лечат леводопой, включающий введение субъекту эффективной дозы соединения общей формулы (I), как определено выше, без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Согласно другому аспекту данного изобретения предложен способ увеличения биодоступности леводопы в плазме субъекта, которого лечат леводопой, включающий введение субъекту эффективной дозы соединения общей формулы (I), как определено выше, без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Настоящее изобретение также относится к упаковке, включающей фармацевтическую композицию соединения общей формулы (I) в комбинации с инструкциями по введению указанной композиции без пищи, и/или между приемами пищи, и/или до сна, и/или до наступления времени сна, и/или при наступлении времени сна, и/или до или после введения катехоламинового лекарственного средства.
Для соединений формулы (I) предпочтительны следующие определения. Группы, гидролизуемые при физиологических условиях, представляют собой группы, расщепляемые in vivo при физиологических значениях pH и температуры. На странице 1354 6-го издания "Foye's Principles of Medicinal Chemistry", 2006, изд. Wolter Kluwer, указаны величины pH для тканевых жидкостей. Примерами групп, гидролизуемых при физиологических условиях, до функциональной группы –OH, являются сложные эфиры, карбаматы и фосфаты. Другие примеры групп, гидролизуемых при физиологических условиях до функциональной группы -OH хорошо известны специалисту в данной области и могут быть найдены, например, на страницах 101-103 Korolkovas, "Essentials of Medicinal Chemistry", 2-е издание, 1988, изд. John Wiley & Sons и на странице 426 Krogsgaard-larsen и др., "Textbook of Drug Design and Discovery", 3-е издание, 2002, изд. Taylor & Francis.
Предпочтительно, R4, R5, R6 и R7 независимо друг от друга представляют собой водород, C1-С6алкил, C6-C12арил, C1-C6тиоалкил, C1-C6алкокси, C6-C10арилокси, C6-C10тиоарил, C1-C6алканоил, C7-C11ароил, амино, C1-C6алкиламино, ди-C1-C6алкиламино, C3-C12циклоалкиламино, C4-C8гетероциклоалкиламино, C1-C6алкилсульфонил, C6-C10арилсульфонил, галоген, C1-C6галогеналкил, трифторметил, циано, нитро или гетероарил.
Когда R4, R5, R6 и/или R7 представляют собой C1-C6алкильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил или гексил.
Когда R4, R5, R6 и/или R7 представляют собой C6-C12арильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой фенил или нафтил.
Когда R4, R5, R6 и/или R7 представляют собой C1-C6тиоалкильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой тиометил, тиоэтил, тио-н-пропил, тио-изопропил, тио-н-бутил, тио-н-пентил или тио-н-гексил.
Когда R4, R5, R6 и/или R7 представляют собой C1-C6алкокси-остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси или трет-бутокси.
Когда R4, R5, R6 и/или R7 представляют собой C6-C10арилокси-остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой фенокси или нафтокси.
Когда R4, R5, R6 и/или R7 представляют собой C6-C10тиоарильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой тиофенил или тионафтил.
Когда R4, R5, R6 и/или R7 представляют собой C1-C6алканоильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой метаноил, этаноил, пропаноил или бутаноил.
Когда R4, R5, R6 и/или R7 представляют собой C7-C11ароильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой бензоил или нафтоил.
Когда R4, R5, R6 и/или R7 представляют собой C1-C6-алкиламино-остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой метиламино, этиламино, н-пропиламино, изопропиламино или н-бутиламино.
Когда R4, R5, R6 и/или R7 представляют собой ди-C1-C6алкиламино-остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой диметиламино, диэтиламино, ди-н-пропиламино, ди-н-бутиламино, диизопропиламино, метилэтиламино, метилпропиламино или этилпропиламино.
Когда R4, R5, R6 и/или R7 представляют собой C3-C12циклоалкиламино-остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой пирролидино, пиперидино, циклогексиламино или дициклогексиламино.
Когда R4, R5, R6 и/или R7 представляют собой C4-C8гетероциклоалкиламино-остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой морфолино, 2,6-диметилморфолино, 3,5-диметилморфолино, пиперазино, N-метилпиперазино или N-этилпиперазино.
Когда R4, R5, R6 и/или R7 представляют собой C1-C6алкилсульфонильные или C6-C10-арилсульфонильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой метилсульфонил, этилсульфонил, фенилсульфонил или толилсульфонил.
Когда R4, R5, R6 и/или R7 представляют собой галогеновые остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой хлор, бром, йод или фтор.
Когда R4, R5, R6 и/или R7 представляют собой C1-C6галогеналкильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой хлорметил, фторметил, дихлорметил, дифторметил, трихлорметил или трифторметил.
Когда R4, R5, R6 и/или R7 представляют собой гетероарильные остатки, предпочтительно R4, R5, R6 и/или R7 представляют собой пиридил, пиримидил, изоксазолил, оксазолил, изоксадиа