Способ получения 17,17-этилендиоксиандроста-1,4-диен-3-она
Иллюстрации
Показать всеПредложен усовершенствованный способ получения известного соединения ряда андростана, 17,17-этилендиоксиандроста-1,4-диен-3-она. Технический результат: разработан новый усовершенствованный способ, который осуществляется взаимодействием андроста-1,4-диен-3,17-диона с этиленгликолем в гетерогенной среде в присутствии триалкилортоформиата и арилсульфокислоты с последующим выделением целевого продукта путем фильтрации непосредственно из предварительно нейтрализованной реакционной массы. 1 з.п. ф-лы, 1 табл.
Реферат
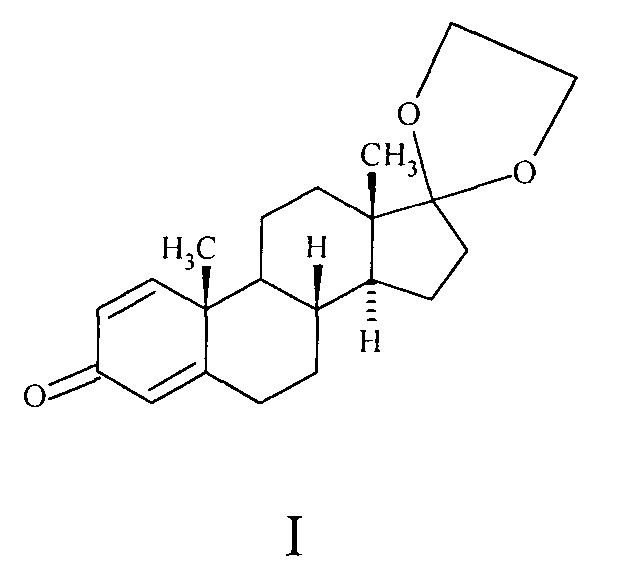
Данное изобретение относится к усовершенствованному способу получения известного соединения ряда андростана, а именно 17,17-этилендиоксиандроста-1,4-диен-3-она формулы Ι:
Соединение Ι - полупродукт для синтеза эстрона [1], который является женским половым гормоном и применяется в качестве лечебного медицинского средства в гинекологии в виде масляного раствора под названием фолликулин. Кроме того, он широко используется как исходный продукт для синтеза практически важных высокоактивных синтетических эстрогенов (например, этинилэстрадиола или валерианата эстрадиола) и 19-норстероидов, нашедших широкое применение в медицинской практике [2, 3]. В настоящее время большинство этих продуктов производится химическим синтезом из андроста-1,4-диен-3,17-диона (АДД, формулы II), который в свою очередь получают микробиологическим расщеплением стеринов [4].
Известно несколько способов получения соединения I [5, 6, 7].
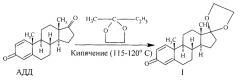
Один из них [5] заключается в том, что АДД подвергают взаимодействию с 2-метил-2-этилдиоксоланом в растворе последнего (весовое соотношение 1:32) в присутствии п-толуолсульфокислоты (весовое соотношение АДД и п-толуолсульфокислоты 1:0,01) при кипячении (115-120°С, 19 часов) с отгонкой образующегося метилэтилкетона на эффективной колонке. Целевой продукт выделяют следующим образом: полученную реакционную массу промывают дважды 2 н раствором соды, избыток 2-метил-2-этилдиоксолана отгоняют в вакууме, остаток извлекают в сокслете эфиром. Эфирный экстракт начисто упаривают и осадок фильтруют.
Схема
Получают целевой продукт I с выходом 87,45%, т. пл. 172-173°С.
Выход целевого продукта, очищенного из метанола (т. пл. 176-177°С), не указан.
Данный способ [5] имеет следующие недостатки:
- использование дефицитного реагента 2-метил-2-этилдиоксана в большом избытке (32-кратный к весу стероида);
- низкая концентрация исходного стероида (3 вес. %);
- высокая энергоемкость процесса (нагревание в течение 19 часов при температуре выше 100°С);
- применение сложного технологического оборудования (колонна на 40 теор. тарелок, сокслет).
Указанные недостатки затрудняют воспроизведение данного способа в промышленном масштабе.
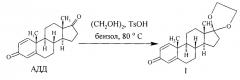
Известны способы получения соединения I путем взаимодействия АДД (II) с этиленгликолем (III) в присутствии кислого катализатора - п-толуолсульфокислоты - в среде бензола при кипячении (80°С) с азеотропной отгонкой [6, 7] согласно нижеследующей схеме:
Согласно способу [6] используют:
- АДД и этиленгликоль - в мольном соотношении 1:0,23;
- АДД и п-толуолсульфокислоту - в весовом соотношении 1:0,01;
- АДД и бензол - в весовом соотношении 1:50.
Целевой продукт выделяют следующим образом: реакционную смесь, после охлаждения, нейтрализуют 10%-ным раствором едкого калия, отмывают водой, сушат, растворитель упаривают в вакууме в присутствии пиридина, остаток растворяют в гексане, смесь хроматографируют и выделяют 2 фракции:
- I фракция, содержащая целевой продукт до 40%,
- II фракция, содержащая исходный АДД. В связи с высоким содержанием исходного АДД во II-ой фракции ее отправляют на докетализацию в вышеприведенных условиях и целевой продукт выделяют тем же способом.
Получают продукт I с общим выходом 87%, т. пл. 168-170°С. Другие показатели качества не приведены.
Недостатком этого способа [6] являются:
- низкий прямой выход целевого продукта ~40% (поскольку реакция кетализации является равновесной, то не удается полностью удалить образующуюся воду азеотропной отгонкой с бензолом);
- необходимость повторного проведения процесса кетализации с целью доведения процесса до конца;
- необходимость очистки целевого продукта путем фильтрации через дифицитный сорбент флоризил, что ведет к большому расходу пожароопасного растворителя - гексана.
В другом известном способе [7, пример 4], где исходные реагенты те же, что и в способе [6], но берут их в ином соотношении, а именно:
- мольное соотношение АДД и этиленгликоля 1:2,34;
- весообъемное соотношение АДД и бензола 1:18.
Температура процесса 80°С, время процесса 2,5 часа.
Целевой продукт выделяют только в виде бензольного раствора следующим образом: охлаждают до комнатной температуры реакционную массу, нейтрализуют пиридином (мольное соотношение п-толуолсульфокислоты и пиридина 1:2,5); бензольный слой, содержащий целевой продукт, промывают водой, затем воду, содержащуюся в бензоле, удаляют, добавляя высушенный бензол и проводя азеотропную отгонку (при этом общее количество бензола составляет 250 мл на 42,66 г стероида).
По данным ТСХ-анализа полученный бензольный раствор содержал 42,3 г 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I, что соответствует достаточно высокому выходу, однако выделение целевого продукта в кристаллическом виде не производилось, так как далее полученный раствор, содержащий соединение I, использовали на ароматизацию для получения эстрона.
Выход целевого продукта I, выделенного в кристаллическом виде, и его качественные характеристики не приведены.
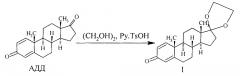
Известен способ получения [1] нагреванием раствора АДД в этиленгликоле в вакууме при температуре 125-135°С в присутствии катализатора тозилата пиридиния (Py.TsOH).
Схема
При этом полное растворение осадка АДД достигается при температуре 110-115°С и перемешивании до подключения вакуума («обеспечение полного растворения АДД до вакуумирования реакционного сосуда и интенсивного перемешивания необходимо для того, чтобы избежать возможных "всплесков" суспензии АДД в этиленгликоле при вакуумировании»). Время растворения 5-10 мин. Сама реакция кетализации далее проводится вакуумированием при 25-35 мм рт.ст. и 125-130°С и интенсивном перемешивании до выпадения осадка I. Выпадение осадка наблюдается через 5-8 мин после достижения указанных температур и вакуума. Образовавшуюся суспензию выдерживали далее при 130-135°С, как пишут авторы, «если возможно - при перемешивании, в течение времени, троекратно превышающего время выдержки до выпадения осадка, примерно 15-24 мин». «В ряде случаев дальнейшее перемешивание после этого становится невозможным (зависит от мощности мешалки)». При этом в реакционной массе остается до 20% исходного АДД, который выделяют и отправляют на докетализацию ранее приведенным способом. Выделение продукта проводится следующим образом:
Реакционный сосуд девакуумируют при 100-110°С и при 90-100°С добавляют триэтиламин и одной порцией 45%-ный (по объемам) раствор H2O в МеОН, предварительно нагретый до 50-60°С. Если ранее перемешивание остановилось, оно восстанавливается через некоторое время вследствие разжижения смеси. Этому же способствует недолгое ручное перемешивание смеси. Полученную суспензию перемешивали 2 ч при понижении температуры от 90°С до 20°С, белый кристаллический осадок отфильтровывают на пористом стеклянном фильтре и промывают 5 раз водой. Полученный белый порошок 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I сушат до постоянного веса в вакуум-эксикаторе (20°С, 2 мм рт.ст., 12 ч). Суммарный выход 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I составляет 94,3% с учетом двух операций кетализации. При этом экспериментальных данных на этот процесс не приведено. В приведенном же примере выход 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I составляет 88%.
Недостатками указанного способа являются:
1. Проведение процесса в концентрированном растворе, не обеспечивающем возможность перемешивания реакционной массы в результате ее сильнейшего загустения, что совершенно исключает масштабирование процесса.
2. Использование объемного оборудования вследствие возможности вспенивания реакционной массы.
3. Низкий прямой выход целевого продукта и вследствие этого необходимость проведения двухступенчатого процесса кетализации для достижения нужного выхода.
4. Необходимость использования вакуума и высоких температур при проведении процесса.
5. Невозможность проведения контроля реакции во времени вследствие проведения его в вакууме.
6. Большие сложности при выделении целевого продукта, требующие использования ручного перемешивания.
7. Прибавление разогретой до 60°С смеси воды с метанолом в густую суспензию (не позволяющую механическое перемешивание и требующую ручное перемешивание) при температуре 90-100°С, нетехнологично и опасно с точки зрения техники безопасности, так как может произойти выброс высокотоксичного и низкокипящего при 64°С метанола.
8. Необходимость дополнительной стадии получения катализатора тозилата пиридиния, требующего особого способа хранения.
Несмотря на то, что способ предлагается для использования в наработке эстрона в промышленном масштабе, с нашей точки зрения, он может быть использован только в разовом варианте для наработки небольшого количества продукта и совершенно не приспособлен для масштабирования процесса.
Наиболее близким к предложенному является способ получения [8] 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I путем взаимодействия АДД (II) с этиленгликолем (III) в присутствии кислого катализатора - п-толуолсульфокислоты - в среде бензола при кипячении (80°С) с азеотропной отгонкой согласно нижеследующей схеме:
После охлаждения реакционной смеси к ней добавляют этилацетат, промывают водным насыщенным раствором карбоната натрия, затем рассолом, отделенный органический слой высушивают, отгоняют растворитель, получают маслообразный продукт I. К маслообразному продукту добавляют небольшое количество этанола, растирают до кристаллизации продукта, после чего продукт фильтруют и высушивают. Получают 17,17-этилендиоксиандроста-1,4-диен-3-он формулы I с выходом 73%. Мольное соотношение АДД : этиленгликоль : п-толуолсульфокислота составляет 3,5:12,3:0,3 (1:3,5:0,085).
Недостатками прототипа является низкий выход целевого продукта, а также сложность процесса, поскольку его ведут при кипячении (т.е., при повышенной температуре) в бензоле с азеотропной отгонкой воды.
В связи с вышеуказанными недостатками, а также в связи с все возрастающей в медицине потребностью в эстрогенах и 19-норстероидах, полупродуктом для синтеза которых является 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I, разработка более безопасного и технологически простого способа получения соединения I является актуальной задачей.
Цель изобретения - повышение выхода целевого продукта и упрощение процесса.
Поставленная цель достигается предлагаемым усовершенствованным способом получения 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I, заключающимся в том, что АДД подвергают взаимодействию с этиленгликолем в присутствии триалкилортоформиата и арилсульфокислоты в гетерогенной среде с последующим выделением целевого продукта фильтрацией непосредственно из реакционной массы после предварительной нейтрализации избытка арилсульфокислоты.
Предлагаемый способ иллюстрируется приведенными ниже примерами.
Пример 1
АДД : этиленгликоль - мольное соотношение 1:2,3
АДД : триметилортоформиат - мольное соотношение 1:1,5
АДД : п-толуолсульфокислота - весовое соотношение 1:0,0136
Температура процесса 22°С. К суспензии 10 г АДД (99,9% чистоты) в 4,5 мл этиленгликоля и 9 мл ортомуравьиного эфира прибавляют 0,0136 г п-толуолсульфокислоты. Смесь перемешивают 2 часа при комнатной температуре. Происходит сначала растворение, а затем выпадение осадка с самопроизвольным подъемом температуры до 29°С.
Через 2 часа прибавляют 0,16 мл триэтиламина и перемешивают 20 минут при комнатной температуре. Суспензию охлаждают до температуры (0±2)°С и выдерживают 2 часа при этой температуре. Осадок отфильтровывают, промывают 15 мл охлажденного метанола.
Получают 11,08 г осадка (96% от теоретического) в виде светлого кристаллического продукта, т. пл 170,5-172,5°С, [α]D+4,34. Содержание исходного продукта - 1%, сумма примесей - 1% (по ТСХ анализу).
Примеры 2-14 приведены в таблице.
При использовании заявляемого способа получают продукт 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I в виде кристаллического порошка с выходом 96-98% - (от теоретического), температура плавления 170,5-172,5°С, [α]D20(+4)-(+5)0 (диоксан). Содержание примесей не более 1% (ТСХ-анализ).
Исходный АДД и этиленгликоль используют в мольном соотношении 1:(2,2-4,4). Уменьшение количества этиленгликоля увеличивает продолжительность процесса, ухудшает качество продукта 1 (примеры 2-3), кроме того способствует загустению реакционной массы, что создает технологические трудности при ее обработке. Увеличение количества этиленгликоля снижает выход целевого продукта за счет частичного растворения стероида в этиленгликоле (примеры 4, 5).
Исходный стероид и арилсульфокислоту (например, п-толуол сульфокислоту (TsOH) или сульфосалициловую кислоту) используют в весовом соотношении 1:(0,005-0,02). При меньшем соотношении чем 1:0,005 реакция не доходит до конца и в результате ухудшается качество продукта и снижается его выход (пример 8). При большем чем 1:0,02 соотношении наблюдается образование большого количества примесей (пример 9).
Отличительными от прототипа признаками заявляемого способа являются следующие признаки:
1. Проведение реакции в гетерогенной среде. Указанное отличие является существенным, так как позволяет повысить концентрацию стероида в исходной смеси, повысить выход целевого продукта, увеличить съем продукта с единицы оборудования. Возможность проведения процесса в гетерогенной среде является неожиданной, так как известно, что большая скорость и полнота превращения исходного соединения в целевой продукт, как правило, обеспечивается проведением реакций в гомогенной среде.
2. Проведение процесса в присутствии триалкилортоформиата, взятого в соотношении к АДД, как (1,125-1,5):1 и используемого для удаления воды путем ее химического связывания. Это позволяет довести процесс кетализации до конца и, тем самым, увеличить выход целевого продукта и упростить его выделение. В прототипе воду удаляют азеотропной отгонкой с бензолом при высокой температуре. Использование триалкилортоформиата в соотношении, меньшем, чем указано, не позволяет довести процесс кетализации до конца, что в результате ухудшает качество целевого продукта (снижается т. пл., увеличивается примесь исходного АДД, пример 10). В случае увеличения количества триалкилортоформиата последний начинает выступать как сорастворитель стероида, что ведет к снижению выхода целевого продукта, пример 11.
3. Проведение процесса при температуре от 20 до 40°С.
При более низкой температуре процесс затягивается, что приводит к нарастанию примесей, ухудшению качества, снижению выхода целевого продукта, пример 12. При повышении температуры также снижается выход и ухудшается качество за счет нарастания примесей, примеры 13-14.
4. Выделение целевого продукта высокого качества путем фильтрации непосредственно из реакционной массы. В прототипе продукт выделяют из реакционной массы после проведения ряда трудоемких операций: экстракцией этилацетатом, многократной промывкой раствором соды с целью нейтрализации, промывкой рассолом, высушиванием и упариванием органического слоя с последующей кристаллизацией высадившегося маслообразного продукта из этанола и фильтрацией кристаллического кеталя. Приведенные отличия позволяют получить целевой продукт высокого качества с высоким выходом 96-98%. В прототипе выход кеталя 73%.
В качестве триалкилортоформиата используют триметилортоформиат или триэтилортоформиат.
Литература
1. Патент РФ №2170740, кл. C07J 1/00. Пивницкий К.К., Васильева Л.Л., Лапицкая М.А., Демин П.М., Кочев Д.М., 20.07.2001.
2. Патент РФ №2449796(13) С2) Хайль Вольфганг, Хильман Юрген, Липп Ральф, Хайтхеккер Ренате, Бюл. №13, 10.05.2012.
3. Патент РФ №2111213, Руссель - Юклаф, Андре Клоссне, Франсуа Нике, Жан-Жорж Тетш, Патрик Ван де Вельд. 1998.
4. Патент РФ №2297455. Войшвилло Н.Е., Андрюшина В.А., Молчанова М.А., Стыценко Т.С., Скрябин К.Г. Бюл. №11, 20.04.2007.
5. Bjarte Loken, Marcel Gut. Steroids, Suppl 1, 1965, с 39-48.
6. M.J. Gentles. J. Chem. Soc., 1958, 80, 3702.
7. Патент Японии JP №55028963, 1980.
8. Chen, Ying; Xia, Peng; Wang, Chunli, Патент Китая № CN 104059118 В, 2016.
1. Способ получения 17,17-этилендиоксиандроста-1,4-диен-3-она формулы I
взаимодействием андроста-1,4-диен-3,17-диона (АДД) с этиленгликолем в присутствии арилсульфокислоты с последующим выделением целевого продукта из предварительно нейтрализованной реакционной массы, отличающийся тем, что с целью повышения выхода целевого продукта и упрощения процесса процесс проводят в присутствии триалкилортоформиата в гетерогенной среде и целевой продукт выделяют путем фильтрации непосредственно из реакционной массы.
2. Способ по п. 1, отличающийся тем, что в качестве арилсульфокислоты используют п-толуолсульфокислоту и сульфосалициловую кислоту.