Способ капацитации криоконсервированных сперматозоидов крупного рогатого скота для работ по in vitro оплодотворению яйцеклеток
Иллюстрации
Показать всеИзобретение касается способа капацитации криоконсервированных сперматозоидов КРС для in vitro оплодотворения яйцеклеток в полностью химически «определенной» системе. Способ заключается в том, что в безбелковую среду оплодотворения Тироде вместо 10 мкг/мл гепарина вводят в качестве капацитирующего агента дбцАМФ в концентрации 100 мкМ. При этом среда оплодотворения не содержит глюкозы, а также каких-либо добавок, активирующих сперматозоиды. Изобретение обеспечивает повышение эффективности получения эмбрионов КРС in vitro и может быть использовано для исследовательских целей. 2 табл., 1 пр.
Реферат
Изобретение относится к области биотехнологии, а именно клеточной инженерии, и может быть использовано для создания химически "определенной" системы получения эмбрионов крупного рогатого скота (КРС) in vitro.
Общеизвестно, что в момент эякуляции сперматозоиды млекопитающих не обладают способностью пенетрировать созревшие ооциты и должны в первую очередь приобрести оплодотворяющую способность, которая возникает вследствие инкубации в течение нескольких часов (Austin, 1952; Chang, 1951). Austin назвал этот феномен капацитацией. Капацитация включает в себя различные физиологические изменения в сперматозоидах, начинающиеся с удаления или изменения в поверхностных компонентах (Brackett and Oliphant, 1975) и, в конечном счете, приводящих к гиперактивации и после соответствующих стимулов к акросомальному экзоцитозу (Yanagimachi, 1994).
В зависимости от видов, капацитация in vivo происходит в матке или яйцеводе (Yanagimachi, 1994). У некоторых видов капацитация может спонтанно происходить в течение инкубации in vitro. Биологические и молекулярные изменения, связанные с капацитацией, до конца не поняты. Однако известно, что капацитация может модулироваться протеинами, найденными в жидкостях фолликулов и половых путей (Мс Nutt et al., 1992). Гликозоаминогликаны, такие как гепарин (или гепарин сульфат) и гиалуроновая кислота (Lee and Ax, 1984), найденные в фолликулярной или яйцеводной жидкостях, как полагают, играют роль в капацитации сперматозоидов КРС in vivo. Более того, обнаружено, что как яйцеводная, так и фолликулярная жидкости могут стимулировать капацитацию спермы КРС in vitro (McNutt and Killian, 1991; Parrish et al., 1989). Гепарин является сульфатированным гликозоаминогликаном-антикоагулянтом (Oscarsson et. al., 1989) и, как считается, стимулирует капацитацию посредством связывания и удаления протеинов семенной плазмы, связанных с мембранами сперматозоидов (Miller et al., 1990). Подобные данные привели к тому, что использование гепарина для капацитации сперматозоидов КРС (Parrish et al., 1988) сделало более воспризводимой методику получения эмбрионов данного вида in vitro.
Следует отметить, что криоконсервированные сперматозоиды КРС капацитируются легче, чем свежеэякулированные. Это происходит, скорее всего, из-за нарушения акросомной и плазматической мембран, которое происходит во время замораживания (Parks and Graham, 1992), что изменяет уровень внутриклеточного кальция (Bailey and Buhr, 1994). Повышение внутриклеточного кальция может стимулировать повышение аденилатциклазной активности в период начальной инкубации спермы. По контрасту, свежеэякулированные сперматозоиды требуют значительно более длительного времени для того, чтобы капацитация произошла. Протеины семенной плазмы, связанные с плазматической мембраной эякулированных спермальных клеток, давно известны как ингибиторы капацитации (Chang, 1957). Тот факт, что гепарин связывает протеины семенной плазмы, напрямую связан с его способностью опосредовать капацитацию (Miller et al., 1990). То, что криоконсервация вызывает диссоциацию протеинов семенной плазмы КРС от мембраны сперматозоидов, было продемонстрировано иммунологически (Nauc et al., 1999).
В настоящее время гепарин является основным препаратом, используемым для капацитации криоконсервированных сперматозоидов КРС скота in vitro. Гепарин получают из слизистой кишечника свиней. Различные препараты гепарина различаются по химическому составу, что влияет на воспроизводимость результатов. Замена гепарина в процессе приготовления спермы на другой капацитирующий агент может позволить использовать полностью "определенную" систему для получения эмбрионов КРС.
Процесс капацитации наделяет сперматозоиды млекопитающих способностью оплодотворять яйцеклетки, в частности, через приобретение ими способности к акросомной реакции, в результате которой освобождаются энзимы, необходимые для пенетрации оболочек, окружающих неоплодотворенные яйцеклетки. Акросомная реакция сперматозоидов протекает аналогично экзоцитотическим событиям в различных соматических клетках, которые включают каскад реакций, например трансмиссию внешнего сигнала через клеточную мембрану, что ведет к активации "усиливающего" энзима и генерации второго посредника. Среди факторов, которые включаются в процесс капацитации, присутствует циклический аденозинмонофосфат (цАМФ).
Имеются исследования с использованием in vitro системы оплодотворения, которые свидетельствуют, что экзогенный цАМФ, используемый в форме дибутирил аналога, (дибутирилциклического АМФ, дбцАМФ), может играть позитивную роль в оплодотворении и укорочении времени, требуемого для капацитации сперматозоидов (крысы: Toyoda and Chang, 1974; кролики: Rosado, Hicks, Reyes and Blanco, 1974). Процент оплодотворения яйцеклеток кролика повышался после обработки эякулята семени кролика дбцАМФ (Brackett et al., 1975).
Fraser L. (1981) показано, что обработка эпидидимальных мышиных сперматозоидов 1 мМ дбцАМФ препятствует оплодотворению яйцеклеток мышей, в то время как дбцАМФ в концентрации 0.1 мМ значительно ускоряет капацитацию, результатом чего явилось раннее и синхронное оплодотворение яйцеклеток по сравнению с контролем. Эти данные подтверждают, что ингибирование оплодотворения у морских свинок, полученное Rogers and Garcia (1979) с 10 мМ дбцАМФ, связано с высокой концентрацией тестируемого вещества.
Опубликованы данные, что химически "определенное" соединение - дбцАМФ, являющийся аналогом цАМФ и проникающий в клетку за счет повышенной растворимости в липидах при использовании в концентрации 1 и 10 мкМ - повышает процент оплодотворения ооцитов беличьих обезьянок на 50.3% и 50.0% соответственно (Chan P.J. et al., 1982).
Используя систему синхронной акросомной реакции (De Jonge C.J. et al., J. Androl., 10: 232-239, 89a), было найдено, что аналоги второго посредника - цАМФ, дбцАМФ и 8-бромо цАМФ, стимулируют акросомную реакцию капацитированных сперматозоидов человека (De Jonge C.J. et al., 1991). Обработка дбцАМФ, одним или с кофеином, ведет к повышенному проценту акросомно-прореагировавшей спермы макак cynomolgus на зоне пеллюцида по сравнению с контролем или обработкой одним кофеином (Vanderoort C.A., 1994).
Для КРС известна работа, взятая нами в качестве прототипа "Chlortetracycline staining patterns of frozen-thawed bull spermatozoa treated with β-cyclodextrins, dibutyryl cAMF and progesterone" (M.B. Dinkins and B.G. Brackett., 2000, Zygote 8, 245-256) и наиболее близко относящаяся к описанной в данной заявке, в которой показано, что включение дбцАМФ в среду Brackett and Oliphant (Brackett B.G. and Oliphant G., 1975) с глюкозой, дополненной рядом факторов, активирующих сперматозоиды (кофеином, пеницилламином, адреналином и гипотаурином), в течение 15 или 30 минут после процедур swim-up и центрифугирования сперматозоидов вызывает достоверное снижение процента сперматозоидов, относящихся к некапацитированной фракции, и повышает процент сперматозоидов, относящихся к капацитированным и акросомно-прореагировавшим при всех тестируемых концентрациях (0.01, 0.1 и 1 мМ). Однако наивысшие проценты подвижных сперматозоидов наблюдали после инкубации с 0.01 и 0.1 мМ дбцАМФ по сравнению с обработкой 1.0 мМ дбцАМФ. Обработки 10 мМ дбцАМФ вели к резкому снижению подвижности сперматозоидов, так только 40% и 20% сперматозоидов сохраняли подвижность через 15 и 30 минут соответственно. Влияние дбцАМФ на оплодотворяющую способность спермы и развитие эмбрионов in vitro в этой работе не исследовалось.
Ранее Parrish et al. (1986) сообщил, что 15 минутная обработка гепарином (20 мкг/мл) криоконсервированных сперматозоидов перед оплодотворением созревших in vitro ооцитов КРС не стимулировала капацитацию или акросомную реакцию в короткий инкубационный период, но являлась проводником для попадания гепарина в среду оплодотворения. Однако, данные прототипа (М.В. Dinkins and B.G. Brackett, 2000) показали достоверное увеличение процента сперматозоидов, относящихся к акросомно-прореагировавшим после 15 минутной обработки гепарином. Эти различия наблюдались, скорее всего, из-за разницы в используемых средах. В то время как Parrish et al. (1986) использовали среду Тироде (Bavister B.D. and Yanagimachi R., 1977) с белком, М.В. Dinkins and B.G. Brackett (прототип) использовали среду Brackett and Oliphant без белка, которая отличалась более высоким pH (7.8 по сравнению с 7.4) и содержала дополнительные активирующие реагенты, все из которых присутствовали в течение преинкубации. Эти данные свидетельствуют о возможном влиянии состава используемых сред на действие применяемого капацитирующего агента.
Таким образом, в работе, выбранной нами в качестве прототипа, показано, что в содержащей глюкозу, безбелковой среде Brackett and Oliphant дбцАМФ можно инициировать капацитацию криконсервированных сперматозоидов КРС в отсутствие гепарина и в присутствии дополнительных активирующих реагентов. Имеющиеся данные обеспечили предпосылки для дальнейшего исследования дбцАМФ при подготовке спермы для систем in vitro оплодотворения с тем, чтобы исключить необходимость использования гепарина. Это должно позволить получать эмбрионы КРС в полностью определенной системе, то есть в отсутствие биологических компонентов среды.
Настоящее изобретение направлено на разработку химически определенной системы, которая бы эффективно капацитировала криоконсервированные сперматозоиды КРС. Удаление гепарина из процесса обработки спермы - один из этапов создания полностью определенной системы получения эмбрионов КРС in vitro. Данное изобретение ориентировано на повышение эффективности и воспроизводимости методики получения эмбрионов КРС in vitro.
Поставленная задача решена тем, что вместо сульфатированного гликозоаминогликана гепарина, повсеместно используемого для капацитации сперматозоидов КРС in vitro, в несодержащую глюкозы и каких-либо добавок, активирующих сперму, безбелковую среду оплодотворения Тироде вводят химически определенный капацитирующий агент - дбцАМФ.
Преимущество предложенного способа капацитации криоконсервированных сперматозоидов КРС in vitro заключается в том, что при его использовании повышается как воспроизводимость, так и эффективность методики получения эмбрионов КРС in vitro. Исключение гепарина из процесса капацитации - это один из моментов, который должен позволить получать эмбрионы КРС в полностью определенной системе, то есть в отсутствие биологических компонентов сред.
Отличительный признак изобретения: улучшение показателей оплодотворения и развития эмбрионов КРС in vitro мы связываем как с повышением процента (доли) капацитированных сперматозоидов, так и с уменьшением временного интервала, необходимого для самого процесса капацитации. Следствием использования в качестве капацитирующего агента дбцАМФ в концентрации 100 мкМ является повышение процента оплодотворенных и развивающихся эмбрионов, а также повышение скорости развития эмбрионов.
В доступной патентной и научно-технической литературе использование дбцАМФ в качестве капацитирующего агента криоконсервированных сперматозоидов КРС в несодержащей глюкозы и каких-либо добавок, активирующих сперматозоиды, безбелковой среде оплодотворения Тироде нами не обнаружено. Данное обстоятельство позволяет считать заявленное изобретение патентоспособным, как отвечающее условию патентоспособность "изобретательский уровень".
Пример 1
Для оценки эффективности способа капацитации сперматозоидов КРС с применением дбцАМФ было проведено две серии экспериментов (по три опыта в каждом) с использованием семени двух быков, так как известно, что чувствительность к капацитирующим агентам у разных быков производителей может существенно различаться. Яичники КРС получали на мясокомбинате и транспортировали в лабораторию в течение 2-х часов при температуре 30°C в фосфатно-солевом буфере Дюльбекко ("ПанЭко", Россия). Ооциты выделяли из антральных фолликулов диаметром 3-8 мм методом рассечения. Для экспериментов отбирали яйцеклетки с многослойным компактным кумулюсом. Для созревания ооцитов использовали среду 199HEPES ("Sigma") с добавлением 5 мкг/мл фолликулостимулирующего гормона ("Folltropin", "Vetrepharm"), 0.3 IU/мл хорионического гонадотропина человека ("Ovogest", "Intervet"), 0.2 мМ пирувата натрия ("Sigma"), 2 мМ глутамина ("Sigma"). Для того чтобы исключить возможное влияние неопределенных белковых компонентов, мы не добавляли сыворотку или сывороточный альбумин к среде созревания. Ооциты созревали в течение 24 часов в атмосфере 5%-ного CO2 в воздухе при температуре 38.5°C.
Для последующего этапа оплодотворения яйцеклеток in vitro было использовано три безбелковые среды, где БСА (бычий сывороточный альбумин) был заменен на 0.1 мг/мл ПВА (поливинилпирролидона). Это среда Тироде для подготовки спермы (T-S), среда Тироде с HEPES для отмывания ооцитов (T-H), среда Тироде оплодотворения для совместного инкубирования яйцеклеток и сперматозоидов (T-F).
Созревшие in vitro ооциты отмывали в среде T-H и помещали для совместного инкубирования со сперматозоидами в 500 мкл T-F (из расчета 10 OKK на 50 мкл среды), дополненную 10 мкг/мл гепарина, либо 100 мМ дбцАМФ. В работе использовали сперму быков "Помпей" и "Вал". Сперму готовили методом "swim up" ("всплывания"), используя среду T-S с добавлением пирувата натрия до концентрации 1 мМ. Совместную инкубацию яйцеклеток и сперматозоидов осуществляли в течение 18 часов в атмосфере 5%-ного CO2 в воздухе при температуре 38.5°C.
Для оценки способности зигот к дальнейшему развитию оплодотворенные ооциты трижды отмывали в среде T-H, а затем помещали для культивирования в микрокапли синтетической жидкости яйцевода (СЖЯ, Tervit et al., 1972) под маслом объемом 50 мкл без глюкозы, содержащей 1 мМ глутамина, 0.33 мМ пирувата натрия и 3 г/л БСА (N3311). Культивирование осуществляли в течение 68 часов в атмосфере трехкомпонентной газовой смеси (5% CO2, 5% O2 и 90% N2). Развитие эмбрионов до 4-8 клеточной стадии через 68 часов после начала совместной инкубации ооцитов и сперматозоидов было взято как критерий нормального оплодотворения и развития.
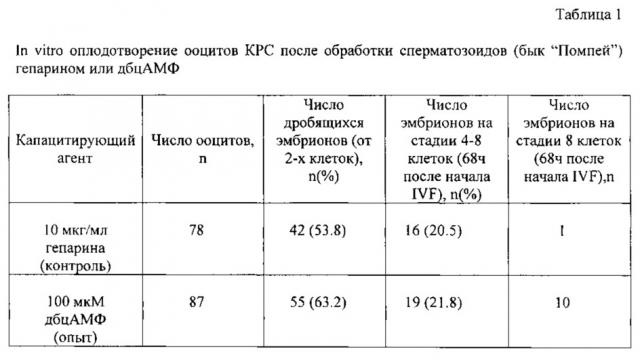
Данные первой серии экспериментов представлены в таблице 1. Показано, что дбцАМФ (опытная группа) капацитирует сперматозоиды КРС также эффективно, как и гепарин (контрольная группа). Достоверных различий между группами не наблюдали. Однако следует отметить, что эмбрионы опытной группы развивались быстрее и выглядели морфологически лучше. Через 68 часов после начала оплодотворения более половины эмбрионов достигли 8-клеточной стадии, в то время как в контроле практически все эмбрионы находились на стадии 4-6 клеток.
Вторая серия экспериментов показала (табл. 2), что сперма быка "Вал" более чувствительна к капацитирующим свойствам дбцАМФ, чем сперма быка "Помпей". В опытной группе процент эмбрионов, достигших 4-8 клеточной стадии, был достоверно выше, по сравнению с контролем. Однако по скорости развития такой разницы, как в первой серии экспериментов, не наблюдали, что говорит об индивидуальных особенностях каждого быка производителя.
Таким образом, полученный экспериментальный материал подтверждает возможность использования дбцАМФ в качестве химически "определенного" капацитирующего агента сперматозоидов КРС. Это позволяет создать полностью определенную культуральную систему для получения эмбрионов КРС in vitro, полностью исключив из нее биологические составляющие.
Литература
1. Austin C.R. (1952). The capacitation of the mammalian sperm. Nature 170, 326.
2. Chang M.C. (1951). Fertilizing capacity of spermatozoa deposited into the fallopian tubes. Nature 168, 697-698.
3. Brackett B.G. and Oliphant G. (1975). Capacitation of rabbit spermatozoa in vitro. Biol. Reprod. 12, 260-74.
4. Yanagimachi R. (1994). Mammalian fertilization. In The Physiology of Reproduction, 2nd edn, ed. E. Knobil and J.D. Neill, pp. 189-317. New York: Raven Press.
5. McNutt Т., Rogowski L., Vasilatos-Younken R. and Killian G. (1992). Adsorption of oviductal fluid proteins by the bovine sperm membrane during in vitro capacitation. Mol. Reprod. Dev. 33, 313-323.
6. Lee C.N. and Ax R.L. (1984). Concentrations and composition of glycosaminoglycans in the bovine reproductive tract. J. Dairy Sci. 67, 2006-2009.
7. McNutt T. and Killian G. (1991). Influence of bovine follicular and oviduct fluids on sperm capacitation in vitro. J. Androl. 12, 244-252.
8. Parrish J.J., Susko-Parrish J.L., Handrow R., Sims M. and First N.L. (1989b). Capacitation of bovine spermatozoa by oviduct fluid. Biol. Reprod. 40, 1020-1025.
9. Oscarsson L.G., Pejler G. and Lindahl U. (1989). Location of the antithrombin-binding sequence in heparin chain. J. Biol. Chem. 264, 296-304.
10. Miller D.J., Winer M.A. and Ax R.L. (1990). Heparin-binding proteins from seminal plasma bind to bovine spermatozoa and modulate capacitation by heparin. Biol. Reprod. 42, 899-915.
11. Parrish J.J., Susko-Parrish J.L., Winer M.A. and First N.L. (1988). Capacitation of bovine sperm by heparin. Biol. Reprod. 38, 1171-80.
12. Parks J.E. and Graham J.K. (1992). Effects of cryopreservation procerdures on sperm membranes. Theriogenology 38, 209-222.
13. Bailey J.L. and Buhr M.M. (1994). Cryopreservation alters the Ca2+ flux of bovine spermatozoa. Can. J. Anim. Sci. 74, 54-61.
14. Chang M.C. (1957). A detrimental effect of seminal plasma on the fertilizing capacity of sperm. Nature. 179, 258-259.
15. Miller D.J., Winer M.A. and Ax R.L. (1990). Heparin-binding proteins from seminal plasma bind to bovine spermatozoa and modulate capacitation by heparin. Biol. Reprod. 42, 899-915.
16. Nauc V., Lane M.E. and Manjunath P. (1999). Quantification of BSP-A1/-A2, BSP-A3 and BSP-30-kDa proteins and their role in sperm capacitation and storage. Biol. Reprod. 60 (Suppl. 1), 102.
17. Toyoda Y. and Chang M.C. (1974). Capacitation of epididymal spermatozoa with high K/Na ratio and cyclic AMP for the fertilization of rat eggs in vitro. J. Reprod. Fert. 36, 125-134.
18. Rosado A., Hicks J.J., Reyes A. and Blanco I. (1974). Capacitation in vitro of rabbit spermatozoa with cyclic adenosine monophosphate and human follicular fluid. Fert. Steril. 25, 821-824.
19. Brackett B.G., Jeitles G.G. and Oh Y.K. (1975). Fertilisation by sperm treated with high ionic strength and N6,O2-dibutyryl adenosine 3':5'-cyclic monophosphoric acid. Fed. Proc. 34, 456.
20. Fraser L.R. (1981). Dibutyryl cyclic AMP decreases capacitation time in vitro in mouse spermatozoa. J. Reprod. Fert. 62, 63-72.
21. Rogers B.J. and Garcia L. (1979). Effect of cAMP on acrosome reaction and fertilization. Biol. Reprod. 21. 365-372.
22. Chan P.J., Hutz R.J., Dukelow W.R. (1982). Nonhuman primate in vitro fertilization: seasonality, cumulus cells, cyclic nucleotides, ribonucleic acid, and viability assays. Fertil. Steril. 38, 609-615.
23. De Jonge C.J., Mack S.R. and Zaneveld L.J.D. (1989a). Synchronous assay for human sperm capacitation and the acrosome reaction. J. Androl. 10, 232-239.
24. De Jonge C.J., Han H.L., Lawrie H., Mack S.R., Zaneveld L.J. (1991). Modulation of the human sperm acrosome reaction by effectors of the adenylate cyclase/cyclic AMP second-messenger pathway. J. Exp. Zool. 258, 113-125.
25. Vande Voort C.A., Tollner T.L., Overstreet J.W. (1994). Separate effects of caffeine and dbcAMP on macaque sperm motility and interaction with the zona pellucida. Mol. Reprod. Dev. 37, 299-304.
26. Dinkins M.B. and Brackett B.G. (2000). Chlortetracycline staining patterns of frozen-thawed bull spermatozoa treated with β-cyclodextrins, dibutyryl cAMF and progesterone. Zygote. 8, 245-256.
27. Bavister B.D. and Yanagimachi R. (1977). The effect of sperm extract and energy sources on the motility and acrosome reaction of hamster sperm in vitro. Biol. Reprod. 16, 228-237.
28. Parrish J.J., Susko-Parrish J.L., Leibfried-Rutledge M.L., Critser R.S., Eyestone W.H. and First N.L. (1986). Bovine in vitro fertilization with frozen-thawed semen. Theriogenology. 25, 591-600.
29. Tervit H.R., Whittingham D., Rowson I. (1972). Successful culture in vitro of sheep and cattle ova. J. Reprod. Fertil. 30, 493-497.
Способ капацитации криоконсервированных сперматозоидов КРС для in vitro оплодотворения яйцеклеток в полностью химически "определенной" системе, не содержащей каких-либо компонентов биологического происхождения, включающий замену в качестве капацитирующего агента 10 мкг/мл гепарина на 100 мкМ дбцАМФ, отличающийся использованием в качестве среды оплодотворения среды Тироде, не содержащей белка, глюкозы и каких-либо добавок, активирующих сперматозоиды.