Способ восстановления лимфоидной ткани селезенки лабораторных животных
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для восстановления регенерации лимфоидной ткани селезенки в эксперименте. Для этого лабораторным животным (мышам) через 20 мин после облучения проводят внутривенную аллогенную трансплантацию мультипотентных стромальных клеток (ММСК) и гемопоэтичных стволовых клеток (ГСК), полученных из хориона плаценты лабораторных животных. При этом ММСК вводят в дозе 6,2 млн клеток/кг, а ГСК - в дозе 330 тыс. клеток/кг. Способ позволяет значительно повысить активацию регенерацию лимфоидной ткани селезенки в сравнении с другими дозами введения стволовых клеток. 2 табл.
Реферат
Изобретение относится к области медицины и предназначено для восстановления регенерации лимфоидной ткани селезенки лабораторных животных (мыши).
Известен способ активации регенерации лимфоидной ткани селезенки лабораторных животных (мыши) при воздействии производного индолилтиоалканкарбоновой кислоты (соединения BL-11-02). Соединение BL-11-02 вводили внутрибрюшинно в дозе 10 мг/кг (1/75 от LD50) (Весовые, морфометрческие и цитологические характеристики лимфоидных органов мышей при воздействии производного индолилтиоалканкарбоновой кислоты (соединения BL-11-02) / В.Л. Лимонов, А.В. Шурлыгина, М.В. Робинсон, Л.В. Вербицкая, Н.Г. Пантелеева, М.В. Тендитник, О.П. Колесникова, В.А. Труфакин // Бюллетень СО РАМН. - 2005. - №2 (116). - С. 55-58). Недостатком этого способа является то, что данное вещество обладает дозозависимой антипролиферативной активностью, оказывает угнетающее влияние на пролиферацию Т- и В-клеточного звеньев иммунитета в центральных и периферических органах иммунной системы (Влияние производного индолтиоалканкарбоновой кислоты (соединения ВЛ-11-02) на пролиферативную активность иммунокомпетентных клеток у интактных мышей / В.Л. Лимонов, А.В. Шурлыгина, М.В. Робинсон, Е.В. Мельникова, О.П. Колесникова, К.В. Гайдуль, А.Н. Мирскова, В.А. Труфакин // Сибирский научный медицинский журнал. - 2005. - Т. 25, №1. - С. 70-73).
Наиболее близким техническим решением является способ восстановления селезенки после лучевой нагрузки путем внутривенной аллогенной трансплантации лабораторным животным через час после облучения мультипотентных мезенхиальных стволовых клеток (ММСК) и гемопоэтичных стволовых клеток (ГСК), полученных из плаценты самок-мышей при сроке гестации 14 дней, при этом ММСК вводят в дозе 6,5 млн клеток, кг, а ГСК - в дозе 400 тыс. клеток/кг (патент RU №2551937, МПК G09B 23/28, A61K 35/44, A61P 43/00, опубл. 10.06.2015).
Данный способ позволяет расширить арсенал средств, способных обеспечить регенераторный потенциал тканей селезенки, а также повысить регенерацию основных морфометрических показателей селезенки после воздействия лучевой нагрузки, однако он не приводит к активации регенерации лимфоидной ткани селезенки, т.е. не влияет на структуру селезенки.
Задачей изобретения является получение лекарственных средств, улучшающих структуру селезенки после лучевой нагрузки.
Технический результат, который будет получен от использования изобретения, заключается в увеличении морфометрических и цитологических показателей лимфоидной ткани селезенки.
Технический результат достигается тем, что в способе восстановления лимфоидной ткани селезенки путем внутривенной сочетанной аллогенной трансплантации лабораторным животным через 20 мин после облучения проводят внутривенную аллогенную трансплантацию мультипотентных стромальных клеток ММСК) и гемопоэтичных стволовых клеток (ГСК), полученных из хориона плаценты лабораторных животных, при этом ММСК вводят в дозе 6,2 млн клеток/кг, а ГСК - в дозе 330 тыс. клеток/кг.
Сущность изобретения состоит в сочетанной трансплантации лабораторным животным плацентарных ММСК и ГСК в количестве 6,2 млн клеток/кг и 330 тыс. клеток/кг соответственно.
Эффективность применения ММСК в качестве котрансплантата при введении ГСК обусловлена тем, что они вырабатывают цитокины и факторы роста, необходимые для хоуминга и дифференцировки гемопоэтических стволовых клеток (Kavanagh D. J. et al., 2011). ММСК синтезируют компоненты матрикса, в том числе фибронектин, ламинин, коллаген и протеогликаны. При этом ММСК способны дифференцироваться в клетки стромы, которая обеспечивает синтез экстрацеллюлярного матрикса, формирующего микроокружение, необходимое для пролиферации и дифференцировки стволовых клеток (Chow A. et al., 2011; Jones Е. et al., 2011). Кроме того, ММСК обладают свойством продуцировать противовоспалительные цитокины, а также обеспечивать стимуляцию ангиогенеза (Kavanagh Н. et al., 2011; Kidd S. et al., 2010).
Способность ММСК оказывать иммуносупрессивное действие может обеспечить приживление аллогенного трансплантата (Aldinucci A. et al., 2010; Gebler A. et al., 2012; Han Z. et al., 2012). Выделение ММСК хемоаттрактантов для ГСК обеспечивает направленный хоуминг ГСК, а формирование соответствующего микроокружения дополнительно улучшает приживление трансплантированных аллогенных ГСК (Zhang Y. et al., 2004, Jorgensen С. et al., 2010).
Из анализа научно-технической и патентной литературы заявляемой совокупности свойств, влияющих положительно на структуру лимфоидной ткани селезенки, не выявлено, что соответствует критериям «новизна» и «изобретательский уровень».
Изобретение осуществляется следующим образом.
Эксперименты выполнены на 20 зрелых лабораторных мышах-самцах в возрасте 3-4 месяцев с массой 18-20 г. Животные содержались в стандартных условиях лабораторного вивария при естественном освещении и сбалансированном рационе.
Лабораторные животные были разделены на две группы: опытную и контрольную. Лабораторным животным опытной группы через 20 мин после облучения внутривенно вводились ММСК и ГСК соответственно в дозе 6,2 млн. клеток/кг и 330 тыс. клеток/кг, суспендированные в 0,2 мл среды RPMI. Животным контрольной подгруппы вводили 0,2 мл среды RPMI внутривенно. Забой лабораторных животных осуществлялся на 7 сутки трансплантации клеток.
Клеточные культуры. Получение клеточной культуры ММСК и ГСК производилось из хориона плаценты лабораторных животных. При этом мононуклеарная фракция клеток была получена путем последовательной механической и ферментативной (раствор аккутазы (Millipore, США)) обработки ткани плаценты.
Выделение ГСК осуществлялось методом позитивной иммуномагнитной сепарации по антигенам SCA-1 (StemCell Technologies, США) и CD 117 (StemCell Technologies, США) (X. Munira et al., 2009).
Проточная цитометрия была проведена на цитометре FACS Calibur (BD Bioscienses, США). В суспензии трансплантируемых клеток оценивалось содержание ГСК с иммунофенотипом положительных по CD 117, Sca-1 и отрицательных по Lin- (CD45, С3е, Ly-6G, M1/70, Ter-119).
В качестве изотипического контроля для антител при проведении позитивной иммуномагнитной сепарации по SCA-1 и CD117 были использованы антитела PE labeled Rat IgG2a, kappa isotype control (BD Bioscienses). С целью определения Lin антигенов на поверхности клеток был использован набор антител - FITC anti-mouse Lineage Coctail with isotype control (Biolegend, США).
Проведенные исследования позволили установить, что содержание клеток после иммуномагнитной сепарации с иммунофенотипом CD117+ (рис. 1), Sca-1+, Lin- составило 70-93%.
Тест колониеобразования. С целью определения функциональной способности клеток, выделенных с помощью позитивной иммуномагнитной сепарации (Sca1+, CD 117+, Lin-), был проведен стандартный тест колониеобразования в метилцеллюлозной среде MethoCult (StemCell Technologies, Канада). Данный тест позволяет установить способность полученных клеток формировать различные типы гемопоэтических колоний. Образование колоний было зарегистрировано под инвертированным микроскопом Unico (США).
Культура ММСК. С целью получения первичной культуры ММСК осуществлялся пассаж мононуклеарной фракции клеток, выделенной из ткани плаценты, в специализированной среде для культивирования ММСК в чашки Петри в концентрации 1⋅106 клеток на 1 см2. Культивирование ММСК проводилось в условиях CO2-инкубатора при температуре 37°C с содержанием углекислого газа 5% и влажностью 90%. Через 24-48 ч инкубации не прикрепленные к дну чашки Петри клетки аспирировали. Среду для культивирования ММСК добавляли к прикрепленным к пластику клеткам. Замена среды проводилась каждые 3-4 сутки до достижения клетками 70-80% конфлюэнтности. При формировании соответствующего монослоя осуществлялся пересев клеток.
При трансплантации лабораторным животным была использована культура ММСК третьего пассажа.
Иммуноцитохимия. Для подтверждения принадлежности культуры к ММСК производилась окраска клеток с помощью набора антител Mesenchymal Stem Cell Characterization Kit (Millipore, США), содержащего позитивные (антитела к integrin β1, CD 54, collagen type I и fibronectin) и негативные маркеры (антитела к CD 14, CD 45).
Производилась дифференцировка полученной культуры в адипоцитарном и остеогенном направлениях. Состав среды, индуцирующей дифференцировку: MesenCult™ Osteogenic Stimulatory Supplement («StemCell Technologies)), Канада) / MesenCult™ Adipogenic Stimulatory Supplement («StemCell Technologies)), Канада) и MesenCult™ MSC Basal Medium (Mouse) («StemCell Technologies)), Канада) в соотношении 1:4, 2 ммоль раствора L-глутамина («StemCell Technologies)), Канада). Факт остеогенной дифференцировки подтвержден гистохимическим методом регистрации увеличения экспрессии щелочной фосфатазы, а также с помощью окраски von Kossa, выявляющей наличие минерализованного фосфата кальция. Способность клеток дифференцироваться в адипоцитарном направлении подтверждена гистохимическим методом регистрации липидных вакуолей, окрашивающихся красителем Oil Red О (J.J. Minguell et al., 2004).
Подсчет и определение жизнеспособности клеток. Жизнеспособность клеток была определена с помощью суправитальной окраски раствором трипанового синего. Подсчет клеток производился в 5 больших квадратах камеры Горяева (или ≥ 100 клеток). Жизнеспособность выделенных клеток перед трансплантацией составляла 95-97%.
Морфологическое исследование селезенки.
Оценка регенераторных процессов в белой пульпе селезенки производилась по определению основных морфометрических показателей и анализе цитограммы данного органа. Для проведения гистологического исследования селезенки были изготовлены гистологические препараты органа толщиной 5 мкм, которые окрашивали гематоксилином и эозином. Морфометрическое исследование проводили с использованием программы Biovison 4.0.
Были определены следующие показатели:
- площадь лимфоидного фолликула = суммарная площадь лимфоидных фолликулов/количество лимфоидных фолликулов;
- площадь В-зоны лимфоидного фолликула = суммарная площадь В-зоны лимфоидных фолликулов/количество лимфоидных фолликулов;
- площадь герминативного центра лимфоидного фолликула = суммарная площадь герминативных центров лимфоидных фолликулов/количество лимфоидных фолликулов;
- площадь периартериальной зоны лимфоидного фолликула = суммарная площадь периартериальной зоны лимфоидных фолликулов/количество лимфоидных фолликулов;
Для каждого лабораторного животного было проведено по 10 измерений в случайно выбранных срезах из разных отделов органа.
Окраска цитологических мазков селезенки проводилась по методу Паппенгейма.
Препараты были исследованы с помощью микроскопа Micros МС-50 (Австрия), фоторегистрацию осуществляли цифровой камерой cam V400.
Статистический анализ
Для каждого ряда значений показателя вычисляли среднюю арифметическую, стандартную ошибку среднего. Достоверность отличий в сравниваемых выборках проведено по критерию Манна-Уитни (U). Статистическая обработка данных проведена с помощью программного пакета SPSS Statistics (версия 17.0). Вероятность различий считалась достоверной при значениях p<0,05.
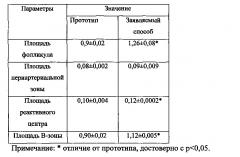
Как видно из таблицы, на 7 сутки по заявляемому способу данные морфометрического анализа, отражающие состояние лимфоидной ткани селезенки (площадь фолликула, площадь В-зоны фолликула, площадь реактивного центра), существенно выше, чем в прототипе. Анализ результатов цитограммы селезенки подтверждает данные морфометрического анализа. Так, в цитограмме селезенки установлено достоверное повышение содержания бластов, лимфоцитов и плазматических клеток. Таким образом выявлено, что трансплантация плацентарных ММСК и ГСК (заявляемый способ) влияет на клеточные и тканевые параметры лимфоидной ткани селезенки селезенки, отражающие процессы миграции, пролиферации и дифференцировки в существенно большей степени, чем прототип.
Способ позволяет активировать регенерацию лимфоидной ткани селезенки.
Способ восстановления лимфоидной ткани селезенки лабораторных животных, отличающийся тем, что лабораторным животным через 20 мин после облучения проводят внутривенную аллогенную трансплантацию мультипотентных стромальных клеток (ММСК) и гемопоэтичных стволовых клеток (ГСК), полученных из хориона плаценты лабораторных животных, при этом ММСК вводят в дозе 6,2 млн клеток/кг, а ГСК - в дозе 330 тыс. клеток/кг.