Способ определения стадии грибовидного микоза
Иллюстрации
Показать всеСпособ определения стадии грибовидного микоза относится к медицине, а именно к дерматовенерологии, и может быть использован для определения стадии грибовидного микоза - наиболее часто встречаемой нозологической разновидности первичных кожных лимфом. Сущность способа: у больного берут биопсию кожи из очага поражения, затем проводят иммуногистохимические исследования с использованием моноклональных антител CD3, CD4 и Ki67 путем компьютерной морфометрии. Затем усредняют данные показатели и рассчитывают суммарную удельную значимость иммунопозитивности указанных моноклональных антител по формуле: F=1,75*Х1+2,03*Х2+12,81*Х3+0,22, где: F - суммарная удельная значимость иммунопозитивности моноклональных антител CD3, CD4 и Ki67; X1 - среднее значение объемной доли позитивной окраски CD3; Х2 - среднее значение объемной доли позитивной окраски CD4; Х3 - среднее значение объемной доли позитивной окраски Ki67; 1,7; 2,03; 12,81 и 0,22 - поправочные коэффициенты. При значении F от 0,220 до 1,535 диагностируют эритематозно-пятнистую стадию, при значении F от 1,536 до 2,888 диагностируют инфильтративно-бляшечную стадию, а при значении F от 2,889 до 4,700 - опухолевую стадию грибовидного микоза. Изобретение обеспечивает повышение объективности и точности диагностирования стадии грибовидного микоза. 8 ил., 4 табл., 3 пр.
Реферат
Изобретение относится к медицине, а именно к дерматовенерологии, и может быть использовано для определения стадии грибовидного микоза - наиболее часто встречаемой нозологической разновидности первичных кожных лимфом.
Грибовидный микоз (ГМ) - форма первичной эпидермотропной Т-клеточной лимфомы кожи, характеризующаяся пролиферацией малых и средних Т-лимфоцитов с наличием церебриформных ядер, сопровождающаяся этапностью клинических проявлений в виде пятен, бляшек и опухолей. Выделяют 3 клинические стадии развития классического варианта течения ГМ: I стадию - пятнисто-эритематозную, II стадию - инфильтративно-бляшечную и III стадию - опухолевую [1, 2, 3].
Своевременная диагностика и правильное установление стадии развития ГМ являются приоритетными задачами дерматовенеролога и гематолога (онколога), поскольку имеют решающее значение при выборе оптимальной тактики лечения больного и определяют долгосрочный прогноз заболевания. Так, терапия ранних стадий ГМ (пятнисто-эритематозная и инфильтративно-бляшечная) предусматривает консервативный подход с постепенным наращиванием потенциала лечебных методов и технологий от тактики «наблюдай и жди» и наружной терапии топическими глюкокортикостероидами до применения ретиноидов, интерферона-α, метотрексата, ультрафиолетового облучения спектра В (311 нм), ПУВА-терапии и локальной лучевой терапии, тогда как осуществление специализированной медицинской помощи больным с поздних стадиями ГМ в учреждениях онкогематологического профиля предусматривает уже «агрессивный» подход с применением арсенала системной химиотерапии, биологических препаратов, электронно-лучевой терапии и аллогенной трансплантации гемопоэтических стволовых клеток [1, 2, 4].
Диагностический процесс при ГМ предусматривает ряд логически связанных этапов, сочетающих оценку анамнеза и клинических проявлений заболевания, анализ данных морфологических и иммуногистохимических (ИГХ) исследований, фиксирующих наличие злокачественной лимфоидной (клональной) пролиферации в коже. При этом иммуногистохимические исследования биоптата кожи считаются «золотым стандартом» диагностики ГМ, на что указывают клинические рекомендации Европейских стран и России [1, 2, 4].
Анализ результатов иммуногистохимических исследований биоптата кожи в диагностике ГМ проводится на основании оценки позитивности маркеров опухолевых клеток - антигенов кластеров дифференцировки (CD) на поверхности лимфоцитов. При этом врач - патоморфолог, анализирующий иммуногистохимические реакции, использует описательные и качественные приемы оценки выраженности окрашивания маркеров с применением критериев «отрицательная/положительная реакция».
Тем не менее, в литературе встречаются и усовершенствованные методики, направленные на объективизацию способа оценки иммуногистохимических маркеров с использованием критериев и балльной шкалы в зависимости от процента окрашивания опухолевых клеток (полуколичественные методы). Методика с использованием критериев предполагает следующие условные (субъективные) оценки: «0» - отсутствие окрашивания или окрашивание менее 10% опухолевых клеток с любой интенсивностью; «1+» - слабое неполное мембранное окрашивание более 10% опухолевых клеток; «2+» - от слабого до умеренного окрашивания всей цитоплазматической мембраны более 10% опухолевых клеток; «3+» - сильное окрашивание всей цитоплазматической мембраны более 10% опухолевых клеток [5].
Из числа полуколичественных методов оценки ИГХ-маркеров одним из наиболее широко применяемых в онкомаммологии и гинекологии является расчет диагностических баллов по Allred D.C. Данная методика суммарной бальной оценки состоит из двух разделов, где раздел «а» - доля окрашенных опухолевых клеток от 0 до 5 баллов (0 баллов - отсутствие окрашивания; 1 балл - количество окрашенных клеток >0, но меньше 1/100; 2 балла - от >1/100 до 1/10; 3 балла - от >1/10 до 1/3; 4 балла - от >1/3 до 2/3; 5 баллов - от >2/3 до 1); раздел «б» - оценка интенсивности окраски опухолевых клеток (от 0 до 3 баллов). Далее вычисляется суммарный балл, состоящий из доли и интенсивности окраски изучаемых клеток, однако определение процента и интенсивности окрашивания ИГХ-маркеров также продолжает основываться на субъективной оценке исследователя [6, 7].
В отечественной практике Сыдиковым А.А., Заславским Д.В. и соавторами для анализа результатов иммуногистохимических реакций был использован полуколичественный метод, где экспрессия исследуемого маркера расценивалась как слабая «+» при наличии окрашенных гранул в 1-50-ти клетках, умеренная «++» - в 51-100 клетках и резко выраженная «+++» - в 101 и более клетках, в четырех полях зрения, также основанный на субъективной оценке данных врачом-патоморфологом [8].
Известен патент на изобретение, выполненный Поповым Ю.В., Бурыкиной П.Н. и соавторами в 2015 году, где для оценки результатов иммуногистохимических реакций у пациенток с миомой матки был использован 6-бальный полуколичественный метод: отсутствие иммуноокрашенных клеток - 0 баллов; менее 5% иммуноокрашенных клеток - 0,5 балла, менее 20% иммуноокрашенных клеток - 2 балла; от 20 до 40% окрашенных клеток - 4 балла; и более 40% окрашенных клеток - 6 баллов [9].
Описанные качественные и полуколичественные приемы оценки выраженности окрашивания маркеров не лишены субъективной составляющей врача-патоморфолога, в связи с этим, использование методов количественной оценки результатов иммунофенотипирования клеток позволит объективизировать диагностический процесс, что соотносится с современными критериями доказательной медицины, своевременностью и точностью верификации диагноза.
Наиболее близким по существу к рассматриваемой проблеме является метод количественной оценки пролиферативной активности лимфоцитов в коже больных грибовидным микозом, разработанный Жуковым А.С., Белоусовой И.Э., Хайрутдиновым В.Р. и соавторами, с использованием системы компьютерного анализа микроскопических изображений, состоящей из светооптического микроскопа, цифровой камеры и персонального компьютера с интегрированным программным обеспечением «Морфология 5.2» [10].
Указанный метод был использован для оценки пролиферативной активности лимфоцитов в коже у 18 больных ГМ, группу которых составили 9 больных с I стадией, 7 больных - со II стадией и 2 больных - с III стадией заболевания. В каждом случае проводился анализ по 3 полям зрения при увеличении 200, выбранных с учетом наибольшей позитивности исследуемых клеток. Данный метод позволил авторам получить статистически значимые различия в относительной площади экспрессии CD3 и Ki67 клеток в дерме у больных ГМ в зависимости от стадии заболевания (7,16±0,31 и 18,8±0,61 - при ГМ I стадии, 0,39±0,21 и 0,89±0,18 - при ГМ II+III стадии соответственно).
Недостатками указанного метода является следующее:
- в проведенных авторами исследованиях были объединены в одну группу больные со II и III стадиями ГМ, тогда как именно нахождение статистических различий в позитивности лимфоцитов кожи при II и III стадиях развития онкопроцесса имеет принципиальное значение для определения дальнейшей тактики лечения больного и прогноза заболевания;
- в данной работе был использован автоматизированный анализ позитивной окраски лишь двух иммуномаркеров CD3 и Ki67, то есть была проведена оценка только общей популяции всех зрелых Т-лимфоцитов и их пролиферативной активности, тогда как при развитии первичных лимфом кожи патогенетически значимым является изучение дисбаланса между пролиферирующими лимфоцитами и процессами их апоптоза, в чем участвуют CD8 цитотоксические клетки, в том числе с продукцией Granzyme В,
- не были изучены субпопуляции Т-лимфоцитов в дерме, а именно Т-хелперная субпопуляция лимфоцитов (CD4+), соотношение хелперно-индукторной субпопуляции лимфоцитов и супрессорно-цитотоксической (CD4+/CD8+),
- данный метод применим для научного изучения диагностической значимости пролиферативной активности лимфоцитов эпидермиса и дермы у больных грибовидным микозом и бляшечным парапсориазом, тогда как дифференциальная диагностика между стадиями ГМ важна в практическом смысле и определяет подходы к терапии и степень ее «агрессивности».
Задачей изобретения является разработка способа определения стадии грибовидного микоза на основании оценки позитивности иммуногистохимических маркеров биоптата кожи.
Технический результат, который будет достигнут от использования данного изобретения, заключается в повышении объективности и точности диагностирования стадии грибовидного микоза.
Технический результат достигается тем, что в способе определения стадии грибовидного микоза, включающем забор у больного биопсии кожи из очага поражения, проведение иммуногистохимических исследований с использованием моноклональных антител CD3 и Ki67, их количественную оценку и установление на этом основании стадии заболевания, для исследований дополнительно используют моноклональное антитело CD4, определяют значения объемных долей позитивного окрашивания моноклональнми антителами CD3, CD4 и Ki67 путем компьютерной морфометрии, затем усредняют данные показатели и рассчитывают суммарную удельную значимость иммунопозитивности данных антител по формуле:
F=1,75*Х1+2,03*Х2+12,81*Х3+0,22,
где: F - суммарная удельная значимость иммунопозитивности моноклональных антител CD3, CD4 и Ki67;
X1 - среднее значение объемной доли позитивной окраски CD3;
Х2 - среднее значение объемной доли позитивной окраски CD4;
Х3 - среднее значение объемной доли позитивной окраски Ki67;
1,75; 2,03; 12,81 и 0,22 - поправочные коэффициенты.
При значении F от 0,220 до 1,535 диагностируют эритематозно-пятнистую стадию, при значении F от 1,536 до 2,888 диагностируют инфильтративно-бляшечную стадию, а при значении F от 2,889 до 4,700 - опухолевую стадию грибовидного микоза.
Сущность изобретения состоит в статистически выверенном и реализованном в формуле подходе к диагностике стадий грибовидного микоза, учитывающем объективизированный вклад каждого из оцениваемых показателей в общую результирующую диагностику.
Из анализа научно-технической и патентной литературы заявляемой совокупности используемых моноклональных антител CD3, CD4 и Ki67 для оценки стадии грибовидного микоза по предлагаемой формуле нами не выявлено, что позволяет сделать выводы о соответствии заявляемого технического решения критериям «новизна» и «изобретательский уровень».
В клинике ГБУ СО «УрНИИДВиИ» с целью улучшения процесса диагностики ГМ и объективизации результатов иммуногистохимических исследований были изучены имиджи биоптатов кожи 30 больных ГМ I, II и III стадий. Диагноз ГМ у каждого больного был установлен на основании анамнеза, клинической картины, результатов патоморфологического, иммуногистохимического и морфометрического методов исследования.
Иммунофенотипирование объектов исследования проводили в стандартных условиях на аппарате для иммуногистохимии Bond-maX LEICA (Германия) с использованием парафиновых срезов толщиной 4 мкм.
Патоморфологические и морфометрические исследования выполнены с использованием аппаратно-программного комплекса, состоящего из светового микроскопа для медико-биологических исследований Axio Imager М2, цифровой камеры AxioCam MRc 5 и специальной программы ZEN 2012 для ввода изображений, проведения измерений и документирования (ZEISS, Германия). Также в составе данного комплекса использованы персональный компьютер Intel Core i5-3570 3.4 GHz и автоматизированная система анализа изображений «SIAMS Photolab» (Россия, свидетельство об утверждении типа средства измерений RU.C.31.058.A №40862 от 28.07.2015 г., срок действия до 28.07.2020 г.).
Обработка изображений в системе «SIAMS Photolab» производится в цепочке взаимосвязанных ячеек, содержащих исходный имидж, результаты промежуточных этапов обработки, конечное обработанное изображение и результаты измерений в виде чисел, графиков и гистограмм. В системе предусмотрена генерация отчетов формата MS Word и экспорт изображений, числовых и текстовых данных в наиболее распространенные форматы.
Использование модуля колорометрической оценки результатов иммуногистохимических реакций системы анализа изображений «SIAMS Photolab» позволило получить квантифицированную оценку площади иммунопозитивности маркеров и объективизировать процесс диагностики ГМ.
В дерме больных ГМ на стандартной площади срезов кожи нами изучены параметры позитивности моноклональных антител (МКА) CD3, CD4, CD8, Ki67 и Granzyme В. Для данных исследований использованы по 5 имиджей в каждом наблюдении.
Результаты исследований поясняются следующими фигурами, где:
на фиг. 1 показаны исходные оцифрованные изображения биоптата кожи больного ГМ с наличием позитивного окрашивания CD3, CD4 и CD8 МКА;
на фиг. 2 - изображения иммунофенотипирования биоптата кожи больного ГМ после автоматизированной компьютерной обработки с точным выделением объектов;
на фиг. 3 - распределение значений функции F от значений доли позитивной окраски иммуномаркера CD3 у всех групп больных;
на фиг. 4 - распределение значений функции F от значений доли позитивной окраски иммуномаркера CD4 у всех групп больных;
на фиг. 5 - распределение значений функции F от значений доли позитивной окраски иммуномаркера Ki67 у всех групп больных;
на фиг. 6 - пятна на коже левой подмышечной области;
на фиг. 7 - пятна и бляшки на коже туловища;
на фиг. 8 - пятна, бляшки и единичные опухоли на коже.
Примеры исходных оцифрованных изображений биоптата кожи больного ГМ с наличием позитивного окрашивания CD3, CD4 и CD8 МКА (выявляются активированные Т-лимфоциты (коричневый цвет) в дерме, увеличение 400) представлены на фиг. 1.
Обработка оцифрованных изображений иммуногистохимических реакций у больных ГМ в системе анализа изображений «SIAMS Photolab» проводилась в несколько этапов: 1 - предобработка и первичное выделение маски, 2 - разделение масок, 3 - пороговая сегментация, 4 - измерение исследуемых объектов.
На завершающем этапе обработки изображений предусматривалось их контрастирование и более точное выделение определенным цветом измеряемых иммунопозитивных объектов с помощью функции пороговой сегментации (выделены активированные CD3, CD4 и CD8 Т-лимфоциты (зеленый цвет) в дерме, увеличение 400, фиг. 2).
В результате автоматизированных измерений выделенных на изображениях объектов по каждому из 5 исследуемых имиджей определялись следующие параметры (в мкм2):
1. Проанализированная площадь гистологического среза кожи.
2. Занимаемая площадь позитивного окрашивания иммуномаркером.
3. Объемная доля позитивного окрашивания иммуномаркером.
На основании обработки 5 имиджей формируется заключительный отчет по выполненному исследованию, содержащий гистограмму распределения объемных долей и таблицу формата MS Word с включением следующих данных:
1. Число проанализированных полей.
2. Проанализированная площадь гистологического среза кожи (мкм2).
3. Занимаемая площадь позитивного окрашивания иммуномаркером (мкм2).
4. Объемная доля позитивного окрашивания иммуномаркером.
5. Средняя объемная доля позитивного окрашивания иммуномаркером.
6. Среднеквадратичное отклонение объемной доли позитивного окрашивания иммуномаркером.
Предварительный анализ данных показал значительную вариабельность площади позитивной окраски иммуномаркерами в дерме у больных при стадийном развитии ГМ.
Для построения модели определения стадии заболевания исходными данными являлись значения площади позитивной окраски иммуномаркерами в дерме у больных ГМ. На основании фактических данных, полученных в результате заполнения стандартизованных карт, была создана электронная база данных в формате таблиц программы Microsoft Excel.
Дальнейшая разработка модели определения стадии ГМ осуществлялась в несколько этапов.
На первом этапе методом вероятностного анализа было проведено выявление нетипичных представителей для каждой из групп исследуемых больных ГМ, присутствие которых в выборке могло существенным образом исказить результаты анализа [11].
Произведен пересчет полученных фактических данных площади позитивной окраски иммуномаркерами в дерме у больных ГМ в безразмерные величины (доля площади иммуномаркеров xi). Для этого находилось отношение площади иммуномаркера Sим данного вида к общей площади среза Sср по формуле: xi=Sим/Sср.
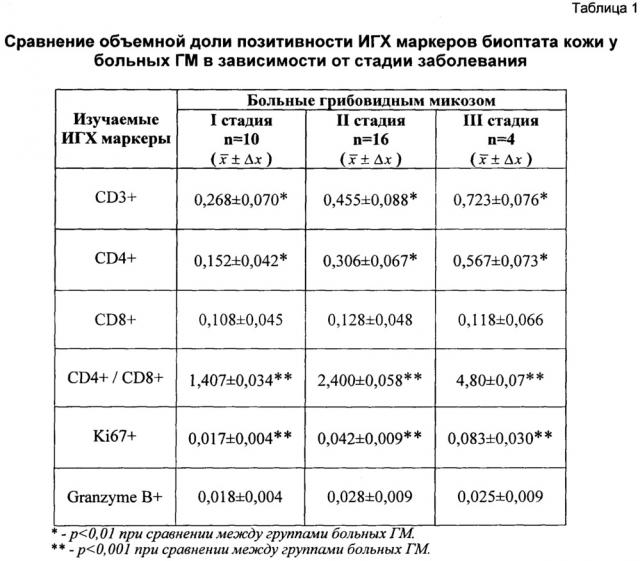
Далее определяли основные статистические характеристики значений доли площади иммуномаркеров: среднее значение , среднеквадратичное отклонение (СКО) Sx, ошибка выборки данных Δx для одного больного и одного иммуномаркера. Расчет производится по стандартным формулам статистической математики:
, , Δx=t⋅Sx,
где: xi - доля площади иммуномаркера в выборке данных данного пациента с определенной стадией заболевания, N - количество срезов одного иммуномаркера у данного пациента, t - коэффициент Стьюдента.
Вычисления проводились при уровне значимости р=0,001 и р=0,01.
При обобщении полученных данных таблицы 1 было отмечено, что изучение иммуноморфологических характеристик клеток дермального инфильтрата в биоптате кожи у больных ГМ продемонстрировало закономерные изменения их популяционного состава в динамике прогрессирования заболевания. Как видно из представленной таблицы 1, в группе больных с III (опухолевой) стадией ГМ наблюдалось достоверное увеличение количества всех зрелых Т-лимфоцитов (CD3+) и Т-хелперной субпопуляции лимфоцитов (CD4+), хелперно-индукторной субпопуляции лимфоцитов над супрессорно-цитотоксической (CD4+/CD8+) при сопоставлении с аналогичными показателями дермального инфильтрата у больных I (пятнисто-эритематозной) и II (инфильтративно-бляшечной) стадиями заболевания. Кроме этого, было обнаружено, что у больных ГМ в III стадии показатель объемной доли позитивности Ki67 (0,083±0,030), отражающий факт высокой пролиферативной активности исследованных клеток дермального инфильтрата, в 4,8 и в 1,9 раз соответственно, также превышал аналогичные показатели у больных в I и во II стадии заболевания. В исследуемых группах больных отмечалась недостоверная тенденция к увеличению объемной доли позитивности экспрессии Granzyme В+ на клетках инфильтрата и к снижению количества Т-цитотоксической субпопуляции лимфоцитов (CD8+) при развитии последующих стадий заболевания.
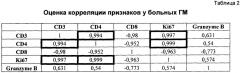
На втором этапе нами был проведен расчет коэффициентов корреляций изучаемых клинико-лабораторных показателей у всех больных ГМ для выявления разнонаправленных векторов у пациентов, входящих в одну группу. Были выявлены разнонаправленные векторы значений площади позитивного окрашивания иммуномаркерами у больных ГМ (таблица 2).
В соответствии с данными таблицы 2, у больных ГМ обнаружены сильные положительные корреляционные параллели между количеством CD3 и CD4, CD3 и Ki67, CD4 и Ki67. Согласно методам статистической математики обнаружена линейная зависимость между CD4 и Ki67. Обратную зависимость демонстрировали показатели CD3 и CD8, CD4 и CD8, Ki67 и CD8, Granzyme В и CD8. Количество Т-хелперной субпопуляции лимфоцитов (CD4) и показатель пролиферативной активности исследованных клеток дермального инфильтрата (Ki67) не имели существенной корреляционной связи с маркером апоптоза (Granzyme В).
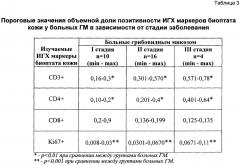
Методами нелинейной динамики [12, 13] определялись пороговые значения объемной доли позитивности ИГХ маркеров биоптата кожи у больных ГМ в зависимости от стадии заболевания (таблица 3).
На третьем этапе все отобранные информативные признаки приняли участие в выработке «решающих правил» диагностики. При помощи процедуры пошагового отбора переменных удалось снизить размерность «решающего правила» при сохранении максимальной правильности распознавания образов. Согласно таблицам 2 и 3 выделены три базисных показателя (CD3, CD4 и Ki67), которые максимально характеризуют векторную динамику стадийного развития заболевания.
Методом наименьших квадратов с учетом пороговых значений показателей были построены линейные функции F от объемной доли позитивной окраски иммуномаркерами CD3, CD4 и Ki67 у больных ГМ (фиг. 3-5).
На фиг. 3. показано распределение значений функции F от значений доли позитивной окраски иммуномаркера CD3 у всех групп больных (точками обозначены данные по CD3 из таблицы 1).
На фиг. 4 показано распределение значений функции F от значений доли позитивной окраски иммуномаркера CD4 у всех групп больных (точками обозначены данные по CD4 из таблицы 1).
На фиг. 5 показано распределение значений функции F от значений доли позитивной окраски иммуномаркера Ki67 у всех групп больных (точками обозначены данные по Ki67 из таблицы 1).
Регрессионным анализом и методом наименьших квадратов с учетом пороговых значений показателей была построена результирующая линейная функция F от объемной доли позитивной окраски иммуномаркерами (моноклональными антителами) CD3, CD4 и Ki67 у больных ГМ для определения стадии заболевания:
F=1,75*Х1+2,03*Х2+12,81*Х3+0,22,
где
F - суммарная удельная значимость иммунопозитивности указанных моноклональных антител;
X1 - среднее значение объемной доли позитивной окраски CD3,
Х2 - среднее значение объемной доли позитивной окраски CD4,
Х3 - среднее значение объемной доли позитивной окраски Ki67,
1,75; 2,03; 12,81 и 0,22 - поправочные коэффициенты.
Поправочные коэффициенты удельной значимости перед переменными X1, Х2 и Х3 и коэффициент 0,22 в функции F были подобраны экспериментальным путем.
В результате для каждой стадии ГМ были получены следующие значения функции F:
ГМ I (эритематозно-пятнистая стадия): 0,220≤F≤1,535;
ГМ II (инфильтративно-бляшечная стадия): 1,536≤F≤2,888;
ГМ III (опухолевая стадия): 2,889≤F≤4,700.
Данные значения интервалов были получены с уровнем значимости р<0,05.
Способ осуществляется следующим образом:
1. После подписания больным информированного согласия на исследование проводится инцизионная биопсия кожи на участке с наиболее выраженными клиническими проявлениями дерматоза.
2. По стандартным методикам изготавливаются парафиновые блоки и гистопрепараты кожи, выполняется ИФТ с использованием панели МКА, рекомендованной для диагностики ГМ [1].
3. Выполняется оцифровка изображений и отбор 5 имиджей для количественных исследований по критерию максимального содержания в них иммунопозитивных лимфоцитов.
4. Проводится автоматизированная обработка каждого из 5 исследуемых изображений в системе «SIAMS Photolab» с вычислением значений средних объемных долей позитивного окрашивания моноклональных антител CD3, CD4 и Ki67.
5. Для определения стадии ГМ у больного рассчитывается суммарная удельная значимость и значение каждого из исследуемых иммуномаркеров, подставив в уравнение значения соответствующих признаков по формуле:
F=1,75*Х1+2,03*Х2+12,81*Х3+0,22,
где X1 - среднее значение объемной доли позитивной окраски CD3, Х2 - среднее значение объемной доли позитивной окраски CD4, Х3 - среднее значение объемной доли позитивной окраски Ki67.
6. Сравнив между собой полученное значение переменной F у конкретного больного и пороговые значения обучающей выборки, делается заключение о наличии у больного соответствующей стадии ГМ.
Клинико-диагностическая апробация заявленного способа определения стадии ГМ:
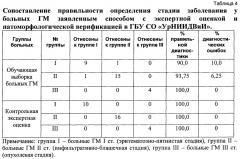
Описываемый способ определения стадии ГМ нами был применен в клинике ГБУ СО «УрНИИДВиИ» у 30 больных. В таблице 4 приведены данные сопоставления правильности определения стадии заболевания у больных ГМ заявленным способом с экспертной оценкой и патоморфологической верификацией.
Как следует из представленной таблицы 4, совпадение результатов проведенных тестов на обучающей выборке с экспертной оценкой и патоморфологической верификацией диагноза у больных свидетельствует о специфичности разработанного нами способа определения стадии ГМ.
Достоверность подобного разделения больных ГМ на стадии заболевания составила в среднем 94,58%, причем наибольшая достоверность была зафиксирована у больных с опухолевой стадией, наименьшая - в начальной стадии заболевания.
В качестве иллюстрации применения способа определения стадии ГМ у больных приводим собственные клинические наблюдения.
Больная З., 1959 года рождения, поступила в отделение хронических дерматозов ГБУ СО «УрНИИДВиИ» с жалобами на распространенные пятна и бляшки на коже верхних конечностей, груди, живота и спины, сопровождающиеся периодическим зудом, покалыванием, стягиванием и шелушением кожи.
Считает себя больной в течение 10-11 лет, когда без видимой причины на коже левой подмышечной области, груди и паховой области появились единичные пятна, без зуда и шелушения. На протяжении последующих нескольких лет на фоне инсоляции в летний период года отмечала исчезновение пятен на коже, и только в 2012 г. при появлении кожного зуда и увеличении размеров и цвета очагов поражения кожи пациентка была вынуждена впервые обратиться к дерматовенерологу. За период с 2012 по 2015 гг. с целью верификации диагноза дважды проводились диагностические биопсии кожи, больная ежегодно находилась на стационарном лечении с диагнозом парапсориаз, где ей назначались Н1-антигистаминные средства, десенсибилизирующая терапия, селективное УФО, ПУВА-ванны с 0,3% р-ром аммифурина, наружно - топические глюкокортикостероиды. В результате проводимой терапии достигались умеренные периоды клинической ремиссии.
За предыдущие 6-7 месяцев отметила ухудшение течения заболевания - усиление кожного зуда и появление новых пятен, в связи с чем была госпитализирована в отделение хронических дерматозов ГБУ СО «УрНИИДВиИ».
Анамнез жизни, аллергоанамнез и профессиональный маршрут у больной без особенностей. Наследственность по кожным заболеваниям и онкопатологии не отягощена.
Объективно: больная среднего роста, правильного телосложения, удовлетворительного питания. В легких дыхание везикулярное, хрипы не выслушиваются. Тоны сердца ясные, ритмичные, АД 120/80 мм рт.ст., ЧСС 76 в минуту. Живот мягкий, безболезненный при пальпации, печень и селезенка не увеличены. Лимфатические узлы мягкие, безболезненные и подвижные при пальпации. Физиологические отправления в норме.
Локальный статус: непораженные участки кожных покровов физиологической окраски, нормальной влажности и тургора. Видимые слизистые влажные, физиологической окраски. Кожный процесс имеет распространенный и симметричный характер, поражены боковые поверхности шеи, грудь, плечи, подмышечные области, предплечья и боковые поверхности живота. Представлен буровато-розовыми пятнами, диаметром до 5,5 см, с четкими границами и шероховатой поверхностью. На коже живота и подмышечных областей присутствуют единичные пятна буроватого цвета, диаметром до 3,5 см, с умеренной инфильтацией и незначительным шелушением в центральной части. На поверхности пятен отсутствует рост волос, имеются единичные экскориации с точечными геморрагическими корочками, дермографизм белый (фиг. 6).
Лабораторные данные. Общий анализ крови: Hb - 130 г/л, эр. - 4,2×1012/л, лейк. - 5,1×109/л, нейтр. - 2,9×109/л, эоз. - 0,1×109/л, лимф. - 1,7×109/л, мон. - 0,4×109/л, СОЭ - 10 мм/ч. В общем анализе мочи и биохимической гепатограмме отклонений не выявлено. Комплекс серологических реакций к Treponema pallidum отрицательный. Антитела к ВИЧ, гепатитам В и С не обнаружены.
Проведенное гистологическое исследование биоптата кожи выявило наличие в верхних отделах дермы умеренно выраженного очагового лимфоцитарного инфильтрата с признаками эпидермотропизма.
Иммуногистохимические препараты кожи больной нами были подвергнуты автоматизированной морфометрии с использованием компьютерной программы «SIAMS-Photolab», вычисленные показатели составили: среднее значение объемной доли позитивной окраски CD3=0,21188, среднее значение объемной доли позитивной окраски CD4=0,1014447, среднее значение объемной доли позитивной окраски Ki67=0,02525.
Для определения стадии ГМ указанным способом в уравнение были подставлены значения соответствующих признаков:
F=1,75*0,21188+2,03*0,1014447+12,81*0,02525+0,22
При сравнении с обучающей выборкой полученное значение F=1,13246 у данной больной имело числовые параметры, характерные для I стадии ГМ (0,220≤F≤1,535). На основании результатов патоморфологического, иммуногистохимического исследования биоптата кожи с использованием способа определения стадии заболевания у больной был установлен диагноз: первичная кожная лимфома: грибовидный микоз, эритематозно-пятнистая стадия.
Больной Р., 1980 г. рождения, поступил в клинику ГБУ СО «УрНИИДВиИ» для уточнения диагноза. Болен в течение 6 лет, когда впервые заметил появление пятна на коже левой лопаточной области. Сезонности обострений не отмечал, наблюдал усиление окраски пятна и появление кратковременного зуда на фоне инсоляции. При появлении пятен на других участках кожного покрова в ноябре 2014 г. впервые обратился к дерматологу по месту жительства. Лечение у дерматолога с диагнозом парапсориаз? и использованием Н1-антигистаминных препаратов, топических глюкокортикостероидов давало лишь кратковременный эффект.
За предыдущие 2-3 месяца отметил прогрессирование заболевания, усиление окраски пятен и появление новых элементов на коже, сопровождающихся интенсивным зудом.
Анамнез жизни, аллергоанамнез и профессиональный маршрут у больного без особенностей. Наследственность по кожным заболеваниям и онкопатологии не отягощена. При общем осмотре патологических отклонений по системам и органам не выявлено. Лимфатические узлы мягкие, безболезненные и подвижные при пальпации. Физиологические отправления в норме.
Локальный статус: кожный процесс имеет распространенный характер. На коже левой лопаточной области, левой половины груди, левой подмышечной области и правого бедра присутствуют буровато-розовые пятна и умеренно инфильтрированные бляшки диаметром до 7 см, овальной формы, с четкими границами и шероховатой поверхностью. На поверхности пятен и бляшек отсутствует рост волос, имеются экскориации с геморрагическими корочками, дермографизм белый (фиг 7).
Лабораторные данные. Общий анализ крови: Hb - 156 г/л, эр. - 5,16×1012/л, лейк. - 7,6×109/л, нейтр. - 5,4×109/л, эоз. - 0,3×109/л, лимф. - 1,5×109/л, мон. - 0,3×109/л, СОЭ - 2 мм/ч. В общем анализе мочи и иммунограмме отклонений не выявлено. В биохимической гепатограмме - повышение общего билирубина до 23,0 мкмоль/л. Комплекс серологических реакций к Treponema pallidum отрицательный. Антитела к ВИЧ, гепатитам В и С не обнаружены.
Патоморфологическое исследование биоптата кожи больного: в верхних отделах дермы присутствует неравномерно выраженный, диффузно-очаговый, эпидермотропный инфильтрат из лимфоидных клеток малого и среднего размера, местами «размывающий» дермо-эпидермальную границу с формированием в эпидермисе небольших скоплений типа микроабсцессов Потрие.
Иммуногистохимическое исследование биоптата кожи больного: опухолевые клетки экспрессируют CD3, CD4 и CD8; В-лимфоциты (CD20) в виде единичных скоплений среди опухолевых клеток; определяются единичные Т-лимфоциты, экспрессирующие CD7, CD8 и Granzyme В.
Иммуногистохимические препараты биоптата кожи больного были подвергнуты морфометрии с использованием компьютерной программы «SIAMS-Photolab», вычисленные показатели составили: среднее значение объемной доли позитивной окраски CD3=0,51, среднее значение объемной доли позитивной окраски CD4=0,131, среднее значение объемной доли позитивной окраски Ki67=0,059437.
Для определения у данного больного стадии ГМ указанным способом в уравнение были подставлены значения соответствующих признаков:
F=1,75*0,51+2,03*0,131+12,81*0,059437+0,22
При сравнении с обучающей выборкой полученное значение F=2,13981 у данного больного имело числовые параметры, характерные для II стадии ГМ (1,536≤F≤2,888).
На основании данных гистологического и иммуногистохимического методов исследования биоптата кожи и результатов, полученных заявленным способом, больному был установлен диагноз: первичная лимфома кожи, грибовидный микоз, инфильтративно-бляшечная стадия.
Больной В., 1955 г. рождения, поступил в клинику ГБУ СО «УрНИИДВиИ» с жалобами на распространенные высыпания на коже туловища и верхних конечностей, сопровождающиеся периодическим интенсивным зудом, шелушением и стягиванием кожи. Болеет в течение 4 лет, когда впервые возникло пятно на коже тыльной поверхности правой кисти. В течение последующих нескольких месяцев обратил внимание на появление аналогичных пятен на коже туловища. Наблюдался у дерматовенеролога по месту жительства (г. Тюмень) с диагнозом крупнобляшечный парапсориаз, на фоне наружного применения топических глюкокортикостероидов отмечалось кратковременное улучшение.
Анамнез жизни, аллергоанамнез и профессиональный маршрут у больного без особенностей. Наследственность по кожным заболеваниям и онкопатологии не отягощена. При общем осмотре патологических отклонений по системам и органам не выявлено. Лимфатические узлы мягкие, безболезненные и подвижные при пальпации. Физиологические отправления в норме.
Локальный статус: непораженные участки кожных покровов физиологической окраски, нормальной влажности и тургора. Видимые слизистые влажные, физиологической окраски. Кожный процесс имеет распространенный характер, поражены - грудь, живот, поясничная область, плечи, предплечья и тыльные поверхности кистей, представлен пятнами, бляшками и единичными опухолевыми элементами. На коже груди, живота, предплечий и поясничной области имеются многочисленные пятна розового и бледно-красного цвета, диаметром до 8-9 см, с четкими границами, без шелушения и экскориаций. На коже правой подлопаточной области, разгибательной поверхности левого предплечья и поясничной области присутствуют округлые бляшки, кирпично-красного цвета, диаметром до 7 см, с точечными геморрагическими корочками в местах экскориаций. На поверхности пятен и бляшек отсутствует рост волос, имеются единичные трещинки в местах физиологических складок кожи, незначительное мелкопластинчатое шелушение. На коже правой подмышечной области отмечены 2 опухолевидных элемента, округлой формы, диаметром 0,8 см и 1,5 см, ярко-красного цвета, с гладкой поверхностью, дермографизм белый (фиг. 8).
Лабораторные данные. Общий анализ крови: Hb - 137 г/л, эр. - 4,89×1012/л, лейк. - 5,1×109/л, нейтр. - 2,8×109/л, эоз. - 0,4×109/л, лимф. - 1,3×109/л, мон. - 0,5×109/л, СОЭ - 4 мм/ч. В общем анализе мочи и иммунограмме отклонений не выявлено. В биохимической гепатограмме - повышение холестерина до 5,77 ммоль/л. Комплекс серологических реакций к Treponema pallidum отрицательный. Антитела к ВИЧ, гепатитам В и С не обнаружены.
Патоморфологическое исследование биоптата кожи больного: в верхних и средних отделах дермы присутствует плотный, полосовидный, эпидермотропный инфильтрат из лимфоидных клеток разных размеров, «размывающий» дермо-эпидермальную границу и проникающий в эпидермис, в котором прослеживается очаговая деструкция. Определяются множественные микроабсцессы Потрие. Митотическая активность достаточно высокая.
Иммуногистохимические препараты биоптата кожи больного были подвергнуты морфометрии с использованием компьютерной программы «SIAMS-Photolab», вычисленные показатели составили: среднее значение объемной доли позитивной окраски CD3=0,713, среднее значение объемной доли позитивной окраски CD4=0,581, среднее значение объемной доли позитивной окраски Ki67=0,0487.
Для определения у данного больного стадии ГМ указанным способом в уравнение были подставлены значения соответствующих признаков:
F=1,75*0,781+2,03*0,476+12,81*0,117+0,22
При сравнении с обучающей выборкой полученное значение F=4,05 у данного больного имело числовые параметры, характерные для III стадии ГМ (2,889≤F≤4,700).
На основании результатов патоморфологического, иммуногистохимического и морфометрического методов исследования биоптата кожи и данных, полученных заявленным способом, больному В. был установлен диагноз: первичная лимфома кожи, грибовидный микоз, опухолевая стадия.
Использованная литература
1. Федеральные клинические рек