Режимы дозирования для соединений класса эхинокандинов
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к инфекционным болезням, и может быть использована для лечения грибковой инфекции. Для этого применяют водный раствор, включающий соединение 22, имеющее структурную формулу
или его фармацевтически приемлемую соль, который вводят пациенту в виде внутривенной инфузии, внутривенного болюса или подкожно, либо фармацевтическую композицию, содержащую эффективное количество соединения 22, причем указанная композиция является лиофилизированной либо представляет собой водный раствор. Группа изобретений обеспечивает повышение эффективности лечения грибковой инфекции при снижении дозировки и частоты введения препарата за счет улучшенного фармакокинетического профиля соединения 22. 3 н. и 12 з.п. ф-лы, 22 ил., 14 табл., 13 пр.
Реферат
Сведения о предшествующем уровне техники
Данное изобретение относится к области лечения грибковых инфекций.
Потребность в новых противогрибковых терапиях является значительной, и особенно острой в области медицины. Для современной системы оказания медицинской помощи едва ли не самую большую проблему представляют иммунокомпромизированные пациенты. За последние три десятка лет частота грибковых инфекций у этих пациентов значительно увеличилась (Herbrecht, Eur. J. Haematol., 56:12, 1996; Cox et al., Curr. Opin. Infect. Dis., 6:422, 1993; Fox, ASM News, 59:515, 1993). Глубокие микозы все в большей степени наблюдаются у пациентов, перенесших трансплантацию органов, и у пациентов, получавших агрессивную химиотерапию по поводу рака (Alexander et al., Drugs, 54:657, 1997). Наиболее распространенными патогенными микроорганизмами, связанными с инвазивными грибковыми инфекциями, являются оппортунистический дрожжевой грибок Candida albicans и плесневый (мицелиальный) гриб Aspergillus fumigatus (Bow, Br. J. Haematol., 101:1, 1998; Wamock, J. Antimicrob. Chemother., 41:95, 1998). Ежегодно насчитывается 200000 пациентов, у которых развиваются нозокомиальные грибковые инфекции (Beck-Sague et al., J. Infect. Dis., 167:1247, 1993). Также росту числа грибковых инфекций способствует появление синдрома приобретенного иммунодефицита (AIDS), когда практически все пациенты поражаются некоторой формой микоза во время течения заболевания (Alexander et al., Drugs, 54:657, 1997; Hood et al., J. Antimicrob. Chemother., 37:71, 1996). Наиболее распространенными организмами, встречающимися у этих пациентов, являются Cryptococcus neoformans, Pneumocystis carinii, и С. albicans (HIV/AIDS Surveillance Report, 1996, 7(2), Year-End Edition; Polis, M.A. et al., AIDS: Biology, Diagnosis, Treatment and Prevention, fourth edition, 1997). Регулярно сообщается о новых оппортунистических грибковых патогенах, таких как Penicillium marneffei, С. krusei, С. glabrata, Histoplasma capsulatum и Coccidioides immitis, у иммунокомпромизированньгх пациентов по всему миру.
Разработка противогрибковых схем лечения продолжает оставаться проблемой. Имеющиеся в настоящее время лекарственные средства для лечения грибковых инфекций включают амфотерицин В, полиен-макролид, который связывается со стеролами клеточной мембраны грибов, флуцитозин, фторпиримидин, который препятствует биосинтезу белка и ДНК грибов, и различные азолы (например, кетоконазол, итраконазол и флуконазол), которые ингибируют биосинтез стерола грибковой мембраны (Alexander et al., Drugs, 54:657, 1997). Несмотря на то, что амфотерицин В обладает широким спектром активности и рассматривается как «золотой стандарт» противогрибковой терапии, его применение ограничено по причине реакций, связанных с инфузией, и нефротоксичности (Wamock, J. Antimicrob. Chemother., 41:95, 1998). Применение флуцитозина также ограничено по причине развития резистентных микроорганизмов и его узкого спектра активности. Широкое применение азолов вызывает появление клинически резистентных штаммов Candida spp. По причине проблем, связанных с существующими в настоящее время терапиями, поиск новых способов лечения продолжается.
Когда эхинокандин каспофунгин был одобрен для продажи в 2001 году, он представлял первый новый класс противогрибковых агентов, который был одобрен за десятилетие. С этого времени два других эхинокандиновых противогрибковых агента, анидулафунгин и микафунгин, были одобрены на различных рынках. Каждый агент в этом классе соединения действует путем ингибирования β-1,3-глюкансинтазы, которая является ключевым ферментом, участвующим в синтезе глюкана клеточной стенки многих грибов. Все эти три препарата изготовлены полусинтетически, начиная с природных продуктов, полученных посредством ферментации.
Эхинокандины представляют собой широкую группу противогрибковых агентов, которые обычно состоят из циклического гексапептида и липофильного хвоста, который присоединен к гексапептидному ядру посредством амидной связи. Хотя многие эхинокандины являются природными продуктами, клинически значимые члены этого класса все являются полу синтетическими производными. Хотя эхинокандины природного происхождения обладают некоторым уровнем противогрибковой активности, они не пригодны в качестве терапевтических средств, главным образом, из-за слабой растворимости в воде, недостаточной активности и/или гемолитического действия. Одобренные эхинокандины являются продуктами значительных усилий по созданию производных или аналогов, которые оказывают поддерживающее или улучшающее действие в результате ингибирования глюкансинтазы, но не вызывают гемолитических эффектов. В качестве терапевтических агентов они являются привлекательными соединениями в аспекте их периодов полувыведения из системного кровотока, широких терапевтических окон, профилей безопасности и относительного отсутствия взаимодействий с другими лекарственными средствами. К сожалению, слабое всасывание в кишечнике этих соединений обуславливает их доставку путем внутривенного вливания. Хотя пациенты, получающие эти лекарственные средства, часто госпитализируются с серьезными инфекциями, было бы весьма желательным, если бы существовала возможность перевода пациентов с внутривенной доставки в больничных условиях на пероральную доставку в домашних условиях, особенно если учесть, что курс лечения обычно превышает 14 дней. Кроме того, пероральный эхинокандин может расширить применение лекарственных средств этого класса для включения пациентов, у которых присутствуют легкие грибковые инфекции.
Краткое описание изобретения
Авторы изобретения раскрыли режимы дозирования и пероральные лекарственные формы для введения соединений класса эхинокандинов.
В первом аспекте изобретение предлагает способ лечения грибковой инфекции у субъекта путем (i) введения субъекту соединения класса эхинокандинов в дозе насыщения; и (ii) введения субъекту одной или нескольких поддерживающих доз соединения класса эхинокандинов, при этом каждую из дозы насыщения и поддерживающих доз вводят в количестве, которое в совокупности является достаточным для лечения грибковой инфекции. Например, дозу насыщения можно вводить путем инъекции (например, подкожно) или перорально, с последующими поддерживающими дозами, вводимыми перорально, внутривенно, назально, подкожно или трансдермально. В одном варианте осуществления дозу насыщения вводят внутривенно. Например, вводимую внутривенно (например, в виде болюса или инфузии) дозу насыщения можно вводить в количестве, достаточном для достижения средней устойчивой концентрации соединения класса эхинокандинов в плазме от 100 нг/мл до 20000 нг/мл (например, от 100 до 500, от 400 до 1000, от 800 до 3000, от 2000 до 7000, от 6000 до 10000, от 8000 до 14000 или от 12000 до 20000 нг/мл); можно вводить субъекту внутривенно в количестве соединения класса эхинокандинов на массу тела субъекта от 0.5 мг/кг до 20 мг/кг (например, от 0.5 до 2.0, от 1.0 до 4.0, от 3.0 до 10, от 8.0 до 15, от 13 до 20 мг/мг); и/или можно вводить субъекту внутривенно в количестве соединения класса эхинокандинов от 25 мг до 1400 мг (например, от 25 до 50, от 40 до 80, от 75 до 130, от 125 до 170, от 150 до 200, от 190 до 250, от 230 до 500, от 450 до 750, от 650 до 1000 или от 900 до 1400 мг) в течение периода 24 часа. Альтернативно, дозу насыщения можно вводить перорально. Например, субъекту вводят перорально в количестве соединения класса эхинокандинов от 250 мг до 4000 мг (например, от 250 до 500, от 400 до 800, от 750 до 1300, от 1250 до 1700 или от 1500 до 4000 мг) в течение периода 24 часа. В одном варианте осуществления любого из указанных выше способов поддерживающие дозы можно вводить в течение периода от 2 до 45 дней (например, от 2 до 10, от 7 до 14, от 10 до 21 или от 18 до 30 дней, или от 24 до 45 дней) после начала лечения. Поддерживающие дозы можно вводить, например, с частотой от одного раза в неделю до трех раз в день (например, один раз каждые 5-7 дней, один раз каждые 3 дня, через день, один раз в день, дважды в день или три раза в день). Соединение класса эхинокандинов может представлять собой соединение любой из формул (I), (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX) или выбрано из анидулафунгина, каспофунгина, микафунгина, соединения 22, или любого другого соединения класса эхинокандинов, описанного здесь, или их фармацевтически приемлемых солей. В определенных вариантах осуществления доза насыщения включает внутривенное введение от 50 до 400 мг (например, от 50 до 125, от 75 до 300 или от 100 до 400 мг) соединения 22 или его фармацевтически приемлемой соли. В некоторых вариантах осуществления способ включает поддерживающее дозирование, которое включает пероральное введение от 250 до 800 мг (например, от 250 до 300, от 275 до 450, от 425 до 625 или от 600 до 800 мг) соединения 22 или его фармацевтически приемлемой соли каждый день, или через день, или каждые три дня. В некоторых вариантах осуществления способ включает поддерживающее дозирование, которое включает подкожное введение от 25 до 150 мг (например, от 25 до 30, от 35 до 45, от 30 до 70, от 50 до 100, от 70 до 120 или от 110 до 150 мг) соединения 22 или его фармацевтически приемлемой соли каждый день, или через день, или один раз каждые три дня, или один раз каждые пять дней. В некоторых вариантах осуществления способ включает поддерживащее дозирование, которое включает внутривенное болюсное введение от 25 до 150 мг (например, от 25 до 30, от 35 до 45, от 30 до 70, от 50 до 100, от 70 до 120 или от 110 до 150 мг) соединения 22 или его фармацевтически приемлемой соли каждый день или через день, или каждые три дня, или один раз каждые пять дней.
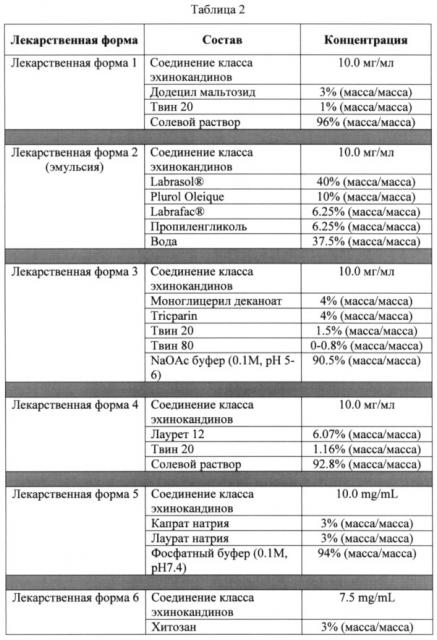
В одном конкретном варианте осуществления любого из указанных выше способов стадия (ii) включает пероральное введение субъекту фармацевтической композиции в виде стандартной лекарственной формы, включающей: (а) лекарственное средство, выбранное из соединений класса эхинокандинов и их солей, и (b) от 0.5% до 90% (масса/масса) (например, от 0.5% до 5%, от 2.5% до 7.5%, от 7% до 12%, от 10% до 25%, от 25% до 35%, от 30% до 50% или от 40% до 90% (масса/масса)) добавки, при этом добавка присутствует в количестве, достаточном для увеличения пероральной биодоступности соединений класса эхинокандинов или их солей. В конкретных вариантах осуществления добавка выбрана из ацилкарнитинов, алкилсахаридов, сахаридов сложных эфиров, жирных амидокислот, поверхностно-активных веществ - сульфоната аммония, желчных кислот и солей желчных кислот (включая холевую кислоту и ее соли), хитозана и его производных, жирных кислот и их солей или сложных эфиров, глицеридов, гидрофильных ароматических спиртов, пегилированных фосфолипидов, пептидных модуляторов плотных контактов эпителия, фосфолипидов, алкиловых эфиров полиэтиленгликоля, полигликозированных глицеридов, сложных эфиров полиглицерина и жирных кислот, поверхностно-активных веществ - полисорбата, карбоновых кислот, полиэтиленгликолей, и их смесей.
В конкретных вариантах осуществления указанных выше способов дозу насыщения вводят внутривенно (например, путем внутривенного болюса или инфузии), и поддерживающую дозу вводят перорально; дозу насыщения вводят подкожно, и поддерживающую дозу вводят перорально; дозу насыщения вводят внутривенно (например, путем внутривенного болюса или инфузии), и поддерживающую дозу вводят подкожно; дозу насыщения вводят подкожно, и поддерживающую дозу вводят подкожно; дозу насыщения вводят перорально, и поддерживающую дозу вводят перорально; или дозу насыщения вводят внутривенно (например, путем внутривенного болюса или инфузии), и поддерживающую дозу вводят путем инъекции (например, путем внутривенного болюса или инфузии, или путем подкожной инъекции). В конкретных вариантах осуществления способа, включающего внутривенный болюс, вводимое количество соединения класса эхинокандинов составляет от 50 мг до 500 мг (например, от 50 до 100, от 100 до 200, от 150 до 225, от 225 до 300, от 275 до 400 или от 400 до 500 мг) в единичной болюсной инъекции.
В связанном аспекте изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей: (а) соединение класса эхинокандинов или его фармацевтически приемлемую соль; и (b) от 0.5% до 90% (масса/масса) (например, от 0.5 до 5%, от 2.5% до 7.5%, от 7% до 12%, от 10% до 25%, от 25% до 35%, от 30%о до 50% или от 40% до 90% (масса/масса) добавки, при этом добавка присутствует в количестве, достаточном для увеличения пероральной биодоступности соединения класса эхинокандинов или его солей. В конкретных вариантах осуществления добавка выбрана из ацилкарнитинов, алкилсахаридов, сложных эфирова сахаридов, жирных амидокислот, поверхностно-активных веществ - сульфоната аммония, желчных кислот и солей желчных кислот (включая холевую кислоту и ее соли), хинозана и его производных, жирных кислот и их солей или сложных эфиров, глицеридов, гидрофильных ароматических спиртов, пегилированных фосфолипидов, пептидных модуляторов плотных контактов эпителия, фосфолипидов, алкиловых эфиров полиэтиленгликоля, полигликолизированных глицеридов, сложных эфиров полиглицерина и жирных кислот, поверхностно-активных веществ - полисорбата, карбоновых кислот, полиэтиленгликолей, и их смесей. В определенных вариантах осуществления фармацевтическая композиция может включать от 2% до 90% (масса/масса) (например, от 3% до 6%, от 3% до 8%, от 5% до 12%, от 8% до 16%, от 15%о до 25%, от 25% до 35%, от 35% до 65% или от 65% до 90% (масса/масса)) алкилсахарида или сложного эфира сахарида, необязательно дополнительно включая от 0.5% до 15% (масса/масса) (например, от 0.5% до 2.5%, от 1% до 4%, от 3% до 7%, от 5% до 10%, от 7% до 12% или от 11% до 15% (масса/масса)) поверхностно-активного вещества - полисорбата. В конкретных вариантах осуществления фармацевтическая композиция может включать от 2% до 90% (масса/масса) (например, от 3% до 6%, от 3% до 8%, от 5% до 12%, от 8% до 16%, от 15% до 25%, от 25% до 35%, от 35% до 65% или от 65% до 90% (масса/масса)) глицерида, необязательно дополнительно включая от 0.5% до 15% (масса/масса) (например, от 0.5% до 2.5%, от 1% до 4%, от 3% до 7%, от 5% до 10%, от 7% до 12% или от 1% до 15% (масса/масса) поверхностно-активного вещества - полисорбата. В некоторых вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 5%, от 3% до 8%, от 5% до 12%, от 10% до 18%, от 15% до 24%, от 20% до 30%, от 25% до 35%, от 30% до 50%, от 50% до 70% или от 65% до 90% (масса/масса)) жирной кислоты, или ее соли или сложного эфира. В определенных вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 6%, от 5% до 12%, от 10% до 18%, от 15% до 25%, от 20% до 35%, от 30% до 45%, от 40% до 60% или от 55% до 90% (масса/масса)) ацилкарнитина, необязательно дополнительно включая буфер с образованием под действием воды раствора, имеющего pH от 2.5 до 8. В некоторых вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 5%, от 3% до 8%, от 5% до 12%, от 10% до 18%, от 15% до 24%, от 20% до 30%, от 25% до 35%, от 30% до 50%, от 50% до 70% или от 65% до 90% (масса/масса)) карбоновой кислоты или ее соли. В определенных вариантах осуществления фармацевтическая композиция может включать от 1% до 90% (масса/масса) (например, от 2% до 5%, от 3% до 8%, от 5% до 12%, от 10% до 18%, от 15% до 24%, от 20% до 30%, от 25% до 35%, от 30% до 50%, от 50% до 70% или от 65% до 90% (масса/масса) полиэтиленгликолей. В конкретных вариантах осуществления фармацевтическая композиция включает аклилсахарид или сложный эфир сахарида, при этом массовое соотношение соединения класса эхинокандинов к алкилсахариду или сложному эфиру сахарида составляет от 1:1 до 1:20 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:5 до 1:20). В определенных вариантах осуществления фармацевтическая композиция включает глицерид, при этом массовое соотношение соединения класса эхинокандинов к глицериду составляет от 1:1 до 1:20 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:5 до 1:20). В некоторых вариантах осуществления фармацевтическая композиция включает жирную кислоту, при этом массовое соотношение соединения класса эхинокандинов к жирной кислоте или ее соли составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30). В конкретных вариантах осуществления фармацевтическая композиция включает ацилкарнитин (например, пальмитоилкарнитин или лауроилкарнитин), при этом массовое соотношение соединения класса эхинокандинов к ацилкарнитиу составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30). В конкретных вариантах осуществления фармацевтическая композиция включает карбоновую кислоту (например, лимонную кислоту, янтарную кислоту, винную кислоту, фумаровую кислоту, малеиновую кислоту, малоновую кислоту, глутаровую кислоту, адипиновую кислоту, молочную кислоту, яблочную кислоту, L-глутаминовую кислоту, L-аспарагиновую кислоту, глюконовую кислоту, глюкуроновую кислоту, салициловую кислоту или их смеси), при этом массовое соотношение соединения класса эхинокандинов к карбоновой кислоте составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30). В конкретных вариантах осуществления фармацевтическая композиция включает полиэтиленгликоль (например, PEG 100, PEG 400, PEG 1000 и т.п.), при этом массовое соотношение соединения класса эхинокандинов к полиэтиленгликолю составляет от 1:1 до 1:30 (например, от 1:1 до 1:3, от 1:2 до 1:5, от 1:4 до 1:10 или от 1:10 до 1:30).
В одном варианте осуществления любой из указанных выше фармацевтических композиций стандартная лекарственная форма включает от 50 до 4000 мг (например, от 50 до 300, от 250 до 750, от 500 до 1500 или от 1000 до 4000 мг) соединения класса эхинокандинов. Стандартная лекарственная форма может быть формулирована для немедленного высвобождения.
Фармацевтическая композиция может содержать соединение класса эхинокандинов любой из формул (I), (II), (III), (IV), (V), (VI), (VII), (VIII) или (IX) или выбрана из анидулафунгина, каспофунгина, микафунгина, соединения 22 или любого другого соединения класса эхинокандинов, описанного здесь, или его фармацевтически приемлемой соли.
В одном варианте осуществления любой из указанных выше фармацевтических композиций добавка присутствует в количестве, достаточном для достижения при пероральном введении субъекту средней биодоступности от 3% до 30% (например, 4±2%, 6±2%, 8±2%, 10±2%, 12±3%, 15±3%, 18±4%, 22±6% или 27±3%).
В связанном аспекте изобретение предлагает способ лечения грибковой инфекции у субъекта путем перорального введения субъекту фармацевтической композиции по изобретению, при этом фармацевтическую композицию вводят в количестве, эффективном для лечения инфекции.
Изобретение дополнительно предлагает способ лечения грибковой инфекции у субъекта путем подкожного введения субъекту водного раствора, включающего соединение 22 или его фармацевтически приемлемую соль, в количестве, которое является достаточным для лечения грибковой инфекции. В конкретных вариантах осуществления водный раствор можно вводить субъекту подкожно два раза в день, один раз в день, через день, каждые три дня или один раз в неделю в течение периода, составляющего, по меньшей мере, 2 недели, 3 недели, 4 недели, 2 месяца, 3 месяца или 4 месяца. Водный раствор может включать от 25 мг/мл до 500 мг/мл соединения 22 или его фармацевтически приемлемой соли (например, 30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл). В конкретных вариантах осуществления от 0.05 мл до 2.0 мл водного раствора вводят субъекту ежедневно. В некоторых вариантах осуществления количество соединения 22 или его фармацевтически приемлемой соли, вводимое подкожно субъекту, составляет от 10 мг до 100 мг (например, 15±5, 25±10, 50±20, 70±25 или 80±20 мг) ежедневно.
В связанном аспекте изобретение предлагает устройство для инъекции водного раствора соединения 22 или его фармацевтически приемлемой соли субъекту, включающее контейнер, содержащий от 0.05 мл до 10 мл водного раствора (например, от 0.2 мл до 0.5 мл, от 0.5 мл до 3 мл, от 2 мл до 5 мл, от 4 мл до 7 мл или от 6 мл до 10 мл водного раствора), и иглу. Например, устройство может представлять собой ручку-инъектор с предварительно заполненным картриджем, например, дозирующее устройство в виде ручки с микроиглой. В конкретных вариантах осуществления контейнер может представлять собой картридж. В конкретных вариантах осуществления устройство представляет собой предварительно заполненный шприц, содержащий от 0.05 мл до 1 мл (например, от 0.2 мл до 0.5 мл или 0.5 мл до 1 мл) водного раствора. В еще других вариантах осуществления водный раствор включает от 25 мг/мл до 500 мг/мл соединения 22 или его фармацевтически приемлемой соли, например, (30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл).
Изобретение дополнительно предлагает способ лечения грибковой инфекции у субъекта путем введения субъекту внутривенного болюса водного раствора, включающего соединение 22 или его фармацевтически приемлемую соль, в количестве, которое является достаточным для лечения грибковой инфекции. В конкретном варианте осуществления водный раствор включает от 25 мг/мл до 500 мг/мл (например, 30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл) соединения 22 или его фармацевтически приемлемой соли. Болюсную инъекцию можно вводить субъекту ежедневно, через день или каждые три дня или каждые 4-7 дней, или каждую неделю в течение периода, составляющего, по меньшей мере, 2 недели, 3 недели. 4 недели, 2 месяца, 3 месяца или 4 месяца. В некоторых вариантах осуществления количество соединения 22 или его фармацевтически приемлемой соли, вводимое в виде внутривенного болюса субъекту, составляет от 25 мг до 500 мг (например, 30±5, 40±10, 50±10, 75±25, 100±25, 150±25, 200±50, 300±100 или 500±100 мг) на болюсное введение.
Изобретение дополнительно предлагает соединение класса эхинокандинов или его соль в виде стандартной лекарственной формы, содержащей от 40 до 90% (масса/масса) неводного растворителя или апротонного растворителя (например, этанола, этиленгликоля, полиэтиленгликоля (например, PEG200, PEG400, PEG800) или пропиленгликоля), и одно или несколько усиливающих абсорбцию вспомогательных веществ, описанных здесь. Необязательно соединение класса эхинокандинов представляет собой соединение 22 или его соль.
Изобретение дополнительно предлагает способ лечения грибковой инфекции у субъекта, нуждающегося в этом, путем введения субъекту посредством внутривенной инфузии водного раствора, включающего соединение 22 или его фармацевтически приемлемую соль в количестве, которое является достаточным для лечения грибковой инфекции. В определенных вариантах осуществления инфузионный раствор включает от 0.5 мг/мл до 3.0 мг/мл (например, 0.75±0.25, 1.0±0.25, 1.5±0.25, 2.0±0.25 или 2.50±0.50 мг/мл) соединения 22 или его фармацевтически приемлемой соли. В конкретных вариантах осуществления способа соединение 22 или его фармацевтически приемлемую соль вводят субъекту в виде двух или более внутривенных инфузий или внутривенных болюсов один раз каждые от 5 до 8 дней (например, еженедельно в течение периода, по меньшей мере, 4 недели, 6 недель, 8 недель или 12 недель). В другом варианте осуществления способ дополнительно включает после внутривенной инфузии пероральное введение от 200 мг до 1000 мг (например, 250±50, 300±50, 400±50, 500±50, 600±50, 700±50, 800±50 или 900±50 мг) соединения 22 или его фармацевтически приемлемой соли субъекту в течение периода, по меньшей мере, от 5 до 8 дней (например, ежедневно в течение периода, по меньшей мере, 2 недели, 4 недели, 6 недель, 8 недель или 12 недель).
Изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей от 25 мл до 500 мл (например, 50±25, 100±25, 150±50, 250±50, 350±50 или 400±100 мл) водного раствора, содержащего от 0.50 мг/мл до 3 мг/мл (например, 0.75±0.25, 1.0±0.25, 1.5±0.25, 2.0±0.25 или 2.50±0.50 мг/мл) соединения 22 или его фармацевтически приемлемой соли, при этом стандартная лекарственная форма является пригодной для внутривенной инфузии субъекту.
В связанном аспекте изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей от 1 мл до 10 мл (например, 1.5±0.5, 3±1, 5±2 или 7.5±2.5 мл) водного раствора, содержащего от 25 мг/мл до 500 мг/мл (например, 30±5, 40±10, 50±10, 60±10, 70±10, 80±10, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл) соединения 22 или его фармацевтически приемлемой соли, при этом стандартная лекарственная форма пригодна для внутривенной болюсной инъекции субъекту.
В еще другом связанном аспекте изобретение предлагает фармацевтическую композицию в виде стандартной лекарственной формы, включающей от 0.05 мл до 1.0 мл (например, 0.2±0.1, 0.5±0.25, 0.75±0.25 или 0.9±0.1 мл) водного раствора, содержащего от 85 мг/мл до 300 мг/мл (например, 100±15 мг/мл, 130±20 мг/мл, 160±30 мг/мл, 190±30 мг/мл, 250±50 мг/мл или 400±100 мг/мл) соединения 22 или его фармацевтически приемлемой соли, при этом стандартная лекарственная форма пригодна для подкожной инъекции субъекту.
В любой из указанных выше фармацевтических композиций, содержащих стандартную дозу, формулированных для инъекции, фармацевтическая композиция может (i) не содержать стабилизирующие сахара (например, фруктозу, сахарозу, трехалозу или их комбинации), (ii) включать поверхностно-активное вещество (например, Твин 20, Твин 80 или любое поверхностно-активное вещество, описанное здесь), (iii) наполнитель (например, маннитол или другой сахарный спирт) и/или (iv) буфер (то есть любой буфер, описанный здесь). Водный раствор в виде стандартной лекарственной формы можно приготовить путем восстановления лиофилизированного порошка, включающего соединение 22 или его фармацевтически приемлемую соль. Альтернативно, водный раствор в виде стандартной лекарственной формы можно приготовить путем восстановления жидкого концентрата, включающего соединение 22 или его фармацевтически приемлемую соль.
Изобретение предлагает набор, включающий (i) стандартную лекарственную форму, содержащую лиофилизированный порошок, включающий соединение 22 или его фармацевтически приемлемую соль, и (ii) инструкции по восстановлению лиофилизированного порошка водным раствором для получения фармацевтической композиции, пригодной для инъекции субъекту.
В связанном аспекте изобретение предлагает набор, включающий (i) стандартную лекарственную форму, содержащую жидкий концентрат, включающий соединение 22 или его фармацевтически приемлемую соль, и (ii) инструкции по восстановлению жидкого концентрата водным раствором для получения фармацевтической композиции, пригодной для инъекции субъекту.
В любом из указанных выше наборов стандартная лекарственная форма может (i) не содержать стабилизирующие сахара (например, фруктозу, сахарозу, трехалозу или их комбинацию), (ii) включать поверхностно-активное вещество (например, Твин 20, Твин 80 или любое поверхностно-активное вещество, описанное здесь), (iii) наполнитель (например, маннитол или другой сахарный спирт) и/или (iv) буфер (то есть любой буфер, описанный здесь).
Изобретение дополнительно предлагает образованную путем добавления кислоты соль соединения класса эхинокандинов в виде стандартной лекарственной формы, при этом образованная путем добавления кислоты соль получена из органической кислоты (например, соли уксусной, молочной, пальмовой (palmoic), малеиновой, лимонной, холевой кислоты, каприновой кислоты, каприловой кислоты, лауриновой кислоты, глутаровой, глюкуроновой, глицериновой, гликоколевой, глиоксиловой, изолимонной, изовалериановой, молочной, яблочной, щавелево-уксусной, щавелево-янтарной, пропионовой, пировиноградной, аскорбиновой, янтарной, бензойной, пальмитиновой, субериновой, салициловой, винной, метансульфоновой, толуолсульфоновой или трифторуксусной кислоты). Необязательно, образованная путем добавления кислоты соль присоединения кислоты включает способствующее всасыванию вещество. Необязательно, соединение класса эхинокандинов представляет собой образованную путем добавления кислоты соль соединения 22. Стандартная лекарственная форма может дополнительно включать одно или несколько вспомогательных веществ, способствующих всасыванию, описанных здесь.
Изобретение дополнительно предлагает соединение класса эхинокандинов или его соль в виде стандартной лекарственной формы, включающей от 2 до 80% (масса/масса) лимонной кислоты. Стандартная лекарственная форма может дополнительно включать одно или несколько вспомогательных веществ, способствующих всасыванию, описанных здесь.
Изобретение также предлагает наборы, включающие: а) любую фармацевтическую композицию по изобретению; и b) инструкции по введению фармацевтической композиции субъекту, у которого диагностирована грибковая инфекция.
Под термином «ацилкарнитин» понимается химическая группа, имеющая формулу:
и его соли, где R представляет собой частично насыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от 8 до 26 атомов углерода. Ацилкарнитины являются производными карнитина (D или L форма, или их смесь) и жирной кислоты. Ацилкарнитин может представлять собой сложный эфир жирной кислоты, содержащей 16 атомов углерода и 0, 1 или 2 двойные связи (С16:0, С16:1 и С16:2), 18 атомов углерода и 1, 2 или 3 двойные связи (С18:1, С18:2 и С18:3), 20 атомов углерода и 1, 2 или 4 двойные связи (С20:1, С20:2 и С20:4), или 22 атома углерода и 4, 5 или 6 двойных связей (С22:4, С22:5 и С22:6). Ацилкарнитины включают, без ограничения, 4, 7, 10, 13, 16, 19 докозагексаноилкарнитин, олеоилкарнитин, пальмитоилкартинин, деканоилкарнитин, додеканоилкарнитин, миристоилкарнитин и стеароилкарнитин.
Используемый здесь термин «введение» или «вводимое» относится к введению любым способом, таким как инъекция (например, внутривенное введение путем болюсной инъекции или инфузии, подкожное введение), трансдермальное введение, местное введение, интраназальное или пероральное введение лекарственного средства субъекту.
Под термином «добавка» понимаются такие компоненты фармацевтической композиции, содержащей лекарственное средство (например, соединение класса эхинокандинов), в виде пероральной лекарственной формы, которые увеличивают пероральную биодоступность лекарственного средства при пероральном введении одновременно с лекарственным средством. Добавки по изобретению включают ацилкарнитины, алкилсахариды, сложные эфиры сахаридов, жирные амидокислоты, поверхностно-активные вещества - сульфонат аммония, желчные кислоты и соли желчных кислот (включая холевую кислоту и ее соли), хитозан и его производные, жирные кислоты и их соли или сложные эфиры, глицериды, гидрофильные ароматические спирты, пегилированные фосфолипиды, пептидные модуляторы плотных контактов эпителия, фосфолипиды, алкиловые эфиры полиэтиленгликоля, полигликолизированные глицериды, сложные эфиры полиглицерина и жирных кислот, поверхностно-активные вещества - полисорбат, карбоновые кислоты, полиэтиленгликоли, и их смеси.
Под термином «количество, достаточное» понимается количество добавки, требуемой для увеличения пероральной биодоступности лекарственного средства.
Под термином «грибковая инфекция» понимается заражение хозяина патогенными грибами. Например, инфекция может включать чрезмерный рост грибов, которые обычно присутствуют в организме или на теле человека, или рост грибов, которые обычно не присутствуют в организме или на теле человека. В общих чертах, грибковая инфекция может представлять собой любую ситуацию, в которой присутствие грибковой популяции(й) является вредной для организма хозяина. Таким образом, человек «страдает» грибковой инфекцией, когда чрезмерная численность грибковой популяции присутствует в организме или на теле человека, или когда присутствие грибковой популяции(й) является вредной для клеток или другой ткани человека.
Под термином «каприлокапроил полиоксиглицерид» понимается полигликолизированный глицерид, который представляет собой смесь сложных моноэфиров, диэфиров и триэфиров глицерина и сложных моноэфиров и диэфиров полиэтиленгликолей, имеющий среднюю молекулярную массу между 70 и 400, и полученный трансэтерификацией сложных эфиров каприловых и каприновых глицеридов полиэтиленгликолем. Каприлокапроил полиоксиглицериды включают, без ограничения, PEG-8 каприловый/каприновый глицерид (LABRASOL®, Gattefosse), PEG-4 каприловый/каприновый глицерид (LABRAFAC® Hydro, Gattefosse), и PEG-6 каприловый/каприновый глицерид (SOFTIGEN®767, Huls).
Под термином «эффективное» количество понимается количество лекарственного средства, требуемое для лечения или предупреждения инфекции или заболевания, связанного с инфекцией. Эффективное количество лекарственного средства, используемое для практического осуществления изобретения для терапевтического или профилактического лечения состояний, вызванных или способствующих микробной инфекции, варьирует в зависимости от способа введения, возраста, массы тела и общего состояния здоровья субъекта. Окончательное решение о целесообразном количестве и режиме дозирования будет принимать лечащий врач. Такое количество называется «эффективным» количеством.
Под термином «эмульсия» понимается двухфазная коллоидная система, такая как смесь двух или более несмешиваемых (несмешивающихся) жидкостей. Жидкие эмульсии представляют собой такие эмульсии, в которых обе фазы, диспергированная и непрерывная, представляют собой жидкость. Как правило, для формирования эмульсии необходима энергия, подводимая посредством процессов встряхивания, перемешивания, гомогенизации или распыления. Например, эмульсия может включать водную фазу и неводную фазу, и может включать самоэмульгирующуюся систему, или эмульсия может состоять из наночастиц, содержащая водную фазу и неводную фазу (например, наноэмульсия или микроэмульсия). Под термином «микроэмульсия» понимается прозрачная, стабильная, изотропная жидкая смесь из масла, воды и поверхностно-активного вещества, необязательно в комбинации с вторичным поверхностно-активным веществом. Водная фаза может содержать соль(и) и/или другие ингредиенты, дополнительно к биологически активному агенту. В отличие от обычных эмульсий микроэмульсии образуются в результате простого смешивания компонентов и не требуют условий высокого усилия сдвига, обычно используемых при формировании обычных эмульсий. Двумя основными типами микроэмульсий являются прямые (масло, диспергированное в воде, o/w) и обратные (вода, диспергированная в масле, w/o).
Под термином «вспомогательное вещество» понимаются такие компоненты фармацевтической композиции, содержащей лекарственное средство (например, соединение класса эхинокандинов), в виде пероральной лекарственной формы, которые не увеличивают пероральную биодоступность лекарственного средства при пероральном введении одновременно с лекарственным средством. Вспомогательные вещества, которые можно использовать в лекарственных формах по изобретению, включают, без ограничения, воду, разбавители, связующие, наполнители и вкусовые агенты.
Под термином «жирная кислота» понимается алифатическая карбоновая кислота. Жирные кислоты включают, но не ограничиваются жирными кислотами, содержащими между 8 и 12 атомов углерода, линейными и разветвленными жирными кислотами, насыщенными и ненасыщенными жирными кислотами, и жирными кислотами, содержащими гидроксильную группу в терминальном положении их боковой цепи (то есть жирными кислотами, несущими первичную гидроксильную группу). Примерами жирных кислот служат каприловая кислота (октановая кислота), пеларгоновая кислота (нонановая кислота), каприновая кислота (декановая кислота) и лауриновая кислота (додекановая кислота), и их первичная гидроксильная группа образует 8-гидрокси октановую кислоту, 9-гидрокси нонановую кислоту, 10-гидрокси декановую кислоту и 12-гидрокси додекановую кислоту.
Под термином «твердая капсула» понимается капсула, которая включает мембрану, которая формирует состоящий из двух частей контейнер в форме капсулы, способный выдерживать твердую, полутвердую или жидкую нагрузку лекарственного средства, добавки(ок) и, необязательно, вспомогательных веществ.
Используемое здесь выражение «увеличение пероральной биодоступности» означает, что биодоступность перорально вводимого лекарственного средства, измеренная по среднему значению AUC у субъектов-собак (например, как описано в примерах), для пероральной лекарственной формы по изобретению, включающей соединение класса эхинокандинов, формулированное с одной или несколькими добавками, по меньшей мере, на 25%, 50%, 75%, 100% или 300% больше по сравнению с этим же лекарственным средством, формулированным без каких-либо добавок. Для этих исследований желудочно-кишечный тракт у субъектов не подвергался хирургическому воздействию способом, который изменяет пероральную биодоступность лекарственного средства.
Под термином «жидкая лекарственная форма» понимается раствор или суспензия, из которой отмеряется доза (то ест