Липосомы, содержащие олигопептидные фрагменты основного белка миелина, фармацевтический состав и способ лечения рассеянного склероза
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению липосом с пептидом основного белка миелина (ОБМ), и может быть использовано в медицине для лечения рассеянного склероза. Получают композицию, содержащую пептид ОБМ с SEQ ID NO: 11 или SEQ ID NO: 12, связанный с первым вектором, где вектор содержит липосому, имеющую поверхность, подверженную воздействию целевой части, которая содержит остаток маннозы или производное маннозы. Изобретение обеспечивает большую терапевтическую пользу, чем копаксон, терапевтически одобренный для лечения возвратно-ремиттирующего рассеянного склероза. 4 н. и 14 з.п. ф-лы, 14 ил., 14 табл., 14 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США № 13/444788, поданной 11 апреля 2012 года, под названием "ЛИПОСОМЫ, СОДЕРЖАЩИЕ ОЛИГОПЕПТИДНЫЕ ФРАГМЕНТЫ ОСНОВНОГО БЕЛКА МИЕЛИНА, ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ И СПОСОБ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА", содержание которой полностью включено в настоящую заявку посредством ссылки для всевозможных целей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Рассеянный склероз (РС) - нейродегенеративное заболевание, при котором повреждаются жировые миелиновые оболочки вокруг аксонов головного мозга и спинного мозга, что приводит к демиелинизации и образованию рубцов. Повреждение, причиненное центральной нервной системе (ЦНС), приводит к неврологическим симптомам широкого спектра. Во всем мире приблизительно один миллион людей страдают от данного аутоиммунного заболевания, имеющего загадочную этиологию и мало изученный патогенез. B- и Т-клетки, химически активные в отношении составляющих миелиновой оболочки, опосредуют демиелинизацию в головном и спинном мозге и, как представляется, отвечают за большую часть прогрессирования заболевания.
Перечень потенциальных аутоантигенов, для которых B- и Т-клетки являются химически активными в отношении пациентов с РС, постепенно растет и включает в себя несколько олигодендроцитарно-ассоциированных белков, в частности, основной белок миелина (ОБМ) и миелиновый олигодендроцитарный гликопротеин (МОГ). Инфильтрация центральной нервной системы этими макрофагами и лимфоцитами посредством гематоэнцефалического барьера (ГЭБ) приводит к образованию воспалительных очагов демиелинизации в головном и спинном мозге.
В то время как Т-клетки несут ответственность за большую часть эффекта демиелинизации, хотя и В-клетки играют в этом существенную роль. Это связано с тем, что В-клетки функционируют в качестве антиген-представляющих клеток и цитокинов продуцирующих клеток, в дополнение к их всеми признанной роли в образовании антител (Хикада и Зуали, журнал "Природа иммунологии" (Hikada and Zouali, Nat Immunol) 2010; 11:1065-8). Дополнительным подтверждением причастности В-клеток к демиелинизации является обнаружение каталитических антител к ОБМ у пациентов с рассеянным склерозом. Эти каталитические антитела способны не только связывать их антиген, но также расщеплять его (Пономаренко Н.А. и др., Труды Национальной академии наук, США 2006; 103:281-6). Факты показывают, что существует сильная экологическая составляющая для прогрессирования РС, в котором аутоантитела, обладающие перекрестной реактивностью к нейронным и вирусным антигенам, способствуют этиологии и патогенезу РС (Габибоа А.Г. и др., журн. Федерация американских обществ экспериментальной биологии 2011; 25:4211-21).
Было предложено множество методов лечения РС, в том числе: (i) введение глатиромерацетата (GA); (ii) введение "измененных пептидных лигандов" (APL), которые взаимодействуют с рецепторами Т-клеток (TCR); (iii) введение IFNβ; (iv) введение анти-CD20, анти-CD25 и анти-CD52 моноклональных антител; (v) различные пероральные терапии; (vi) вакцинация инактивированных Т-клеток или гипервариабельных участков TCR; (vii) толеризация иммунной системы путем введения аутоантигенов или DNA-вакцинация; и (viii) нацеленная деплеция B-клеток.
Однако, несмотря на многообещающие клинические, иммунологические и биохимические данные, ни один из существующих методов лечения не способен вылечить или предотвратить прогрессирование РС. Таким образом, в данной области существует большая потребность в эффективных терапевтических подходах к лечению РС.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение удовлетворяет потребность в области медицины по эффективным составам и способам лечения рассеянного склероза (РС), путем предоставления терапевтической композиции иммунодоминантных пептидов ОБМ, связанных с вектором для введения нуждающемуся в этом субъекту. В конкретном воплощении композиция включает в себя иммунодоминантные пептиды ОБМ, инкапсулированные в маннозилированные липосомы. Как видно из данного документа, введение этих композиций улучшает непрерывный экспериментальный аутоиммунный энцефаломиелит в ЭАЭ-индуцированной модели крыс с РС.
Настоящее изобретение основано, отчасти, на обнаружении того факта, что определенные пептиды ОБМ являются основными эпитопами В-клеток у пациентов, страдающих рассеянным склерозом. Было обнаружено, что введение липосомальных рецептур этих пептидов, а не свободных пептидов, моделям грызунов с РС привело к статистически значимому снижению паралича. Не вдаваясь в теорию, мы можем смело заявить, что липосомная рецептура данных пептидов приводит к улучшению доставки пептидов в иммунные клетки (например, В-клетки и/или антигенпрезентирующие клетки) и/или улучшает потребление этих пептидов в иммунных клетках (например, В-клетки и/или антигенпрезентирующие клетки).
Таким образом, настоящее изобретение, кроме всего прочего, предоставляет нам композиции (составы) и способы лечения рассеянного склероза. Композиции содержат один или несколько идентифицированных пептидов ОБМ, связанных с вектором (например, a маннозилированные липосомы).
В одном аспекте данное изобретение обеспечивает композицию для лечения рассеянного склероза. Данная композиция содержит в себе первый пептид основного белка миелина (ОБМ), связанный с первым вектором; первый пептид ОБМ состоит из следующей аминокислотной последовательности: (R1)a-P1-(R2)b, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R1 и R2, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a и b, независимо друг от друга, равна нулю или единице.
В одном из воплощений составов, приведенных выше, а и b оба равны нулю. В другом из воплощений составов, приведенных выше, а равно единице, а b равно нулю. В другом из воплощений составов, приведенных выше, а равно нулю, а b равно единице. В другом из воплощений составов, приведенных выше, а и b оба равны единице.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:1. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 90%-идентичностью с SEQ ID NO:1. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 95%-идентичностью с SEQ ID NO:1. В другом из воплощений составов, приведенных выше, Р1 - это аминокислотная последовательность SEQ ID NO:1.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:2. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 90%-идентичностью с SEQ ID NO:2. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:2. В другом из воплощений составов, приведенных выше, Р1 - это аминокислотная последовательность SEQ ID NO:2.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:3. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 90%-идентичностью с SEQ ID NO:3. В другом из воплощений составов, приведенных выше, Р1 - аминокислотная последовательность, обладающая, по меньшей мере 95%-идентичностью с SEQ ID NO:3. В другом из воплощений составов, приведенных выше, Р1 - это аминокислотная последовательность SEQ ID NO:3.
В одном из воплощений составов, приведенных выше, состав дополнительно содержит второй пептид ОБМ, связанный со вторым вектором, второй пептид ОБМ состоит из следующей аминокислотной последовательности: (R3)c-P2-(R4)d, где P2 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R3 и R4, независимо друг от друга, является аминокислотными последовательностями состоящими из 1-10 аминокислот; а каждая переменная c и d, независимо друг от друга, равна нулю или единице, и где P1 и P2 представляют собой различные аминокислотные последовательности.
В одном из воплощений составов, приведенных выше, первый и второй векторы являются одним вектором.
В одном из воплощений составов, приведенных выше, состав дополнительно содержит третий пептид ОБМ, связанный с третьим вектором, третий пептид ОБМ состоит из следующей аминокислотной последовательности: (R5)e-P3-(R6)f, где P3 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R5 и R6, независимо друг от друга, является аминокислотными последовательностями состоящими из 1-10 аминокислот; а каждая переменная e и f, независимо друг от друга, равна нулю или единице, и где P1, P2, и P3 - различные аминокислотные последовательности.
В одном из воплощений составов, приведенных выше, первый, второй и третий векторы являются одним вектором.
В одном из воплощений составов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:1; P2 - аминокислотная последовательность SEQ ID NO:2; а P3 - аминокислотная последовательность SEQ ID NO:3.
В одном из воплощений составов, приведенных выше, пептид ОБМ ковалентно связан с вектором. В другом из воплощений составов, приведенных выше, пептид ОБМ нековалентно связан с вектором.
В одном из воплощений составов, приведенных выше, вектор содержит наночастицы. В особом воплощении составов, приведенных выше, наночастицы представляют собой липосомы.
В одном из воплощений составов, приведенных выше, вектор содержит целевой фрагмент. В особом воплощении составов, приведенных выше, вектор представляет собой целевой фрагмент.
В одном из воплощений составов, приведенных выше, целевой фрагмент повышает: (a) доставку пептида ОБМ к иммунной клетке; или (б) поступление пептида ОБМ в иммунную клетку; по сравнению с пептидом ОБМ, связанного с вектором при отсутствии целевой части.
В одном из воплощений составов, приведенных выше, целевой фрагмент содержит остаток маннозы. В другом из воплощений составов, приведенных выше, целевой фрагмент содержит антитело, которое особым образом связывается с иммунной клеткой. В другом из воплощений составов, приведенных выше, целевой фрагмент содержит аптамер, который особым образом связывается с иммунной клеткой. В одном из воплощений составов, приведенных выше, целевой фрагмент содержит пептид, который особым образом связывается с иммунной клеткой. В одном из воплощений составов, приведенных выше, иммунная клетка представляет собой В-клетку. В другом из воплощений составов, приведенных выше, иммунная клетка представляет собой антигенпрезентирующую клетку (АПК).
В одном аспекте данное изобретение обеспечивает композицию для лечения рассеянного склероза. Данная композиция содержит в себе первый пептид основного белка миелина (ОБМ), связанный с первым вектором; первый пептид ОБМ состоит из следующей аминокислотной последовательности: (R1)a-P1-(R2)b, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NOS:1-3; каждый R1 и R2, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a и b, независимо друг от друга, равна нулю или единице, где вектор представляет собой липосому, содержащую маннозилированные липиды.
В одном из воплощений составов, приведенных выше, P1 - это аминокислотная последовательность SEQ ID NO:1.
В одном из воплощений составов, приведенных выше, состав дополнительно содержит: второй пептид ОБМ, связанный со вторым вектором, второй пептид ОБМ состоит из следующей аминокислотной последовательности: (R3)c-P2-(R4)d; и третий пептид ОБМ, связанный с третьим вектором, третий пептид ОБМ состоит из следующей аминокислотной последовательности: (R5)e-P3-(R6)f, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью SEQ ID NO:1; P2 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью SEQ ID NO:2; P3 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью SEQ ID NO:3; каждый R1, R2, R3, R4, R5 и R6, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a, b, c, d, e и f, независимо друг от друга, равна нулю или единице.
В одном из воплощении составов, приведенных выше, пептид(ы) ОБМ нековалентно связан(ы) с липосомами. В другом из воплощений составов, приведенных выше, пептид(ы) ОБМ инкапсулирован(ы) липосомами.
В одном из воплощений составов, приведенных выше, средний диаметр липосомы составляет 100-200 нм.
В одном из воплощений составов, приведенных выше, маннозилированным липидом является тетраманнозил-3-L-лизин-диолеоил глицерола. В другом из воплощений составов, приведенных выше, маннозилированным липидом является manDOG.
В одном аспекте настоящее изобретение предлагает способ лечения рассеянного склероза у пациента, нуждающегося в лечении: способ, включающий в себя введение указанному пациенту состава, состоящего из первого пептида основного белка миелина (ОБМ), связанного с первым вектором; первый пептид ОБМ состоит из следующей аминокислотной последовательности: (R1)a-P1-(R2)b, где P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R1 и R2, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; а каждая переменная a и b, независимо друг от друга, равна нулю или единице.
В одном варианте осуществления способов, приведенных выше, а и b оба равны нулю. В другом варианте осуществления способов, приведенных выше, а равно единице, а b равно нулю. В другом варианте осуществления способов, приведенных выше, а равно нулю, а b равно единице. В другом варианте осуществления способов, приведенных выше, а и b оба равны единице.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:1. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 90%-идентичностью с SEQ ID NO:1. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:1. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:1.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:2. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 90%-идентичностью с SEQ ID NO:2. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:2. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:2.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с SEQ ID NO:3. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 90%-идентичностью с SEQ ID NO:3. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность, обладающая, по меньшей мере, 95%-идентичностью с SEQ ID NO:3. В другом варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:3.
В одном варианте осуществления способов, приведенных выше, состав дополнительно содержит второй пептид ОБМ, связанный со вторым вектором, второй пептид ОБМ состоит из следующей аминокислотной последовательности: (R3)c-P2-(R4)d, где P2 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R3 и R4, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; каждая переменная c и d, независимо друг от друга, равна нулю или единице, и где P1 и P2 представляют собой различные аминокислотные последовательности.
В одном варианте осуществления способов, приведенных выше, первый и второй векторы являются одним вектором.
В одном варианте осуществления способов, приведенных выше, состав дополнительно содержит третий пептид ОБМ, связанный с третьим вектором, третий пептид ОБМ состоит из следующей аминокислотной последовательности: (R5)e-P3-(R6)f, где P3 - аминокислотная последовательность, обладающая, по меньшей мере, 85%-идентичностью с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1-3; каждый R5 и R6, независимо друг от друга, является аминокислотными последовательностями, состоящими из 1-10 аминокислот; каждая переменная e и f, независимо друг от друга, равна нулю или единице, и где P1, P2 и P3 представляют собой различные аминокислотные последовательности.
В одном варианте осуществления способов, приведенных выше, первый, второй и третий векторы являются одним вектором.
В одном варианте осуществления способов, приведенных выше, P1 - аминокислотная последовательность SEQ ID NO:1; P2 - аминокислотная последовательность SEQ ID NO:2; а P3 - аминокислотная последовательность SEQ ID NO:3.
В одном варианте осуществления способов, приведенных выше, пептид ОБМ ковалентно связан с вектором. В другом варианте осуществления способов, приведенных выше, пептид ОБМ нековалентно связан с вектором.
В одном варианте осуществления способов, приведенных выше, вектор содержит наночастицы. В конкретном воплощении наночастица представляет собой липосому.
В одном варианте осуществления способов, приведенных выше, вектор содержит целевой фрагмент.
В одном варианте осуществления способов, приведенных выше, целевой фрагмент повышает: (a) доставку пептида ОБМ к иммунной клетке; или (б) поступление пептида ОБМ в иммунную клетку; по сравнению с пептидом ОБМ, связанным с вектором при отсутствии целевой части.
В одном варианте осуществления способов, приведенных выше, вектор представляет собой целевой фрагмент. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит остаток маннозы. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит антитело, которое особым образом связывается с иммунной клеткой. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит аптамер, который особым образом связывается с иммунной клеткой. В другом варианте осуществления способов, приведенных выше, целевой фрагмент содержит пептид, который особым образом связывается с иммунной клеткой. В одном варианте осуществления способов, приведенных выше, иммунная клетка представляет собой В-клетку. В другом варианте осуществления способов, приведенных выше, иммунная клетка представляет собой антигенпрезентирующую клетку (АПК).
В одном варианте осуществления способов, приведенных выше, состав содержит пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:1, пептид ОБМ связан с вектором, содержащим целевой фрагмент, где вектор, содержащий целевой фрагмент, представляет собой липосому, содержащую маннозилированный липид.
В одном варианте осуществления способов, приведенных выше, состав содержит: (i) первый пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:1; (ii) второй пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:2; и (iii) третий пептид ОБМ, имеющий аминокислотную последовательность SEQ ID NO:3.
В одном варианте осуществления способов, приведенных выше, пептид(ы) ОБМ нековалентно связан(ы) с липосомой.
В одном варианте осуществления способов, приведенных выше, пептид(ы) ОБМ инкапсулирован(ы) липосомами.
В одном варианте осуществления способов, приведенных выше, средний диаметр липосомы составляет 100-200 нм.
В одном варианте осуществления способов, приведенных выше, маннозилированным липидом является тетраманнозил-3-L-лизин-диолеоил глицерола. В другом варианте осуществления способов, приведенных выше, маннозилированным липидом является manDOG.
В одном варианте осуществления способов, приведенных выше, состав вводят пациенту, по меньшей мере, один раз в неделю. В другом варианте осуществления способов, приведенных выше, состав вводят пациенту, по меньшей мере, два раза в неделю. В другом варианте осуществления способов, приведенных выше, состав вводят пациенту ежедневно.
В одном варианте осуществления способов, приведенных выше, состав вводится пациенту путем местного применения, энтеросолюбильного введения или парентерального введения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1. Крысы линии DA с индуцированным ЭАЭ (экспериментальный аллергический энцефаломиелит) являются наиболее соответствующими моделями грызунов с РС с точки зрения анти-ОБМ аутоантител, связывающих паттерн. (A) Сыворотка аутоантител от пациентов с РС и моделей грызунов, вырабатывающих экспериментальный аутоиммунный энцефаломиелит (крысы линии DA и SJL, а также мыши линии C57BL/6), воспроизводимым образом связывает ОБМ при методе ELISA (энзим-связанный иммуносорбентный метод исследования). В качестве отрицательного контроля была использована сыворотка мышей линии BALB/c. (B) Построение эпитопного банка ОБМ. Типичное окрашивание Кумасси и гибридизация с использованием вестерн-блоттинга для anti-с-myc и анти-ОБМ мАт с эпитопным банком ОБМ. Anti-с-myc Ab связывает все члены эпитопного банка ОБМ благодаря наличию целевого эпитопа во всех слитых белках (схема сверху), тем самым, предполагая воздействие и доступность всех пептидов ОБМ, расположенный непосредственно выше по потоку к эпитопу с-myc. Моноклональные анти-ОБМ Ab (клон F4A3, эпитоп ОБМ RHGFLPRHR (SEQ ID NO:20)) вступает в реакцию с ОБМ и его пептидами ОБМ2 и ОБМ3, как и было предсказано. (C) Сыворотка аутоантител, связывающих паттерн с эпитопным банком ОБМ согласно методу ELISA. По нашим данным крысы линии DA, вырабатывающие ЭАЭ, являются наиболее подходящей моделью грызунов с РС. Последовательность ОБМ с пептидами, представленными в его эпитопном банке, показаны снизу (SEQ ID NO:17). Каждый десятый аминокислотный остаток отмечен жирным шрифтом. Квадратные скобки представляют собой иммунодоминантные пептиды ОБМ-1/-2/-3, отобранные для достижения эффективности скрининга лечения.
Фиг.2. Характеристика специфичности и аффинности поликлональных антител от крыс линии DA, иммунизированных ОБМ (63-81). (A) Верхняя панель показывает нам, что три фрагмента ОБМ распознаются по сыворотке аутоантитела от крыс линии DA с искусственным ЭАЭ. Иммунодоминантные пептиды были определены согласно методу ELISA из аutoАb, связывающегося с эпитопным банком, а дальнейший теоретический расчет основан на предположении их перекрывающихся последовательностей. Кроме того, для проверки анализа связывания, эпитопный банк ОБМ был гибридизован с anti-с-myc и анти-ОБМ F4A3 мкАт (нижняя панель). (B) Количественные характеристики распознавания определенных эпитопов с помощью аутоантитела, измеряемого методом ППР (поверхностный плазмонный резонанс). Вы можете также увидеть соответствующие пептиды и эффективные константы диссоциации. Точные эпитопы выделены жирным шрифтом, н/о = не определено.
Фиг.3. Схематическое изображение метода липосомации, используемого для инкапсуляции иммунодоминантных пептидов ОБМ в маннозилированные SUV липосомы. (Сверху слева) Смесь липидов (Egg PC с 1% маннозилированного DOG) в хлороформе. (Сверху посередине) Образование нерегулярных липидных слоев при испарении органического растворителя. (Сверху справа) Первая регидратация приводит к образованию многослойных MLV липосом. Средний диаметр частиц составляет 1-5 мкм. (Снизу слева) Лиофилизация SUV липосом, полученных из MLV липосом путем гомогенизации под высоким давлением, и смеси пептидов избыточным сахаром. (Снизу посередине) Пептиды расположены между обрушившимися SUV липосомами. (Снизу справа) Инкапсулирование пептидов в течение второй регидратации в SUV липосомы размером около 60-80 нм и 1,0% остатков маннозы на поверхность. Воспроизведения были выполнены компанией "Visual Science Company".
Фиг.4. Включенные в липосомы иммунодоминантные пептиды ОБМ улучшают показатели экспериментального аутоиммунного энцефаломиелита у крыс линии DA. Все рассматриваемые группы (А-G) были изучены по среднему индексу заболевания, показателю глиоза/демиелинизации. Необработанная контрольная (получающая носитель) группа показана жирной темной линией (А) и повторяется на каждом графике для сравнения. Для лечения ЭАЭ у крыс линии DA использовались три иммунодоминантных фрагмента ОБМ, инкапсулированные в маннозилированные SUV липосомы: Во время первой атаки (B) ОБМ (46-62) оказался наиболее эффективным при снижении максимального индекса заболевания, ОБМ (124-139) (C) и ОБМ (147-170) (D) предотвратили развитие периода ремиссии. Введение смеси ОБМ (46-62), ОБМ (124-139) и ОБМ (147-170) иммунодоминантных пептидов ОБМ, включенных в липосомы, значительно улучшило показатели затянувшийся ЭАЭ (E), копаксон (copaxone) (F) и свободный пептид ОБМ (46-62) (G) использовались в качестве положительного и отрицательного контроля, соответственно. Для каждой группы представлен средний индекс заболевания. Статистически существенная разница показана жирным курсивом. Характерный профиль отдельно выбранной крысы показан тонкой линией. Характерный показатель гематоксилина и окрашивания эозином показаны на панели справа.
Фиг.5. Включенные в липосомы иммунодоминантные пептиды ОБМ снижают содержание сывороточного анти-ОБМ титра аутоантител и подавляет Th1 профиль цитокина ЦНС. (A) Концентрация сывороточного анти-ОБМ аутоантитела у крыс линии DA c ЭАЭ, получавших ОБМ1 SUV, ОБМ1/2/3 SUV и копаксон, в сравнении с необработанными и неиммунизированными крысами. Типичное окрашивание luxol fast blue (B), иммуноокрашивание для Th1 цитокинов IFNγ (B) и IL2 (C), и иммуноокрашивание BDNF (нейротрофический фактор головного мозга) (D) в срезах мозга крыс линии DA, получивших ОБМ1 SUV (внизу справа), ОБМ1/2/3 SUV (внизу слева) и копаксон (сверху справа), в сравнении c необработанными крысами (сверху слева).
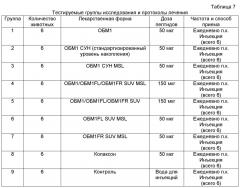
Фиг.6. Средний балл паралича для ЭАЭ-индуцированных моделей крыс с РС. В течение всего срока периодов исследования мы ежедневно присваивали показатель паралич каждой крысе: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 35 дней). 54 ЭАЭ-индуцированных крыс линии DA были поровну разделены на 9 групп. Группы I-VII лечили лекарственными средствами 1-7, VIII группу лечили копаксоном (положительная контрольная группа), IX группе вводили инъекции воды (отрицательная контрольная группа). Мы ежедневно записывали показатели паралича, и они отображаются в виде средних значений для групп I-V (A) и групп VI-IX (B). Статистически значимое снижение показателя паралича, в сравнении контрольных групп, наблюдалось у группы IV (лечение 4 лекарственным средством) на 3 и 4 день после лечения (n=6, *p<0,05). Стандартное отклонение измеряется планками погрешностей.
Фиг.7. Средний вес туловища (г) ЭАЭ-индуцированных моделей крыс с РС. Мы записывали вес всех животных на протяжении всех периодов исследования: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 35 дней). 54 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 9 групп. Статистически значимых различий между весом тел крыс, получавших препараты с пептидом ОБМ, и контрольными группами не выявлено. Стандартное отклонение измеряется планками погрешностей.
Фиг.8. Окрашивание гематоксилином и эозином (H & E) спинного мозга от ЭАЭ-индуцированной модели крысы с РС. Изображения при 10× и 40× увеличении спинного мозга, выделенного из ЭАЭ-индуцированных крыс линии DA, получавших: (A) (крыса 35; группа II), (крыса 53; группа IV), (крыса 69; группа IX); (B) (крыса 71; группа VIII), (крыса 77; группа III), (крыса 79; группа V); (C) (крыса 81; группа I), (крыса 95; группа VII), (крыса 2003; группа VI).
Фиг.9. Экспериментальный план. Экспериментальная модель, включая пептидные идентичности, содержание липосомное и дозировка для всех экспериментальных лекарственных средств, испытанная в примерах 12, 13 и 14. ОБМ1 (SEQ ID NO:1); ОБМ1FL (SEQ ID NO:9); ОБМ1FR (SEQ ID NO:10); ОБМ2 (SEQ ID NO:2); ОБМ3 (SEQ ID NO:3).
Фиг.10. Средний показатель паралича для ЭАЭ-индуцированных моделей крыс с РС. В течение всего срока периодов исследования мы ежедневно присваивали показатель паралич каждой крысе: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 36 дней). 54 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 10 групп. Группы I-VIII лечили лекарственными средствами ОБМ F 1-8, IX группу лечили Копаксоном (положительная контрольная группа), X группе вводили инъекции воды (отрицательная контрольная группа). Статистически значимое снижение показателя паралича, в сравнении контрольных групп, наблюдалось у групп III и IV (лечение осуществлялось 200 мг дозой) на 2 и 3 день после лечения (n=5, *p<0,05). Стандартное отклонение измеряется планками погрешностей.
Фиг.11. Средний вес туловища (г) ЭАЭ-индуцированных моделей крыс с РС. Мы записывали вес всех животных на протяжении всех периодов исследования: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения (всего 36 дней). 54 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 10 групп. Статистически значимых различий между весом тел крыс, получавших препараты с пептидом ОБМ, и контрольными группами не выявлено. Стандартное отклонение измеряется планками погрешностей.
Фиг.12. Средний показатель паралича для ЭАЭ-индуцированных моделей крыс с РС. В течение всего срока периодов исследования мы ежедневно присваивали показатель паралич каждой крысе: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения. 42 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 7 групп. Группы II-V лечили лекарственными средствами ОБМ F I-IV, группы VI и VII лечили копаксоном (150 мкг и 450 мкг, соответственно; положительная контрольная группа), а I группе вводили инъекции воды (отрицательная контрольная группа). Статистически значимое снижение показателя паралича, в сравнении с отрицательным контролем, наблюдалось для: группа II (лечение осуществлялось липосомной рецептурой ОБМ1; соотношение пептида к липиду 1:330) на 1-4 день после лечения (n=6, *p<0,005); группа III (лечение осуществлялось липосомной рецептурой ОБМ1/2/3; соотношение пептида к липиду 1:330) в 1 день после лечения (n=6, *p<0,05); и группа V (лечение осуществлялось липосомной рецептурой ОБМ1/2/3; соотношение пептида к липиду 1:110) на 1-3 день после лечения (n=6, *p<0,05). Стандартное отклонение измеряется планками погрешностей.
Фиг.13. Средний вес туловища (г) ЭАЭ-индуцированных моделей крыс с РС. Мы записывали вес всех животных на протяжении всех периодов исследования: акклиматизация, введение ЭАЭ, лечение и процедуры после лечения. 42 ЭАЭ-индуцированные крысы линии DA были поровну разделены на 7 групп. Статистически значимых различий между весом тел крыс, получавших препараты с пептидом ОБМ, и контрольными группами не выявлено. Стандартное отклонение измеряется планками погрешностей.
Фиг.14. Выравнивание последовательности 7 сплайсированных изоформ ОБМ Идент. номера компании "UniProt": P02686 (SEQ ID NO:13); P02686-2 (SEQ ID NO:14); P02686-3 (SEQ ID NO:15); P02686-4 (SEQ ID NO:16); P02686-5 (SEQ ID NO:17); P02686-6 (SEQ ID NO:18); и P02686-7 (SEQ ID NO:19).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Введение
Рассеянный склероз (РС) - нейродегенеративное заболевание тяжелой степени, имеющее аутоиммунный фон. Хотя уже известно несколько методов лечения по управлению рассеянным склерозом, лекарства от этой болезни не существует. Кроме того, существующие в настоящее время терапии имеют ограниченную эффективность и могут привести к нежелательным побочным эффектам. Соответственно, разработка новых подходов к лечению РС имеет большое значение. В данном документе мы приводим доклад о композициях и использовании В-клеточных эпитопов основного белка миелина (ОБМ), инкапсулированного в небольшие однослойные (SUV) маннозилированные липосомы, в качестве эффективного лекарственного средства для экспериментального лечения аутоиммунного энцефаломиелита (ЭАЭ) у крыс линии DA, и принятую в данной области модель РС у людей.
Одновременно, настоящее изобретение предлагает терапевтические композиции антигенных пептидов ОБМ, связанных с вектором, пригодные для лечения рассеянного склероза. В конкретном воплощении терапевтические композиции содержат один, два или три антигенных пептида ОБМ, связанных с вектором (например, липосомы), необязательно содержащих целевую часть (например, маннозилированный липид). При введении пациенту с рассеянным склерозом, терапевтические композиции улучшают когнитивные способности и облегчают симптомы паралича. Таким образом, настоящее изобретение также предлагает способы лечения, управления и профилактики рассеянного склероза у нуждающегося в этом субъекта.
Используя эпитопный банк основного белка миелина, мы смогли проанализировать вяжущий шаблон сывороточных аутоантител (autoAb) ремиттирующих пациентов с РС и сравнить с анти-ОБМ autoAb от швейцарских мышей Джеймса Ламберта (SJL), мышей линии C57 black 6 (C57BL/6) и крыс линии Dark Agouti (DA) с ЭАЭ. На основе спектрального анализа autoAb по отношению к ОБМ фрагментам было обнаружено, что крысы линии DA с ЭАЭ являются наиболее соответствующими моделями грызунов с РС. Для лечения ЭАЭ у крыс линии DA использовались три иммунодоминантных фрагмента ОБМ, инкапсулированного в маннозилированные SUV липосомы. ОБМ (46-62) оказался наиболее эффективным в снижении максимального индекса заболевания во время первой атаки, в то время как ОБМ (124-139) и ОБМ (147-170) предотвратили развитие стадии обострения заболевания. Введение смеси иммунодоминантных пептидов ОБМ, значительно включенных в липосомы, улучшает затянувшийся ЭАЭ. благодаря понижающей регуляции цитокинов Th1 и вызыванию выработки BDNF (нейротрофический фактор головного мозга) в ЦНС. Синергетические эффекты ОБМ пептидов снижают общие показатели течения заболевания при умеренной первой атаке и дают быстрый результат при обострении, предлагая новейшее лечебное воздействие для лечения РС.
II. Определения
В данном контексте понятие "вектор" относится к молекулярной структуре, способной связываться с грузом (например, терапевтические или диагностические малые молекулы, пептиды, нуклеиновые кислоты и белковые биопрепараты). В одном воплощении вектор представляет собой молекулярную структуру, которая "таит" или "пасет" терапевтический груз (например, пептид ОБМ), введенный нуждающемуся субъекту. Вектор может, но вовсе не обязательно: улучшить терапевтический эффект, придаваемый грузом; улучшить или осуществить целевую доставку груза к местоположению в условиях in vivo или клеточному типу; улучшить усвоение груза во всех клетках или отдельных клетках в условиях in vitro или in vivo; увеличить период полураспада груза в условиях in vivo; защитить груз от нежелательных взаимодействий в условиях in vivo; или уменьшить с