Набор олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации возбудителя бластомикоза blastomyces dermatitidis
Иллюстрации
Показать всеИзобретение относится к области биохимии и молекулярной биологии, в частности к набору олигонуклеотидных праймеров и флуоресцентно-меченого зонда. Указанный набор предназначен для идентификации ДНК возбудителя бластомикоза Blastomyces dermatitidis методом полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов. Настоящий набор содержит зонд BDags-2P, сконструированный по типу «молекулярного маяка», и олигонуклеотиды BDags-1F и BDags-2R, комплементарные фрагментам гена α-1,3-глюкансинтазы B. dermatitidis и обладающие активностью прямого и обратного праймеров в реакции амплификации. Настоящее изобретение отличается тем, что указанные олигонуклеотиды обладают следующей структурой: 5’- GCG TTA TTGAAG CCG ATC CT - 3’ и 5’- AAC AGC CCG ATT GTC CAA AG - 3’, соответственно. Настоящий зонд обеспечивает флуоресцентную детекцию и имеет структуру 5’(FAM)-GGGATGCAGCGCAATTGCAATCCC-(BHQ1)3’, где FAM – флуоресцентный краситель карбоксифлуоресцеин, BHQ1 – гаситель флуоресценции. Настоящее изобретение позволяет идентифицировать ДНК возбудителя бластомикоза B. dermatitidis с высокой чувствительностью и специфичностью. 1 табл., 1 ил., 3 пр.
Реферат
Изобретение относится к области биотехнологии, молекулярной биологии и может быть использовано для выявления ДНК возбудителя бластомикоза Blastomyces dermatitidis в биологическом материале и объектах окружающей среды специалистами учреждений как практического здравоохранения, Роспотребнадзора, так и в научных исследованиях.
Бластомикоз относится к особо опасным заболеваниям, этиологическим агентом которого является диморфный гриб Blastomyces dermatitidis. Заболевание характеризуется образованием гранулем и гнойных абсцессов в легких, коже, подкожной клетчатке, а при диссеминации - во многих внутренних органах. Специфические симптомы отсутствуют. Острую форму бластомикоза клинически трудно дифференцировать от бактериальной пневмонии, хронической формы туберкулеза или рака легких. Существует молниеносная форма заболевания с развитием ОРДС (острый респираторный дистресс-синдром). Причем в таком виде заболевание заканчивается в большинстве случаев летально [Dworkin M.S., Duckro A.N., Proia L. et al. The epidemiology of blastomycosis in Illinois and factors associated with death // Clin. Infect. Dis. - 2005. - Vol. 41. - P. 107-111]. Бластомикоз относится к категории «респираторных», т.е. основной путь инфицирования - аэрогенный при вдыхании спор мицелия гриба из окружающей среды.
В настоящее время бластомикоз регистрируют в районе южных и восточных штатов США. В Африке бластомикоз известен в 18 странах, однако большинство случаев заболевания регистрируют в южной части материка, особенно в Южно-Африканской республике и Зимбабве. Известны случаи завоза бластомикоза в некоторые страны Европы (Италия, Франция, Венгрия, Польша).
Необходимость исследований, направленных на обнаружение штаммов В. dermatitidis, связана с ростом уровня миграции населения, туристической и деловой активности между странами Африки, Северной и Южной Америки и Российской Федерацией, а также с сохранением угрозы возникновения чрезвычайных ситуаций, обусловленных возможностью террористических актов с использованием этого возбудителя.
Установление этиологической роли возбудителя при глубоких микозах является непростой задачей, обусловленной определенными ограничениями стандартных методов их диагностики. Так, при микроскопическом исследовании клинического материала возможно предположить природу заболевания, но не определить вид возбудителя. Выделение чистой культуры В. dermatitidis с последующим подтверждением конверсии мицелиальной формы в дрожжевую может занять несколько недель.
Метод полимеразной цепной реакции обладает высокой специфичностью и чувствительностью и является прямым методом выявления ДНК возбудителя бластомикоза, позволяющим быстро идентифицировать культуру гриба в пробах различного происхождения.
Выбор специфического фрагмента ДНК-мишени и подбор праймеров играет важнейшую роль в проведении реакции, влияя на качество диагностики заболеваний. Использование метода ПЦР в режиме реального времени (ПЦР-РВ) с флуоресцентной детекцией позволяет детектировать продукты амплификации в момент проведения реакции. Для этого в одной пробирке совместно с праймерами используют меченые флуоресцентными красителями зонды, что позволяет повысить специфичность анализа и одновременно дает возможность для автоматической регистрации полученных результатов. Отсутствие стадии электрофореза в проведении исследования ведет к уменьшению вероятности контаминации исследуемых проб и лаборатории продуктами амплификации, позволяет снизить требования, предъявляемые к ГТЦР лаборатории, а также раньше получить результат.
Известен способ идентификации возбудителя бластомикоза, где разработана мультиплексная ПЦР в реальном времени с использованием праймеров и гибридизационных зондов с резонансным переносом энергии, комплементарных фрагментам гена гистидинкиназы В. dermatitidis [Babady N.E, Buckwalter S.P., Hall L., Le Febre K.M., Binnicker M.J., Wengenack N.L. Detection of Blastomyces dermatitidis and Histoplasma capsulatum from culture isolates and clinical specimens by use of real-time PCR / J. Clin. Microbiol. - 2011 - Vol. 49, №9. - p. 3204-3208]. Применение такой технологии сопряжено с необходимостью использования двух олигонуклеотидных зондов, меченых разными флуорофорами, что предъявляет высокие требования к выбору пары флуоресцентных красителей, между которыми возможен резонансный перенос энергии, а также повышает стоимость проведения анализа.
Наиболее близким аналогом являются специфичные праймеры и зонд по типу TaqMan, сконструированые на основе промоторной области гена BAD1, предложенные K. Sidamonidze с соавторами для идентификации возбудителя бластомикоза методом ПЦР-РВ [Sidamonidze K., Peck М.K., Perez М. et al. Real-Time PCR assay for identification of Blastomyces dermatitidis in culture and in tissue / J. Clin. Microbiol. - 2012. - Vol. 50 (5). - p. 1783-1786. doi:10.1128/JCM.00310-12]. Однако при секвенировании гена BAD-1, ответственного за синтез адгезина клеточной стенки В. dermatitidis, был обнаружен полиморфизм промоторной области, а у штаммов В. dermatitidis, принадлежащих к африканскому типу (серотип 2), BAD1 отсутствует. Вполне возможно, что в этом случае выбор праймеров, нацеленных на промоторную область гена BAD1, вызовет трудности при осуществлении лабораторной диагностики.
Целью настоящего изобретения является разработка набора специфичных олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации ДНК возбудителя бластомикоза методом полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов.
Цель достигается созданием набора олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации ДНК возбудителя бластомикоза Blastomyces dermatitidis методом полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов, содержащего олигонуклеотиды, комплементарные фрагментам гена α-1,3-глюкансинтазы В. dermatitidis, обладающих активностью прямого и обратного праймеров в реакции амплификации, и зонда, сконструированного по типу «молекулярного маяка», обеспечивающего флуоресцентную детекцию, имеющих следующую структуру:
где FAM - карбоксифлуоресцеин, флуоресцентный краситель, длина волны поглощения которого составляет 490 нм, а длина волны флуоресценции - 520 нм. BHQ1 - гаситель флуоресценции с диапазоном гашения 480-580 нм.
Характеристика олигонуклеотидных праймеров, зонда и ДНК мишени для идентификации возбудителя бластомикоза.
Основываясь на данных, представленных в базе GenBank NCBI (National Center for Biotechnology Information, США), для идентификации возбудителя бластомикоза были подобраны праймеры, обозначенные BDags-1F / BDags-2R, комплементарные фрагменту гена α-1,3-глюкансинтазы (alpha-1,3-glucan synthase) и обеспечивающие амплификацию специфического фрагмента размером 178 п.н.
Для детекции продуктов ПЦР в режиме реального времени был сконструирован зонд формата «молекулярный маяк», обозначенный BDags-2P, на разных концах которого расположены флуорофор и гаситель флуоресценции. Подобная структура зонда обеспечивает максимальный эффект тушения и низкую фоновую флуоресценцию, поскольку молекулы флуорофора и гасителя сближены в пространстве.
Апробация разработанного набора олигонуклеотидов была осуществлена на наборе штаммов возбудителей особо опасных микозов лаборатории коллекционных штаммов ФКУЗ Волгоградский научно-исследовательский противочумный институт Роспотребнадзора. В качестве положительного контроля использовали коллекционный штамм В. dermatitidis 9. Для выделения ДНК использовали обеззараженные суспензии микромицетов в концентрациях от 1×107 м.к./мл до 1×101 кл./мл.
Чувствительность реакции амплификации с флуоресцентной детекцией в режиме реального времени с праймерами - BDags-1F / BDags-2R и зондом BDags-2P оценивалась при исследовании проб ДНК, выделенных из десятикратных разведений чистых культур возбудителя бластомикоза, и составила 1×102 кл./мл.
Примеры конкретного выполнения
Пример 1. Методика конструирования олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации ДНК возбудителя бластомикоза методом ПЦР в режиме реального времени.
На основе анализа in silico секвенированных нуклеотидных последовательностей возбудителя бластомикоза, присутствующих в базах данных Broad Institute (http://www.broadinstitute.org/scientific-community/data) и GenBank NCBI (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov), для конструирования прямого BDags-1F и обратного BDags-2R праймеров были выбраны участки, комплементарные фрагментам гена α-1,3-глюкансинтазы (alpha-1,3-glucan synthase) В. dermatitidis, который является одним из факторов вирулентности и кодирует фермент, осуществляющий синтез компонента клеточной стенки гриба (GenBank NCBI, GeneID: 8507939). Расчетная длина предполагаемого ампликона - 178 п.н. (табл. 1).
При использовании компьютерных программ была проанализирована структура выбранной пары праймеров BDags-1F / BDags-2R (образование димеров, шпилек и других вторичных структур) и показана их теоретическая пригодность для успешной инициации реакции амплификации.
Для флуоресцентной детекции продуктов ПЦР в режиме реального времени сконструирован олигонуклеотидный зонд BDags-2P размером 24 п.н., который гибридизуется на участке ампликона между прямым и обратным праймерами BDags-1F / BDags-2R. На разных концах зонда расположены флуорофор FAM и гаситель флуоресценции BHQ1. Комплементарные концевые последовательности зонда образуют «шпильку» по принципу «молекулярного маяка». В онлайн-режиме с использованием программы Mfold на интернет-сайте http://mfold.rna.albany.edu оценивали вторичную структуру и термодинамические параметры разработанного зонда.
Специфичность разработанных олигонуклеотидов оценивали с использованием компьютерной программы BLAST на web-сервере Национального Центра Биотехнологической Информации (NCBI) (http://www.ncbi.nlm.nih.gov/BLAST/) для установления гомологии между сконструированными праймерами BDags-1F/BDags-2R и зондом BDags-2P и нуклеотидными последовательностями В. dermatitidis и других гетерологичных микроорганизмов, присутствующих в базах данных (GenBank, Broad Institute). На момент проведения компьютерного анализа гомологии выявлено не было.
Пример 2. Амплификация специфических фрагментов ДНК с использованием разработанных праймеров BDags-1F / BDags-2R и флуоресцентно-меченого зонда BDags-2P для идентификации возбудителя бластомикоза методом ПЦР в режиме реального времени.
Инактивацию образцов микромицетов и выделение ДНК проводили согласно требованиям СП 1.3.3118-13 «Безопасность работы с микроорганизмами I-II групп патогенности (опасности)» и МУ 1.3. 2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности».
Обеззараживание исследуемых проб проводили добавлением раствора мертиолята натрия до конечной концентрации 0,1% и последующим прогреванием в течение 40 мин при температуре температуре 56°C и инкубированием при комнатной температуре до 24 ч. Выделение ДНК из чистых культур микромицетов осуществляли с помощью метода гуанидинтиоцианат-фенольной экстракции с переосаждением ДНК изопропанолом [Sandhu G.S. et al., 1995].
Для проведения ПЦР в режиме реального времени в состав реакционной смеси входили анализируемая ДНК микромицетов, разработанные комплементарным специфичным фрагментам ДНК В. dermatitidis прямой BDags-1F и обратный BDags-2R праймеры, олигонуклеотидный зонд BDags-2P, а также дезоксирибонуклеозидтрифосфаты, буферный раствор, MgCl2 и фермент Taq-F полимераза (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора). Амплификацию продолжительностью 45 циклов проводили в объеме 25 мкл. В качестве отрицательного контрольного образца добавляли ТЕ-буфер.
Амплификацию и детекцию продуктов ПЦР осуществляли в режиме реального времени на приборе «Rotor-Gene 6000» («Corbett Research», Австралия). Результаты регистрировали в табличной и графической форме. Если кривая накопления флуоресценции по каналу детекции пересекала пороговую линию на участке характерного экспоненциального роста уровня флуоресценции, на цикле, не превышающем значение порогового цикла реакции (Ct), то результат амплификации ДНК В. dermatitidis считался положительным. При этом значение Ct для исследуемых образцов было не более 33.
Пример 3. Определение чувствительности и специфичности реакции амплификации с помощью разработанного набора олигонуклеотидных праймеров BDags-1F / BDags-2R и флуоресцентно-меченого зонда BDags-2P для идентификации возбудителя бластомикоза.
При подготовке проб для ПЦР исследуемые культуры грибов в мицелиальной фазе роста культивировали на агаре Сабуро, содержащем 5% левомицетина, pH 6,8±0,2, и инкубировали при температуре (28±1) 0С в течение 30-45 сут. Дрожжевые формы микромицетов выращивали на среде Френсиса, содержащей 5% цистеина и 5% дефибринированной крови, в течение 7-14 сут при 37°C. Из выросших культур готовили суспензии в 0,9% растворе натрия хлорида, pH 7,2±0.1.
После обеззараживания и фильтрования суспензий грибов проводили подсчет клеток исходных взвесей в камере Горяева и разводили таким образом, чтобы концентрация возбудителя бластомикоза составляла от 1×107 до 1×101 кл./мл, а для гетерологичных микроорганизмов - 1×107 кл./мл.
Выделение ДНК, постановку и учет результатов реакции ПЦР в режиме реального времени осуществляли, как описано в примере 2.
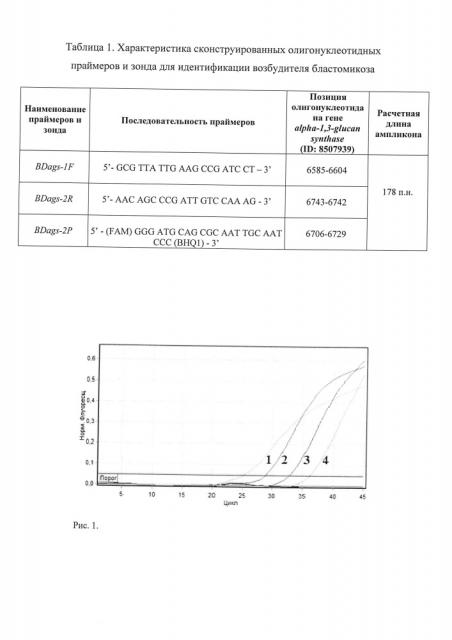
Чувствительность реакции амплификации с разработанными специфичными праймерами BDags-1F / BDags-2R и флуоресцентно-меченым зондом BDags-2P оценивалась при исследовании проб ДНК, выделенных из десятикратных разведений взвесей дрожжевых клеток В. dermatitidis. В амплификационную смесь добавляли по 10 мкл ДНК, выделенной из разведений от 1×105 до 1×101 м.к./мл. Анализ результатов показал, что с помощью разработанных праймеров BDags-1F / BDags-2R и флуоресцентно-меченого зонда BDags-2P минимальный порог аналитической чувствительности достигал концентрации 1×102 кл/мл (рис. 1).
Рисунок 1 отображает график нарастания флуоресцентных кривых, полученных при амплификации ДНК штамма В. dermatitidis 9 с праймерами BDags-1F / BDags-2R и флуоресцентно-меченым зондом Bdags-2P (изображены кривые 1 - В. dermatitidis 9 в концентрации 105 кл./мл, 2 - В. dermatitidis 9 в концентрации 104 кл./мл, 3 - В. dermatitidis 9 в концентрации 103 кл./мл, 4 - В. dermatitidis 9 в концентрации 102 мк./мл, кривые ниже уровня пороговой линии - отрицательный контроль и кривые накопления флуоресценции проб В. dermatitidis 9 в концентрации меньше 102 кл./мл).
Специфичность разработанного набора праймеров BDags-1F / BDags-2R и флуоресцентно-меченого зонда BDags-2P оценена на коллекции из 40 штаммов, из которых 3 штамма В. dermatitidis и 37 штаммов гетерологичных микроорганизмов (9 штаммов Histoplasma capsulatum, 6 штаммов Coccidioides immitis, 2 штамма Coccidioides posadasii 5 штаммов Cryptococcus neoformans, и по 1 штамму Candida parapsilosis BKM Y-58, Candida glabrata BKM Y-1481, Candida kefyr BKM Y-257, Candida guilliermondii BKM Y-41, Rhodotorula mucilaginosa BKM Y-339, Geotrichum fermentans BKM Y-813, Fusarium javanicum (solani) BKM F-134, Absidia hyalospora (syn. Mycocladus hyalospora) BKMF-1435, Aspergillus fumigatus BKM F-753, Rhizopus microsporia var. microsporus BKM F-774, Fusarium culmorum BKM F-1017, Gymnoascus reesii BKM F-1707, Mucor racemosus var. racemosus BKM F-1128, Phialophora verrucosa BKM F-1990, Scopulariopsis brevicaulis BKM F-406). Оценка специфичности ПЦР показала отсутствие перекрестных реакций с близкородственными гетерологичными штаммами, в том числе с ДНК возбудителей особо опасных микозов.
Таким образом, разработанный набор праймеров BDags-1F / BDags-2R и флуоресцентно-меченого зонда BDags-2P может быть использован для идентификации возбудителя бластомикоза и позволяет в короткий срок с высокой чувствительностью и специфичностью детектировать ДНК В. dermatitidis в пробах чистых культур, объектах окружающей среды и биологическом материале.
Набор олигонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации ДНК возбудителя бластомикоза Blastomyces dermatitidis методом полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов, содержащий олигонуклеотиды, комплементарные фрагментам гена α-1,3-глюкансинтазы B. dermatitidis, обладающих активностью прямого и обратного праймеров в реакции амплификации, и зонда, сконструированного по типу «молекулярного маяка», обеспечивающего флуоресцентную детекцию, имеющие следующую структуру:
5’- GCG TTA TTGAAG CCG ATC CT - 3’- BDags-1F
5’- AAC AGC CCG ATT GTC CAA AG - 3’ - BDags-2R
5’(FAM)-GGGATGCAGCGCAATTGCAATCCC-( BHQ1) 3’ - BDags-2P,
где FAM – карбоксифлуоресцеин, флуоресцентный краситель, длина волны поглощения которого составляет 490 нм, а длина волны флуоресценции - 520 нм. BHQ1 – гаситель флуоресценции с диапазоном гашения 480-580 нм.