Способ определения зиготности гена fad-2 канолы с использованием пцр с детекцией по конечной точке
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу определения зиготности гена fad-2 растения канолы. Также раскрыт набор для осуществления указанного способа. Изобретение позволяет определить зиготность гена fad-2. 2 н. и 9 з.п. ф-лы, 2 ил., 1 табл., 1 пр.
Реферат
Перекрестная ссылка на родственную заявку
Настоящая заявка испрашивает приоритет предварительной патентной заявки США №61/550165, поданной 21 октября 2011 г., которая во всей своей полноте включается в данный документ посредством ссылки.
Уровень техники, к которой относится изобретение
Род Brassica (капуста) включает канолу, одну из наиболее важных в мире масличных культур, причем эту важную масличную культуру выращивают в географических регионах с умеренным климатом. Канола традиционно характеризуется как Brassica napus L., вид, полученный в результате межвидового скрещивания видов Brassica rapa (репа) и Brassica oleracea (капуста огородная), в котором содержание эруковой кислоты и глюкозинолатов устранено или значительно сокращено посредством традиционной селекции. Основная масса масла канолы присутствует в форме растительных масел, производимых для питания человека. Кроме того, растет рынок для использования масла канолы в промышленных приложениях.
Род Brassica составляют три диплоидных вида, каждый из которых характеризует уникальный геном, который называется «геном A», «геном B» или «геном C». Растения вида Brassica rapa (репа) имеют диплоидный геном A. Растения вида Brassica nigra (горчица черная) имеют диплоидный геном В. Растения вида Brassica oleracea (капуста огородная) имеют диплоидный геном C. Гибриды этих видов можно производить посредством скрещивания между двумя из диплоидных видов. Канола представляет собой амфидиплоидный вид, который рассматривается как продукт гибридизации вида Brassica oleracea, имеющего диплоидный геном C, и вида Brassica rapa, имеющего диплоидный геном A. Цитогенетическое исследование обнаружило, что геномы AA и CC проявляют степень родства, будучи частично гомологичными по отношению друг к другу, и считается, что они произошли от генома их общего предка (Prakash и Hinata, 1980 г.). Хотя технически они классифицируются как диплоидные, геномы обоих видов-предшественников имеют высокое процентное содержание областей, которые дублируют друг друга (Song et al., 1991 г.). Генетический анализ обнаружил, что вид Brassica napus получил десять хромосом от генома AA вида Brassica rapa и девять хромосом от генома СС вида Brassica oleracea в качестве материнского донора (Song et al., 1992 г.).
Качество пищевого и технического масла, получаемого из определенного ассортимента разнообразных семян канолы, определяется составляющими его жирными кислотами, поскольку тип и количество ненасыщенных жирных кислот имеют значение для пищевого и промышленного применения. Традиционное масло канолы содержит приблизительно 60% олеиновой кислоты (C18:1), 20% линолевой кислоты (C18:2) и 10% линоленовой кислоты (18:3). Уровни полиненасыщенной линоленовой кислоты, которые являются типичными для традиционной канолы, оказываются нежелательными, поскольку масло легко окисляется, причем на скорость окисления влияют несколько факторов, в том числе присутствие кислорода, воздействие света и тепла, а также присутствие в масле природных или добавленных веществ, которые препятствуют и способствуют окислению. Окисление вызывает неприятный запах и прогорклый вкус в результате повторной жарки (индуцированное окисление) или в процессе хранения в течение продолжительного периода (автоокисление). Окисление может также изменять смазочные и вязкие свойства масла канолы.
Свойства масла канолы, которое проявляет пониженные уровни полиненасыщенных жирных кислот и повышенные уровни мононенасыщенной олеиновой кислоты по сравнению с традиционным маслом канолы, связаны с повышенной устойчивостью к окислению. Подверженность отдельных жирных кислот к окислению зависит от степени их ненасыщенности. Таким образом, скорость окисления линоленовой кислоты, молекула которой содержит три двойные связи между атомами углерода, в 25 раз превышает скорость окисления олеиновой кислоты, молекула которой содержит только одну двойную связь между атомами углерода, и в два раза превышает скорость окисления линолевой кислоты, молекула которой содержит две двойные связи между атомами углерода. Линолевая и линоленовая кислоты также вносят наибольший вклад во вкус и запах, потому что они легко образуют гидропероксиды. Масло, имеющее высокое содержание олеиновой кислоты (не менее чем 70% олеиновой кислоты), подвержено окислению в меньшей степени в процессе хранения, жарки и очистки, и его можно нагревать до более высокой температуры без образования дыма, что делает его более подходящим в качестве кулинарного масла.
Качество масла канолы определяется составляющими его жирными кислотами, такими как олеиновая кислота (C18:1), линолевая кислота (C18:2) и линоленовая кислота (C18:3). Из большинства культурных сортов канолы, как правило, производят масло, содержащее приблизительно от 55 до 65% олеиновой кислоты и от 8 до 12% линоленовой кислоты. Высокие концентрации линоленовой кислоты приводят к тому, что масло становится неустойчивым и приобретает неприятный запах, в то время как высокие уровни олеиновой кислоты повышают устойчивость к окислению и питательную ценность масла. Таким образом, выведение культурных сортов канолы с повышенным содержанием олеиновой кислоты и пониженным содержанием линоленовой кислоты является в высокой степени желательным для повышения качества масла канолы.
Были определены два локуса и их геномное положение, локализованное от культурного сорта канолы, который обладает повышенным содержанием олеиновой кислоты и пониженным содержанием линоленовой кислоты. Один локус производит основной эффект, и второй локус производит второстепенный эффект на образование повышенного содержания олеиновой кислоты и пониженного содержания линоленовой кислоты. Основной локус для высокого содержания олеиновая кислота (C18:1) был определен в гене десатуразы-2 жирных кислот (fad-2), и он расположен на группе сцепления N5. Второй второстепенный локус расположен на группе сцепления N1. Один основной локус количественных признаков (ЛКП) для линоленовой кислоты (C18:3) представляет собой ген десатуразы-3 жирных кислот генома С (fad-Зс) и расположен на группе сцепления N14. Второй основной ЛКП расположен на группе сцепления N4 и представляет собой ген десатуразы-3 жирных кислот генома A (fad-3а). Геномные последовательности генов fad-2 и fad-3c были амплифицированы и секвенированы из индуцированного этилметансульфонатом (ЭМС) мутантного и (немутантного) культурного сорта канолы дикого типа. Сравнение аллельных последовательностей генов fad-2 и fad-3c мутантного и дикого типов обнаружило однонуклеотидные полиморфизмы (ОНП) в генах из индуцированных ЭМС мутантных растений. На основании различий последовательностей между аллелями мутантного и дикого типов были разработаны два маркера ОНП, соответствующие мутациям генов fad-2 и fad-3c (Ни et al., 2006).
Существующие до настоящего времени способы получения семян гибрида Brassica первого поколения (F1) имеют ограничения в отношении стоимости и чистоты семян. Как правило, для этих способов требуются устойчивые, родственно-несовместимые и самонесовместимые, почти гомозиготные родительские генеалогические линии, причем данные родительские генеалогические линии можно произвести только после многократного самоопыления для получения инбредных линий. Кроме того, близкородственное скрещивание (инбридинг) для развития и сохранения родительских линий осуществляется посредством трудоемких технологий, таких как почечное опыление, поскольку системы производства гибридных семян рода Brassica на основе самонесовместимых признаков должно использовать растения, имеющие сильную самонесовместимость. Условия окружающей среды в течение процесса разведения, такие как температура и влажность, как правило, влияют на липидный метаболизм растений и, таким образом, влияют также на уровень содержания жирных кислот (Harwood, 1999 г.). Таким образом, изменчивость условий окружающей среды делает фенотипическую селекцию растений менее надежной. Deng и Scarth (1998 г.) обнаружили, что повышение температуры после цветения значительно снижает уровни C18:3 и повышает уровни C18:1. Аналогичные результаты были получены и в других исследованиях (Yermanos и Goodin, 1965 г.; Canvin, 1965 г.).
Селекция в целях низкого содержания линоленовой кислоты является особенно проблематичной, поскольку содержание C18:3 представляет собой мультигенный признак и наследуется рецессивным образом с относительно низкой способностью наследования. Генетический анализ популяции, полученной в результате скрещивания сорта Stellar (имеющего низкое содержание C18:3 на уровне 3%) и сорта Drakkar (имеющего «традиционное» содержание C18:3 на уровне от 9 до 10%), показал, что признак низкого содержания C18:3 регулируют два основных локуса, которые производят аддитивные эффекты, обозначенные L1 и L2 (Jourdren et al., b, 1996 г.). Было обнаружено, что эти два основных локуса, которые регулируют содержание C18:3, соответствуют двум генам fad-3 (десатураза-3 жирных кислот), причем один из них содержит геном А (происходящий от вида Brassica rapa), а другой содержит геном C (происходящий от вида Brassica oleracea) (Jourdren et al., 1996 г.; Barret et al.,, 1999 г.).
Признаки, которые постоянно изменяются вследствие генетических факторов (аддитивных, доминантных и эпистатических) и воздействий окружающей среды, обычно называют термином «количественные признаки». Количественные признаки могут отличаться от «качественных» или «дискретных» признаков на основании двух факторов: влияние условий окружающей среды на экспрессию генов, которые производят непрерывное распределение фенотипов; и сложная картина сегрегации, которую производит мультигенное наследование. Определение одной или нескольких областей генома, связанных с экспрессией количественного признака, привело к открытию локусов количественных признаков (ЛКП). Thormann et al. (1996 г.) картировали два ЛКП, которые объясняли 60% изменчивости содержания линоленовой кислоты, а затем Somers et al. (1998 г.) определили три ЛКП, которые в совокупности объясняли 51% фенотипической изменчивости содержания C18:3. Трехлокусную аддитивную модель также описали Chen и Beversdorf (1990 г.). Rucker и Robbelen (1996 г.) показали, что несколько второстепенных генов наиболее вероятно принимают участие на стадии десатурации.
Способность наследования содержания C18:3 была оценена на уровне от 26 до 59% (Kondra и Thomas, 1975 г.) (где изменчивость способности наследования представляет собой функцию генетических факторов, а не факторов окружающей среды). Сложность наследования содержания линоленовой кислоты может быть обусловлена тем, что линоленовая кислота может быть синтезирована как путем десатурации C18:2, так и путем увеличения цепи C16:3 (Thompson, 1983 г.).
В отличие от линоленовой кислоты, наследование содержания олеиновой кислоты является менее сложной, и способность наследования содержания олеиновой кислоты является относительно высокой. Согласно сообщениям высокое содержание олеиновой кислоты регулирует основной локус, так называемый ген fad-2 (десатураза-2 жирных кислот), который кодирует фермент, ответственный за десатурацию олеиновой кислоты в линолевую кислоту (C18:2) (Tanhuanpaa et al., 1998 г.; Schierholt et al., 2001 г.). Все функциональные генные копии гена fad-2, которые были описаны и картированы до настоящего времени, расположены на происходящей из генома A группе сцепления N5 (Scheffler et al.,, 1997 г.; Schierholt et al.,, 2000 г.). Chen и Beversdorf (1990) сообщили, что накопление олеиновой кислоты регулируется в двух сегрегационных генетических системах, причем одна воздействует на удлинение цепи, а вторая участвует в десатурации. Способность наследования содержания C18:1 была оценена на уровне от 53% до 78% (Kondra и Thomas 1975 г.) и 94% (Schierholt и Becker, 1999 г.), соответственно. Вследствие повышенной способности наследования, на экспрессию содержания C18:1 в меньшей степени воздействуют условия окружающей среды, и она является относительно устойчивой (Schierholt и Becker, 1999 г.).
Было обнаружено, что в зародышевой плазме канолы Nexera™ (Nexera™ представляет собой товарный знак компании Dow AgroSciences, LLC) один или два гена регулируют содержание C18:1 и, по меньшей мере, три гена участвуют в экспрессии C18:3. При сегрегации потомства распределение содержания C18:3 в семенах является непрерывный, и в результате этого оказывается затруднительным определение генотипических классов с желательными уровнями содержания C18:3. Кроме того, существует низкая корреляция содержание жирных кислот между растениями, выращиваемыми в оранжерее (GH) и в полевых условиях, что делает еще более проблематичным надежную селекцию оранжерейных растений с желательными уровнями содержания C18:3.
Можно использовать разнообразные способы для обнаружения присутствия конкретного гена в образце растительной ткани. Один пример представляет собой способ пиросеквенирования, который описал Winge (Innov. Pharma. Tech. 00:18-24, 2000 г.). Согласно данному способу, олигонуклеотид должен перекрывать последовательность вставленной ДНК и прилегающей к ней геномной ДНК. С олигонуклеотидом гибридизуется одноцепочечный продукт ПЦР (ампликон) из рассматриваемой области (т.е. один праймер во вставленной последовательности и один во фланкирующей геномной последовательности), и осуществляется инкубация, при которой присутствуют ДНК-полимераза, аденозинтрифосфат (АТФ), сульфурилаза, люцифераза, апираза, аденозин-5'-фосфосульфат и люциферин. Дезоксирибонуклеозидтрифосфаты (дНТФ) добавляют индивидуально, и их введение приводит к световому сигналу, который измеряется. Световой сигнал показывает присутствие трансгенной вставленной/фланкирующей последовательности вследствие успешной амплификации, гибридизации и удлинения цепи на одно или несколько оснований (этот способ обычно используется для начального секвенирования, а не для обнаружения конкретного гена, когда он известен).
Флуоресцентная поляризация представляет собой еще один способ, который можно использовать, чтобы обнаруживать ампликон. Согласно данному способу, олигонуклеотид должен перекрывать соединение геномной фланкирующей и вставленной ДНК. С олигонуклеотидом гибридизуется одноцепочечный продукт ПЦР из рассматриваемой области (один праймер во вставленной ДНК и один праймер в последовательности фланкирующей геномной ДНК), и осуществляется инкубация, при которой присутствуют ДНК-полимераза и содержащий флуоресцентную метку дидезоксирибонуклеозидтрифосфат (ддНТФ). Удлинение цепи на одно основание приводит к введению ддНТФ. Степень введения можно измерять как изменение поляризации, используя флуорометр. Изменение поляризации показывает присутствие трансгенной вставленной/фланкирующей последовательности вследствие успешной амплификации, гибридизации и удлинения цепи на одно основание.
Были описаны молекулярные маяки для использования в обнаружении последовательностей. Вкратце, молекулярные маяки включают осуществляющий РПЭФ (резонансный перенос энергии флуоресценции) олигонуклеотидный зонд, который может быть устроен таким образом, что зонд РПЭФ перекрывает соединение фланкирующей геномной и вставленной ДНК. Уникальная структура зонда РПЭФ приводит к тому, что она содержит вторичную структуру, которая сохраняет в непосредственной близости флуоресцентные и гасящие фрагменты. Зонд РПЭФ и праймеры ПЦР (один праймер в последовательности вставленной ДНК и один праймер во фланкирующей геномной последовательности) циклически обрабатывают в присутствие термоустойчивой полимеразы и дНТФ. После успешной амплификации ПЦР гибридизация зонда РПЭФ с целевой последовательностью приводит к удалению вторичной структуры зонда и пространственному разделению флуоресцентных и гасящих фрагментов. Флуоресцентный сигнал показывает, что присутствует фланкирующая геномная/трансгенная вставленная последовательность вследствие успешной амплификации и гибридизации.
Исследования с гидролитическим зондом, также известные как ПЦР TaqMan® (TaqMan® представляет собой зарегистрированный товарный знак компании Roche Molecular Systems, Inc.), предлагают способ обнаружения и количественного определения присутствия of последовательности ДНК. Вкратце, в методе ПЦР TaqMan® используется олигонуклеотидный зонд РПЭФ, который содержит часть олигонуклеотида в трансгене и другую часть олигонуклеотида во фланкирующей геномной последовательности для обнаружения определенного события. Зонд РПЭФ и праймеры ПЦР (один праймер во вставленной последовательности ДНК и один праймер во фланкирующей геномной последовательности) циклически обрабатывают в присутствии термоустойчивой полимеразы и дНТФ. Гибридизация зонда РПЭФ и последующий гидролиз в течение стадии амплификации ПЦР вследствие 5'-экзонуклеазной активности полимеразы термофильной бактерии Thermus aquaticus (Taq) приводят к расщеплению связи и отделению флуоресцентного фрагмента от гасящего фрагмента на зонде РПЭФ. Флуоресцентный сигнал показывает, что фланкирующая/трансгенная вставленная последовательность присутствует вследствие успешной гибридизации и амплификации.
Молекулярные маркеры можно также использовать для специфического определения последовательности ДНК. Выбор молекулярных маркеров осуществляется на основании генотипов и, таким образом, является независимым от воздействия окружающей среды. Молекулярные маркеры способствуют устранению проблемы ненадежной селекции растений в оранжерее, что обусловлено низкой корреляцией содержания жирных кислот между растениями, выращиваемыми в оранжерее, и растениями, выращиваемыми в полевых условиях. Следует отметить, что молекулярные маркеры, прочно связанные с генами, которые регулируют содержание C18:1 и C18:3, могут способствовать ранней селекции растений, несущих гены высокого содержания C18:1 и низкого содержания C18:3. Селекция с помощью маркеров на ранней стадии может способствовать экономии оранжерейного пространства, повышению эффективности использования оранжереи и сокращению трудоемкости селекции в полевых условиях.
Более конкретно, молекулярные маркеры обладают следующими преимуществами по сравнению с морфологическими маркерами: молекулярные маркеры могут быть высокополиморфными, в то время как морфологические маркеры являются строго зависимыми от фенотипа; морфологические маркеры могут вмешиваться в подсчет определенных количественных фенотипов, в то время как молекулярные маркеры проявляют соотношение 1:1 между генотипом и фенотипом (таким образом, обеспечивается однозначный подсчет всех возможных генотипов для данного локуса); и эпистатические взаимодействия, как правило, ограничивают число морфологических маркеров, которые можно использовать в популяции, в то время как молекулярные маркеры не вступают в эпистатические взаимодействия.
Было определено, что различные типы молекулярных маркеров, таких как маркеры статистически амплифицированной полиморфной ДНК (САПД) (Tanhuanpaa et al.,, 1995 г.; Ни et al.,, 1995 г.; Rajcan et al.,, 1999 г.; Jourdren et al.,, 1996 г.), маркеры полиморфизма длины рестрикционных фрагментов (ПДРФ) (Thormann et al.,, 1996 г.) и маркеры характеризуемой последовательностью амплифицированной области (ХПАО) (Ни et al.,, 1999 г.), связаны с низкими уровнями C18:3 у вида Brassica napus. Молекулярные маркеры были также определены для высокого содержания C18:1. Было определено, что маркер САПД связан с ЛКП, который влияет на концентрацию олеиновой кислоты у яровой репы масличной (подвид Brassica rapa oleifera вида Brassica rapa), а затем его превратили в маркер ХПАО (Tanhuanpaa et al.,, 1996 г.). Schierholt et al., (2000 г.) идентифицировали три маркера полиморфизма длины амплифицированного фрагмента (ПДАФ), связанные с мутацией в сторону повышенного содержания олеиновой кислоты у озимого рапса масличного (Brassica napus L.). Tanhuanpaa et al., (1998 г.) разработали аллель-специфичный маркер ПЦР для олеиновой кислоты, сравнивая аллели дикого типа и высокого содержания олеиновой кислоты локуса гена fad-2 у яровой репы масличной (подвид Brassica rapa oleifera вида Brassica rapa). Однако большинство этих маркеров представляют собой низкопроизводительные маркеры, такие как САПД, ПДАФ и ПДРФ, которые не являются подходящими для крупномасштабного автоматизированного исследования.
Сущность изобретения
Настоящее изобретение относится, в частности, к исследованиям методом ПЦР TaqMan® по конечной точке для обнаружения и высокопроизводительного анализа зиготности гена fad-2 канолы. Настоящее изобретение также относится, в частности, к использованию ДНК дикого типа в качестве стандарта для применения в определении зиготности. Эти и другие родственные процедуры можно использовать для уникальной идентификации зиготности и изменчивости линий канолы, включающих исследуемый ген.
Настоящее изобретение также предлагает соответствующие наборы для определения зиготности и изменчивости в образце, например, канолы.
Таким образом, согласно варианту осуществления настоящего изобретения, предлагается ПЦР TaqMan® в качестве универсальной основы для высокопроизводительного анализа зиготности и селекции. Использование метода ПЦР TaqMan® по конечной точке, который предлагает настоящее изобретение, представляет собой надежное, точное и высокопроизводительное приложение для анализа зиготности fad-2 и селекции канолы.
Краткое описание фигур
Фиг. 1 представляет участок последовательности гена fad-2 (SEQ ID NO: 1), иллюстрирующий положение мутации fad-2 с, которую определили Hu et al., (200 6 г.).
Фиг. 2 представляет пример результатов анализа зиготности (канолы), иллюстрирующий три генотипа fad-2 после исследования TaqMan® по конечной точке; данные результаты получены с использованием программного обеспечения SDS 2.4, поставляемого компанией Applied Biosystems (Фостер-сити, штат Калифорния, США).
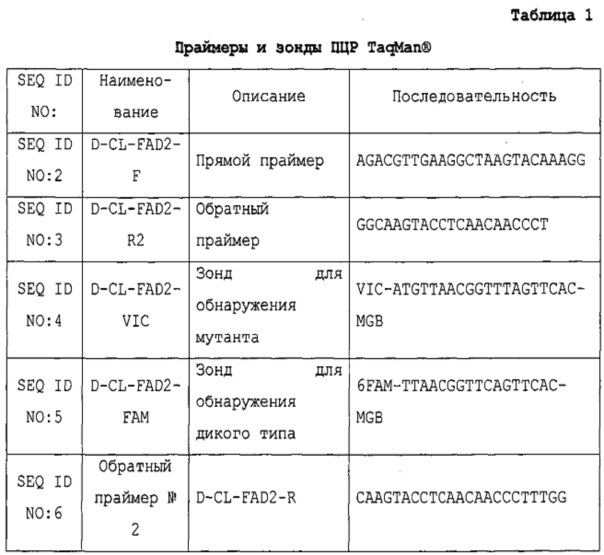
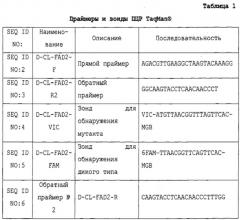
Краткое описание последовательностей SEQ ID NO: 1 представляет собой участок последовательности гена fad-2, иллюстрирующий положение мутации fad-2c.
SEQ ID NO: 2 представляет собой прямой праймер D-CL-FAD-2-F, который связывает фланкирующую геномную последовательность.
SEQ ID NO: 3 представляет собой обратный праймер D-CL-FAD-2-R2, который связывает вставляемую последовательность.
SEQ ID NO: 4 представляет собой зонд D-CL-FAD-2-VIC для предпочтительного связывание мутировавшего гена fad-2, имеющего однонуклеотидный полиморфизм С→Т.
SEQ ID NO: 5 представляет собой зонд D-CL-FAD-2-FAM для обнаружения гена fad-2 дикого типа.
Подробное описание изобретения
Настоящее изобретение относится, в частности, к исследованиям методом ПЦР TaqMan® по конечной точке для обнаружения и высокопроизводительного анализа зиготности гена fad-2 канолы. Настоящее изобретение также относится, в частности, к использованию ДНК дикого типа в качестве стандарта для применения в определении зиготности. Эти и другие родственные процедуры можно использовать для уникальной идентификации зиготности и изменчивости линий канолы, включающих исследуемый ген. Настоящее изобретение также предлагает соответствующие наборы для определения зиготности и изменчивости в образце, например, канолы. Таким образом, согласно варианту осуществления настоящего изобретения, предлагается ПЦР TaqMan® в качестве универсальной основы для высокопроизводительного анализа зиготности и селекции. Использование метода ПЦР TaqMan® по конечной точке, который предлагает настоящее изобретение, представляет собой надежное, точное и высокопроизводительное приложение для анализа зиготности fad-2 и селекции канолы.
Новые исследования согласно настоящему изобретению были разработаны, в частности, на основании мутации однонуклеотидного полиморфизма (ОНП) аллеля fad-2 reported by Hu et al., (2006). В данном исследовании используются две области праймера и два зонда MGB, чтобы обнаруживать аллели fad-2 мутантного и дикого типа (см. таблицу 1). Праймеры и зонды TaqMan® для обнаружения этой мутации SNP предназначены, в частности, для программного обеспечения Primer Express от компании Applied Biosystems (Остин, штат Техас) с использованием последовательностей гена fad-2. Данное новое исследование гена fad-2 методом TaqMan® было подтверждено с использованием ДНК, экстрагированной из растений канолы, которые относятся к гомозиготному, гемизиготному и дикому типу (отсутствие мутации) гена fad-2. Исследование гена fad-2 методом TaqMan® было также оптимизировано для осуществления, в частности, с использованием в режиме реального времени системы ПЦР 7900 НТ от компании Applied Biosystems в форматах 96 или 384 лунки в условиях ПЦР с быстрым циклическим изменением температуры.
В исследовании использовали образцы листьев NEX845 и Quantum. Для подтверждения данного исследования использовали ДНК выведенных популяций канолы.
Аспекты настоящего изобретения включают способы разработки и/или получения диагностических молекул нуклеиновых кислот, примеры которых представлены и/или предложены в настоящем документе. Конкретные праймеры и зонды для метода TaqMan® были разработаны, как подробно описано в настоящем документе, в частности, согласно последовательностям ДНК, которые расположены точно или вблизи выше или ниже определенных в настоящем документе конкретных SNP гена fad-2.
Таким образом, согласно некоторым вариантам осуществления, настоящее изобретение относится к определению зиготности производящих масло растений канолы. Настоящее изобретение относится, в частности, к обнаружению присутствия ОНП, согласно описанию в настоящем документе, в целях определения того, содержит ли потомство от полового скрещивания рассматриваемые ОНП, а также зиготности потомства. Кроме того, предусмотрены способы обнаружения, которые могут оказаться полезными, например, для соблюдения требований, определяющих предпродажное разрешение и маркировку продуктов питания, произведенных из рекомбинантных культурных растений.
Настоящее изобретение относится, в частности, к исследованию на основе флуоресцентного метода ПЦР TaqMan® по конечной точке использованием эндогенного немутантного гена fad-2 в качестве контрольного образца для высокопроизводительного анализа зиготности растения канолы.
Настоящее изобретение также относится, в частности, к разработке биплексного метода ПЦР TaqMan® по конечной точке для анализа зиготности канолы. Кроме того, настоящее изобретение относится, в частности, к разработке наборов для исследования гена fad-2 выращиваемой канолы.
Как правило, исследования методом TaqMan® по конечной точке основаны на стратегии «плюс/минус», согласно которой «плюс» означает, что образец является положительным для исследуемого гена, а «минус» означает, что образец является отрицательным для исследуемого гена. В этих исследованиях, как правило, используется один набор олигонуклеотидных праймеров и два олигонуклеотидных зонда, причем один зонд предпочтительно гибридизуется с мутировавшим SNP fad-2, а другой зонд предпочтительно гибридизуется с последовательностью fad-2 дикого типа, соответственно.
Преимущества, связанные с настоящим изобретением, включают уменьшение его зависимости от качества и количества ДНК. Кроме того, для настоящего изобретения не требуется продолжительная начальная стадия денатурации, которая, если не осуществляется надлежащим образом, может часто делать безуспешными другие исследования по обнаружению ОНП. Кроме того, настоящее изобретение предлагает способ эффективного анализа многочисленных образцов канолы высокопроизводительным образом на промышленной основе. Еще одно преимущество настоящего изобретения представляет собой экономию времени. Предлагаемое исследование методом TaqMan® по конечной точке для анализа зиготности канолы и анализа селекции предоставляет преимущества по сравнению с другими прикладными форматами, в частности, в целях анализа большого числа образцов.
Настоящее изобретение относится, в частности, к анализу селекции растений. Настоящее изобретение предлагает новый способ обнаружения SNP в растениях канолы, которые влияют на уровни содержания олеиновой и линоленовой кислот в исследуемых растениях.
Кроме того, становится возможным обнаружение присутствия исследуемых ОНП, используя другие известные способы обнаружения нуклеиновых кислот, такие как ПЦР или гибридизация ДНК с применением содержащих нуклеиновые кислоты зондов, которые описаны в настоящем документе. В настоящем документе обсуждаются исследования определенного события методом ПЦР (см. также статью Windels et al., Med. Fac. Landbouww, Univ. Gent (Факультет медицины и сельского хозяйства Гентского университета), 1999 г., 64/5b:459462).
При использовании в настоящем документе, термин «потомство» означает любое поколение потомства родительского растения.
Способы обнаружение согласно настоящему изобретению являются особенно полезными в сочетании с селекцией растений, например, для определения зиготности потомства растений после того, как родительское растение, включающее рассматриваемый ОНП, скрещивается с другим растением. Исследуемые приложения и способы благоприятствуют программам селекции канолы, а также процессам контроля качества. Наборы обнаружения методом ПЦР для линий канолы, способы их применения и исследования, которые описаны в настоящем документе, теперь можно осуществлять и использовать. Кроме того, настоящее изобретение может благоприятствовать регистрации продуктов и обслуживанию продуктов.
Растение канолы, включающее желательное сочетание гена fad-2, можно выводить, осуществляя сначала половое скрещивание первого родительского растения канолы, представляющее собой растение канолы, выращенное из семени любой из линий, которые указаны в настоящем документе, и второго родительского растения канолы, получая в результате этого множество растений первого поколения; затем осуществляя селекцию из первого поколения растений, обладающих желательным геном fad-2, как предусмотрено в настоящем изобретении; проводя самоопыление первого поколения растений, получая в результате этого множество растений второго поколения; и затем осуществляя селекцию из второго поколения растений, обладающих желательным геном fad-2 согласно настоящему изобретению. Эти стадии могут дополнительно включают возвратное скрещивание первого поколения растений или второго поколения растений со вторым родительским растением канолы или третьим родительским растением канолы. После этого можно выращивать урожай канолы, включающий семена канолы согласно настоящему изобретению или соответствующее потомство.
Настоящее изобретение дополнительно включает способы осуществления скрещивания с использованием растения канолы, включающего желательное сочетание гена fad-2, в качестве, по меньшей мере, одного родительского растения. Например, настоящее изобретение включает гибридное растение первого поколения F1, имеющее в качестве одного или обоих родительских растений любые растения канолы, включающие желательное сочетание гена fad-2. Кроме того, в объем настоящего изобретения входят семена, производимые такими гибридными растениями первого поколения F1. Настоящее изобретение включает способ идентификации семян гибридного растения первого поколения F1 посредством скрещивания выбранного в качестве примера растения с другим (например, инбредным родительским) растением, получение урожая и исследование полученных в результате гибридных семян с использованием способа согласно настоящему изобретению. Растения канолы, которые используются для производства гибридных растений первого поколения F1, могут представлять собой женские родительские растения или мужские родительские растения.
Кроме того, следует понимать, что можно производить трансгенные растения, которые содержат гены fad-2, описанные в настоящем документе. Кроме того, трансгенные растения, включающие генетические характеристики fad-2, которые описаны в настоящем документе, можно скрещивать с растениями, включающими другое генетическое сочетание, и в результате этого получается потомство, содержащее независимо сегрегируемые экзогенные гены. Путем самоопыления соответствующего потомства можно производить растения, которые являются гомозиготными в отношении дополнительных экзогенных генов. Кроме того, предусмотрены возвратное скрещивание с родительским растением и скрещивание с нетрансгенным растением из другой линии, а также вегетативное размножение. В технике также известны и другие способы разведения, обычно используемые для получения различных растений и признаков. Разведение посредством возвратного скрещивания используется для переноса генов, которые легко подвергаются интрогрессии и несут признак, обладающий высокой способностью наследования, в желательное гомозиготное культурное растение или инбредную линию, которая является рекуррентной родительской линией. Источник передаваемого признака называется термином «родитель-донор». Предполагается, что получаемое в результате растение должно иметь признаки рекуррентного родительского (например, культурного) растения, и что желательный признак передается от родителя-донора. После исходного скрещивания выбираются экземпляры, обладающие фенотипом родителя-донора, которые повторно скрещиваются (возвратное скрещивание) с рекуррентным родительским растением. Предполагается, что получаемое в результате растение должно иметь признаки рекуррентного родительского (например, культурного) растения, и что желательный признак передается от родителя-донора. Способ согласно настоящему изобретению представляет собой высокопроизводительное основанное на флуоресценции исследование ПЦР TaqMan® по конечной точке для обнаружения трансгена fad-2 в растениях потомства и определение уровня зиготности в растениях потомства.
Средства согласно настоящему изобретению, например, олигонуклеотидные праймеры и зонды, можно применять для способов скрещивания с использованием маркера (СИМ). Средства согласно настоящему изобретению, например, олигонуклеотидные праймеры и зонды, можно применять в родственных исследованиях, таких как исследования полиморфизма длины амплифицированного фрагмента (ПДАФ), исследования полиморфизма длины рестрикционных фрагментов (ПДРФ), исследования статистически амплифицированной полиморфной ДНК (САПД), в которых идентифицируются генетически связанные агрономически полезные признаки посредством обнаружения SNP или простых повторяющих последовательностей (ППП), используя общедоступные методики, которые известны в технике. Описанные в настоящем документе SNP можно наблюдать в потомстве от скрещивания с растением канолы согласно настоящему изобретению (или в потомстве его и любого другого культурного растения канолы или его разновидности), используя способы СИМ. Молекулы ДНК можно использовать в качестве маркеров для данного признака, и способы СИМ, которые являются хорошо известными в технике, можно использовать для наблюдения SNP в растениях канолы, где, по меньшей мере, одно растение канолы согласно настоящему изобретению или его потомство представляет собой растение родителя или предка. Способы согласно настоящему изобретению можно использовать для идентификации любой разновидности канолы, которая имеет исследуемые ОНП, описанные в настоящем документе.
Способы согласно настоящему изобретению включают способ получения растения канолы, включающего сочетание ОНП, которые определены в настоящем документе, причем вышеупомянутый способ включает скрещивание с растением согласно настоящему изобретению. Более конкретно, вышеупомянутые способы могут включать скрещивание двух растений согласно настоящему изобретению или одного растения согласно настоящему изобретению и любого другого растения. Примерные способы могут дополнительно включать селекцию потомства от вышеупомянутого скрещивания посредством анализа вышеупомянутого потомства в отношении SNP согласно настоящему изобретению, которые могут быть обнаружены с использованием настоящего изобретения. Например, настоящее изобретение можно использовать для наблюдения зиготности растений канолы в ходе циклов скрещивания с растениями, включающими другие желательные признаки, такие как агрономические признаки, в том числе признаки, которые исследуются в разнообразных примерах, описанных в настоящем документе. Растения, включающие исследуемые SNP и желательные признаки, можно также обнаруживать, идентифицировать, выбирать и быстро использовать, например, в следующих циклах скрещивания. Исследуемые ОНП/признаки можно также сочетать в процессе скрещивания и наблюдать согласно настоящему изобретению вместе с другими признаками, на