Энхансер палочковидного вируса сахарного тростника (scbv) и его применение в функциональной геномике растений
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности конструкции для усиления транскрипции представляющей интерес нуклеотидной последовательности. Также раскрыты трансгенное растение кукурузы или Aspergillus nidulans, семя, клетка, ткань, плод, корень, побег, цветок, срез, содержащие указанную конструкцию. Раскрыты способы получения трансгенного растения с помощью указанной конструкции, способ снижения профиля жирных кислот. Изобретение позволяет получить трансгенное растение кукурузы или Aspergillus nidulans, обладающее усиленной транскрипцией представляющей интерес нуклеотидной последовательности по сравнению с диким типом. 17 н. и 15 з.п. ф-лы, 10 ил., 3 табл., 11 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/605147, зарегистрированной 29 февраля 2012 года, которая, таким образом, полностью включена.
ОБЛАСТЬ
Изобретение относится к области молекулярной биологии и генетической инженерии растений, и конкретно к молекулам полинуклеотидов, пригодных для модуляции (например, усиления) экспрессии гена и/или продукции белка у растений.
СТОРОНЫ СОГЛАШЕНИЯ О СОВМЕСТНОМ ИССЛЕДОВАНИИ
В этой заявке описан и заявлен определенный объект изобретения, который разработан на основании письменного соглашения о совместном исследовании между Agrigenetics, Inc., Mycogen Corporation, Exelixis Plant Sciences, Inc. и Exelixis, Inc. c датой вступления в силу 4 сентября 2007 года.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Существует постоянная необходимость в генетических регуляторных элементах, направляющих, контролирующих или иным образом регулирующих экспрессию транскрибируемой нуклеиновой кислоты (например, трансгена), например, для применения в генно-инженерном организме, таком как растение. Как правило, генетические регуляторные элементы содержат 5'-нетранслируемые последовательности, такие как области инициации транскрипции, которые содержат факторы транскрипции и участок(ки) связывания РНК-полимеразы, энхансерные/сайленсерные элементы, TATA-бокс и CAAT-бокс вместе с последовательностями 3'-полиаденилирования, стоп-сигналы транскрипции, старт- и стоп-сигналы трансляции, донорные/акцепторные последовательности сплайсинга и т.п.
Как правило, для целей генетической инженерии генетические регуляторные элементы включают в экспрессирующий вектор или другую инженерную конструкцию для регуляции экспрессии трансгенов, функционально связанных с регуляторными элементами. Хорошо известными примерами промоторов, используемых таким способом, являются промотор CaMV35S (Nagy et al. In: Biotechnology in plant science: relevance to agriculture in the eighties. Eds. Zaitlin et al. Academic Press, Orlando, 1985), промотор убиквитина кукурузы (Ubi; Christensen & Quail, Transgenic Research 5:213, 1996) и промотор Emu (Last et al., Theor. Appl. Genet. 81 581, 1991), хотя специалистам известно множество других промоторов. Подобным образом, из различных источников для применения в генетической инженерии выделены энхансеры; они включают энхансер вируса мозаики цветной капусты (35S CaMV), энхансер вируса мозаики норичника (FMV), энхансер каулимовируса хлоротической полосатости арахиса (PClSV) или энхансер вируса мозаики мирабилис (MMV).
Существует постоянная необходимость в идентификации генетических регуляторных элементов, таких как энхансерные домены, которые можно использовать для контроля экспрессии функционально связанных с ними последовательностей, например, в гетерологичных молекулах нуклеиновой кислоты, таких как векторы и другие инженерные конструкции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем описании описаны новые области регуляции транскрипции, содержащие энхансерный домен и домен регуляции транскрипции под энхансерным контролем энхансерного домена. Энхансерный домен содержит множество (например, от двух до четырех или более) копий природного, но ранее неизвестного энхансера SCBV, расположенного в тандеме. Области регуляции транскрипции (промоторы) по настоящему изобретению обеспечивают усиленную транскрипцию по сравнению с промотором в отсутствие энхансерного домена. В одном из примеров описана химерная область регуляции транскрипции, содержащая одну или несколько копий энхансерного элемента SCBV, представленных от положения 337 до положения 618 в SEQ ID NO: 1; и функционально связанный с ними промотор, содержащий участок связывания РНК-полимеразы и участок инициации иРНК, где, когда представляющая интерес нуклеотидная последовательность транскрибируется под регуляторным контролем химерной области регуляции транскрипции, количество продукта транскрипции по сравнению с количеством продукта транскрипции, получаемым с использованием химерной области регуляции транскрипции, содержащей промотор и не содержащей энхансерной последовательности SCBV, увеличивается.
Также предоставлены конструкции ДНК, содержащие описанную область регуляции транскрипции и последовательность ДНК, предназначенную для транскрипции. В одном из примеров конструкция ДНК содержит описанную область инициации транскрипции, функционально связанную с транскрибируемой полинуклеотидной молекулой, функционально связанной на 3'-конце с полинуклеотидной молекулой терминации транскрипции. Конструкции ДНК обеспечивают усиленную транскрипцию последовательности ДНК, предназначенной для трансляции. Также описаны трансгенные растения, клетки или ткани растений (таких как растения, клетки или ткани растений двудольных или однодольных), трансформированные описанными конструкциями. Также предоставлены семена, плоды, листья, корни, побеги, цветки, срезы растений и другой репродуктивный материал, пригодный при половом или бесполом размножении, растения-потомки, включая гибриды F1, стерильные по мужскому полу растения и все другие растения и растительные продукты, получаемые из описанных трансгенных растений. Также по настоящему документу предоставлены способы получения описанных трансгенных растений, клеток или тканей растений.
Указанные выше и другие характеристики изобретения будут более понятны из приводимого ниже подробного описания, которое приведено со ссылкой на сопровождающие фигуры.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлена последовательность промотора SCBV (соответствующая положениям 6758-7596 номера доступа GeneBank AJ277091.1, "Sugarcane bacilliform IM virus complete genome, isolate Ireng Maleng", который полностью включен в настоящий документ в качестве ссылки, как он был представлен онлайн на 15 апреля 2010 года); эта последовательность также представлена в SEQ ID NO: 1. Энхансерные последовательности, определенные в этом исследовании, расположены от -222 до -503 и подчеркнуты на фигуре (соответственно положениям от 337 до 618 SEQ ID NO: 1).
Фиг. 2A и 2B иллюстрируют результаты анализа промотора SCBV. На фиг. 2A представлены фрагменты промотора SCBV, содержащие последовательности от -839 п.н., -576 п.н. и -333 п.н. выше участка начала транскрипции до 106 п.н. ниже участка начала транскрипции, слитые с репортерным геном люциферазы (LUC). На фиг. 2B представлена гистограмма отношения активности LUC/GUS в клетках HiII совместно трансформированных указанными выше плазмидами и репортерной конструкцией UBI::GUS. Результаты демонстрируют, что промоторный фрагмент, содержащий последовательности от -576 п.н. выше участка начала транскрипции, обладает 60% активности промоторного фрагмента, содержащего 839 п.н. выше участка начала. В отличие от этого, промоторный фрагмент, содержащий последовательности от -333 п.н. выше участка начала, обладает только 10% активности полноразмерного промотора (от -839 п.н. выше участка начала транскрипции). Таким образом, последовательности, вовлеченные в активность промотора, расположены выше -333 п.н.
Фиг. 3 иллюстрирует, что энхансерные элементы SCBV, описываемые в настоящем документе, усиливают транскрипцию с промотора Adh1 кукурузы. От -503 до -222 выше укороченного промотора Adh1 кукурузы, слитого с геном люциферазы светляка, клонировали одну, две и четыре копии последовательности промотора SCBV. Для сравнения, выше укороченного промотора Adh1 кукурузы клонировали 4 копии энхансерной последовательности MMV и 2 копии энхансера MMV и 2 копии промотора SCBV и сливали с геном люциферазы светляка. Эти конструкции посредством бомбардировки вводили в суспензию клеток кукурузы Hi-II вместе с репортерной конструкцией UBI::GUS. Конструкции, содержащие 1, 2 и 4 копии энхансера SCBV, были, соответственно, более чем в 5 раз, 6 раз и 10 раз более активными, чем это происходило в клетках, в которые посредством бомбардировки вводили укороченную конструкцию Adh1 без каких-либо энхансеров. Конструкция с 4× MMV была в 2,5 раз более активна, чем укороченная конструкция Adh1, а конструкция с 2X MMV и 2X SCBV была в 6 раз более активна, чем укороченная конструкция Adh1.
На фиг. 4 представлено накопление транскриптов области, расположенной рядом ("фланкирующий ген") с участком интеграции 4XSCBV, в трансгенных (T) растениях по сравнению c нетрансгенными (W) контрольными растениями, анализируемой с использованием обратной транскрипции и ПЦР (ОТ-ПЦР). Для сравнения представлен уровень гена домашнего хозяйства GAPDH. Энхансер 4XSCBV вызывал увеличенное накопление транскриптов генов, рядом с которыми он интегрировался; это увеличение накопления транскриптов является результатом увеличенной скорости транскрипции.
На фиг. 5 представлена pDAB3892, которая содержит слияние с промотором 4XSCBV::LfKCS3, используемое для контроля трансгена ацил-КоА-дельта-9-десатуразы Aspergillus nidulans у Arabidopsis thaliana.
На фиг. 6 представлена pDAB1757, которая содержит промотор LfKCS3, используемый для контроля трансгена ацил-КоА-дельта-9-десатуразы Aspergillus nidulans у Arabidopsis thaliana.
На фиг. 7 представлена pDAB1759, которая содержит промотор фазеолина Pv, используемый для контроля трансгена ацил-КоА-дельта-9-десатуразы Aspergillus nidulans у Arabidopsis thaliana.
На фиг. 8 представлена pDAB9381, которая содержит промотор убиквитина 10 Arabidopsis thaliana, используемый для контроля трансгена желтого флуоресцентного белка у Arabidopsis thaliana.
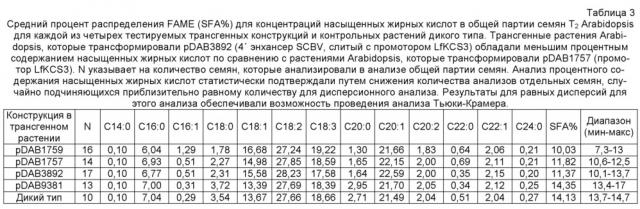
На фиг. 9 представлен процент фенотипа с уменьшением насыщенных жирных кислот для трансгенных растений, содержащий трансгенную вставку конструкций.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Нуклеотидные и/или аминокислотные последовательности, приведенные в списке последовательностей ниже, представлены с использованием стандартных буквенных сокращений для нуклеотидных оснований и трехбуквенного кода для аминокислот, как определено в 37 C.F.R. 1.822. Представлена только одна цепь каждой последовательности нуклеиновой кислоты, но комплементарная цепь подразумевается включенной посредством обращения к приведенной цепи. Последовательности нуклеиновых кислот (в списке последовательностей или любом другом месте настоящего документа) представлены в стандартном направлении от 5' к 3', а последовательности белков представлены в стандартном направлении от амино (N) конца к карбокси (C) концу.
В SEQ ID NO: 1 представлена последовательность нуклеиновой кислоты промотора SCBV (соответствующего положениям 6758-7596 номера доступа GeneBank AJ277091.1, "Sugarcane bacilliform IM virus complete genome, isolate Ireng Maleng", полностью включенного в настоящий документ в качестве ссылки, как он был представлен онлайн на 15 апреля 2010 года). Энхансерные элементы, описываемые в настоящем документе, расположены от положения 337 до положения 618 в SEQ ID NO: 1.
В SEQ ID NO: 2 представлена последовательность нуклеиновой кислоты для единицы транскрипции растения (PTU) ацил-КоА-дельта-9-десатуразы Aspergillus nidulans из pDAB3892.
В SEQ ID NO: 3 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB3892.
В SEQ ID NO: 4 представлена последовательность нуклеиновой кислоты для PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans из pDAB1757.
В SEQ ID NO: 5 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB1757.
В SEQ ID NO: 6 представлена последовательность нуклеиновой кислоты для PTU ацил-КоА-дельта-9-десатуразы Aspergillus nidulans из pDAB1759.
В SEQ ID NO: 7 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB1759.
В SEQ ID NO: 8 представлена последовательность нуклеиновой кислоты для PTU желтого флуоресцентного белка из pDAB9381.
В SEQ ID NO: 9 представлена последовательность нуклеиновой кислоты для PTU фосфинотрицинацетилтрансферазы из pDAB9381.
В SEQ ID NO: 10 представлена последовательность нуклеиновой кислоты для прямого праймера, используемого для амплификации pat для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 11 представлена последовательность нуклеиновой кислоты для обратного праймера, используемого для амплификации pat для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 12 представлена последовательность нуклеиновой кислоты для зонда, используемого для амплификации pat для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 13 представлена последовательность нуклеиновой кислоты для прямого праймера, используемого для амплификации TAFFII для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 14 представлена последовательность нуклеиновой кислоты для обратного праймера, используемого для амплификации TAFFII для молекулярного подтверждения с использованием анализа гидролиза зонда.
В SEQ ID NO: 15 представлена последовательность нуклеиновой кислоты для зонда, используемого для амплификации TAFFII для молекулярного подтверждения с использованием анализа гидролиза зонда.
ПОДРОБНОЕ ОПИСАНИЕ
I. Сокращения
| 3'-UTR | 3'-нетранслируемая область |
| 5'-UTR | 5'-нетранслируемя область |
| Adh1 | алкогольдегидрогеназа 1 |
| LfKCS 3 | промотор KCS Lesquerella fendleri |
| асРНК | антисмысловая РНК |
| кДНК | комплементарная ДНК |
| дцРНК | двухцепочечная РНК |
| GAPDH | глицеральдегид-3-фосфатдегидрогеназа |
| КБ | килобайты |
| т.п.н. | тысячи пар оснований |
| LUC | люцифераза |
| мкРНК | микроРНК |
| нт | нуклеотид |
| ORF | открытая рамка считывания |
| ПЦР | полимеразная цепная реакция |
| PAT | фосфинотрицинацетилтрансфераза |
| ОТ-ПЦР | обратная транскрипция и ПЦР |
| SCBV | палочковидный вирус сахарного тростника |
| миРНК | малая интерферирующая РНК |
| оцРНК | одноцепочечная РНК |
| Tm | температура плавления |
| UTR | нетранслируемая область |
II. Термины
Если не указано иначе, технические термины используют в соответствии с общепринятым употреблением. Определения общих терминов в молекулярной биологии можно найти в Benjamin Lewin, Genes V, published by Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
Для облегчения рассмотрения различных вариантов осуществления изобретения предоставлены приведенные ниже разъяснения конкретных терминов:
5' и/или 3': молекулы нуклеиновой кислоты (такие как ДНК и РНК) указаны, как содержащие "5'-концы" и "3'-концы", так как мононуклеотиды реагируют с получением полинуклеотидов таким образом, что 5'-фосфат пентозного кольца одного мононуклеотида посредством фосфодиэфирной связи в одном направлении связывается с 3'-кислородом его соседа. Таким образом, один конец полинуклеотида обозначают как "5'-конец", когда его 5' фосфат не связан с 3'-кислородом пентозного кольца мононуклеотида. Другой конец полинуклеотида обозначают как "3'-конец", когда его 3'-кислород не связан с 5'-фосфатом другого пентозного кольца мононуклеотида. Несмотря на то, что 5'-фосфат одного пентозного кольца мононуклеотида связан с 3'-кислородом его соседа, внутренняя последовательность нуклеиновой кислоты также может быть указана, как содержащая 5'- и 3'-концы.
В линейной или кольцевой молекуле нуклеиновой кислоты, отдельные внутренние элементы обозначают как расположенные "выше" или с 5'-конца от расположенных "ниже" или с 3'-конца элементов. В отношении ДНК эта терминология отражает, что транскрипция проходит вдоль цепи ДНК в направлении от 5' к 3'. Как правило, промоторные и энхансерные элементы, контролирующие транскрипцию сцепленного гена, расположены с 5'-конца или выше кодирующей области. Однако энхансерные элементы могут проявлять свое действие даже тогда, когда они расположены с 3'-конца от промоторного элемента и кодирующей области. Сигналы терминации транскрипции и полиаденилирования расположены с 3'-конца или ниже кодирующей области.
Агрономический признак: Характеристика растения, где такие характеристики в качестве неограничивающих примеров включают морфологию, физиологию, рост и развитие, урожай, питательное обогащение растения, устойчивость растения к заболеваниям или вредителям, или агрономическими признаками являются устойчивость к условиям окружающей среды или химическая устойчивость. "Улучшенный агрономический признак" относится к измеримому улучшению агрономического признака, включая, в качестве неограничивающих примеров, увеличение урожая, включая увеличенный урожай без стрессовых условий и увеличенный урожай в стрессовых условиях окружающей среды. Например, стрессовые условия могут включать засуху, недостаток освещенности, грибковое заболевание, вирусное заболевание, бактериальное заболевание, поражение насекомыми, поражение круглыми червями, воздействие низких температур, воздействие высоких температур, осмотический стресс, сниженную доступность питательного азота, сниженную доступность питательного фосфора и высокую плотность растений. На "урожай" могут влиять множество свойств, включая, в качестве неограничивающих примеров, высоту растения, количество стручков, положение стручков на растении, количество междоузлий, частоту растрескивания стручков, размер зерна, эффективность образования клубеньков и фиксации азота, эффективность усваивания питательных веществ, устойчивость к биотическому и абиотическому стрессу, усваивание углерода, строение растения, устойчивость к полеганию, процент прорастания семян, всхожесть и ювенильные признаки. На урожай также могут влиять эффективность прорастания (включая прорастание в условиях с неблагоприятным воздействием), скорость роста (включая скорость роста в условиях с неблагоприятным воздействием), количество початков, количество семян в початке, размер семян, состав семян (крахмал, масло, белок) и характеристики наполнения семян. Увеличенный урожай может являться результатом улучшенного использования ключевых биохимических соединений, таких как азот, фосфор и углевод, или улучшенной реакции на стрессовые условия окружающей среды, такие как холод, жара, засуха, соль и поражение вредителями или возбудителями заболеваний. Рекомбинантную ДНК, используемую в настоящем изобретении, также можно использовать для придания растениям признаков улучшенного роста и развития и, в конечном итоге, увеличенного урожая, в результате измененной экспрессии регуляторов роста растений или изменения метаболических путей клеточного цикла или фотосинтеза. Дополнительные примеры агрономических признаков и изменения таких признаков у растений предоставлены в настоящем документе и/или известны специалистам в данной области.
Альтерации: Альтерации в полинуклеотиде (например, в полипептиде, кодируемом нуклеиновой кислотой по настоящему изобретению), как этот термин используют в настоящем документе, включают любые делеции, вставки и точечные мутации в полинуклеотидной последовательности. В это определение включены изменения в последовательности геномной ДНК, кодирующей полипептид. Подобным образом, термин "альтарация" можно использовать для обозначения делеций, вставок и других мутаций в полипептидных последовательностях.
Изменение уровня продукции или экспрессии: Изменение, увеличение или снижение, уровня продукции или экспрессии молекулы нуклеиновой кислоты или аминокислотной молекулы (например, миРНК, мкРНК, иРНК, гена, полипептида, пептида) по сравнению с контрольным уровнем продукции или экспрессии.
Амплификация: Когда используют по отношению к нуклеиновой кислоте, она относится к способу, которым увеличивают количество копий молекулы нуклеиновой кислоты в образце или препарате. Примером амплификации является полимеразная цепная реакция, в которой биологический образец, получаемый у индивидуума, приводят в контакт с парой олигонуклеотидных праймеров в условиях, которые обеспечивают гибридизацию этих праймеров c матрицей нуклеиновой кислоты в образце. Праймеры достраиваются в подходящих условиях, диссоциируют с матрицей, затем снова отжигаются, достраиваются и диссоциируют с увеличением количества копий нуклеиновой кислоты. Продукт амплификации in vitro можно характеризовать посредством электрофореза, профилей рестрикционного эндорасщепления нуклеазами, гибридизации или лигирования олигонуклеотидов и/или секвенирования нуклеиновой кислоты стандартными способами. Другие примеры способов амплификации in vitro включают амплификацию с замещением цепей (см. патент США № 5744311); изотермическую амплификацию без транскрипции (см. патент США № 6033881); амплификацию посредством реакции репарации цепи (см. WO 90/01069); амплификацию посредством лигазной цепной реакции (см. EP-A-320308); амплификацию посредством лигазной цепной реакции с заполнением разрыва (см. патент США № 5427930); объединенные лигазную детекцию и ПЦР (см. патент США № 6027889) и амплификацию без транскрипции РНК NASBA™ (см. патент США № 6025134).
Антисмысловая молекула, смысловая молекула и антиген: ДНК содержит две антипараллельных цепи, цепь 5' → 3', обозначаемая как плюс-цепь, и цепь 3' → 5', обозначаемая как минус-цепь. Так как РНК-полимераза добавляет нуклеиновые кислоты в направлении 5' → 3', минус-цепь ДНК служит в качестве матрицы для РНК при транскрипции. Таким образом, РНК-транскрипт будет иметь последовательность, комплементарную минус-цепи и идентичную плюс-цепи (за исключением того, что U заменяет T).
Антисмысловые молекулы представляют собой молекулы, которые специфически гибридизуются или специфически комплементарны к РНК или плюс-цепи ДНК. Смысловые молекулы представляют собой молекулы, которые специфически гибридизуются или специфически комплементарны минус-цепи ДНК. Антигенные молекулы представляют собой антисмысловые или смысловые молекулы, направленные к ДНК-мишени. Антисмысловая РНК (асРНК) представляет собой молекулу РНК, комплементарную смысловой (кодирующей) молекуле нуклеиновой кислоты.
Антисмысловое ингибирование: Этот термин относится к классу регуляции генов на основе цитоплазматического, ядерного или внутриорганелльного ингибирования экспрессии гена (например, экспрессии генома клетки-хозяина или генома патогенного организма, такого как вирус) вследствие присутствия в клетке молекул РНК, комплементарных по меньшей мере части транслируемой иРНК.
кДНК (комплементарная ДНК): Участок ДНК, в котором отсутствуют внутренние некодирующие участки (интроны) и последовательности регуляции транскрипции. Также кДНК может содержать нетранслируемые области (UTR), которые в соответствующей молекуле РНК отвечают за контроль трансляции. Как правило, кДНК синтезируют в лаборатории посредством обратной транскрипции с информационной РНК, выделяемой из клеток или других образцов.
Химерный или химера: Продукт слияния частей двух или более различных полинуклеотидных или полипептидных молекул. Например, фразы "химерная последовательность" и "химерный ген" относятся к нуклеотидным последовательностям, получаемым по меньшей мере из двух гетерологичных частей. Химерная последовательность может содержать ДНК или РНК.
Химерная область регуляции транскрипции: Набор контрольных или регуляторных последовательностей нуклеиновой кислоты, которые контролируют транскрипцию нуклеиновой кислоты, функционально связанной с нею, где набор собран из различных полинуклеотидных источников. Например, химерные области регуляции транскрипции, как описано в настоящем документе, можно получать посредством манипуляций с известными промоторами или другими полинуклеотидными молекулами. В химерных областях регуляции транскрипции можно комбинировать один или несколько энхансерных доменов с одним или несколькими промоторами, например, посредством слияния гетерологичного энхансерного домена из первого природного промотора со вторым промотором с его собственным частичным или полным набором регуляторных элементов. По настоящему изобретению, в числе прочего, предоставлены химерные области регуляции транскрипции, содержащие по меньшей мере один энхансерный домен SCBV, слитый (т.е. функционально связанный) с промотором, активным в растении(ях).
Конструкция: Любая рекомбинантная полинуклеотидная молекула, такая как плазмида, космида, вирус, автономно реплицирующаяся полинуклеотидная молекула, фаг или линейная или кольцевая одноцепочечная или двухцепочечная полинуклеотидная молекула ДНК или РНК, полученная из любого источника, способная к интеграции в геном или автономной репликации, содержащая полинуклеотидную молекулу, где функционально связаны одна или несколько транскрибируемых полинуклеотидных молекул.
Контрольное растение: Растение, не содержащее рекомбинантной ДНК, обеспечивающей у трансгенного растения (например) улучшенный или измененный агрономический признак, используемое в качестве основы для сравнения, например, для идентификации у трансгенного растения улучшенного или измененного агрономического признака. Подходящее контрольное растение может представлять собой не являющееся трансгенным растение родительской линии, используемой для получения трансгенного растения, или растение, которое не является трансгенным по меньшей мере по конкретному исследуемому признаку (т.е., контрольное растение может быть подвергнуто инженерии с введением других гетерологичных последовательностей или рекомбинантных молекул ДНК). Таким образом, контрольное растение в некоторых случаях может представлять собой линию трансгенных растений, содержащую пустой вектор или маркерный ген, но не содержащую рекомбинантную ДНК, или не содержащую всех рекомбинантных ДНК тестируемого растения.
Косупрессия: Экспрессия чужеродного (гетерологичного) гена со значительной гомологией с эндогенным геном, приводящая к супрессии экспрессии чужеродного и эндогенного гена.
ДНК (дезоксирибонуклеиновая кислота): ДНК представляет собой длинноцепочечный полимер, содержащий генетический материал большинства организмов (гены некоторых вирусов содержат рибонуклеиновую кислоту (РНК)). Повторяющимися единицами в полимерах ДНК являются четыре различных нуклеотида, каждый из которых содержит одно из четырех оснований: аденин, гуанин, цитозин и тимин, связанные с сахаром дезоксирибозой, с которым связана фосфатная группа. Триплеты нуклеотидов (называемые кодонами) кодируют каждую аминокислоту в полипептиде или стоп-сигнал. Термин кодон также используют для соответствующих (и комплементарных) последовательностей из трех нуклеотидов в иРНК, в которую транскрибируется последовательность ДНК.
Если не указано иначе, любое указание молекулы ДНК включает молекулу, обратно комплементарную этой молекуле ДНК. За исключением случаев, когда одноцепочечность необходима по тексту настоящего документа, молекулы ДНК, несмотря на то, что записаны только в виде одной цепи, включают обе цепи двухцепочечной молекулы ДНК.
Десатураза: Как используют в настоящем документе, термин "десатураза" относится к полипептиду, который может уменьшать насыщенность (например, вводя двойную связь) одной или нескольких жирных кислот с получением представляющих интерес жирной кислоты или предшественника. Фермент десатураза растворимых у растений жирных кислот может региоспецифично вводить двойную связь в субстрат ацил-ACP насыщенных кислот. Ацил-КоА-десатуразы вводят двойную связь региоспецифично в субстрат ацил-КоА насыщенных жирных кислот. Реакция включает активацию молекулярного кислорода посредством восстановленного двумя электронами центра из двух атомов железа, координированных четырехспиральным пучком, который формирует кор архитектуры десатуразы. Особый интерес в некоторых вариантах осуществления представляют ацил-КоА-дельта-9-десатуразы.
Жирная кислота: Как используют в настоящем документе, термин "жирная кислота" относится к длинноцепочечным алифатическим кислотам (алкановым кислотам) с различными длинами цепей, например, приблизительно от C12 до C22, хотя известны обе кислоты с более длинными и более короткими цепями. Структура жирной кислоты представима обозначением x:yДz, где "x" представляет собой общее количество атомов углерода (C) в конкретной жирной кислоте, а "y" представляет собой количество двойных связей в углеродной цепи в положении "z", отсчитывая от карбоксильного конца кислоты.
Кодировать: Говорят, что полинуклеотид кодирует полипептид, если в своем нативном состоянии или при манипуляции способами, известным специалистам в данной области, молекула полинуклеотида может транскрибироваться и/или транслироваться с получением иРНК для полипептида или его фрагмента и/или полипептида или его фрагмента. Антисмысловая цепь является комплементарной такой нуклеиновой кислоте, и кодирующую последовательность можно вывести из нее.
Энхансерный домен: цис-действующий транскрипционный регуляторный элемент (также известный как цис-элемент), который обеспечивает составную часть общего контроля экспрессии гена. Энхансерный домен может функционировать, связывая факторы транскрипции, которые представляют собой транс-действующие белковые факторы, которые регулируют транскрипцию. Некоторые энхансерные домены связывают более одного фактора транскрипции, и факторы транскрипции могут с различными аффинностями взаимодействовать более чем с одним энхансерным доменом. Энхансерные домены можно идентифицировать рядом способов, включая делеционный анализ (делеция одного или нескольких нуклеотидов с 5'-конца или внутри промотора); анализ ДНК-связывающих белков с использованием футпринтинга с ДНКазой I, интерференцию метилированием, анализы изменения подвижности при электрофорезе, геномный футпринтинг in vivo посредством опосредованной лигированием ПЦР и другие общепринятые анализы; или посредством сравнения последовательности ДНК с известными мотивами цис-элементов общепринятыми способами сравнения последовательностей ДНК. Точную структуру энхансерного домена можно дополнительно исследовать посредством мутагенеза (или замены) одного или нескольких нуклеотидов или другими общепринятыми способами. Энхансерные домены можно получать посредством химического синтеза или посредством выделения из промоторов, включающих такие элементы, и их можно синтезировать с дополнительными фланкирующими нуклеотидами, которые содержат подходящие участки распознавания рестрикционных ферментов для облегчения манипуляций с подпоследовательностями.
Экспрессия (генов): Транскрипция молекулы ДНК в транскрибированную молекулу РНК. В более общем смысле, процесс, посредством которого кодируемая генами информация преобразуется в структуры, находящиеся и действующие в клетке. Экспрессируемые гены включают гены, которые транскрибируются в иРНК, а затем транслируются в белок, и гены, которые транскрибируются в РНК, но не транслируются в белок (например, миРНК, транспортная РНК и рибосомная РНК). Таким образом, экспрессия последовательности-мишени, такой как ген или промоторная область гена, может приводить к экспрессии иРНК, белка или и иРНК, и белка. Экспрессию последовательности-мишени можно ингибировать или усиливать (снижать или увеличивать). Экспрессию генов можно описать как связанную с временными, пространственными, связанными с развитием или морфологическими характеристиками, а также количественными или качественными показателями.
Генорегуляторная активность: Способность полинуклеотида влиять на транскрипцию или трансляцию функционально связанной транскрибируемой или транслируемой полинуклеотидной молекулы. Выделенная полинуклеотидная молекула с генорегуляторной активностью может обеспечивать временную или пространственную экспрессию или модулировать уровни и степень экспрессии функционально связанной транскрибируемой полинуклеотидной молекулы. Выделенная полинуклеотидная молекула с генорегуляторной активностью может включать промоторную, интронную, лидерную области или 3'-концевую область терминации транскрипции.
Сайленсинг генов: Сайленсинг генов относится к отсутствию (или снижению) экспрессии гена в результате, хотя и не ограничиваясь им, действия на уровне геномной (ДНК), такого как перестройка хроматина, или на посттранскрипционном уровне посредством воздействия на стабильность или трансляцию транскриптов. Современные данные позволяют предположить, что основным процессом, вовлеченным в транскрипционный и посттранскрипционный сайленсинг генов, является РНК-интерференция (РНКи).
Так как РНКи проявляет свое действие на транскрипционном и/или посттранскрипционном уровне, полагают, что РНКи можно использовать для специфического ингибирования альтернативных транскриптов того же гена.
Гетерологичный: Тип последовательности, который в норме (например, в последовательности дикого типа) не находится рядом со второй последовательностью. В одном из вариантов осуществления последовательность происходит из другого генетического источника, такого как вирус, или организм, или вид, отличающегося от источника второй последовательности.
Гибридизация: Олигонуклеотиды и их аналоги гибридизуются посредством образования водородных связей, что включает образование уотсон-криковских, хугстиновских или обращенных хугстиновских водородных связей между комплементарными основаниями. Как правило, нуклеиновая кислота состоит из азотистых оснований, которые представляют собой или пиримидины (цитозин (C), урацил (U) и тимин (T)), или пурины (аденин (A) и гуанин (G)). Эти азотистые основания формируют водородные связи между пиримидином и пурином, и связывание пиримидина с пурином обозначают как спаривание оснований. Более конкретно, A связывается водородной связью с T или U, а G связывается с C. В молекулах РНК, G также связывается с U. Комплементарные относится к спариванию оснований, которое происходит между двумя отдельными последовательностями нуклеиновой кислоты или двумя отдельными областями одной и той же последовательности нуклеиновой кислоты.
Условия гибридизации, приводящие к конкретным степеням жесткости, варьируют в зависимости от особенностей выбранного способа гибридизации и состава и длины гибридизующихся последовательностей нуклеиновой кислоты. Как правило, жесткость гибридизации определяет температура гибридизации и ионная сила (особенно концентрация Na+) гибридизационного буфера. Расчеты условий гибридизации, необходимых для достижения конкретных степеней жесткости, описаны в Sambrook et al. (ed.), Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, главы 9 и 11, включенной в настоящий документ в качестве ссылки.
Приведенное ниже представляет собой иллюстративный набор условий гибридизации, и он не предназначен для ограничения.
Очень высокая жесткость (детектируют последовательности с 90% идентичностью последовательностей)
Гибридизация: 5× SSC при 65°С в течение 16 часов
Двукратная отмывка: 2× SSC при комнатной температуре (RT) в течение 15 минут каждая
Двукратная отмывка: 0,5× SSC при 65°C в течение 20 минут каждая
Высокая жесткость (детектируют последовательности с 80% идентичностью последовательностей или более)
Гибридизация: 5×-6× SSC при 65°C-70°C в течение 16-20 часов
Двукратная отмывка: 2× SSC при RT в течение 5-20 минут каждая
Двукратная отмывка: 1× SSC при 55°C-70°C в течение 30 минут каждая
Низкая жесткость (детектируют последовательности более чем с 50% идентичностью последовательностей)
Гибридизация: 6× SSC при температурах от RT до 55°