Пептидомиметические макроциклы и их применение
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии и медицине. Предложены пептидомиметический макроцикл, который связывается с рецептором гормона, высвобождающего гормон роста (GHRH), и его применения. Предложенный пептидомиметический макроцикл имеет структуру, как представлено в формуле. Указанный пептидомиметический макроцикл обладает улучшенной биологической активностью, стимулирует получение и высвобождение гормона роста и может быть использован для увеличения сухой мышечной массы у пациента, для уменьшения жировой ткани у пациента, для лечения мышечной атрофии, липодистрофии, нарушения гормона роста, пареза желудка или синдрома короткой кишки у пациента. 9 н. и 22 з.п. ф-лы, 11 ил., 5 табл., 4 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА
По настоящей заявке испрашивается приоритет временной заявки №61/548690, US, поданной 18 октября 2011, которая включена в настоящее описание в качестве ссылки в полном объеме.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка включает Список последовательностей, представленный в формате ASCII посредством EFS-Web и таким образом полностью включенный в настоящее описание путем ссылки. Указанная копия ASCII, созданная 2 ноября 2012, имеет название 35769601.txt и размер 225304 байт.
УРОВЕНЬ ТЕХНИКИ
Человеческий GHRH (гормон, высвобождающий гормон роста) представляет собой пептид, состоящий из 44 аминокислот, чья полная биологическая активность локализована в его первых 29 аминокислотах ("GHRH 1-29"). GHRH связывается с рецептором GHRH и стимулирует секрецию пульсативного GH [гормона роста], и с этим механизмом действия GHRH представляет собой альтернативу терапии с использованием GH в случае пациентов с интактным гипофизом, который может минимизировать побочные действия, сопутствующие длительному применению GH. Так как величина высвобождения GH, вызванного GHRH, ограничена уровнями IGF-1, который оказывает отрицательный эффект обратной связи, риск побочных действий, связанных с избыточной секрецией GH, также может быть меньше с терапией GHRH, чем с терапией GH. Кроме того, методика лечения с GHRH может приводить к секреции гипофизом более широкого набора протеинов GH, а не только формы 22 кДа, которую обеспечивает рекомбинантный человеческий GH, что может также иметь благоприятные эффекты. Было показано, что в клиническом аспекте, GHRH является безопасным и эффективным для увеличения уровней GH у взрослых и детей, а эффект стимулирования роста GHRH коррелируется с дозой и частотой введения. При этом период полувыведения GHRH после внутривенного введения составляет только 10-12 мин, что значительно ограничивает его применение в качестве терапевтического средства. Таким образом, существует клиническая необходимость в аналогах GHRH, которые обладают более длительным периодом полувыведения in vivo, что может обеспечивать больший терапевтический эффект с улучшенным (менее частым) режимом дозирования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает пептидомиметические макроциклы - производные GHRH, которые могут обладать улучшенными по сравнению с GHRH фармацевтическими свойствами. Эти улучшенные свойства включают повышенную химическую стабильность, более длительный период полувыведения in vivo, увеличенную активность и сниженную иммуногенность. Эти пептидомиметические макроциклы пригодны для увеличения уровней циркулирующего GH в качестве методики лечения мышечных атрофий, липодистрофий, нарушений деятельности гормона роста, пареза желудка/синдрома короткой кишки, и других патологических состояний, при которых увеличение GH обеспечило бы терапевтический эффект.
Ниже описаны стабильные сшитые пептиды, полученные из пептида GHRH. Эти сшитые пептиды содержат по меньшей мере две модифицированные аминокислоты, которые вместе образуют внутримолекулярную сшивку, которая может помочь в стабилизации односпиральной вторичной структуры участка GHRH, что, как полагают, важно для активности агониста в рецепторе GHRH. По сравнению с аминокислотной последовательностью пептида дикого типа, любая аминокислота, которая не является необходимой для активности пептида в высвобождении гормона роста, может быть заменена любыми другими аминокислотами, тогда как аминокислоты, которые являются необходимыми для активности пептида в высвобождении гормона роста, могут быть заменены только на аминокислоту, аналоги которой существенно не уменьшают указанную активность.
Соответственно, сшитый полипептид, описанный в данном документе, может иметь улучшенную биологическую активность по сравнению с соответствующим полипептидом, который не является сшитым. Без привязки к теории, омиметические макроциклы GHRH, как полагают, существуют для того, чтобы активировать рецептор GHRH, тем самым стимулируя получение и высвобождение гормона роста, который может увеличивать сухую мышечную массу или уменьшать жировую ткань (такую как абдоминальная жировая ткань). Например, жировая ткань может быть снижена у субъектов, страдающих от ожирения, включая абдоминальное ожирение. Омиметические макроциклы GHRH, описанные в данном документе, могут быть использованы с терапевтической целью, например, для лечения мышечных атрофий, которые включают анорексии, кахексии (такие как раковая кахексия, кахексия при хронической сердечной недостаточности, кахексия при хроническом обструктивном заболевании легких, кахексия при ревматоидном артрите) и саркопении, для лечения липодистрофий, которые включают липодистрофию при HIV, для лечения нарушений деятельности гормона роста, которые включают недостатки гормона роста у взрослых и детей, или для лечения пареза желудка или синдрома короткой кишки. Недостаток гормона роста у детей может быть, например, связан с или сопутствующим идиопатической низкорослости, SGA (низкой массой для данного гестационного возраста у новорожденного), хронической почечной недостаточности, синдромом Прадера-Вилли, синдромом Тернера, дефектом гена SHOX (shortstaturehomeobox), или первичным недостатком IGF-1.
В одном аспекте, настоящее изобретение обеспечивает пептидомиметический макроцикл, содержащий аминокислотную последовательность, который на по меньшей мере приблизительно 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентична GHRH 1-44, GHRH 1-29 и/или аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей из Таблицы 1, 2 или 4. Альтернативно, аминокислотная последовательность указанного пептидомиметического макроцикла представляет собой выбранную из группы, состоящей из аминокислотных последовательностей, представленных в Таблицах 1, 2 или 4. Пептидомиметический макроцикл может содержать один, два, три, четыре, пять или более макроцикл-образующих линкеров, где каждый макроцикл-образующий линкер соединяет одну аминокислоту к другой аминокислоте в структуру пептидомиметического макроцикла. Например, пептидомиметический макроцикл содержит по меньшей мере два макроцикл-образующих линкера, где первый из указанных по меньшей мере двух макроцикл-образующих линкеров соединяет первую аминокислоту со второй аминокислоте, а вторая из указанных по меньшей мере двух макроцикл-образующих линкеров соединяет третью аминокислоту с четвертой аминокислоте. В отдельных вариантах осуществления настоящего изобретения пептидомиметический макроцикл содержит ровно два макроцикл-образующих линкера. В других вариантах осуществления настоящего изобретения пептидомиметический макроцикл содержит ровно один макроцикл-образующий линкер.
Макроцикл-образующие линкеры соединяют любые две аминокислоты, которые могут быть сшиты без ослабления активности пептидомиметического макроцикла. В отдельных вариантах осуществления настоящего изобретения макроцикл-образующий линкер соединяет одну из следующих пар аминокислот (пронумерованные со ссылкой на любую последовательность в соответствии с GHRH 1-29): 4 и 8; 5 и 12; 8 и 12; 8 и 15; 9 и 16; 12 и 16; 12 и 19; 15 и 22; 18 и 25; 21 и 25; 21 и 28; 22 и 29; 25 и 29. Например, макроцикл-образующий линкеры соединяют следующие пары аминокислот: 4 и 8; 5 и 12; 12 и 19; 15 и 22; 18 и 25; 21 и 25; 21 и 28. В отдельных вариантах осуществления настоящего изобретения первый макроцикл-образующий линкер соединяет аминокислотные пары 4 и 8; 5 и 12; 8 и 12; 8 и 15; 9 и 16; 12 и 16; или 12 и 19; а второй макроцикл-образующий линкер соединяет аминокислотные пары 15 и 22; 18 и 25; 21 и 25; 21 и 28; 22 и 29; или 25 и 29. Например, первый макроцикл-образующий линкер соединяет аминокислотные пары 4 и 8; 5 и 12; или 12 и 19; а второй макроцикл-образующий линкер соединяет аминокислотные пары 15 и 22; 18 и 25; 21 и 25; или 21 и 28. В отдельных вариантах осуществления настоящего изобретения первый макроцикл-образующий линкер соединяет аминокислотные пары 4 и 8, а второй макроцикл-образующий линкер соединяет аминокислотные пары 21 и 25.
В отдельных вариантах осуществления настоящего изобретения пептидомиметический макроцикл содержит аминокислотную последовательность, которая по меньшей мере на приблизительно 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентична GHRH 1-44, GHRH 1-29 и/или аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей из Таблицы 1, 2 или 4, и к тому же содержит макроцикл-образующий линкер, соединяющий первую аминокислоту со второй аминокислотой, где первая и вторая аминокислоты выбраны из следующих пар аминокислот: 4 и 8; 5 и 12; 8 и 12; 8 и 15; 9 и 16; 12 и 16; 12 и 19; 15 и 22; 18 и 25; 21 и 25; 21 и 28; 22 и 29. Например, макроцикл-образующий линкер соединяет аминокислоты 12 и 19.
В отдельных вариантах осуществления настоящего изобретения пептидомиметический макроцикл содержит последовательность, выбранную из группы, состоящей из аминокислотных последовательности в Таблицах 1, 2 или 4, или аминокислотную последовательность пептидомиметического макроцикла, выбранную из группы, состоящей из аминокислотных последовательностей, представленных в Таблицах 1, 2 или 4.
В отдельных вариантах осуществления настоящего изобретения пептидомиметический макроцикл содержит спираль, такую как α-спираль или 310 спираль. В других вариантах осуществления настоящего изобретения пептидомиметический макроцикл содержит α,α-двузамещенную аминокислоту. Например, по меньшей мере одна аминокислота, или каждая аминокислота, соединенная с помощью макроцикл-образующего линкера, представляет собой α,α-двузамещенную аминокислоту.
В отдельных вариантах осуществления настоящего изобретения пептидомиметический макроцикл по настоящему изобретению содержит сшивающее средство, сшивающее α-положения по меньшей мере двух аминокислот.
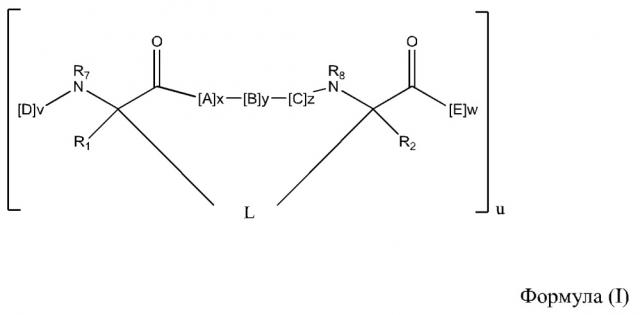
В отдельных вариантах осуществления настоящего изобретения пептидомиметический макроцикл имеет Формулу:
где:
каждый A, C, D, и E независимо представляет собой аминокислоту;
B представляет собой аминокислоту,, [-NH-L3-CO-], [-NH-L3-SO2-], или [-NH-L3-];
R1 и R2 независимо представляют собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил, или гетероциклоалкил, незамещенный или замещенный галогеном;
R3 представляет собой водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил, или гетероциклоарил, который необязательно замещен на R5;
L представляет собой макроцикл-образующий линкер Формулы –L1–L2–;
и где A, B, C, D, и E, взятые вместе со сшитыми аминокислотами, соединенные с помощью макроцикл-образующего линкера L, образуют аминокислотную последовательность пептидомиметического макроцикла, который на по меньшей мере приблизительно 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентичен GHRH 1-44, GHRH 1-29 и/или аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей в Таблице 1, 2 или 4;
L1 и L2 независимо представляют собой алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен, или [-R4-K-R4-]n, каждый из которых который необязательно замещен на R5;
каждый R4 представляет собой алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен, или гетероарилен;
каждый K представляет собой O, S, SO, SO2, CO, CO2, или CONR3;
каждый R5 независимо представляет собой галоген, алкил, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентную функциональную группу, радиоизотоп или терапевтическое средство;
каждый R6 независимо представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентную функциональную группу, радиоизотоп или терапевтическое средство;
R7 представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил, или гетероциклоарил, который необязательно замещен на R5,иличасть циклической структуры с остатком D;
R8 представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил, или гетероциклоарил, который необязательно замещен на R5,иличасть циклической структуры с остатком E;
v и w независимо представляют собой целые числа от 1 до 1000, например от 1 до 500, от 1 до 200, от 1 до 100, от 1 до 50, от 1 до 40, от 1 до 25, от 1 до 20, от 1 до 15, или от 1 до 10;
u, x, y и z независимо представляют собой целые числа от 0 до 10, например u представляет собой 1, 2, или 3; и
n представляет собой целое число от 1 до 5. Например, u представляет собой 2. В отдельных вариантах осуществления настоящего изобретения сумма x+y+z представляет собой 2, 3 или 6, например 3 или 6.
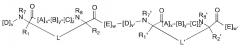
В отдельных вариантах осуществления настоящего изобретения пептидомиметический макроцикл Формулы (I) имеет Формулу:
где каждый A, C, D, и E независимо представляет собой аминокислоту;
B представляет собой аминокислоту,[-NH-L3-CO-], [-NH-L3-SO2-], или [-NH-L3-];
L’ представляет собой макроцикл-образующий линкер Формулы –L1’–L2’–;
и где A, B, C, D, и E, взятые вместе со сшитыми аминокислотами, соединенные с помощью макроцикл-образующих линкеров L и L’, образуют аминокислотную последовательность пептидомиметического макроцикла;
R1’ и R2’ независимо представляют собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил, или гетероциклоалкил, незамещенный или замещенный на галоген;
L1’ и L2’ независимо представляют собой алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен, или [-R4-K-R4-]n, каждый из которых который необязательно замещен на R5;
каждый K независимо представляет собой O, S, SO, SO2, CO, CO2, или CONR3;
R7’ представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил, или гетероциклоарил, который необязательно замещен на R5,иличасть циклической структуры с остатком D;
R8’ представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил, или гетероциклоарил, который необязательно замещен на R5, или часть циклической структуры с остатком E;
v’ и w’ независимо представляют собой целые числа от 1 до 1000, например, от 1 до 500, от 1 до 200, от 1 до 100, от 1 до 50, от 1 до 40, от 1 до 25, от 1 до 20, от 1 до 15, или от 1 до 10;
x’, y’ и z’ независимо представляют собой целые числа от 0 до 10; и
n представляет собой целое число от 1 до 5. В отдельных вариантах осуществления настоящего изобретения сумма x’+y’+z’ представляет собой 2, 3 или 6, например 3 или 6.
В отдельных вариантах осуществления любого из пептидомиметических макроциклов, описанных в данном документе, каждый K представляет собой O, S, SO, SO2, CO, или CO2.
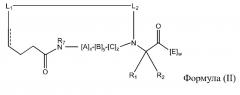
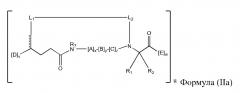
В других вариантах осуществления настоящего изобретения пептидомиметический макроцикл может содержать сшивающее средство, которое сшивает остов аминогруппы первой аминокислоты ко второй аминокислоте в структуру пептидомиметического макроцикла. Например, настоящее изобретение обеспечивает пептидомиметические макроциклы Формулы (II) или (IIa):
где:
каждый A, C, D, и E независимо представляет собой аминокислоту;
B представляет собой аминокислота,, [-NH-L3-CO-], [-NH-L3-SO2-], или [-NH-L3-];
R1 и R2 независимо представляют собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил, или гетероциклоалкил, незамещенный или замещенный на галоген, или часть циклической структуры с остатком E;
R3 представляет собой водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил, или гетероциклоарил, который необязательно замещен на R5;
L1 и L2 независимо представляют собой алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен, или [-R4-K-R4-]n, каждый из которых необязательно замещен на R5;
и где A, B, C, D, и E, взятые вместе со сшитыми аминокислотами, соединенные с помощью макроцикл-образующего линкера -L1-L2-, образуют аминокислотную последовательность пептидомиметического макроцикла, который на по меньшей мере приблизительно 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% идентичен GHRH 1-44, GHRH 1-29 и/или аминокислотная последовательность, выбранная из группы, состоящей из аминокислотных последовательностей в Таблице 1, 2 или 4;
каждый R4 представляет собой алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен, или гетероарилен;
каждый K представляет собой O, S, SO, SO2, CO, CO2, или CONR3;
каждый R5 независимо представляет собой галоген, алкил, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентную функциональную группу, радиоизотоп или терапевтическое средство;
каждый R6 независимо представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентную функциональную группу, радиоизотоп или терапевтическое средство;
R7 представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил, или гетероциклоарил, который необязательно замещен на R5;
v и w независимо представляют собой целые числа от 1 до 1000, например, от 1 до 500, от 1 до 200, от 1 до 100, от 1 до 50, от 1 до 40, от 1 до 25, от 1 до 20, от 1 до 15, или от 1 до 10;
u, x, y и z независимо представляют собой целые числа от 0 до 10, например, u представляет собой от 1 до 3; и
n представляет собой целое число от 1 до 5.
Кроме того, приведенное в данном документе представляет собой пептидомиметический макроцикл, который содержит аминокислотную последовательность Формулы:
Х1-Х2-Х3-Х4-Х5-Х6-Х7-Х8-Х9-Х10-Х11-Х12-Х13-Х14-Х15-Х16-Х17-Х18-Х19-Х20-Х21-Х22-Х23-Х24-Х25-Х26-Х27-Х28-Х29 (SEQ ID NO: 1)
где:
X1 представляет собой Tyr или His;
Х2 представляет собой Ala, D-Ala, или Val;
Х3 представляет собой Asp;
Х4 представляет собой Ala или сшитую аминокислоту;
Х5 представляет собой Ile;
Х6 представляет собой Phe;
Х7 представляет собой Thr;
Х8 представляет собой Gln, Asn, или сшитую аминокислоту;
Х9 представляет собой Ser или сшитую аминокислоту;
Х10 представляет собой Tyr;
X11 представляет собой Arg, Ala или Gln;
Х12 представляет собой Lys, Ala, Gln или сшитую аминокислоту;
Х13 представляет собой Val или Ile;
Х14 представляет собой Leu;
Х15 представляет собой Gly, Ala или сшитую аминокислоту;
Х16 представляет собой Gln, Glu или сшитую аминокислоту;
Х17 представляет собой Leu;
X18 представляет собой Ser, Tyr или сшитую аминокислоту;
X19 представляет собой Ala или сшитую аминокислоту;
X20 представляет собой Arg или Gln;
X21 представляет собой Lys, Gln или сшитую аминокислоту;
X22 представляет собой Leu, Ala, или сшитую аминокислоту;
X23 представляет собой Leu;
X24 представляет собой Gln, Glu или His;
X25 представляет собой Asp, Glu или сшитую аминокислоту;
X26 представляет собой Ile;
X27 представляет собой Met, Ile, Leu или Nle;
X28 представляет собой Ser или сшитую аминокислоту;
X29 представляет собой Arg, Ala, Gln или сшитую аминокислоту;
где пептидомиметический макроцикл содержит по меньшей мере один макроцикл-образующий линкер, соединяющий по меньшей мере одну пару аминокислот, выбранную из X1-X29;
L представляет собой макроцикл-образующий линкер Формулы –L1–L2–;
L1 и L2 независимо представляют собой алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен, или [-R4-K-R4-]n, каждый из которых который необязательно замещен на R5;
каждый R4 представляет собой алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен, или гетероарилен;
каждый K представляет собой O, S, SO, SO2, CO, или CO2;
каждый R5 независимо представляет собой галоген, алкил, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентную функциональную группу, радиоизотоп или терапевтическое средство; и
каждый R6 независимо представляет собой –H, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентную функциональную группу, радиоизотоп или терапевтическое средство.
Например, полипептид содержит по меньшей мере один, или по меньшей мере два макроцикл-образующий линкера, которые соединяют одну из следующих пар аминокислот: X4 и X8; X5 и X12; X8 и X12; X8 и X15; X9 и X16; X12 и X16; X12 и X19; X15 и X22; X18 и X25; X21 и X25; X21 и X28; X22 и X29; X25 и X29. Например, каждый макроцикл-образующий линкер соединяет одну из следующих пар аминокислот: X4 и X8; X5 и X12; X12 и X19; X15 и X22; X18 и X25; X21 и X25; X21 и X28.
В отдельных вариантах осуществления настоящего изобретения пептидомиметические макроциклы содержат макроцикл-образующий линкер Формулы –L1-L2-, где L1 и L2 независимо представляют собой алкилен, алкенилен или алкинилен. Например, L1 и L2 независимо представляют собой C3-C10 алкилен или алкенилен, или C3-C6 алкилен или алкенилен.
В отдельных вариантах осуществления настоящего изобретения R1 и R2 независимо представляют собой H или алкил, например, метил.
Кроме того, настоящее изобретение обеспечивает способ увеличения циркулирующего уровня гормона роста (GH) у субъекта, способ увеличения сухой мышечной массы у субъекта и способ уменьшения жировой ткани (такой как абдоминальная жировая ткань) у субъекта содержит введение субъекту пептидомиметического макроцикла по настоящему изобретению. Например, субъекты, страдающие от ожирения, включая абдоминальное ожирение, проходят лечение с использованием пептидомиметического макроцикла по настоящему изобретению. Настоящее изобретение также обеспечивает способ лечения мышечной атрофии, которая включает анорексии, кахексии (такие как раковая кахексия, кахексия при хронической сердечной недостаточности, кахексия при хроническом обструктивном заболевании легких, кахексия при ревматоидном артрите) и саркопении, способ лечения липодистрофий, которые включают липодистрофию при HIV, способ лечения нарушения деятельности гормона роста, который включает недостаток гормона роста у взрослых и детей, или способ лечения пареза желудка или синдрома короткой кишки. Недостаток гормона роста у детей может быть, например, связан с, или быть сопутствующим, идиопатической низкорослостью, SGA (низкой массой для данного гестационного возраста у новорожденного), хронической почечной недостаточностью, синдромом Прадера-Вилли, синдромом Тернера, дефектом гена SHOX (shortstaturehomeobox), или первичным недостатком IGF-1. Настоящее изобретение также обеспечивает способ лечения мышечных атрофий, липодистрофий, нарушений деятельности гормона роста или пареза желудка/синдрома короткой кишки у субъекта с помощью введения агониста рецептора GHRH, такого как аналог GHRH, где агонист вводят не чаще чем раз в день, не чаще чем раз в два дня, не чаще чем дважды в неделю, не чаще чем раз в неделю или не чаще чем раз в две недели. Настоящее изобретение также обеспечивает способ увеличения циркулирующего уровня гормона роста (GH) у субъекта с помощью введения агониста рецептора GHRH, такого как аналог GHRH, где агонист вводят не чаще чем раз в день, не чаще чем раз в два дня, не чаще чем дважды в неделю, не чаще чем раз в неделю или не чаще чем раз в две недели.
ВКЛЮЧЕНИЕ СВЕДЕНИЙ ПУТЕМ ССЫЛКИ
Все публикации, патенты и патентные заявки, упомянутые в этом описании, включены данный документ в виде ссылки так, как если бы каждая отдельная публикация, патент или патентная заявка были конкретно и отдельно указаны как включенные посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Новые отличительные признаки настоящего изобретения будут подробно изложены в прилагаемой формуле изобретения. Лучшее понимания особенностей и преимуществ настоящего изобретения будет получено при обращении к следующему подробному описанию, которое излагает иллюстративные варианты осуществления настоящего изобретения, в которых используются принципы изобретения, и прилагаемых графических материалах, на которых:
ФИГУРЫ 1A и 1B иллюстрируют повышенные устойчивости пептидомиметических макроциклов по настоящему изобретению к протеолизу трипсином.
ФИГУРА 2 иллюстрирует повышенные устойчивости пептидомиметических макроциклов по настоящему изобретению к сыворотке крови.
ФИГУРЫ 3 и 3a иллюстрируют активности агониста рецептора GHRH пептидомиметических макроциклов по настоящему изобретению, которые измеряли с помощью высвобождения cAMP и периодов полувыведения трипсина. В случае значений сАМР, "+" представляет собой значения больше 50 нмоль; "++" представляет собой значения между 10 и 50 нмоль; "+++" представляет собой значения между 1 и 10 нмоль; "++++" представляет собой значения менее 1 нмоль. В случае периодов полувыведения трипсина, "+" представляет собой значения меньше чем 50 мин.; "++" представляет собой значения между 50 и 100 мин.; "+++" представляет собой значения между 100 и 200 мин.; "++++" представляет собой значения более 200 мин.; и "NT" означает "не измерено". На Фигуре 3 раскрыты SEQ ID NOS 89-131, соответственно, в порядке появления. На Фигуре 3а раскрыты SEQ ID NOS 132-137, соответственно, в порядке появления.
ФИГУРА 4 иллюстрирует результат фармакокинетического анализа плазмы крови, выполненного с пептидомиметическим макроциклом SP-1.
ФИГУРА 5 иллюстрирует результат фармакокинетического анализа плазмы крови, выполненного с пептидомиметическим макроциклом SP-8.
ФИГУРА 6 иллюстрирует результат фармакокинетического анализа плазмы крови, выполненного с пептидомиметическим макроциклом SP-6.
ФИГУРА 7 иллюстрирует результат фармакокинетического анализа плазмы крови, выполненного с пептидомиметическим макроциклом SP-21.
ФИГУРА 8 иллюстрирует результат фармакокинетического анализа плазмы крови, выполненного с пептидомиметическим макроциклом SP-32.
ФИГУРА 9 иллюстрирует результат фармакокинетического анализа плазмы крови, выполненного с пептидомиметическими макроциклами SP-1, SP-6, SP-8, SP-21, и SP-32.
ФИГУРА 10 иллюстрирует стимулирование выделения гормона роста с помощью пептидомиметического макроцикла SP-8.
ФИГУРА 11 иллюстрирует высвобождение гормона роста (AUC), вызванного серморелином по сравнению с пептидомиметическими макроциклами SP-1, SP-6, SP-8, SP-21, и SP-32.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используемый в данном документе термин “макроцикл” соответствует молекуле, которая имеет химическую структуру, включающую кольцо или цикл, образованный по меньшей мере 9 ковалентно связанными атомами.
Используемый в данном документе термин “пептидомиметический макроцикл” или “сшитый полипептид” соответствует соединению, которое содержит множество аминокислотных остатков, связанных множеством пептидных связей, и по меньшей мере один макроцикл-образующий линкер, который образует макроцикл между первым, встречающимся в природе или не встречающимся в природе, аминокислотным остатком (или его аналогом) и вторым, встречающимся в природе или не встречающимся в природе, аминокислотным остатком (или его аналогом) в структуру этой же молекулы. Пептидомиметический макроцикл включает варианты осуществления настоящего изобретения, в которых макроцикл-образующий линкер соединяет α-углеродный атом первого аминокислотный остаток (или его аналога) с α-углеродным атомом второго аминокислотного остатка (или его аналога). Пептидомиметические макроциклы необязательно включают одну или несколько непептидных связей между одним или несколькими аминокислотными остатками и/или остатками аналогов аминокислот, и необязательно включают один или несколько не встречающиеся в природе аминокислотных остатков или остатков аналогов аминокислот, в дополнение к любому, образующему макроцикл. “Соответствующий несшитый полипептид”, когда в контексте соответствует пептидомиметическому макроциклу, подразумевается как относящийся к полипептиду такой же длины, что и макроцикл, и содержит эквивалентные природные аминокислоты в последовательности дикого типа, соответствующей макроциклу.
Используемый в данном документе термин “стабильность” соответствует поддержанию определенной вторичной структуры в растворе с помощью пептидомиметического макроцикла по настоящему изобретению, которую измеряли с помощью кругового дихроизма, NMR или другого биофизического метода измерения, или устойчивость к протеолитическому распаду invitro или invivo. Неограничивающие примеры вторичных структур, предполагаемых по настоящему изобретению, представляют собой α-спирали, 310 спирали, β-петли, и β-складки.
Используемый в данном документе термин “спиральная стабильность” соответствует поддержание α-спиральной структуры с помощью пептидомиметического макроцикла по настоящему изобретению, которую измеряли с помощью кругового дихроизма или NMR. Например, в отдельных вариантах осуществления настоящего изобретения пептидомиметические макроциклы по настоящему изобретению демонстрируют по меньшей мере 1,25, 1,5, 1,75 или 2-кратное увеличение α-спиральности, что определяли с помощью кругового дихроизма по сравнению с соответствующим несшитым макроциклом.
Термин “аминокислота” соответствует молекуле, которая содержит и аминогруппу, и гидроксильную группу. Соответствующие аминокислоты включают, без ограничения, и D- и L-изомеры встречающихся в природе аминокислот, и не встречающихся в природе аминокислот, полученные с помощью органического синтеза или другими путями метаболизма. Термин аминокислота, используемый в данном документе, включает без ограничения α-аминокислоты, природные аминокислоты, искусственные аминокислоты и аналоги аминокислот.
Термин “α-аминокислота” соответствует молекуле, которая содержит и аминогруппу и гидроксильную группу, связанную с атомом углерода, который обозначен как α-углерод.
Термин “β-аминокислота” соответствует молекуле, которая содержит и аминогруппу и гидроксильную группа в β положении.
Термин “встречающаяся в природе аминокислота” соответствует любой из двадцати аминокислот, которые обычно встречаются в пептидах, синтезируемые в природе, и известные под одним из буквенных обозначений A, R, N, C, D, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y и V.
Следующая Таблица иллюстрирует краткие сведения о свойствах природных аминокислот:
| Аминокислота | 3-бук-венное обозна-чение | 1-бук-венное обозна-чение | Поляр-ность боковой цепи | Заряд боковой цепочки (pH 7,4) | Индекс гидро-фобности |
| Аланин | Ala | A | неполярная | нейтральный | 1,8 |
| Аргинин | Arg | R | полярная | положительный | −4,5 |
| Аспарагин | Asn | N | полярная | нейтральный | −3,5 |
| Аспарагиновая | Asp | D | полярная | отрицательный | −3,5 |
| кислота | |||||
| Цистеин | Cys | C | полярная | нейтральный | 2,5 |
| Глутаминовая кислота | Glu | E | полярная | отрицательный | −3,5 |
| Глутамин | Gln | Q | полярная | нейтральный | −3,5 |
| Глицин | Gly | G | неполярная | нейтральный | −0,4 |
| Гостидин | His | H | полярная | Положительный (10%)Нейтральный (90%) | −3,2 |
| Изолейцин | Ile | I | неполярная | нейтральный | 4,5 |
| Лейцин | Leu | L | неполярная | нейтральный | 3,8 |
| Лизин | Lys | K | полярная | положительный | −3,9 |
| Метионин | Met | M | неполярная | нейтральный | 1,9 |
| Фенилаланин | Phe | F | неполярная | нейтральный | 2,8 |
| Пролин | Pro | P | неполярная | нейтральный | −1,6 |
| Серин | Ser | S | полярная | нейтральный | −0,8 |
| Треонин | Thr | T | полярная | нейтральный | −0,7 |
| Триптофан | Trp | W | неполярная | нейтральный | −0,9 |
| Тирозин | Tyr | Y | полярная | нейтральный | −1,3 |
| Валин | Val | V | неполярная | нейтральный | 4,2 |
“Гидрофобные аминокислоты” включают малые гидрофобные аминокислоты и большие гидрофобные аминокислоты. “Малыми гидрофобными аминокислотами” являются глицин, аланин, пролин, и их аналоги. “Большими гидрофобными аминокислотами” являются валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, и их аналоги. “Полярными аминокислотами” являются серин, треонин, аспарагин, глутамин, цистеин, тирозин, и их аналоги. “Заряженными аминокислотами” являются лизин, аргинин, гостидин, аспартат, глутамат, и их