Способ направленного неинвазивного воздействия на морфологическое состояние клеток-мишеней тканей представителей семейства кошачьих
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к биотехнологии и ветеринарии, и может быть использовано для направленного неинвазивного воздействия на морфологическое состояние клеток-мишеней тканей представителей семейства кошачьих. Воздействуют непрерывной ультразвуковой волной 0,88 МГц интенсивностью 0,2-0,7 Вт/см2 на клеточную суспензию объемом от 1 мл до 1,5 мл, содержащую (6-7)106 клеток/мл. Время воздействия выбирают в зависимости от размера и структуры клеток: в течение 15-30 с воздействуют на ядросодержащие клетки размером более 10 μ, имеющие гранулы или клеточные включения. В течение 35-50 с воздействуют на безъядерные клетки размером до 4 μ или клетки ядросодержащие, без каких-либо включений в цитоплазме, размера 5-17 μ. Способ обеспечивает выборочное разрушение в одной ткани клеток определенного размера и структуры.
Реферат
Изобретение относится к медицине, биотехнологии и ветеринарии, а именно, к применению акустических волн для направленного неинвазивного воздействия на функциональное состояние клеток тканей животной этиологии с возможностью выборочного изменения состояния/разрушения клеток-мишеней. Акустическую атаку проводят с целью управления процессами жизнедеятельности, пролиферативной активностью клеток/культур клеток и тканей и избирательного подавления или активации их функций. Изобретение также может быть использовано в клеточной и молекулярной биологии, представляет интерес для разработки методов экспериментальной медицины, фармакологии, диагностики/терапии злокачественных новообразований, индивидуального подбора лекарственных препаратов и герондопротекторов, при проведении радио-, химио- и озонотерапии.
При воздействии акустических волн за счет сжатия в волне клеточных мембран и реализации пьезоэффекта возможен эффект изменения поверхностного заряда и функционального состояния мембран. Таким образом, мембрана может быть мишенью, на уровне которой реализуются цепи одинаковых в дальнейшем эффектов как для акустических, так и для электромагнитных волн. Клетки, находящиеся в акустической волне и являющиеся точечными по сравнению с длиной волны, могут испытывать сжатия и расширения объема, достигающее 20% при действии волн с амплитудой до 100 кПа. Это в свою очередь может уменьшить количество активных каналов за счет латеральной диффузии молекул липидного бислоя и изменить проницаемость цитоплазматической мембраны (ЦПМ), функциональное состояние клетки [1].
В настоящее время нет однозначной теории формирования частотно-зависимых ответов на акустическое воздействие. Ряд исследователей показали особенности в биологических эффектах воздействия на ткани непрерывных и модулированных волн различной физической природы [2-6].
Из уровня техники известен способ создания индуцированных повреждений дезоксирибонуклеиновой кислоты (ДНК) в индивидуальных неделимых ядросодержащих клетках (RU 2527345 от 05.04.2013 г.). Данный способ эффективен и информативен при малом количестве требуемого экспериментального материала.
Однако указанный способ является затратным за счет использования дорогостоящего стационарного оборудования при создании индуцированных повреждений клеточной ДНК. Способ требует при его реализации работы специально обученного персонала, средств эффективной защиты обслуживающих технических работников от рентгеновского излучения и соблюдения высоких требований безопасности к помещению.
Известен способ неинвазивного разрушения расположенных за костями грудной клетки биологических тканей (RU 2472545 от 20.01.201, Бюл. №2), выбранный в качестве ближайшего аналога. Данный способ основан на воздействии фокусированным УЗ пучком на биологическую ткань для локального разрушения клеток только в месте нахождения основного фокуса, без повреждения в побочных фокусах.
Однако данный способ применяется в УЗ хирургии только для одновременно теплового и механического воздействий, сопровождается сильным разогревом ткани. Ограничение в применении способа акустического разрушения клеток определяется использованием высокоинтенсивного УЗ, возможностью воздействия только на один вид ткани организма человека - костную, причем на всю ткань одновременно, а не на отдельные клетки (остеобласты), генерацией локального избыточного пикового положительного давления 30-80 МПа в месте воздействия.
Заявленное изобретение осуществляется путем нахождения оптимальных условий ультразвукового воздействия на ткань, приводящего к избирательному изменению цитоморфологии или к разрушению клеток/клеточных структур животных семейства кошачьих.
Задачей предлагаемого изобретения является разработка эффективного способа неинвазивного направленного воздействия на клетки ткани животных, безопасного при реализации и не требующего дорогостоящего стационарного оборудования, специально обученного персонала и специально оборудованного помещения; осуществление способа без дополнительных технических средств и химических реагентов; минимальная затрата времени (10-45 с); полная безопасность метода для медицинского персонала и научных сотрудников при максимальном эффекте.
Целью предлагаемого изобретения является плановое воздействие на клетки разных типов и размеров.
Техническим результатом заявленного изобретения является: направленное изменение проницаемости/структуры цитоплазматической и/или ядерной мембраны; регулирование глубины эффекта акустического воздействия; торможение или активация транспортных систем клеток; выборочное разрушение в одной ткани ядер у клеток определенного, заранее заданного размера; направленная супрессия роста клеток, в том числе и ненормированного; нарушение аппарата межклеточного взаимодействия и клеточных контактов; регуляция активности внутриклеточных и мембран-связанных ферментов, что даст возможность проводить купирование заболеваний различной этиологии на клеточном уровне.
Заявленный технический результат осуществляется тем, что на клеточную суспензию объемом от 1 мл до 1,5 мл, содержащую (6-7)106 клеток/мл, помещенную в кювету, воздействуют бегущей непрерывной УЗ волной с частотой 880 кГц, интенсивностью 0,4-0,7 Вт/см2, в течение 15-30 с - на ядросодержащие клетки размером более 10 μ, имеющие гранулы или клеточные включения, на безъядерные клетки размером до 4 μ или клетки ядросодержащие, без каких-либо включений в цитоплазме, размера 5-17 μ, воздействуют в течение 35-45 с.
Пробы обрабатывают в абсолютно одинаковых условиях, поддерживают постоянную температуру образцов в кюветах с проточным охлаждением, а также проводят анализ морфологического состояния клеток методами световой микроскопии и пробой с трипановым синим [7]. По окраске клетки в синий цвет, началу деформации, состоянию ее ЦПМ, по морфологическим изменениям: деформации/изменению структуры ядер, ядерному лизису или разрушению ядер, изменению структуры цитоплазмы, ее вакуолизации - определяют наличие и выбирают необходимое направление действия.
Заявленный способ осуществляется следующим образом.
Воздействовали ультразвуком in vitro на жидкую подвижную ткань - кровь, в которой одновременно представлены клетки разного вида, размера и возраста. Среднее количество клеток в суспензии при обработке УЗ составляло (6-7)106 клеток/мл.
Для обеспечения постоянной концентрации образцы разбавлялись сывороткой крови того же животного. Для реализации заявляемого изобретения используются любые из отечественных ультразвуковых терапевтических генераторов с излучателями, работающих на несущей частоте 0,88 МГц: УЗТ-1-01Ф; Ультразвук Т-5 и УЗТ-1.02С и др. Экспозиция УЗ: время от 10 с до 50 с, ISATA - средняя по пространству и времени интенсивность - 0,4-0,7 Вт/см2, что контролировали с помощью дифференциальной термопары, калиброванной по интенсивности. Интенсивность УЗ, прошедшего в ткань in vitro, составляла 90% номинальной интенсивности. Объем облучаемых образцов составлял 1-1,5 мл.
Кровь брали из периферических вен: вены Сафена и подкожной вены предплечья диких (тигр, лев) и домашних кошек разных пород, веса, возраста и пола. Образцы крови облучались в абсолютно одинаковых условиях (площадь излучателя, охлаждение, циркуляция жидкости). УЗ воздействие на клетки крови, находящейся в термостатируемой кювете, осуществлялось по отработанной ранее методике [6]. Делали мазки крови и окрашивали их по методу быстрого дифференцированного окрашивания биопрепаратов ДИФФ-КВИК: фиксация в абсолютном метаноле 15 с, затем в растворах красителей по 10 с, промывание в забуференной воде, сушка и просмотр под иммерсией. Контролем служили интактные клетки тех же животных. Образцы, опытные и контроль, красили трипановым синим [8] для определения изменения проницаемости ЦПМ. Результат воздействия УЗ на клетки сразу же наблюдали в световой микроскоп («Микмед-5», объектив 100x/1,25, окуляр 10х/18). О направлении воздействия УЗ на клетки ткани судили по количественным и качественным морфологическим изменениям.
Подсчет лейкоцитов вели по линии «Меандра»: 3-5 полей зрения вдоль края мазка, 3-5 полей зрения под прямым углом к середине мазка, потом 3-5 полей зрения параллельно краю мазка и вновь под прямым углом к краю мазка. Так продолжали до тех пор, пока не было подсчитано 100 целых клеток. Считали все лейкоциты, находящиеся в 25 больших квадратах, содержащих по 16 малых квадратов (т.е. в 400 квадратах). Для расчета в 1 мл использовали формулу:
, где
X - количество лейкоцитов в 1 мл крови; М - количество лейкоцитов, подсчитанное в 25 квадратах; 20 - разведение крови; 400 - количество квадратов [9]. Статистическую обработку результатов проводили с использованием пакета прикладных программ «Statistica 6.0». Достоверность различий средних значений определяли, используя парный t-критерий Стьюдента; достоверными считали различия при р<0,05. Референсный ряд клеточных размеров приведен по Н.А. Любину [10].
Направленное действие непрерывного УЗ на клетки крови представителей семейства кошачьих (р<0,05)
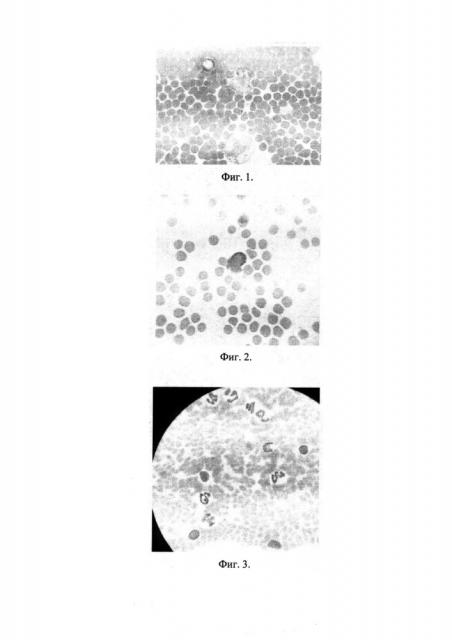
После обработки ткани интенсивностью 0,2-0,7 Вт/см2 в течение 15-30 с, последовательно менялась проницаемость ЦПМ, вспенивалась цитоплазма, начинали разрушаться ЦПМ и ядра клеток размера более 10 μ, имеющих гранулы или клеточные включения. На рисунке показано влияние интенсивности УЗ 0,4 Вт/см2, 15 с - вспенивание цитоплазмы гранулоцита, начало разрушения ЦПМ и ядра (фиг. 1). При увеличении времени воздействия до 35-50 с изменялись или разрушались ядра ядросодержащих клеток размера 5-17 μ без каких-либо включений в цитоплазму и объем их цитоплазмы, а также проницаемость ЦПМ безъядерных клеток размером до 4 μ. На фотографии (фиг. 2) показано типичное изменение лимфоцитов после облучения УЗ (0,2 Вт/см2, 40 с Лимфоцит, разрыв ядра) по сравнению с контролем-интактными клетками крови (фиг. 3). При интенсивности 0,7 Вт/см2, экспозиции 15-30 с, наблюдался лизис ЦПМ и ядер ядросодержащих, имеющих гранулы или клеточные включения, клеток размера более 10 μ. При увеличении экспозиции до 35-45 с установленная стадийность цитоморфологических изменений «доза-эффект» сохранялась.
Выводы
1. Предложена схема ультразвукового воздействия на суспензии клеток-мишеней тканей представителей семейства кошачьих в фиксированном, термостатируемом объеме и определена оптимальная клеточная концентрация при облучении - (6-7)106 клеток/мл.
2. Показана общая закономерность УЗ влияния акустической волны выбранного диапазона действия на клетки крови всех представителей Семейства, независимо от вида животного.
3. Применение УЗ в диапазоне интенсивностей 0,2-0,4 Вт/см2 в течение 15-30 с на клетках размера более 10 μ, имеющих гранулы или клеточные включения, приводило к цепи взаимосвязанных эффектов: изменению проницаемости ЦПМ, вспениванию цитоплазмы, разрушению ЦПМ и/или ядер.
4. При увеличении времени воздействия до 35-50 с изменялись или разрушались ядра ядросодержащих клеток размера 5-17 μ и объем их цитоплазмы, а также проницаемость ЦПМ безъядерных клеток размером до 4 μ.
5. Интенсивность 0,7 Вт/см2, экспозиция 15-20 с, инициировала лизис ЦПМ и ядер ядросодержащих, имеющих гранулы или клеточные включения, клеток размера более 10 μ.
6. Рост времени УЗ обработки 45 с приводил к лизису ЦПМ безъядерных клеток размером до 4 μ и изменение структуры ЦПМ ядросодержащих клеток, без каких-либо включений в цитоплазме, размером 5-17 μ.
Список литературы
1. Акопян В.Б., Ершов Ю.Α., Основы взаимодействия ультразвука с биологическими объектами (МГТУ им. Н.Э. Баумана. М., 2005, 223 с.).
2. Утешев В.К., Пашовкин Т.Н., Гахова Э.Н. Выживаемость зародышей амфибий после воздействия модулированного ультразвука терапевтического диапазона // Вестник новых медицинских технологий, 2010, №4, С. 7-10.
3. Максутова Д.Ж. Применение фокусированного ультразвука под контролем магнитно-резонансной томографии // Проблемы репродукции / Russian Journal of Human Reproduction. 2009. №2. С. 30-36.
4. Пашовкина M.C., Акоев И.Г., Пашовкин Т.Н. Изменение активности некоторых ферментов животных и человека при воздействии модулированных микроволн и феномены выявления нелинейных эффектов. // Биологические эффекты слабых электромагнитных излучений. Пущино. 2002. С. 26-37.
5. Олешкевич Α.Α., Кутликова И.В. Влияние ультразвука на лимфоциты и сегментоядерные нейтрофилы // Научное обозрение. - 2015. - №13. - С. 145-150.
6. Олешкевич А.А. Действие непрерывного и модулированного ультразвука на клетки крови животных in vitro / V Съезд биофизиков России. Материалы докладов: в 2 т. - Ростов-на-Дону: ЮФУ - Т. 2: 2015. - С. 107.
7. Скибо Ю.В., Абрамова З.И. Методы исследования программируемой клеточной гибели: - Казань: ФГАОУ ВПО КФУ, 2011. - 61 с.
8. Олешкевич А.А., Пашовкин Т.Н. Возможность изменения лейкограмм животных при действии непрерывного ультразвука терапевтического диапазона интенсивностей // Аграрная Россия. - №6 (2015). С 13-17.
9. Кондрахин И.П., Курилов Н.В., Малахов А.Г. и др. Клиническая лабораторная диагностика в ветеринарии. - М.: Агропромиздат, 1985. - с. 59-64.
10. Любин Н.А., Конова Л.Б. Методические рекомендации к определению и выведению гемограммы у сельскохозяйственных и лабораторных животных при патологиях. Ульяновск, ГСХА, 2005, с. 113.
Способ направленного неинвазивного воздействия на морфологическое состояние клеток-мишеней тканей представителей семейства кошачьих, включающий воздействие непрерывной ультразвуковой волной 0,88 МГц интенсивностью 0,2-0,7 Вт/см2 на клеточную суспензию объемом от 1 мл до 1,5 мл, содержащую (6-7)106 клеток/мл, причем время воздействия выбирают в зависимости от размера и структуры клеток: в течение 15-30 с воздействуют на ядросодержащие клетки размером более 10 μ, имеющие гранулы или клеточные включения, в течение 35-50 с - на безъядерные клетки размером до 4 μ или клетки ядросодержащие, без каких-либо включений в цитоплазме, размера 5-17 μ.