Инсектицидные n-замещенные сульфилимины и сульфоксимины n- оксидов пиридина
Иллюстрации
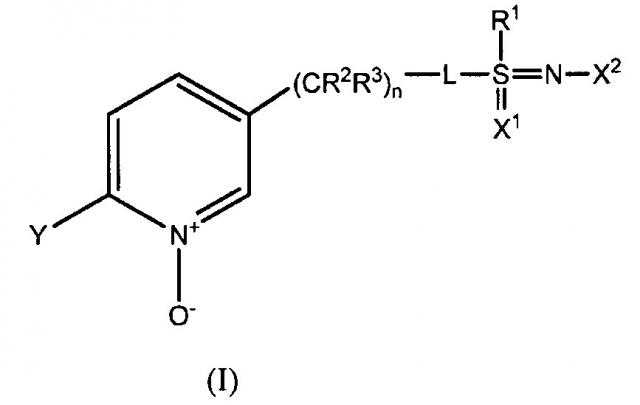
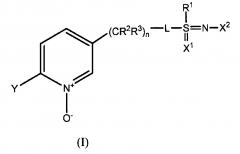
Показать всеИзобретение относится к соединениям формулы (I):
где L означает одинарную связь; R1 означает (C1-C4) алкил; R2 и R3 индивидуально означают водород или метил; n является целым числом от 0 до 3; Y означает (C1-C4)галоалкил, F, Cl, Br или I; X1 необязателен и означает О, когда присутствует; X2 означает NO2, CN или CONH2; и R4 означает (C1-С3) алкил; и их применению в борьбе с насекомыми и другими беспозвоночными. 3 н. и 4 з.п. ф-лы, 6 табл., 17 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по предварительной патентной заявке США № 61/666814, поданной 30 июня 2012 г., текст которой введен здесь в виде ссылки во всей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящая заявка относится к новым N-замещенным сульфилиминам и сульфоксиминам N-оксидов пиридина и их использованию для борьбы с насекомыми и другими беспозвоночными. Настоящая заявка также описывает новые способы получения этих соединений, композиции пестицидов, содержащие эти соединения, и способы борьбы с насекомыми с применением этих соединений.
ОБОСНОВАНИЕ ИЗОБРЕТЕНИЯ
Борьба с популяциями насекомых является важной задачей современной агрономии, хранения продуктов и гигиены. Более десяти тысяч видов насекомых наносят ущерб сельскому хозяйству. Потери в сельском хозяйстве достигают биллионов долларов США каждый год. Также известно, что насекомые, такие как термиты, наносят ущерб всем видам частных и общественных структур, что приводит к потерям биллионов долларов США каждый год, также как уничтожение продуктов питания, необходимых людям.
У определенных насекомых развилась устойчивость к используемым пестицидам. Сотни видов насекомых устойчивы к одному или более пестицидам. В связи с этим существует постоянная потребность в новых пестицидах и способах получения таких пестицидов.
Патенты США №№ 7678920 и 7687634 описывают определенные пестицидные сульфоксиминные соединения, и патент США № 8188292 описывает определенные пестицидные сульфилиминные соединения. Некоторые из этих сульфоксиминных и сульфилиминных соединений содержат пиридиновую функциональную группу. Неожиданно было обнаружено, что формы одного или более этих соединений, в которых пиридиновая функциональная группа N-оксидирована, проявляют инсектицидные свойства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из вариантов осуществления настоящего изобретения, описанный здесь, относится к соединениям, пригодным для борьбы с насекомыми. Другой вариант относится к соединениям, соответствующим формуле (I)
,
где
L означает одинарную связь, или R1, S и L вместе представляют собой 4-, 5- или 6-членное кольцо;
R1 означает (С1-С4)алкил;
R2 и R3 индивидуально означают водород, метил, этил, фтор, хлор или бром;
n является целым числом от 0 до 3;
Y означает (С1-С4)галоалкил, F, Cl, Br или I;
Х1 необязателен и означает О, когда присутствует;
Х2 означает NО2, CN, COOR4 или CONH2; и
R4 означает (С1-С3)алкил.
Более конкретные, но не лимитирующие, формы соединений формулы (I) включают следующие классы:
(1) Соединения формулы (I), где присутствует Х1, и Х2 означает NО2, CN или CONH2.
(2) Соединения формулы (I), где Y означает CF3 или Cl.
(3) Соединения формулы (I), где R2 и R3 независимо означают водород, метил или этил.
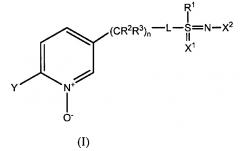
(4) Соединения формулы (I), где R1 означает СН3, и L означает одинарную связь, т.е. имеющие структуру
,
где n=1-3.
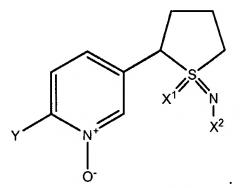
(5) Соединения формулы (I), где R1, S и L вместе формируют насыщенное 5-членное кольцо, и n=0, т.е. имеющие структуру
Для специалистов в данной области понятно, что возможны одна или более комбинаций описанных выше классов соединения формулы (I).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
С целью облегчения способствования пониманию сущности изобретения будет дана ссылка на следующие варианты осуществления изобретения, и определенный язык будет использован для описания. Тем не менее, следует понимать, что это не предполагает ограничения объема изобретения, и возможны изменения и дальнейшие модификации в иллюстрированном способе, и такие дальнейшие применения изобретения, проиллюстрированные здесь, которые обычно рассматриваются специалистами в данной области, для которых предназначено изобретение.
Если специально не оговорено иначе, ниже приведенные термины, как они использованы здесь, будут иметь следующее значение:
«алкенил», как использовано здесь, означает ациклический, ненасыщенный (с, по крайней мере, одной двойной углерод-углеродной связью), разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил;
«алкокси», как использовано здесь, означает алкил, далее содержащий одинарную углерод-кислородную связь, например, метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изо-бутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси и децокси;
«алкил», как использовано здесь, означает ациклический насыщенный, разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изо-бутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, окстил, нонил и децил;
«арил», как использовано здесь, означает циклический ароматический заместитель, состоящий из водорода и углерода, например, фенил, нафтил и бифенилил;
«гало», как использовано здесь, означает фтор, хлор, бром и иод;
«галоалкил», как использовано здесь, означает алкил, далее содержащий от одного до максимально возможного числа одинаковых или различных галоидов, например, фторметил, дифторметил, трифторметил, 1-фторметил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил; и
«гетероарил», как использовано здесь, относится к 5- или 6-членному ароматическому кольцу, содержащему один или более гетероатомов, а именно, N, O или S; эти гетероароматические кольца могут быть сопряжены с другими ароматическими системами.
Соединения, описанные здесь, могут существовать в виде одного или более стереоизомеров. Различные стереоизомеры включают геометрические изомеры, диостереомеры и энантиомеры. Так, соединения, описанные в этом документе, могут включать рацемические смеси, индивидуальные стереоизомеры и оптически активные смеси. Специалисту в данной области будет понятно, что один стереоизомер может быть более активным, чем другие. Индивидуальные стереоизомеры и оптически активные смеси могут быть получены селективными синтетическими процедурами, традиционными синтетическими процедурами с использованием расщепляющихся исходных материалов или обычными процедурами расщепления.
Один вариант, описанный здесь, относится к инсектицидным N-замещенным сульфилиминам и сульфоксиминам N-оксидов пиридина и их применению для борьбы с насекомыми и другими беспозвоночными. Другой, более частный, но неограничивающий раздел относится к соединениям N-замещенных сульфилиминов или сульфоксиминов N-оксидов пиридина с формулой (I)
,
где
L означает одинарную связь, или R1, S и L вместе представляют собой 4-, 5- или 6-членное кольцо;
R1 означает (С1-С4)алкил;
R2 и R3 индивидуально означают водород, метил, этил, фтор, хлор или бром;
n является целым числом от 0 до 3;
Y означает (С1-С4)галоалкил, F, Cl, Br или I;
Х1 необязателен и означает О, когда присутствует;
Х2 означает NО2, CN, COOR4 или CONH2; и
R4 означает (С1-С3)алкил.
Более частные, но не ограничивающие формы соединений формулы (I) включают следующие классы:
(1) Соединения формулы (I), где присутствует Х1, и Х2 означает NО2, CN или CONH2.
(2) Соединения формулы (I), где Y означает CF3 или Cl.
(3) Соединения формулы (I), где R2 и R3 независимо означают водород, метил или этил.
(4) Соединения формулы (I), где R1 означает СН3, и L означает одинарную связь, т.е. имеющие структуру
,
где n=1-3.
(5) Соединения формулы (I), где R1, S и L вместе образуют насыщенное 5-членное кольцо, и n=0, т.е. имеющие структуру
Для специалиста в данной области понятно, что возможны одна или более комбинаций описанных выше классов соединения формулы (I).
В одном случае соединения, соответствующие формуле (I), где Y означает (С1-С4)галоалкил, могут быть получены в соответствии с реакцией, приведенной на схеме А:
Дальнейшие детали относительно получения N-оксидов 2-замещенного-5-(1-алкилтио)алкилпиридина в соответствии с формулой (II) на схеме А будут предоставлены ниже. В зависимости от желаемой конечной формы соединения формулы (I) схема А может включать одну или более стадий и отображает введение NX2 в соединение, соответствующее формуле (II), для получения соединения N-замещенного сульфилимина пиридин N-оксида в соответствии с формулой (I), или введение обоих фрагментов Х1 и NX2 в соединение, соответствующее формуле (II), для получения соединения N-замещенного сульфоксимина пиридин N-оксида в соответствии с формулой (I).
В одном случае получение соединения N-замещенного сульфилимина пиридин N-оксида, где Х2 представляет собой NO2, включает реакцию соединения, соответствующего формуле (II), с нитрамидом в присутствии уксусного ангидрида в схеме А. В другой форме получение соединения N-замещенного сульфилимина пиридин N-оксида, где Х2 представляет собой СN, включает окисление соединения, соответствующего формуле (II), диацетатом иодобензола в присутствии цианамида в схеме А. Это окисление может быть проведено в полярном апротонном растворителе, таком как CH2Cl2. Дальнейшие детали, касающиеся получения N-замещенных сульфилиминов пиридинов такой природы и таких, в которых 2-замещенные-5-(1-алкилтио)алкилпиридин N-оксиды формулы (II) схемы А могут быть использованы для получения соответствующих N-замещенных сульфилиминов пиридин N-оксидов, приведены в патенте США № 8188292, содержание которого введено здесь в виде ссылки со всей полнотой.
Получение N-замещенных соединений сульфоксиминов пиридин N-оксидов, соответствующих формуле (I), т.е. таких, где X1 присутствует и обозначает О, может сопровождаться дальнейшим окислением соединений N-замещенных сульфилиминов пиридин N-оксидов, описанных выше. Например, в одной неограничивающей форме соединение N-замещенного сульфилимина пиридин N-оксида, в котором X2 представляет собой CN и фрагмент CN был введен окислением соединения, соответствующего формуле (II), диацетатом иодобензола в присутствии цианамида, может быть далее окислено, например, мета-хлорнадбензойной кислотой (м-ХНБК) в присутствии основания, такого как карбонат калия, для получения соответствующего соединения N-замещенного сульфоксимина пиридин N-оксида. Эта реакция может быть проведена в протонном полярном растворителе, таком как этанол или вода.
Получение N-замещенных соединений сульфоксиминов пиридин N-оксидов, соответствующих формуле (I), т.е. таких, где X1 присутствует и обозначает О, может сопровождаться постепенным введением X1, N и X2 в соединение, соответствующее формуле (II). Так, например, соединение, соответствующее формуле (II), может быть окислено мХНБК в полярном растворителе, таком как дихлорметан, при температуре ниже 0ºС с получением сульфоксида. Сульфоксид затем иминируют азидом натрия в присутствии концентрированной серной кислоты в апротоном растворителе, таком как хлороформ, при нагревании для получения сульфоксимина. Так, например, соединение, в котором X1 присутствует, и X2 представляет собой NO2, CN или COOR4, этот сульфоксимин может быть или пронитрован азотной кислотой в присутствии уксусного ангидрида при слегка повышенной температуре, или цианизирован бромцианом в присутствии основания, или карбоксилирован алкил(R4)хлорформиатом в присутствии основания, такого как 4-диметиламинопиридин (ДМАП), с получением N-замещенного сульфоксимина N-оксида пиридина. Основание требуется для эффективного цианилирования или карбоксилирования, и предпочтительным основанием является ДМАП, в то время как серная кислота применяется как катализатор для эффективной реакции нитрования. Дальнейшие детали относительно получения N-замещенных сульфоксиминов пиридинов этой природы и 2-замещенных-5-(1-алкилтио)алкилпиридин N-оксидов формулы (II) в схеме А, которые могут применяться для получения соответствующих N-замещенных сульфоксиминов пиридин N-оксидов, приведены в патентах США №№ 7678920 и 7687634, содержание которых введено здесь в виде ссылки со всей полнотой.
Получение соединений N-замещенных сульфоксиминов пиридин N-оксидов, соответствующих формуле (I), где X2 представляет собой CONH2, может быть проведено кислотным гидролизом соединения сульфоксимина, соответствующего формуле (I), в которой X2 представляет собой CN, т.е. имеющих следующую структуру
.
Нелимитирующие примеры кислот, которые могут использоваться в этой реакции, включают серную кислоту, соляную кислоту, фосфорную кислоту, трифторуксусную кислоту и азотную кислоту.
Для одной формы кислотный гидролиз проводят при температуре от примерно 50ºC до примерно 90ºC и обычном давлении, применяется и более высокая или более низкая температура и давление, если это желательно.
Нелимитирующие примеры растворителей, которые могут применяться в реакции кислотного гидролиза, включают полярные растворители, такие как дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид.
В одном аспекте этой формы определенные соединения, соответствующие формуле (II), которые могут быть использованы в реакции, проиллюстрированной на Схеме А, могут быть получены конденсацией енамина с α, β-ненасыщенным кетоном с получением промежуточного соединения, и промежуточное соединение циклизуют с использованием аминного нуклеофила. Более конкретно, один не лимитирующий процесс получения 2-замещенного-5-(1-алкилтио)алкилпиридин N-оксида, соответствующего формуле (II)
,
где Y представляет собой (С1-С4)галоалкил, и L, R1, R2, R3 и n такие, как определено ранее, применяет подход, иллюстрированный схемой В:
.
В схеме В енамин, соответствующий формуле (III)
,
в которой L, R1, R2, R3 и n такие, как определено ранее; и R5 и R6 независимо друг от друга означают С1-С8алкил, С2-С8алкенил, С1-С8арилалкил, С1-С8галоалкил, С1-С8алкоксиалкил, С1-С8алкиламиноалкил, арил или гетероарил, или R5 и R6 вместе с N представляют собой 5- или 6-членное насыщенное или ненасыщенной кольцо; конденсируют с α, β-ненасыщенным кетоном, соответствующим формуле (IV)
,
где
Y представляет собой (С1-С4)галоалкил; и
X3 представляет собой галоген, OR7, OSО2R7, SR7, SOR7, SО2R7 или NR8R9, где R7 представляет собой водород, (С1-С8)алкил, (С2-С8)алкенил, (С1-С8)арилалкил, (С1-С8)галоалкил, (С1-С8)алкоксиалкил, (С1-С8)алкиламиноалкил, арил или гетероарил, и R8 и R9 независимо представляют собой водород, (С1-С8)алкил, (С2-С8)алкенил, (С1-С8)арилалкил, (С1-С8)галоалкил, (С1-С8)алкоксиалкил, (С1-С8)алкиламиноалкил, арил или гетероарил, или R8 и R9 вместе с N представляют 5- или 6-членное насыщенное или ненасыщенное кольцо;
для получения промежуточного соединения, соответствующего формуле (V)
,
где Y представляет собой (С1-С4)галоалкил, и R1, R2, R3, R5, R6, L и n такие, как определены ранее.
Как проиллюстрировано на схеме В, промежуточное соединение формулы (V) циклизуют с использованием аминного нуклеофила, соответствующего формуле (VI)
H2N-X4
(VI),
где Х4 представляет собой гидроксил, алкокси, циано, амино или меркаптан, при кипячении, с получением соединения формулы (II).
Енамины формулы (III) могут быть традиционно получены добавлением подходяще замещенного амина к подходяще замещенному альдегиду в присутствии материала, адсорбирующего воду, с или без подходящего растворителя. Обычно, подходяще замещенный альдегид вводят в реакцию с безводным ди-замещенным амином при примерно от -20ºС до примерно 20ºС в присутствии осушителя, такого как безводный карбонат калия, и продукт выделяют обычными процедурами и обычно используют без дальнейшей очистки. В одном не лимитирующем примере, где енамин формулы (III) имеет следующую структуру
соответствующе замещенный альдегид вводят в реакцию с пирролидином при примерно от -20ºС до примерно 20ºС в присутствии осушителя, такого как безводный карбонат калия, и полученный продукт выделяют обычными процедурами и обычно используют без дальнейшей очистки. Дальнейшие детали, относящиеся к получению енамина формулы (III), приведены, например, в патенте США № 2008/0033180, содержание которого введено здесь в виде ссылки со всей полнотой.
α, β-ненасыщенные кетоны, соответствующие формуле (IV), коммерчески доступны или могут быть получены из соответствующих виниловых субстратов и ацилирующих агентов. В одной форме, например, алкилвиниловые эфиры могут быть ацилированы галоалкилуксусными ангидридами с получением соединений формулы (IV).
В процессе конденсации требуются примерно эквимолярные количества енамина формулы (III) и α, β-ненасыщенного кетона формулы (IV).
В одной форме конденсацию проводят при температуре от примерно -20°C до примерно 35ºС, в другой более частной форме применяют температуру от примерно -5°C до примерно 20ºС.
Конденсацию енамина, соответствующего формуле (III), с α, β-ненасыщенным кетоном формулы (IV) можно проводить в полярном или неполярном растворителе, хотя также рассматриваются формы, в которых реакцию проводят в условиях, свободных от растворителей. Не лимитирующие примеры полярных растворителей включают дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид, а не лимитирующие примеры неполярных растворителей включают углеводородные и ароматические углеводородные растворители, такие как толуол. В одной частной, но не лимитирующей форме конденсацию проводят в толуоле.
В одном аспекте α, β-ненасыщенный кетон формулы (IV) добавляют к предварительно полученной смеси енамина формулы (III).
В типичной реакции конденсации енамин формулы (III) растворяют в желаемом растворителе при температуре от примерно -5°C до примерно 20ºС, и постепенно через воронку добавляют к этому раствору α, β-ненасыщенный кетон формулы (IV). Смесь перемешивают до тех пор, пока енамин формулы (III) и α, β-ненасыщенный кетон формулы (IV) не будут израсходованы. При использовании неполярного растворителя, такого как толуол, промежуточное соединение формулы (V) можно применять без дальнейшего выделения или очистки.
Циклизацию промежуточного соединения формулы (V) аминным нуклеофилом формулы (VI) осуществляют в условиях кипячения; т.е. в интервале температур от 50ºC до 90ºС. Как указано выше, Х4 может представлять гидроксил, алкокси, циано, амино или меркаптан. Возможно также присутствие аминного нуклеофила, используемого в схеме В, в солевой форме. Когда аминный нуклеофил используется в солевой форме, применяют также ненуклеофильное основание для нейтрализации аналога соли кислоты. Не лимитирующие примеры ненуклеофильных оснований включают карбонатные соли, триэтиламин, N,N-диизопропилэтиламин и 1,8-диазабициклоундец-7-ен. В одной не лимитирующей форме, где Х4 представляет гидроксил, а соединение, соответствующее формуле (VI), является гидроксиламином, гидрохлорид гидроксиламина используется в реакции схемы В вместе с триэтиламином. Следует понимать, что возможны другие варианты аминных нуклеофилов формулы (VI) и ненуклеофильного основания, если оно присутствует.
Циклизация промежуточного соединения формулы (V) может проводиться в том же растворителе, что и конденсация енамина формулы (III) и α, β-ненасыщенного кетона формулы (IV).
Формы промежуточного соединения, соответствующего формуле (V), где Y представляет собой (С1-С4)галоалкил, и R1, R2, R3, R5, R6, L и n такие, как они определены выше, могут быть также получены подходом, проиллюстрированным на схеме С.
В схеме С ацетилхлорид, соответствующий формуле (VII), где Y представляет собой С1-С4галоалкил, вводят в реакцию с алкилвиниловым эфиром, соответствующим формуле (VIII), где R10 представляет собой С1-С4алкил. В процессе используют примерно эквимолярные количества соединений, соответствующих формулам (VII) и (VIII), хотя может применяться избыток того или другого. В одной частной форме 10-50 процентов стехиометрического избытка алкилвинилового эфира формулы (VIII) было использовано.
Эту реакцию проводят или в отсутствие растворителя, например, с избытком алкилвинилового эфира формулы (VIII), или в присутствии безводного органического растворителя. Не лимитирующими примерами подходящих растворителей являются углеводородные растворители, включая ароматические углеводороды, такие как толуол. Реакцию можно проводить при температуре от примерно -10ºC до примерно 35ºС. В одной частной форме используется температура от 0ºC до 20ºС. В типичной реакции соединение ацетилхлорида формулы (VII) пробулькивают под поверхностью соединения алкилвинилового эфира формулы (VIII) или в чистом виде, или в присутствии углеводородного растворителя в интервале 0-5ºС. Реакции дают нагреться при перемешивании в течение примерно 1 часа, поддерживая температуру не выше комнатной. Сырую реакционную смесь, содержащую промежуточное соединение, соответствующее формуле (IX), можно использовать без дальнейшего выделения или очистки реакционной смеси.
Промежуточное соединение формулы (IX) затем конденсируют с енамином, соответствующим формуле (III), в присутствии основания - третичного амина, для получения промежуточного соединения формулы (V), где Y представляет собой С1-С4галоалкил. Примерно эквимолярные количества промежуточного соединения формулы (IX) и енамина формулы (III) требуются в процессе конденсации; требуется, по крайней мере, один эквивалент третичного амина, при этом в определенных формах в реакции используется от одного до двух эквивалентов.
Эту конденсацию можно проводить при температуре от примерно -20ºC до примерно 35ºC. В одной частной форме применяют температуру от примерно -5ºC до примерно 20ºC. Эту конденсацию можно проводить в неполярном или полярном апротонном растворителе. Примеры неполярных растворителей включают углеводородные растворители или ароматические углеводороды. Полярные апротонные растворители также представляют собой хороший выбор в этой реакции. В частных, но не лимитирующих формах используется ацетонитрил или толуол. В одной форме промежуточное соединение формулы (IX) добавляют в предварительно приготовленную смесь енамина формулы (III) и третичного аминного основания. В типичной реакции конденсации енамин формулы (III) и, по крайней мере, стехиометрическое количество третичного аминного основания растворяют в желаемом растворителе при примерно от 50ºC до примерно 200ºC и промежуточное соединение, соответствующее формуле (IX), постепенно добавляют через капельную воронку к этому раствору. Смесь перемешивают до полного расхода промежуточного соединения формулы (IX) и енамина формулы (III). Промежуточное соединение формулы (V) можно использовать без дальнейшего выделения или очистки. Дальнейшие детали, касающиеся подхода, проиллюстрированного в схеме С, приведены в международном патенте № WO 2010/002577, содержание которого введено здесь в виде ссылки во всей полноте.
Промежуточное соединение, соответствующее формуле (V), полученное этим подходом, может быть циклизовано при использовании аминного нуклеофила согласно формуле (VI), как обсуждалось выше.
Более частные, но не лимитирующие формы соединений формулы (II) включают следующие классы:
(1) Соединения формулы (II), где Y представляет собой СF3.
(2) Соединения формулы (II), где R2 и R3 независимо друг от друга представляют собой водород, метил или этил.
(3) Соединения формулы (II), где R1 представляет собой СН3, и L представляет собой простую связь, то есть имеющие структуру
,
где n равно 1-3.
(4) Соединения формулы (II), где R1, S и L вместе образуют насыщенный 5-членый цикл, и n равно 0, то есть имеющие структуру
Нужно понимать, как известно в этой области, что возможны одна или более комбинаций вышеописанных классов соединений формулы (I).
В другой форме сульфоксимин пиридин-N-оксидные соединения, соответствующие формуле (I), где Х1 присутствует и представляет собой О, могут быть получены окислением соединений, соответствующих формуле (Х)
где Y представляет собой (С1-С4)галоалкил, F, Cl, Br или I, и Х2, L, R1, R2, R3, n и R4 такие, как определено выше, добавлением перекиси водорода-мочевины и трифторуксусного ангидрида. Эту реакцию иллюстрирует схема D.
В одной форме окисление проводят при температуре от примерно 0ºC до примерно 30ºС. В другой выборочной форме окисление может быть проведено при комнатной температуре и обычном давлении, но можно применять также, если это желательно, более высокую температуру и давление.
Нелимитирующие примеры растворителей, которые могут применяться, включают полярные растворители, такие как дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид.
В одной форме соединение формулы (X) смешивают с гидроперекисью мочевины и растворителем и перемешивают. К полученной смеси добавляют затем трифторуксусный ангидрид с последующим перемешиванием до тех пор, пока не будет израсходована основная порция исходных материалов. Реакционную смесь затем можно отфильтровать, промыть и концентрировать в вакууме. Остаток забирают в подходящий растворитель, такой как ТГФ (тетрагидрофуран) и промывают, органическую фазу высушивают, фильтруют и концентрируют в вакууме, получая соответствующее соединение сульфоксимина N-окиси пиридина, соответствующее формуле (I). Следует понимать, однако, что вышеперечисленные стадии не лимитированы и что возможны вариации и добавления.
Дальнейшие детали, касающиеся получения соединений формулы (X), где Х2 означает NО2, CN или COOR4, Y представляет собой (C1-C4)галоалкил, F, Cl, Br или I, и L, R1, R2, R3, n и R4 такие, как определено ранее, содержатся в патентах США №№ 7678920 и 7687634. Получение соединений сульфоксимина N-окиси пиридина, соответствующих формуле (I), где X2 означает CONH2, Y представляет собой (C1-C4)галоалкил, F, Cl, Br или I, и L, R1, R2, R3, n и R4 такие, как определено ранее, может сопровождаться, например, получением соединения формулы (X), где X2 означает CN, Y представляет собой (C1-C4)галоалкил, F, Cl, Br или I, и L, R1, R2, R3, n и R4 такие, как определено ранее, т.е. имеющго следующую структуру
,
которое подвергается реакции кислотного гидролиза с последующим окислением, проиллюстрированным схемой D. Не лимитирующие примеры кислот, которые могут применяться в этой реакции, включают серную кислоту, соляную кислоту, фосфорную кислоту, трихлоруксусную кислоту и азотную кислоту. В одной форме реакцию кислотного гидролиза проводят при примерно от 50ºC до примерно 90ºC и обычном давлении, но рассматривается также применение более высокой или более низкой температуры и давления, если это желательно.
Нелимитирующие примеры растворителей, которые могут применяться в реакции кислотного гидролиза, включают полярные растворители, такие как дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид.
Как альтернативный подход, получение соединений сульфоксимина N-окиси пиридина, соответствующих формуле (I), где X2 означает CONH2, Y представляет собой (C1-C4)галоалкил, F, Cl, Br или I, и L, R1, R2, R3 и n такие, как определено ранее, может сопровождаться, например, получением соединения формулы (I), соответствующего процессу окисления, кратко описанному выше, где X2 означает CN, и L, R1, R2, R3, n и Y такие, как определено ранее, т.е. имеющего следующую структуру
,
которое подвергается реакции кислотного гидролиза. Не лимитирующие примеры кислот, которые могут применяться в этой реакции, включают серную кислоту, соляную кислоту, фосфорную кислоту, трихлоруксусную кислоту и азотную кислоту. В одной форме реакцию кислотного гидролиза проводят при примерно от 50ºC до примерно 90ºC и обычном давлении, но рассматривается также применение более высокой или более низкой температуры и давления, если это желательно.
Нелимитирующие примеры растворителей, которые могут применяться в реакции кислотного гидролиза, включают полярные растворители, такие как дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид.
ПРИМЕРЫ
Примеры приведены для целей иллюстрации и не ограничивают изобретение, предложенное в этом документе, разделами, предложенными в этих примерах.
Исходные материалы, реагенты и растворители, которые получали из коммерческих источников, использовали без дальнейшей очистки. Молекулам присвоено их известное имя, проименованное в соответствии с программами наименований ISIS Draw, ChemDraw или ACD Name Pro. Если эти программы не в состоянии дать название, молекулу именуют с использованием традиционных правил наименования. Если не указано другое, спектры ЯМР 1Н и 13С получены на приборе Bruker 300 МГц; газовую хроматографию проводили с использованием системы Agilent 6850 Network GC или Agilent 6890 с возможностью охлаждения колоночных инжекций с капиллярной колонкой; и ВЭЖХ проводили с использованием системы Agilent 1200, снабженной автоматической подачей образца, вакуумным дегазатором, нагревателем колонки и УФ детектором.
Пример 1: Малообъемное получение N-оксида 5-(1-(метилтио)этил)-2-(трифторметил)пиридина (1):
Реакция конденсации 1-(3-метилтиобут-1-енил)пирролидона (2)
с 4-этокси-1,1,1-трифторбут-3-ен-2-оном (3)
в толуоле с получением выхода 27% вес 1,1,1-трифтор-6-(метилтио)-5-(пирролидин-1-илметилен)гепт-3-ен-2-она (4) в толуоле
403 мг (0,37 ммоль) 27% вес 1,1,1-трифтор-6-(метилтио)-5-(пирролидин-1-илметилен)гепт-3-ен-2-она (4) в толуоле добавляли в круглодонную трехгорлую 25 мл колбу, снабженную обратным холодильником для кипения и отводом в обесцвечивающий скруббер. К этой смеси добавляли в одну порцию 34 мг (0,34 ммоль) триэтиламина. Реакционную смесь охлаждали до примерно 12,8ºС и затем в одну порцию добавляли 24 мг (0,34 ммоль) гидрохлорида гидроксиламина. Реакционную смесь медленно нагревали до 85ºС и перемешивали 1 час 45 мин. Реакционную смесь затем охлаждали до комнатной температуры. Реакционную смесь разделяли затем на много фракций для инструментального анализа и очистки. Порцию реакционной смеси распределяли между толуолом и водой. Оба слоя - органический и водный - анализировали ЖХ/МС. Оба слоя демонстрировали наличие пика с молекулярным значением N-оксида 5-(1-(метилтио)этил)-2-(трифторметил)пиридина (C9H10F3NOS). Рассчитанное значение m/z=237,04, найденное m/z=237,04.
Малую порцию реакционной смеси очищали с использованием препаративной тонкослойной хроматографии, загружая 2 мл реакционной смеси на 20×20 см пластину (1000 микрон) и элюируя ее смесью с соотношением гексан и 2-пропанол 4:1 (Rf составлял примерно от 0,5 до 0,6). Подходящую полосу срезали с пластины и экстрагировали на силикагели 20 мл этилацетата. Самые лучшие порции этого разделения отобрали для протонного ЯМР. Материал содержал небольшую порцию этилацетата, но химические сдвиги желаемого соединения были: 1Н ЯМР (300 МГц, CDCl3)δ 8,30 (с, 1H), 7,64 (д, J=8,3 Гц, 1H), 7,35 (д, J=8,3 Гц, 1H), 3,78 (кв, J=7,1 Гц, 1H), 1,98 (с, 3H), 1,58 (д, J=7,1 Гц, 3H).
Пример 2: Более объемное получение N-оксида 5-(1-(метилтио)этил)-2-(трифторметил)пиридина (1):
5,0 г (0,03 моль) 1-(3-метилтиобут-1-енил)пирролидона (2) и 100 мл ацетонитрила (АЦН) добавляли в сухую круглодонную 250 мл колбу, снабженную магнитной мешалкой, входом азота, капельной воронкой и обратным холодильником. По каплям в течение 2-3 мин добавляли 4-этокси-1,1,1-трифторбут-3-ен-2-он (3) (ЭТФБО) (4,9 г, 0,03 моль) и полученный темный раствор перемешивали при комнатной температуре 1 час. К этому раствору добавляли затем 2,1 г (0,03 моль) гидрохлорида гидроксиламина с последующим добавлением 4,2 мл (0,03 моль) триэтиламина. Реакцию кипятили при 85ºС 2 часа, охлаждали и аликвоту анализировали ТСХ и ГХ/МС, которые показали, что реакция в основном завершена, не осталось исходных материалов, и присутствовали два новых продукта. Основной продукт идентифицировали анализом ГХ/МС как соответствующий структуре 5-(1-(метилтио)этил)-2(трифторметил)пиридин-N-оксида (1), а минорный продукт, по-видимому, являлся продуктом транс-аминирования ЭТФБО и пирролидина. Реакционную смесь затем перемешивали при комнатной температуре 12 часов, выливали в примерно 100 мл воды и экстрагировали трижды 100 мл этилового эфира. Эфирный экстракт промывали водой и насыщенным водным раствором хлорида натрия, высушивали над безводным сульфатом магния, фильтровали и концентрировали в вакууме на роторном испарителе. Сырой продукт (6,1 г) хроматографировали на силикагеле с градиентом 100% гексана до 100% этилацетата в течение 20 мин. Выделяли 2,2 г желтой жидкости, которая соответствовала структуре 5-(1-(метилтио)этил)-2-(трифторметил)пиридин-N-оксида (1) при анализе 1Н ЯМР 300 МГц и ГХ/МС; выход 31%. 1Н ЯМР (300 МГц, хлороформ-d)δ 8,28 (с, 1H), 7,63 (д, J=8,3 Гц, 1H), 7,34 (д, J=8,3 Гц, 1H), 3,77 (кв, J=7,1 Гц, 1H), 1,98 (с, 3H), 1,56 (д, J=7,3 Гц, 3H). Вычислено m/z=237,04, найдено m/z=237,04.
Пример 3: Получение N-оксида N-циано-S-[1-(6-трифторметил-3-пиридинил)этил]-S-метилсульфилимина (5):
2,2 г (0,0092 моль) N-оксида 5-(1-(метилтио)этил)-2-(трифторметил)пиридина (1), 0,38 г (0,0092 моль) цианамида и 100 мл безводного тетрагидрофурана (ТГФ) помещали в сухую 250 мл круглодонную колбу, снабженную магнитной мешалкой, вводом азота и термометром. Раствор охлаждали до примерно 4ºС, и в одну порцию добавляли диацетат иодбензола (3,0 г, 0,0092 моль). Реакцию перемешивали при 0-4ºС 2 часа, оставляли постепенно нагреваться до комнатной температуры и затем перемешивали при комнатной температуре под азотом. Через 13 часов аликвоту реакционной смеси анализировали ВЭЖХ, используя колонку YMC AQ (Киото, Япония) со скоростью потока 1,0 мл/мин. В качестве растворителей применяли ацетонитрил (АЦН) и воду в 0,05% трифторуксусной кислоте (ТФУ). Применяли линейный градиент, начиная с 20% АЦН/80% воды с 0,05% ТФУ и переходя к 95% АЦН/5% воды с 0,05% ТФУ в течение 25 мин. ВЭЖХ анализ показал, что реакция практически закончилась. Реакционную смесь затем разбавляли 200 мл АЦН и промывали дважды 100 мл гексана для удаления побочного иодбензола. Раствор АЦН концентрировали в вакууме на роторном испарителе и полученны